Болезнь Паркинсона (БП) – хроническое, прогрессирующее заболевание, которое вызвано нарастающей гибелью нейронов черного вещества среднего мозга и других отделов ЦНС, использующих в качестве нейромедиатора дофамин. «Очень часто начало болезни остается незамеченным, поскольку стадии домоторных, доклинических проявлений длятся несколько лет», – отметил заведующий кафедрой нервных болезней ФППОВ Первого МГМУ им. И.М. Сеченова, д.м.н., профессор В.Л. ГОЛУБЕВ. – Первые симптомы появляются, когда 75–80% нейронов в черной субстанции уже погибло, поэтому больной обращается к врачу на довольно запущенной стадии заболевания». Следующие 2–4 года длится так называемый медовый месяц – период, когда назначенная терапия препаратами леводопы (предшественника дофамина) наиболее эффективна. Затем начинается прогрессирование двигательных, вегетативных, психических и других нарушений, требующих пересмотра лечения. На поздних стадиях болезни эффективность терапии продолжает снижаться, развиваются тяжелые осложнения.
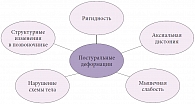
Профессор В.Л. Голубев более подробно остановился на симптомах, сопровождающих развитые стадии БП. Субъективная картина поздних стадий заболевания характеризуется укорочением времени действия каждой отдельной дозы дофаминергических препаратов. Ответ на отдельные дозы лекарств становится более непредсказуемым, а благоприятный эффект ночного сна, после которого самочувствие больного раньше улучшалось, – менее заметным. Для развитых стадий БП типична избыточная двигательная активность, непроизвольные («лишние») движения. При поздних стадиях БП пациенты страдают от дисбазии (расстройства ходьбы), невозможности самообслуживания и, наконец, обездвиженности. Объективно моторные нарушения на поздних стадиях БП можно объединить в три группы: флюктуации, дискинезии и постуральные расстройства.
Флюктуации характеризуются чередованием периодов нормальной двигательной активности («включение») и ее нарушений («выключение»), которые принимают форму гипокинезии (снижения спонтанной двигательной активности) или, в более тяжелых случаях, акинезии (невозможности произвольных движений). «В физиологических условиях дофамин выделяется в синусах по потребности. В ходе лечения леводопа вводится кратно, несколько раз в сутки, в результате чего происходит не постоянная – физиологическая – стимуляция рецепторов, а периодическая, ее называют пульсирующей, – объяснил профессор В.Л. Голубев. – Падает способность к накоплению дофамина: нейроны еще синтезируют этот медиатор, но их функции тоже постепенно ухудшаются. Рецепторы становятся или гиперчувствительными, или гипочувствительными». Это и становится главной причиной развития флюктуаций.
Гипокинезия (акинезия) представлена многими самостоятельными формами. При гипокинезии конца дозы целесообразен дробный прием малых доз дофаминсодержащих препаратов, агонистов дофаминовых рецепторов, а также ингибиторов моноаминоксидазы типа B (МАО-В) и катехол-О-метил-трансферазы (КОMT), которые препятствуют распаду дофамина. Положительный эффект дают дофаминсодержащие препараты пролонгированного действия. При отставленном «включении», когда препарат леводопы не действует сразу после приема, из-за чего состояние больного ухудшается, профессор В.Л. Голубев рекомендовал принимать леводопу до еды или через 2 часа после еды.
Дискинезии (гиперкинезы) – патологические внезапно возникающие непроизвольные движения в различных группах мышц – обычно развиваются позднее флюктуаций. Выделяют дискинезии периода «включения», дискинезии периода «выключения» и двухфазные дискинезии.
Дискинезия периода «включения» возникает в результате избыточной стимуляции рецепторов дофаминсодержащими препаратами. Корректировать это состояние следует путем перехода на дробный прием малых доз леводопы при сохранении прежней суточной дозы. Если этого недостаточно, назначают атипичный бензодиазепин либо вальпроат натрия в обычных среднесуточных дозировках. В качестве третьей линии терапии можно использовать один из атипичных нейролептиков. Возможны и другие терапевтические подходы (применение антагонистов глутамата, ботулотоксина) или, в крайнем случае, необходимым становится проведение нейрохирургической операции.
Терапия дискинезии периода «выключения» направлена на то, чтобы задержать распад дофамина и увеличить его концентрацию в организме больного. Именно поэтому основными лекарственными средствами служат агонисты дофаминовых рецепторов, ингибиторы MAO-B и дофаминсодержащие препараты пролонгированного действия. Возможно также включение в терапию бензодиазепинов и атипичных нейролептиков.
Двухфазная дискинезия, по мнению профессора В.Л. Голубева, – «это самый мучительный для пациента гиперкинез». К счастью, она встречается довольно редко, однако возможности врачей помочь больным с такими состояниями ограничены. В качестве лекарственных средств при двухфазных дискинезиях используют агонисты дофаминовых рецепторов, ингибиторы MAO-B и КОMT, ботулотоксин.
В основе постуральных нарушений (рис.) лежит дефицит не дофамина, а других медиаторов. Именно поэтому усиление дофаминергической передачи с помощью леводопы и агонистов дофаминовых рецепторов влияет на эти симптомы незначительно. Пациентам следует рекомендовать не медикаментозное лечение, а специально разработанные программы для больных БП, направленные на увеличение физической активности.
Помимо флюктуаций, дискинезий и постуральных расстройств, существуют и другие моторные проявления поздних стадий болезни Паркинсона: нарушения речи, дисфагия, тремор действия, синдром беспокойных ног, стереотипии, миоклонус, акатизия, а также нарушения поведения, связанные с быстрым сном. Многие из этих симптомов (например, нарушения речи и дисфагия) приводят к полной социальной дезадаптации. К редким двигательным нарушениям при болезни Паркинсона принадлежат блефароспазм, писчий спазм, контрактуры, апраксия открывания век и «амбулаторный спазм стопы», не связанный с лечением.
Главной причиной большинства моторных проявлений поздних стадий БП является нехватка дофамина в организме больного, а также резкие колебания его концентрации под влиянием приема лекарств. Именно поэтому лечение осложнений поздних стадий БП должно быть направлено на поддержание постоянной (а не пульсирующей) дофаминергической стимуляции. Ее можно проводить несколькими способами: путем трансдермального введения агонистов дофаминовых рецепторов (используется накожный пластырь с ротиготином), подкожных инфузий апоморфина, глубокой стимуляции головного мозга (deep brain stimulation, DBS) или дуоденальной инфузии препаратов. Постоянная дофаминергическая стимуляция путем прямой дуоденальной инфузии геля леводопы/карбидопы – это новая концепция лечения поздних стадий БП. По мнению профессора В.Л. Голубева, преимуществами данного способа являются обеспечение непрерывного введения препарата на протяжении 16 часов инфузии, возможность индивидуально подобрать дозу и отрегулировать скорость введения леводопы. Профессор В.Л. Голубев подчеркнул, что данный способ может обеспечить достойное качество жизни больным БП на развитых стадиях заболевания благодаря поддержанию стабильной концентрации леводопы в плазме и постоянной стимуляции стриарных дофаминергических рецепторов.
Немоторные симптомы болезни Паркинсона. Что, когда и отчего?
Болезнь Паркинсона ранее традиционно рассматривалась как поражение преимущественно моторной или двигательной сферы. Однако в последнее время большое внимание уделяется немоторным проявлениям БП, которые отмечаются практически у всех пациентов, независимо от возраста дебюта и стадии болезни. Как объяснила к.м.н., доцент кафедры неврологии СПбГМУ им. академика И.П. Павлова А.А. ТИМОФЕЕВА, если дегенерация черной субстанции, вызывающая дисфункцию дофаминергической системы, сопровождается моторными нарушениями, то дегенерация вегетативных сплетений, дорсального ядра n. vagus, обонятельной луковицы, голубоватого ядра, ядер шва, ядер Мейнерта и коры полушарий приводит к дисфункции серотонин-, норадреналин- и холинергической систем, что становится причиной немоторных симптомов БП.
J. Parkinson, впервые описавший позже названное его именем заболевание, полагал, что у больных «чувства и интеллект не страдают». Однако для ранних стадий БП характерны такие немоторные симптомы, как вегетативные нарушения, аффективные нарушения, нарушение обоняния, нарушения сна и чувствительности. Все они сохраняются и усиливаются на развернутых стадиях БП, для которых также характерно наличие психотических и когнитивных расстройств. В целом, следует отметить, что всевозможные немоторные симптомы БП встречаются у 68–97% больных. Частота распространения отдельных симптомов различна: тревога встречается у 49% пациентов с БП, гипергидроз – у 48%, дизестезия – у 48%, усталость – у 42%, дисфория – у 37%, кардиалгии – у 29%, нарушения мочеиспускания – у 26% больных и т.д.
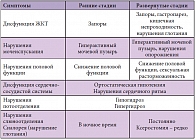
Раньше других немоторных симптомов пациента начинают беспокоить вегетативные нарушения (дисфункция желудочно-кишечного тракта (ЖКТ), нарушения мочеиспускания, половой функции, потоотделения, постуральная гипотензия, себорея) (табл.). К немоторным симптомам болезни Паркинсона относятся и нарушения дыхания, которые, как правило, возникают на поздних стадиях в результате гипокинезии и утомляемости дыхательных мышц и нарастают в период «выключения». Дисфункция мышц верхних дыхательных путей становится причиной респираторной апраксии, обструктивного или центрального апноэ во сне.
Сенсорные нарушения встречаются и на ранних, и на поздних стадиях БП, усиливаясь в периоды «выключения». Они не проявляются традиционными расстройствами чувствительности, отсутствуют зоны гипо- или гиперестезии. Пациенты с БП предъявляют жалобы на ощущения покалывания, жжения, зуда, онемения, иногда очень выраженные боли, которые локализуются в грудной клетке или в области живота.
Болезнь Паркинсона может также сопровождаться различными нарушениями сна и бодрствования. В их число входят инсомнии (при акинезии, депрессии и др.), нарушения сна в фазе с быстрым движением глаз (БДГ), устрашающие сновидения и гиперсомнии (дневная сонливость). Больные БП часто предъявляют жалобы на хроническую усталость – состояние крайнего утомления, слабости, истощения, упадка физических и психических сил, наступающих в результате выполнения привычной для пациента нагрузки и ограничивающей его функциональную активность.
Легкие когнитивные расстройства (20–30% случаев) проявляются в замедленности, снижении внимания и работоспособности. У 50–80% пациентов с БП развивается деменция, ведущая к социальной дезадаптации. Аффективные нарушения встречаются и на ранних, и на развернутых стадиях БП. Самое частое из этих нарушений – депрессия, наблюдающаяся в среднем у 40% больных БП. «Депрессия проявляется различными симптомами – тревогой, раздражительностью, суицидальными идеями, ангедонией, астенией», – отметила А.А. Тимофеева. У больных БП наблюдаются различные психотические нарушения: иллюзии, малые (экстракампинные) галлюцинации, истинные галлюцинации, бредовые расстройства, делирий. Психотические нарушения может спровоцировать любой дофаминергический препарат. Следует учитывать, что психотогенный потенциал – способность препарата вызывать психотические расстройства – нарастает в ряду: леводопа → ингибиторы КОMT → агонисты рецепторов дофамина → амантадины → ингибиторы MAO → холинолитические препараты.
«Немоторные симптомы развиваются раньше моторных, являясь наиболее чувствительным индикатором состояния пациента», – подчеркнула А.А. Тимофеева. Таким образом, немоторные симптомы не только встречаются на доклинической и развернутой стадиях БП, но и являются предикторами заболевания. Наиболее ранними симптомами, появляющимися за 15–20 лет до болезни, считаются нарушения вегетативных функций. Мутация гена, ответственного за синтез альфа-синуклеина, ведет к отложениям этого вещества в кишечных сплетениях и симпатических ганглиях блуждающего нерва, что приводит к запорам, нарушению эрекции и мочеиспускания. За 10–13 лет до развития БП у больных нарушается обоняние. Степень гипосмии коррелирует с дисфункцией дофаминергической системы по данным однофотонной эмиссионной компьютерной томографии (ОФЭКТ), моторными и немоторными симптомами. Дегенерация аксонов симпатических волокон приводит к симпатической денервации миокарда, лежащей в основе частых при БП нарушений ритма сердца. К числу ранних симптомов (за 3–13 лет до болезни) также относят и расстройства сна в фазе с БДГ. Это самый надежный маркер риска: более трети людей с подобными нарушениями сна заболевают БП в течение 12 лет.
Большинство маркеров БП (кроме результатов позитронно-эмиссионной томографии и ОФЭКТ) неспецифично, но наличие их в комбинации существенно повышает достоверность ранней и доклинической диагностики. Например, у лиц с расстройствами сна в фазе с БДГ выше частота гипосмии и изменений при ОФЭКТ по сравнению с общей популяцией. На наличие биомаркеров досимптомной стадии БП необходимо обследовать, прежде всего, лиц с факторами риска: родственников пациентов с БП, носителей мутаций, лиц с жалобами на снижение обоняния, нарушения сна или работы ЖКТ.
Как отметила А.А. Тимофеева, лечение немоторных симптомов БП включает два основных подхода: коррекцию дофаминергической терапии и симптоматическое лечение.
Коррекция дофаминергической терапии при нарушениях сна, дыхания, чувствительности и аффективных расстройствах направлена на уменьшение периодов «выключения». При депрессии назначают агонисты дофаминовых рецепторов, при апатии – амантадины. При ортостатической гипотензии необходим контроль приема быстродействующих препаратов леводопы. При инсомнии и нарушениях сна в фазе с БДГ уменьшают вечернюю дозу дофаминергического препарата. При психотических нарушениях препараты отменяют в следующей последовательности: холинолитические препараты → ингибиторы MAO → амантадины → агонисты рецепторов дофамина → ингибиторы КОMT.
Симптоматическое лечение, например, при дисфункции ЖКТ включает диету, обильное питье, прием домперидона, слабительных. При нарушениях мочеиспускания назначают оксибутинин и толтеродин. При ортостатической гипотензии рекомендуют использовать эластичные чулки, пить больше воды. При когнитивных нарушениях пациент должен принимать ингибиторы ацетилхолинэстеразы (АХЭ) и антагонисты рецепторов N-метил-D-аспартата (N-methyl-D-aspartate, NMDA).
Традиционная точка зрения подразумевает леводопорезистентность немоторных симптомов, поскольку считается, что в основе их развития лежат нарушения недофаминергического обмена. Однако уменьшение выраженности немоторных симптомов БП может быть достигнуто путем обеспечения максимально возможной постоянной стимуляции рецепторов дофамина. Существуют два пути достижения этой цели: пероральная терапия леводопой в сочетании с другими противопаркинсоническими средствами либо постоянная энтеральная инфузия леводопы. «Так, на фоне постоянной инфузии леводопы при длительном введении леводопы непосредственно в тощую кишку наблюдается значительный регресс немоторных симптомов. Это свидетельствует о том, что уменьшение выраженности немоторных симптомов болезни Паркинсона может быть достигнуто оптимизацией дофаминергической терапии», – заключила А.А. Тимофеева.
Леводопа. Продолжение истории и новые перспективы
Заведующий кафедрой неврологии Казанского государственного медицинского университета, д.м.н., профессор Э.З. ЯКУПОВ напомнил участникам симпозиума основные вехи истории открытия и применения препаратов леводопы – «золотого стандарта» лечения БП. В конце 1950-х гг. А. Carlsson идентифицировал дофамин в головном мозге (спустя полвека ученый получил за это открытие Нобелевскую премию). Значительное снижение содержания дофамина в базальных ганглиях головного мозга пациентов, умерших от болезни Паркинсона, выявили в 1961 г. H. Ehringer и О. Hornykiewicz. В том же году А. Barbea и соавт. изучали эффективность леводопы (метаболического предшественника дофамина) у больных с БП и отметили ее эффективность. Тогда же W. Birkmayer и О. Hornykiewicz в небольшом открытом исследовании показали значительное уменьшение выраженности акинезии при однократном внутривенном введении леводопы (2 г). В 1967 г. G. Cotzias и соавт. сообщили об улучшении состояния больных БП, пролеченных высокими дозами (до 16 г/сут) пероральной формы леводопы. Они впервые предложили методику постепенного наращивания дозы леводопы в процессе лечения БП. С 1970 г. леводопа была разрешена к применению у больных БП в США.
Внедрение препаратов леводопы кардинально изменило судьбу больных БП. До начала применения леводопы смертность при БП в 3 раза превышала смертность в контрольных статистических группах. Средняя продолжительность жизни со времени установления диагноза составляла 9 лет. При лечении препаратами леводопы смертность больных БП в течение первых 5 лет становится меньше, чем в контрольной популяции, на 6–7-м году – превышает ее в 1,5 раза, а через 12 лет лечения – в 2,5 раза.
Однако применение «чистой» леводопы сопровождалось большим количеством побочных эффектов, таких как тошнота, рвота, колебания артериального давления, нарушения сердечного ритма. W. Birkmayer впервые использовал леводопу в комбинации с ингибитором ДОФА-декарбоксилазы (ДДК), что позволило повысить терапевтическую эффективность леводопы и улучшить ее переносимость. Ингибиторы ДДК – карбидопа и бенсеразид – не проникают через гематоэнцефалический барьер, но блокируют трансформацию леводопы в дофамин на периферии. В результате удается уменьшить число побочных желудочно-кишечных и сердечно-сосудистых эффектов, а доза леводопы понижается на 60–80%.
Производство комбинации леводопы и ингибитора ДДК было начато в 1975 г. Первый двухкомпонентный препарат леводопы, выпущенный в Швейцарии, содержал леводопу и бенсеразид. Несколько позже в США создали еще один препарат, содержащий леводопу и другой ингибитор ДДК – карбидопу. В 1980-е гг. были разработаны препараты с контролируемым высвобождением с целью преодоления развития моторных флуктуаций и дискинезий и обеспечения физиологической стимуляции рецепторов дофамина, а также быстродействующие диспергируемые формы. В 1990-е гг. начались разработки трехкомпонентных препаратов, содержащих леводопу, ингибитор ДДК и ингибитор КОMT. В 2003 г. в США и странах Европы разрешен к применению первый трехкомпонентный препарат (леводопа/карбидопа/энтакапон). Комбинация леводопы с ингибиторами ДДК и КОMT позволяет увеличить время полувыведения леводопы на 85%, биодоступность – до 45%, уменьшить колебания концентрации леводопы в крови больного до 50%. Следствием этого является увеличение продолжительности действия леводопы и существенное повышение эффективности терапии флюктуаций.
Реакция на леводопу при прогрессировании БП изменяется. В ранней фазе (приблизительно первые 4 года болезни) у организма существует способность сохранять дофамин. Порог есть только для утренней дозы леводопы. Во второй период (примерно через 4–7 лет после начала заболевания) появляется «истощение» и короткие периоды «выключения». В третий период (примерно через 7–10 лет после возникновения болезни) истощение с дискинезиями возникает регулярно. Характерны предсказуемые колебания с дискинезиями «включения», имеется четкое терапевтическое окно. В четвертый период (как правило, через 10 и более лет после начала болезни) развиваются непредсказуемые колебания «включения – выключения», а терапевтическое окно становится очень узким. Именно для таких пациентов, у которых пероральное лечение больше не является эффективным, был предложен инновационный подход к терапии – инфузионная терапия гелем для интестинального введения леводопа/карбидопа.
Профессор Э.З. Якупов рассказал, что гель для интестинального введения содержит суспензию карбидопы/леводопы (5/20 мг/мл соответственно). Суспензия распределена по кассетам, соединенным с переносной помпой, которую носят снаружи на теле. Индивидуально программируемая помпа осуществляет постоянную доставку содержимого кассет через трубку непосредственно в начальную часть тонкого кишечника пациента (12-перстную кишку или тонкую кишку). Интрадуоденальное (минуя желудок) введение карбидопы/леводопы уменьшает колебания плазменной концентрации леводопы и, следовательно, выраженность моторных расстройств и обеспечивает поддержание постоянной концентрации дофамина в плазме (так реализуется концепция постоянной дофаминергической стимуляции).
Показаниями для инфузионной монотерапии гелем являются развернутые стадии болезни Паркинсона с выраженными колебаниями двигательных расстройств, с/без дискинезий, и с недостаточной эффективностью наиболее адекватно подобранного противопаркинсонического лечения.
Метод зарегистрирован в 34 странах, включая Швецию, Финляндию, Германию, Канаду, Австралию, Хорватию и Швейцарию. В настоящее время терапию с применением инфузии геля для интестинального введения леводопы/карбидопы получают более 1200 пациентов в мире. В России первая чрескожная гастроскопическая эндоскопия для проведения инфузионной терапии леводопой/карбидопой осуществлена 28 января 2009 г. на базе Казанского ГМУ. На сегодняшний день ведется наблюдение за 19 пациентами с БП III–IV стадий, получающих данную инфузионную терапию. У 17 пациентов обнаружены явные признаки клинического улучшения: отмечено увеличение длительности периодов «включения» и уменьшение продолжительности периодов «выключения», уменьшение выраженности дискинезий.
Помимо тех параметров, влияние на которые инфузионной терапией леводопой/карбидопой было ранее отмечено в зарубежных работах, в Казани изучалось воздействие терапии на вариабельность ритма сердца у пациентов. У больных БП при тяжелом течении обнаружены типичные особенности показателей вариации ритма сердца. Наблюдается выраженное снижение общей мощности спектра (100–600 мс2), обусловленное уменьшением вклада парасимпатических (HF), симпатических (LF) и гуморально-метаболических (VLF) влияний. За счет уменьшения вклада гуморально-метаболических механизмов регуляции усугубляется феномен «ускользания» ритма сердца из-под модулирующего влияния центральных структур – этим обусловлены резкое снижение адаптивных реакций и быстрая истощаемость больных БП. Сердечный ритм у них имеет характеристики авариабельного:
- стабильного (при ЧСС < 80 ударов/мин);
- ригидного (при ЧСС > 80 ударов/мин).
Происходит выраженное снижение вегетативной реактивности и вегетативного обеспечения деятельности. Как отметил профессор Э.З. Якупов, инфузионная терапия заметно влияет на вариабельность сердечного ритма. Перед началом терапии у пациентов с БП наблюдали стабильный авариабельный сердечный ритм. После 6 месяцев терапии сердечный ритм стал вариабельным, изменились в сторону увеличения параметры VLF, LF, HF.
Разумеется, существуют доводы как «за», так и «против» нового метода. Среди первых можно выделить трудоемкость, инвазивность, необходимость постоянного ухода за гастростомой, а также особенности хранения препарата (ему нужен особый холодовой режим). Однако использование инфузии геля для интестинального введения леводопы/карбидопы как монотерапии уменьшает дозировку леводопы в процессе лечения на 5–7%, что является фармакоэкономическим преимуществом. В результате лечения также увеличивается длительность периодов «включения» и уменьшаются периоды «выключения» по сравнению со схемами традиционной терапии. Происходит выраженное улучшение качества жизни пациентов, их бытовая и социальная адаптация. Проанализировав собственный опыт, профессор Э.З. Якупов отметил, что для успешного лечения необходимы проведение «пробной» фиброгастродуоденоскопии (ФГДС), тщательная фиксация трубок, строгий уход за гастростомой, мониторинг состояния пациента на послеоперационном этапе. Предпочтительно отбирать для инфузионной терапии пациентов астенической и нормостенической конституции. Не следует также забывать о психологической поддержке пациента и его родственников.
Заключение
Итоги симпозиума подвела его председатель д.м.н., профессор кафедры неврологии и нейрохирургии РНИМУ им. Н.И. Пирогова А.Б. ГЕХТ. Она еще раз подчеркнула необходимость своевременной терапии моторных и немоторных симптомов у больных БП, особенно на развернутых стадиях. Основной причиной большинства моторных проявлений поздних стадий БП является нехватка дофамина в организме больного, а также резкие колебания концентрации дофамина под влиянием приема лекарств. Главный же принцип лечения осложнений поздних стадий БП заключается в оптимизации дофаминергической терапии, а именно в поддержании постоянной (а не пульсирующей) дофаминергической стимуляции.
Представленные докладчиками данные подтверждают, что новый метод инфузионной терапии гелем для интестинального введения леводопы/карбидопы обеспечивает постоянную дофаминергическую стимуляцию и поэтому существенно улучшает состояние и качество жизни пациентов, находящихся на поздних стадиях болезни Паркинсона. При постоянной инфузии препарата достигается стабильный уровень леводопы в плазме с исключением эпизодов резкого снижения плазменной концентрации препарата. Пациенты отмечают значительное улучшение периода «выключения», а период «включения» сопровождается либо незначительными дискинезиями, либо их отсутствием. Профессор А.Б. Гехт подчеркнула, что у людей, страдающих от многих тяжелых моторных и немоторных симптомов, благодаря внедрению инфузионной терапии леводопой/карбидопой появляется надежда на бытовую и социальную адаптацию.