количество статей
7098
Загрузка...
Пожалуйста, авторизуйтесь:
Медицинский форум
XIX Российский национальный конгресс «Человек и лекарство»: Нерешенные вопросы профилактики и лечения инсульта
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Неврология и Психиатрия" №3
- Аннотация
- Статья
- Ссылки

Д.м.н. О.И. Виноградов
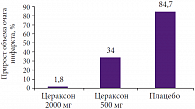
Рис. 1. Динамика объема инфаркта головного мозга на фоне применения препарата Цераксон (n = 214)

Профессор О.С. Левин

Сателлитный симпозиум компании Nycomed: a Takeda Company

Профессор А.Б. Гехт
Терапия ишемического инсульта: состояние проблемы и перспективы
Специфическая терапия, по мнению О.И. Виноградова, является именно тем методом, который доказал свою эффективность у больных с ишемическим инсультом. Специфическое лечение при ишемическом инсульте включает проведение реперфузионной (тромболитической) и нейропротекторной терапии. Реканализацию тромба проводят либо с помощью медикаментозной реперфузии или тромболизиса, либо с помощью механического удаления (тромбо- или эмболоэкстракция). Как отметил О.И. Виноградов, в настоящее время весьма перспективными считаются такие направления в тромболитической терапии, как комбинированное – внутривенное и внутриартериальное – введение тромболитика, использование тромболизиса и механической экстракции тромба, а также совместное применение тромболизиса и сонотромболизиса.
В отличие от тромболизиса, применение которого ограничено пределами 4,5-часового «терапевтического окна», нейропротекторы можно назначать до выяснения характера нарушения мозгового кровообращения на догоспитальном этапе (на дому, в машине скорой помощи), в условиях стационара и в период реабилитации. Существует мнение, что некоторые из нейропротекторов позволяют значительно уменьшить размеры инфаркта мозга, удлинить период «терапевтического окна». В последние годы медикаментозная нейропротекция получила серьезное развитие, появились десятки агентов с различными эффектами, действие которых направлено на стабилизацию функции клеточных мембран, угнетение глутаматно-кальциевой эксайтотоксичности, коррекцию оксидативного стресса и т.д. О.И. Виноградов детально проанализировал эффективность ряда нейропротективных лекарст-
венных средств с позиции доказательной медицины.
Исследование IWEST (Intravenous Nimodipine West European Stroke Trial) продемонстрировало, что раннее назначение нимодипина приводит к худшим исходам инсульта по сравнению с приемом плацебо. Предположительно, это связано с гипотензивным эффектом антагонистов кальция. Результаты исследования группы блокаторов NMDA-рецепторов показали, что выживаемость в группе больных, получавших терапию блокаторами NMDA-рецепторов, была ниже, чем в группе получавших плацебо, – на 30-е сутки в группе плацебо было достоверно больше выживших пациентов. Изучение эффективности назначения магнезии в 12-часовом «терапевтическом окне» показало, что функциональное состояние пациентов в группе лечения было сопоставимо с состоянием пациентов в группе плацебо, однако смертность была выше. Систематический обзор исследований, посвященных использованию антагонистов глутамата у больных инсультом, не обнаружил увеличения частоты благоприятных исходов и снижения уровня смертности после лечения. Применение антиоксидантов сопровождается улучшением функционального состояния у пациентов с ишемическим инсультом в первый месяц, однако это улучшение нивелируется к исходу 3-го месяца (р > 0,05).
На сегодняшний день одним из немногих нейропротекторных препаратов с подтвержденной клинической эффективностью является цитиколин (Цераксон), который обладает наибольшей доказательной базой (исследования начались с середины 1980-х гг.). Цитиколин – это донатор холина в процессе синтеза ацетилхолина и незаменимый метаболит в биосинтезе фосфолипидов, в том числе мембран
нервных клеток. Мембраны клеток мозга богаты фосфолипидами, которые в первую очередь подвергаются разрушению под воздействием факторов первичного и вторичного повреждения. Применение Цераксона способствует восстановлению мембраны нейрона и ее компонентов. В последние 10 лет было проведено большое число исследований, которые продемонстрировали разнонаправленность эффектов Цераксона, защищающих клетку от ишемии и гипоксии. Были показаны существенное уменьшение объема инфаркта мозга, значительное ускорение процессов восстановления, снижение частоты летальных исходов и хорошая переносимость препарата даже в очень больших дозах.
Ряд исследований посвящен оценке влияния препарата Цераксон на прирост ишемического очага у больных в остром периоде ишемического инсульта. Одно из исследований включало результаты наблюдения 214 пациентов. В группы лечения были включены 103 больных, они получали Цераксон в разных дозах (41 пациент – в дозе 500 мг/сут; 62 пациента – 2000 мг/сут), в группу плацебо вошли 111 пациентов. Цераксон назначался в первые 24 часа от начала заболевания, продолжительность курса составила 12 недель. Оценку состояния по шкале NIHSS и морфометрию очага поражения с использованием МРТ/КТ проводили при поступлении и на 12-й неделе.
На фоне применения Цераксона было показано достоверное снижение прироста объема очага инфаркта (по сравнению с плацебо, р = 0,015) и, соответственно, достоверно более низкая частота неблагоприятных исходов. Средний прирост объема очага поражения составил при применении Цераксона 2000 мг/сут – 1,8%; Цераксона 500 мг/сут – 34% ; плацебо – 84,7% (рис. 1). О.И. Виноградов подчеркнул, что цитиколин (Цераксон) – это единственный нейропротектор, который включен в рекомендации по лечению инсульта Европейской инсультной организации (ESO): «Метаанализ результатов исследований выявил эффективность цитиколина…». Экспериментальные исследования продемонстрировали, что совместное применение цитиколина и тромболизиса позволяет уменьшать объем инфаркта мозга, улучшать функциональное восстановление и снижать частоту смертельных исходов.
Постинсультные когнитивные расстройства
Под постинсультными когнитивными нарушениями следует понимать любые когнитивные расстройства, которые имеют временную связь с инсультом: ранние (выявляются в первые 3 месяца после инсульта) или поздние (выявляются спустя 3 месяца, но не позднее 1 года после инсульта). По мнению д.м.н., профессора О.С. ЛЕВИНА (кафедра неврологии Российской медицинской академии последипломного образования), традиционно у пациентов, перенесших инсульт, основное внимание уделяют таким выраженным формам когнитивного дефицита, как деменция или тяжелая афазия. Между тем гораздо чаще встречаются легкие и умеренные формы когнитивного дефицита, раннее выявление которых может способствовать предупреждению дальнейшего нарастания когнитивного дефицита и улучшению прогноза восстановления. В целом, по степени и распространенности когнитивного дефицита выделяют три варианта когнитивных нарушений:
В спектре постинсультных нейропсихологических расстройств фокальные когнитивные нарушения составляют 10–20% случаев, умеренные – 40–60%, деменция – 6–32%. Общая тенденция заключается в том, что доля случаев умеренного когнитивного расстройства уменьшается благодаря процессу спонтанного восстановления когнитивных функций. Тем не менее общая частота когнитивных нарушений спустя 6 месяцев составляет около 10%. Повышенный риск возникновения деменции у лиц, перенесших инсульт, сохраняется, по крайней мере, в течение последующих нескольких лет. В сравнительно небольшом числе эпизодов развитие когнитивных нарушений можно связать с моноочаговым поражением мозга, затрагивающим те мозговые структуры, которые особенно тесно связаны с регуляцией когнитивной деятельности. В этом случае характерны острое и подострое развитие когнитивного дефицита, последующая его стабилизация и полное или частичное обратное развитие нейропсихологических расстройств.
Чаще всего стратегическими являются зоны, входящие в бассейн передней и задней мозговых артерий, базальные ганглии, прилегающее белое вещество, а также область стыка затылочной, височной и теменной коры. Риск развития когнитивных нарушений после инсульта зависит от многих факторов: возраста, низкого социального статуса и уровня образования, наличия когнитивных нарушений до инсульта, артериальной гипертонии, сахарного диабета, кардиальной патологии и пр. Инсульт является одной из самых частых причин деменции, депрессии и эпилепсии у пожилых. По некоторым данным, риск развития когнитивных расстройств выше после атеротромботического инсульта, чем после лакунарного или кардиоэмболического. Вместе с тем нередки случаи развития деменции после лакунарного инсульта, если он возникает на фоне распространенных микроваскулярных изменений, приводящих к диффузному поражению белого вещества, «немым» инфарктам и церебральной атрофии.
Гетерогенность проблемы постинсультной деменции заключается в том, что деменция развивается по разным сценариям. Термин «постинсультная деменция», хотя и означает развитие деменции после инсульта, не обязательно предполагает ее развитие вследствие инсульта. В клинической практике нередки случаи, когда тяжелый когнитивный дефицит развивается у пациента со сравнительно легким двигательным дефектом. Более высоким риском развития когнитивных нарушений сопровождаются повторные инсульты и множественные поражения. Ключевым фактором, влияющим на риск развития когнитивных нарушений, является церебральная атрофия, которая может стать следствием сосудистого поражения мозга и такого нейродегенеративного процесса, как болезнь Альцгеймера.
Отсроченное прогрессирование когнитивных нарушений может быть связано с повторными ишемическими эпизодами, нарастанием микроваскулярных нарушений или нейродегенеративным заболеванием. Необходимость раннего выявления когнитивных нарушений требует от врача настороженности в отношении возможной когнитивной дисфункции у пациента, перенесшего инсульт. Врач может провести быструю скрининговую оценку когнитивных функций с помощью простых тестов, в том числе обязательных регуляторных. Одновременно необходимо оценить аффективный статус пациента. Для пациентов с постинсультной деменцией характерны более высокая смертность, более высокий риск повторного инсульта –деменция, диагностируемая через 3 месяца после инсульта, ассоциируется с трехкратным увеличением риска повторного инсульта.
По мнению профессора О.С. Левина, при инсульте можно выделить не одно, а целых три «терапевтических окна», каждое из которых подразумевает использование определенных терапевтических методов. Первое окно предполагает своевременную тромболитическую и нейропротекторную терапию, второе – вторичную профилактику инсульта, третье – раннюю реабилитацию. Что касается лечения постинсультных когнитивных нарушений, то, по мнению профессора О.С. Левина, оно должно включать базисную терапию с целью предупреждения дальнейшего повреждения мозга и коррекции сопутствующих кардиоваскулярных и иных заболеваний, а также назначение средств, усиливающих когнитивные функции, и отмену средств, ухудшающих когнитивные функции. Кроме того, следует проводить нейропсихологическую реабилитацию.
Ноотропные средства для лечения когнитивных нарушений включают препараты, воздействующие на нейромедиаторные системы, препараты нейротрофического, нейрометаболического или вазо-активного действия. Одним из перспективных подходов к лечению постинсультных когнитивных нарушений является применение предшественника ацетилхолина – цитиколина (Цераксона). Цераксон – один из немногих нейропротекторных препаратов с доказанной клинической эффективностью. Цитиколин – природное эндогенное соединение, которое является промежуточным метаболитом в синтезе фосфатидилхолина – одного из основных структурных компонентов клеточной мембраны.
Под постинсультными когнитивными нарушениями следует понимать любые когнитивные расстройства, которые имеют временную связь с инсультом: ранние (выявляются в первые 3 месяца после инсульта) или поздние (выявляются спустя 3 месяца, но не позднее 1 года после инсульта). По мнению д.м.н., профессора О.С. ЛЕВИНА (кафедра неврологии Российской медицинской академии последипломного образования), традиционно у пациентов, перенесших инсульт, основное внимание уделяют таким выраженным формам когнитивного дефицита, как деменция или тяжелая афазия. Между тем гораздо чаще встречаются легкие и умеренные формы когнитивного дефицита, раннее выявление которых может способствовать предупреждению дальнейшего нарастания когнитивного дефицита и улучшению прогноза восстановления. В целом, по степени и распространенности когнитивного дефицита выделяют три варианта когнитивных нарушений:
- фокальные (монофункциональные – афазия, амнезия);
- множественные, не достигающие степени деменции (постинсультное умеренное когнитивное расстройство);
- множественные, нарушающие социальную адаптацию, независимо от двигательного дефекта.
В спектре постинсультных нейропсихологических расстройств фокальные когнитивные нарушения составляют 10–20% случаев, умеренные – 40–60%, деменция – 6–32%. Общая тенденция заключается в том, что доля случаев умеренного когнитивного расстройства уменьшается благодаря процессу спонтанного восстановления когнитивных функций. Тем не менее общая частота когнитивных нарушений спустя 6 месяцев составляет около 10%. Повышенный риск возникновения деменции у лиц, перенесших инсульт, сохраняется, по крайней мере, в течение последующих нескольких лет. В сравнительно небольшом числе эпизодов развитие когнитивных нарушений можно связать с моноочаговым поражением мозга, затрагивающим те мозговые структуры, которые особенно тесно связаны с регуляцией когнитивной деятельности. В этом случае характерны острое и подострое развитие когнитивного дефицита, последующая его стабилизация и полное или частичное обратное развитие нейропсихологических расстройств.
Чаще всего стратегическими являются зоны, входящие в бассейн передней и задней мозговых артерий, базальные ганглии, прилегающее белое вещество, а также область стыка затылочной, височной и теменной коры. Риск развития когнитивных нарушений после инсульта зависит от многих факторов: возраста, низкого социального статуса и уровня образования, наличия когнитивных нарушений до инсульта, артериальной гипертонии, сахарного диабета, кардиальной патологии и пр. Инсульт является одной из самых частых причин деменции, депрессии и эпилепсии у пожилых. По некоторым данным, риск развития когнитивных расстройств выше после атеротромботического инсульта, чем после лакунарного или кардиоэмболического. Вместе с тем нередки случаи развития деменции после лакунарного инсульта, если он возникает на фоне распространенных микроваскулярных изменений, приводящих к диффузному поражению белого вещества, «немым» инфарктам и церебральной атрофии.
Гетерогенность проблемы постинсультной деменции заключается в том, что деменция развивается по разным сценариям. Термин «постинсультная деменция», хотя и означает развитие деменции после инсульта, не обязательно предполагает ее развитие вследствие инсульта. В клинической практике нередки случаи, когда тяжелый когнитивный дефицит развивается у пациента со сравнительно легким двигательным дефектом. Более высоким риском развития когнитивных нарушений сопровождаются повторные инсульты и множественные поражения. Ключевым фактором, влияющим на риск развития когнитивных нарушений, является церебральная атрофия, которая может стать следствием сосудистого поражения мозга и такого нейродегенеративного процесса, как болезнь Альцгеймера.
Отсроченное прогрессирование когнитивных нарушений может быть связано с повторными ишемическими эпизодами, нарастанием микроваскулярных нарушений или нейродегенеративным заболеванием. Необходимость раннего выявления когнитивных нарушений требует от врача настороженности в отношении возможной когнитивной дисфункции у пациента, перенесшего инсульт. Врач может провести быструю скрининговую оценку когнитивных функций с помощью простых тестов, в том числе обязательных регуляторных. Одновременно необходимо оценить аффективный статус пациента. Для пациентов с постинсультной деменцией характерны более высокая смертность, более высокий риск повторного инсульта –деменция, диагностируемая через 3 месяца после инсульта, ассоциируется с трехкратным увеличением риска повторного инсульта.
По мнению профессора О.С. Левина, при инсульте можно выделить не одно, а целых три «терапевтических окна», каждое из которых подразумевает использование определенных терапевтических методов. Первое окно предполагает своевременную тромболитическую и нейропротекторную терапию, второе – вторичную профилактику инсульта, третье – раннюю реабилитацию. Что касается лечения постинсультных когнитивных нарушений, то, по мнению профессора О.С. Левина, оно должно включать базисную терапию с целью предупреждения дальнейшего повреждения мозга и коррекции сопутствующих кардиоваскулярных и иных заболеваний, а также назначение средств, усиливающих когнитивные функции, и отмену средств, ухудшающих когнитивные функции. Кроме того, следует проводить нейропсихологическую реабилитацию.
Ноотропные средства для лечения когнитивных нарушений включают препараты, воздействующие на нейромедиаторные системы, препараты нейротрофического, нейрометаболического или вазо-активного действия. Одним из перспективных подходов к лечению постинсультных когнитивных нарушений является применение предшественника ацетилхолина – цитиколина (Цераксона). Цераксон – один из немногих нейропротекторных препаратов с доказанной клинической эффективностью. Цитиколин – природное эндогенное соединение, которое является промежуточным метаболитом в синтезе фосфатидилхолина – одного из основных структурных компонентов клеточной мембраны.
В условиях ишемии под действием фосфолипаз, активированных резким повышением концентрации кальция в клетках, фосфатидилхолин распадается с образованием свободных жирных кислот (в том числе арахидоновой кислоты) и свободных радикалов, что ведет к перекисному окислению липидов и окислительному стрессу. Введенный в организм экзогенный цитиколин в результате гидролиза в стенке кишечника и печени распадается на свои основные компоненты цитидин и холин, которые попадают в системный кровоток и участвуют в различных метаболических процессах. Они пересекают гематоэнцефалический барьер, после чего в клетках мозга из них вновь ресинтезируется цитиколин.
Экспериментальные данные свидетельствуют, что цитиколин оказывает плейотропный эффект при ишемии мозга, противодействуя прогрессированию ишемического повреждения тканей. Показано, что цитиколин способствует восстановлению уровня и других фосфолипидов клеточных мембран. Кроме того, цитиколин может способствовать повышению уровня глутатиона и активности глутатионредуктазы, усиливая активность антиоксидантных систем. В результате уменьшения проницаемости гематоэнцефалического барьера препарат может способствовать снижению выраженности отека мозга, играющего важную роль в развитии вторичного повреждения мозга. Нейропротекторный эффект может быть связан и с уменьшением выброса глутамата, что ослабляет ишемический каскад на его ранней стадии. В заключение профессор О.С. Левин подчеркнул, что Цераксон, наряду с Актовегином, может с успехом использоваться для восстановительного лечения пациентов с инсультом.
Экспериментальные данные свидетельствуют, что цитиколин оказывает плейотропный эффект при ишемии мозга, противодействуя прогрессированию ишемического повреждения тканей. Показано, что цитиколин способствует восстановлению уровня и других фосфолипидов клеточных мембран. Кроме того, цитиколин может способствовать повышению уровня глутатиона и активности глутатионредуктазы, усиливая активность антиоксидантных систем. В результате уменьшения проницаемости гематоэнцефалического барьера препарат может способствовать снижению выраженности отека мозга, играющего важную роль в развитии вторичного повреждения мозга. Нейропротекторный эффект может быть связан и с уменьшением выброса глутамата, что ослабляет ишемический каскад на его ранней стадии. В заключение профессор О.С. Левин подчеркнул, что Цераксон, наряду с Актовегином, может с успехом использоваться для восстановительного лечения пациентов с инсультом.
Возможности профилактики и лечения постинсультных когнитивных расстройств, или Так ли неизбежны когнитивные расстройства после инсульта?
Согласно современным европейским данным, деменция занимает второе место среди всех болезней мозга, являясь одной из основных причин инвалидности. Д.м.н., профессор А.Б. ГЕХТ (кафедра неврологии и нейрохирургии лечебного факультета Российского национального исследовательского медицинского университета им. Н.И. Пирогова, главный врач специализированной клинической больницы № 8 им. З.П. Соловьева) сфокусировала свое выступление на возможностях использования препарата Актовегин для предотвращения постинсультных когнитивных нарушений (ПИКН), и в частности деменции. «Если 15 лет назад преобладала “альцгеймеровая” деменция, то сейчас на одну из первых позиций выдвигается смешанная деменция, которая выявляется примерно в 30% случаев, поэтому наиболее актуальными являются препараты, способные эффективно лечить разные варианты деменции», – отметила профессор А.Б. Гехт.
Актовегин включает порядка 200 органических и физиологических компонентов, из них основные – аминокислоты, олигопептиды, гексозы, олигосахариды, полиамины, фосфолипиды, витамины, энергетические метаболиты и пр. Множественный компонентный состав предполагает и плейотропный механизм действия препарата. Согласно результатам ранних клинических исследований, наличие основных компонентов способствует усилению захвата и потребления кислорода при фосфорилировании в митохондриях, усилению утилизации глюкозы клетками, ускорению заживления ран и повышению выживаемости клеток при ишемии. По мнению ряда авторов, изменения, возникающие в стареющем мозге, характеризуются общностью клеточных и молекулярных механизмов, единых для различных нейродегенеративных болезней, а нарушения передачи сигналов и гомеостаза могут приводить к нарушению функционирования нейронов перед их гибелью и изменением нейрональных сетей.
Интерес к изучению механизма действия препарата Актовегин не ослабевает, что подтверждает большое число проводимых современных исследований, сконцентрированных на источнике нейрокинеза. С результатами некоторых из них профессор А.Б. Гехт познакомила участников симпозиума. На модели нейронов гиппокампа эмбрионов крыс in vitro было изучено общее число клеток, длина дендритов, число синапсов, уровень оксидантного стресса и апоптоз. Данные исследования показали, что в культуре клеток, обработанной Актовегином, число клеток увеличилось в 2,4 раза по сравнению с контролем, а число синаптических контактов – в 3,6 раза. Применение Актовегина в высоких дозах значимо подавляло индукцию апоптоза нейронов: в присутствии нейротоксического белка Аβ 25-35 при использовании высоких доз Актовегина в нейронах отмечено существенное снижение индукции апоптоза и снижение уровня перекисного окисления липидов.
Таким образом, результаты исследования in vitro позволили сделать следующие выводы: Актовегин поддерживает жизнеспособность нейронов; уменьшает апоптоз, индуцированный белком Аβ 25-35; увеличивает общее число синаптических связей; снижает выраженность окислительного стресса. Это делает обоснованным применение препарата в раннем восстановительном периоде после инсульта. Эффективность Актовегина доказана в клинических исследованиях:
Актовегин включает порядка 200 органических и физиологических компонентов, из них основные – аминокислоты, олигопептиды, гексозы, олигосахариды, полиамины, фосфолипиды, витамины, энергетические метаболиты и пр. Множественный компонентный состав предполагает и плейотропный механизм действия препарата. Согласно результатам ранних клинических исследований, наличие основных компонентов способствует усилению захвата и потребления кислорода при фосфорилировании в митохондриях, усилению утилизации глюкозы клетками, ускорению заживления ран и повышению выживаемости клеток при ишемии. По мнению ряда авторов, изменения, возникающие в стареющем мозге, характеризуются общностью клеточных и молекулярных механизмов, единых для различных нейродегенеративных болезней, а нарушения передачи сигналов и гомеостаза могут приводить к нарушению функционирования нейронов перед их гибелью и изменением нейрональных сетей.
Интерес к изучению механизма действия препарата Актовегин не ослабевает, что подтверждает большое число проводимых современных исследований, сконцентрированных на источнике нейрокинеза. С результатами некоторых из них профессор А.Б. Гехт познакомила участников симпозиума. На модели нейронов гиппокампа эмбрионов крыс in vitro было изучено общее число клеток, длина дендритов, число синапсов, уровень оксидантного стресса и апоптоз. Данные исследования показали, что в культуре клеток, обработанной Актовегином, число клеток увеличилось в 2,4 раза по сравнению с контролем, а число синаптических контактов – в 3,6 раза. Применение Актовегина в высоких дозах значимо подавляло индукцию апоптоза нейронов: в присутствии нейротоксического белка Аβ 25-35 при использовании высоких доз Актовегина в нейронах отмечено существенное снижение индукции апоптоза и снижение уровня перекисного окисления липидов.
Таким образом, результаты исследования in vitro позволили сделать следующие выводы: Актовегин поддерживает жизнеспособность нейронов; уменьшает апоптоз, индуцированный белком Аβ 25-35; увеличивает общее число синаптических связей; снижает выраженность окислительного стресса. Это делает обоснованным применение препарата в раннем восстановительном периоде после инсульта. Эффективность Актовегина доказана в клинических исследованиях:
- 6 из 7 плацебоконтролируемых клинических исследований использования Актовегина для лечения деменции с участием 450 больных показали положительные результаты;
- 2 плацебоконтролируемых рандомизированных исследования доказали эффективность и безопасность Актовегина в лечении пациентов с диабетической полинейропатией.
В обзоре 2011 г. по вкладу сосудистой патологии в развитие когнитивных нарушений и деменции, подготовленном Американской кардиологической ассоциацией (American Heart Association) и Американской ассоциацией по борьбе с инсультом (American Stroke Association), была подчеркнута необходимость клинических фармацевтических количественных исследований препаратов с привлечением методов нейровизуализации. Именно сейчас начинается широкомасштабное рандомизированное плацебоконтролируемое исследование, целью которого является изучение терапевтической эффективности Актовегина у пациентов с ПИКН.
«В исследовании ARTEMIDA (A Randomized Trial of Efficacy, 12 Months International Double-blind Actovegin) примут участие около 25 исследовательских центров России, Беларуси и Казахстана», – сообщила профессор А.Б. Гехт. К основным задачам исследования относятся: изучение эффективности и безопасности применения Актовегина у пациентов с ПИКН; оценка способности Актовегина влиять на течение заболевания (динамика когнитивных функций после инсульта); изучение влияния Актовегина на развитие постинсультной деменции; изучение способности Актовегина улучшать другие исходы инсульта, помимо когнитивных расстройств. Методология включает рандомизацию пациента в первые 5–7 дней с момента инсульта, подтверждение диагноза с помощью КТ или МРТ перед скринингом, 6 месяцев лечения и 6 месяцев наблюдения. Планируется включить в исследование 500 пациентов.
По мнению профессора А.Б. Гехт, 200 пациентов в каждой группе будет достаточно, чтобы с 90-процентной вероятностью продемонстрировать различия между группами, по меньшей мере, в 2,6 балла по когнитивной подшкале шкалы оценки при болезни Альцгеймера (Alzheimer Disease Assessment cognitive subscale, ADAS-cog+) через 6 месяцев. Будет исследована эффективность внутривенного введения Актовегина по сравнению с плацебо на протяжении до 20 дней, а также эффект перорального курса приема препарата в течение последующих 140 дней. Для оценки будут использованы, помимо ADAS-cog+, Монреальская шкала когнитивной оценки (Montreal Cognitive Assessment, MoCА), мини-шкала психического статуса (Mini-mental State Examination, MMSE), а также шкалы для оценки вторичных конечных точек – качества жизни и депрессии. Завершая выступление, профессор А.Б. Гехт подчеркнула, что предотвращение развития когнитивных нарушений после инсульта имеет все возрастающее значение, поэтому современные исследования сконцентрированы на изучении наиболее эффективных и безопасных методов профилактики деменции и ПИКН в целом.
Заключение
Современные алгоритмы лечения ишемического инсульта включают 5 направлений, наиболее эффективным из которых является специфическое лечение с использованием нейропротекторов. К наиболее эффективным нейропротекторам относятся Цераксон и Актовегин. Данные исследований показали, что на фоне применения Цераксона достоверно снижается частота неблагоприятных исходов – происходит существенное уменьшение объема инфаркта мозга и значительное ускорение восстановительных процессов. На сегодняшний день Цераксон является одним из немногих нейропротекторных препаратов, эффективность которых подтверждена большим числом плацебоконтролируемых исследований. Кроме того, цитиколин (Цераксон) – это единственный нейропротектор, который рекомендован ESO к использованию в терапии инсульта.
Многокомпонентный состав Актовегина способствует усилению захвата и потребления кислорода при фосфорилировании в митохондриях, усилению утилизации глюкозы клетками, ускорению заживления ран и повышению выживаемости клеток при ишемии. Актовегин поддерживает жизнеспособность нейронов, уменьшает апоптоз, увеличивает общее число синаптических связей и снижает выраженность окислительного стресса. По мнению докладчиков, применение Цераксона и Актовегина является одним из перспективных подходов к лечению инсульта и предотвращению постинсультных когнитивных нарушений. Изучение терапевтической эффективности препаратов продолжается. В скором времени стартует широкомасштабное исследование ARTEMIDA c участием 25 медицинских центров России, Беларуси и Казахстана. В рамках этого исследования будет изучаться эффективность и безопасность применения Актовегина у пациентов с ПИКН, а также способность Актовегина влиять на течение заболевания и предотвращать развитие постинсультной деменции.
Современные алгоритмы лечения ишемического инсульта включают 5 направлений, наиболее эффективным из которых является специфическое лечение с использованием нейропротекторов. К наиболее эффективным нейропротекторам относятся Цераксон и Актовегин. Данные исследований показали, что на фоне применения Цераксона достоверно снижается частота неблагоприятных исходов – происходит существенное уменьшение объема инфаркта мозга и значительное ускорение восстановительных процессов. На сегодняшний день Цераксон является одним из немногих нейропротекторных препаратов, эффективность которых подтверждена большим числом плацебоконтролируемых исследований. Кроме того, цитиколин (Цераксон) – это единственный нейропротектор, который рекомендован ESO к использованию в терапии инсульта.
Многокомпонентный состав Актовегина способствует усилению захвата и потребления кислорода при фосфорилировании в митохондриях, усилению утилизации глюкозы клетками, ускорению заживления ран и повышению выживаемости клеток при ишемии. Актовегин поддерживает жизнеспособность нейронов, уменьшает апоптоз, увеличивает общее число синаптических связей и снижает выраженность окислительного стресса. По мнению докладчиков, применение Цераксона и Актовегина является одним из перспективных подходов к лечению инсульта и предотвращению постинсультных когнитивных нарушений. Изучение терапевтической эффективности препаратов продолжается. В скором времени стартует широкомасштабное исследование ARTEMIDA c участием 25 медицинских центров России, Беларуси и Казахстана. В рамках этого исследования будет изучаться эффективность и безопасность применения Актовегина у пациентов с ПИКН, а также способность Актовегина влиять на течение заболевания и предотвращать развитие постинсультной деменции.
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.