Нарушение когнитивных функций является одним из наиболее распространенных неврологических расстройств, особенно среди пациентов пожилого возраста. У лиц старше 65 лет распространенность когнитивных нарушений составляет 6–10%, старше 80 лет – 20%, а в возрасте старше 95 лет – 50%. В ближайшие десятилетия в мире ожидается резкое увеличение численности и доли людей пожилого и старческого возраста. Если в 2005 г. число людей старше 65 лет в 5 основных частях света (Европа, Азия, Африка, Северная Америка и Латинская Америка) составляло 473 млн человек, то к 2050 г. оно достигнет 1457 млн человек. Численность людей старше 80 лет в тех же частях света за тот же период возрастет в 4,5 раза: с 87 до 391 млн человек. Следовательно, можно прогнозировать резкий рост больных с когнитивными нарушениями: с 37 млн человек в 2005 г. до 133 млн человек в 2050 г.
По степени тяжести когнитивные нарушения классифицируют как легкие, умеренные и тяжелые. В последнее время врачи и исследователи все чаще уделяют внимание проблеме додементных (легких и умеренных) когнитивных нарушений. Однако наиболее существенное негативное влияние на повседневную активность человека, его дезадаптацию в профессиональной и социально-бытовой сфере оказывают тяжелые когнитивные нарушения (деменция).
Самый распространенный вид деменции – деменция Альцгеймеровского типа (55–75%), которая характеризуется нарушением памяти и других когнитивных функций (речи, ориентации, планирования, абстрактного мышления, суждения), а также привычных для пациента форм повседневной активности. Ей свойственно постепенное начало и развитие, а также отсутствие фокального неврологического дефицита.
Существенный вклад в развитие деменции вносят цереброваскулярные и кардиоваскулярные заболевания. Критерии диагностики сосудистой деменции основаны на критериях постановки диагноза болезни Альцгеймера (обязательным критерием является нарушение памяти), однако когнитивная дисфункция при сосудистой деменции может иметь разнообразные клинические проявления.
Причинами сосудистой деменции могут быть инсульты, церебральные инфаркты, ишемическое повреждение белого вещества, патология сосудистой стенки. К числу факторов сосудистого риска принадлежат артериальная гипертензия, избыточный вес, гиперхолестеринемия, сахарный диабет, ишемическая болезнь сердца и курение.
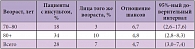
Доктор И. Скуг привел данные собственного исследования, в котором изучался риск развития деменции после инсульта (табл. 1). Так, в группе пациентов 60–70 лет с инсультом когнитивные нарушения развились у 18% человек, по сравнению с 3% в контрольной группе. У пациентов с инсультом старше 80 лет деменция наблюдалась уже в 34% случаев (в контрольной группе – 10%)1.
В другой работе было показано, что через 3 месяца после инсульта легкие когнитивные нарушения развиваются у значительной части больных. Так, у 37% пациентов отмечены нарушения конструктивных и зрительно-пространственных функций, у 31% – кратковременной памяти, у 23% – долговременной памяти. Столь же часто наблюдалось и нарушение исполнительных функций (25%).
Последствия постинсультных когнитивных нарушений неблагоприятны: в 3 раза увеличиваются затраты на лечение таких пациентов, учитывая расходы на госпитализацию и различные виды социальной помощи, растет смертность у больных с постинсультными когнитивными нарушениями.
Насколько распространена сосудистая деменция? Как отметил доктор И. Скуг, это зависит от критериев, положенных в основу постановки диагноза. Было проведено исследование, в котором к пациентам 85 лет были применены различные системы критериев выявления когнитивных нарушений. Оказалось, что по системе DSM-IV деменцией страдают 74% пациентов, по шкале ICD-10 – 33%, Chui-criteria – 27%, а по шкале NINDS-AIREN – только 14%. Несмотря на то что все критерии научно обоснованы, они показали совершенно разные результаты.
«При наличии у пациента и болезни Альцгеймера, и какого-либо цереброваскулярного заболевания невозможно сказать, что сильнее повлияло на когнитивные функции пациента. Нарушения в таком случае диагностируют как смешанную деменцию», – указал доктор И. Скуг.
Факторами риска развития постинсультной деменции являются возраст, мужской пол, артериальная гипертензия, сахарный диабет, фибрилляция предсердий, инфаркт миокарда в анамнезе, гиперлипидемия, повышенный уровень липопротеинов низкой плотности и курение. Стратегия лечения постинсультных когнитивных нарушений включает вторичную профилактику с целью предотвращения других сосудистых событий, оптимальную терапию инсульта в остром периоде и принятие мер, направленных на улучшение когнитивных функций.
Доктор И. Скуг отметил, что существуют данные о достоверном уменьшении выраженности когнитивных функций у пациентов с цереброваскулярными заболеваниями на фоне приема цитиколина (Цераксона) в дозе 1 или 2 г в сутки2. Благоприятное влияние цитиколина на когнитивные функции связано с усилением активности холинергической системы, синтезом и высвобождением дофамина и норадреналина в определенных участках мозга, повышением синтеза фосфолипидов, стабилизацией клеточных мембран и увеличением захвата глюкозы нейронами.
Клинически доказана эффективность препарата Актовегин, влияющего на когнитивные функции при дисциркуляторной энцефалопатии, в том числе у лиц пожилого возраста. Препарат способствует улучшению когнитивных функций благодаря комплексному антигипоксическому и антиоксидантному действию.
Российскими учеными было проведено исследование (2007) по изучению эффективности применения Актовегина для коррекции когнитивных расстройств у больных с инфарктом головного мозга легкой и средней степени тяжести3. В исследовании приняли участие 43 больных с ишемическим инсультом легкой и средней степени тяжести в остром периоде. Пациенты были разделены на две группы. В первую группу включены 32 больных (средний возраст 56,2 ± 2,4 года), получающих Актовегин, вторую группу (сравнения) составили 11 пациентов (средний возраст 55,6 ± 2,4 года), принимавших пирацетам. Анализ динамики клинических проявлений у больных с инфарктами головного мозга легкой и средней степени тяжести при лечении Актовегином в остром периоде показал отчетливое положительное влияние препарата как на общемозговые, так и на очаговые неврологические симптомы. К концу исследуемого периода лечения (30 дней) степень восстановления нарушенных функций при оценке суммарного ишемического балла была достоверно выше (p < 0,05) у больных, получавших Актовегин, чем у больных, пролеченных пирацетамом (табл. 2).
На 10-й день отмечалось достоверное улучшение (p < 0,05) в обеих группах по подшкалам «восприятие» и «память», а в группе больных, получавших Актовегин, – по подшкалам «концентрация внимания» и «счет». К концу 30-дневного курса лечения выявлено значимое (p < 0,05) повышение устойчивости и концентрации внимания, улучшение кратковременной памяти, логического мышления в группе пациентов, получавших Актовегин.
В другое исследование (2010) были включены 104 пациента в остром периоде ишемического инсульта, рандомизированные на 4 группы4. Пациенты 1-й группы (контрольной) получали только стандартную базисную и реперфузионную терапию без применения нейропротекторов, пациенты 2-й группы дополнительно получали терапию цитиколином (Цераксоном) в суточной дозе 1000 мг в/в капельно, 3-й группы – 250 мл 20%-ного раствора Актовегина и 4-й группы – комбинированную терапию цитиколином и Актовегином. Дополнительная терапия нейропротекторами проводилась с 1-го по 10-й день от начала заболевания. Основными критериями оценки терапевтической эффективности препаратов явились степень функционального восстановления больных к 30-м суткам инсульта, определяемая по модифицированной шкале Рэнкина и индексу Бартел, а также выраженность регресса неврологического дефицита к концу острого периода заболевания по шкале тяжести инсульта Институтов здоровья США (National Institutes of Health Stroke Scale, NIHSS).
К 10-м суткам с момента развития инсульта выявлено достоверно более выраженное восстановление неврологических функций по шкале NIHSS (р < 0,05) в группе, получавшей Актовегин и Цераксон. Подобные различия сохранялись и на 30-е сутки заболевания. На 30-е сутки инсульта было выявлено достоверное преобладание больных с хорошим функциональным восстановлением, оцененным по модифицированной шкале Рэнкина, в группах, получавших Актовегин, Цераксон, а также комбинированную терапию, по сравнению с контрольной группой. При этом наибольшее число пациентов с полной функциональной независимостью было выявлено в группе, получавшей комбинированную терапию Актовегином и Цераксоном (р = 0,01), по сравнению с контрольной. Средний балл по индексу Бартел на 30-е сутки также был выше в группах больных, получавших Цераксон и Актовегин (89,3 ± 11,5 и 87,7 ± 13,4 соответственно), и был наиболее высоким в группе комбинированного лечения (94,6 ± 6,2; р = 0,007) в сравнении с контрольной группой.
Выявлена также тенденция к более значимому уменьшению объема ишемического повреждения головного мозга в динамике на 5-е сутки в группе пациентов, получавших комбинированную терапию Актовегином и Цераксоном. Ни в одной из исследуемых групп не было зарегистрировано нежелательных явлений на фоне назначенных препаратов.
В заключение доктор И. Скуг отметил, что результаты приведенных исследований свидетельствуют об эффективности Актовегина и Цераксона у пациентов с перенесенным инсультом, в том числе у пациентов с выявленными когнитивными нарушениями. Однако в настоящее время требуется проводить больше рандомизированных плацебоконтролируемых исследований, чтобы иметь больше статистических данных, делать уверенные выводы и с большей эффективностью помогать пациентам с постинсультными когнитивными нарушениями.
Нерешенные вопросы реабилитации больных, перенесших инсульт
Вопросу оптимизации реабилитационных мероприятий, проводимых пациентам с церебральным инсультом, был посвящен доклад руководителя отдела медико-социальной реабилитации НИИ цереброваскулярной патологии и инсульта, д.м.н., профессора кафедры реабилитации и спортивной медицины РНИМУ им. Н.И. Пирогова Г.Е. ИВАНОВОЙ. «Именно в реабилитации реализуется глобальная концепция в медицине – лечить больного, а не болезнь», – подчеркнула профессор Г.Е. Иванова.
Очень важно помнить о том, что реабилитационные мероприятия должны начаться в течение 48 часов с момента, когда произошла сосудистая катастрофа, они должны быть комплексными и индивидуальными для каждого пациента. На первом этапе следует назначить оптимальное число медикаментозных и немедикаментозных реабилитационных мероприятий. Для этого следует определить объем энергетических ресурсов пациента, а также те нарушения, которые требуют наибольших расходов энергии. Побороть энергодефицит – значит минимизировать осложнения. «Время восстановления энергетических ресурсов – индивидуальный параметр, который зависит от эффективности и функционирования буферной системы (легких, печени, почек)», – отметила профессор Г.Е. Иванова. При этом все терапевтические воздействия должны быть направлены либо на восполнение содержания макроэргов, либо на стимуляцию их образования, либо на снижение потребностей пациента в энергии.
Одним из основных показателей, определяющих реабилитационный потенциал больного с инсультом, является способность организма изменять уровень потребления кислорода и утилизации его тканями в соответствии с изменяющейся потребностью. В зависимости от конкретных условий деятельности и индивидуальных особенностей больных с инсультом первопричинами несоответствия потребления кислорода и необходимости в нем могут быть: снижение энергетических ресурсов в работающих тканях, активности ключевых ферментов; накопление продуктов обмена; нарушение целостности функционирующих структур из-за недостаточности их пластического обеспечения или нарушения гомеостаза; изменение нервной или гуморальной регуляции, подавление иммунитета и др. Все это в равной степени может ограничить применение различных реабилитационных методик.
Реабилитационные мероприятия, базирующиеся на нейропротективной и репаративной коррекции, должны осуществляться на клеточном, тканевом, органном, системном и межсистемном уровне. В процессе восстановления большую роль играют методы повышения толерантности – дыхательные упражнения, аэробные циклические упражнения, медикаментозная поддержка (улучшающие метаболизм миокарда, центральную нервную систему, вегетативную регуляцию). Реабилитационные мероприятия должны не только сами стимулировать эндогенную пластичность и потенцировать накопление энергетических субстратов, но и в полной мере использовать результаты проводимой медикаментозной терапии. Они должны сочетаться с ней по механизмам действия во избежание истощения резервов организма и развития обратной реакции. Следует помнить о том, что неоправданный объем, несвоевременность, неверный выбор стимуляции, неверное сочетание реабилитационных мероприятий могут способствовать не только усугублению неврологической симптоматики, но и приводить к развитию или усугублению полиорганной недостаточности.
По мнению профессора Г.Е. Ивановой, особое значение при инсульте приобретает правильный выбор средств, позволяющих повысить возможности адаптации организма больного с церебральным инсультом, ускорить процессы восстановления функций организма больного в случаях нарушения гомеостаза, то есть необходимо говорить о выборе стратегии проведения нейропротективной терапии, способствующей защите мозга от повреждающих воздействий при любых состояниях. Примером подобного подхода может быть применение препарата Актовегин – одного из самых длительно использующихся в клинике корректоров гипоксии и ишемии, обладающего комплексным влиянием на многие виды нарушений тканевого метаболизма (табл. 3).
Актовегин – высокоактивный стимулятор синтеза и утилизации кислорода и глюкозы в условиях ишемии и гипоксии. Данными экспериментальных исследований показано, что Актовегин не только помогает нейронам пережить период критической ишемии, но и сокращает отрицательное действие постишемической рециркуляции, способствуя ликвидации отсроченного энергетического дефицита. Это наряду с данными клинических исследований делает патогенетически обоснованным применение данного препарата в процессе реабилитационных мероприятий в раннем восстановительном периоде церебрального инсульта с целью увеличения реабилитационного потенциала – безопасного расширения диапазона применяемых стимулирующих методов и увеличения эффективности их использования.
Возможности профилактики и лечения постинсультных когнитивных расстройств
Как отметила д.м.н., профессор кафедры неврологии и нейрохирургии РНИМУ им. Н.И. Пирогова А.Б. ГЕХТ, треть всех расходов здравоохранения уходит на лечение болезней мозга. По некоторым данным, в 30 странах Европы с населением в 514 млн человек экономическое бремя болезней мозга достигает 798 млрд евро в год. Количество людей с болезнями мозга только с 2004 по 2010 г. возросло в Европе с 127,0 до 178,5 млн человек. Среди них 6,3 млн составляют больные с деменцией, 1,3 млн – пациенты, перенесшие инсульт, и 1,2 млн человек страдают болезнью Паркинсона. Одно из первых мест по стоимости лечения и инвалидизации населения занимает деменция.
Преобладающим типом деменции является болезнь Альцгеймера (47,2%), на втором месте стоит смешанная деменция (27,5%), третье место занимает сосудистая деменция (8,7%). Данные о развитии постинсультной деменции разноречивы, можно считать, что через год после инсульта когнитивные нарушения развиваются у 5–15% пациентов, через 3 года – у 10–30%, а через 5 лет – у 20–35% больных.
«В настоящее время большое внимание уделяется препаратам, которые позволяют лечить различные виды деменции одинаково эффективно», – отметила профессор А.Б. Гехт. Одним из таких препаратов является Актовегин, который был разработан еще в 1958 г. Актовегин включает почти 200 органических компонентов, именно благодаря множественному компонентному составу препарат обладает различными механизмами действия. Ранние доклинические исследования демонстрировали способность Актовегина усиливать захват и потребление кислорода при фосфорилировании в митохондриях, усиливать утилизацию глюкозы клетками (инсулиноподобный эффект), ускорять заживление ран и повышать выживаемость клеток после ишемии и действия гамма-излучения. Изучению механизма действия Актовегина был посвящен ряд исследований. Так, на модели нейрона гиппокампа эмбрионов крыс in vitro было изучено влияние Актовегина на общее число клеток, длину дендритов, число синапсов, уровень оксидантного стресса и апоптоз5.
Результаты исследования показали, что число клеток в культуре при добавлении Актовегина увеличилось в 2,4 раза по сравнению с контролем, а число синаптических контактов – в 3,6 раза. Был выявлен дозозависимый эффект роста числа нейронов и синапсов: в присутствии нейротоксического белка Aβ 25-35 при использовании больших доз Актовегина в нейронах отмечено существенное снижение индукции апоптоза и снижение уровня перекисного окисления липидов. Таким образом, в исследовании была показана способность Актовегина поддерживать жизнеспособность нейронов, уменьшать апоптоз, увеличивать общее число синаптических связей и снижать выраженность окислительного стресса. Результаты исследования обосновывают применение в реабилитационном постинсультном периоде Актовегина как препарата, обладающего нейропротективными свойствами.
Эффективность Актовегина продемонстрирована в ряде плацебоконтролируемых исследований. Шесть из семи плацебоконтролируемых клинических исследований эффективности Актовегина у пациентов с деменцией (с общим числом пациентов 450) дали положительные результаты. Двойное слепое плацебоконтролируемое исследование с участием 60 пациентов показало, что Актовегин внутривенно по 250 мл в день улучшает когнитивные функции при смешанной деменции. Результаты по шкале клинической гериатрической оценки (Sandoz Clinical Assessment Geriatric, SCAG) улучшились за 28 дней с 56,3 до 36,3 баллов, тогда как на плацебо это изменение было небольшим (с 61 до 52 баллов)6.
Убедительные данные об эффективности Актовегина получены у пациентов с диабетической полинейропатией в двух рандомизированных плацебоконтролируемых исследованиях. Так, в 6-месячном крупном исследовании показано положительное влияние терапии Актовегином в течение 140 дней на нейропатические симптомы, порог восприятия вибрации, сенсорную функцию и качество жизни у пациентов с диабетом 2 типа7.
Профессор А.Б. Гехт подчеркнула, что Актовегин имеет доказанный профиль безопасности при неврологических заболеваниях. Клинические данные показывают, что частота нежелательных явлений и число больных, досрочно выбывших из исследований, очень малы. Частота нежелательных явлений при использовании Актовегина сопоставима с таковой при приеме плацебо. К 12 июля 2011 г. база данных компании «Никомед» по безопасности препарата насчитывала всего 106 подтвержденных отчетов о нежелательных явлениях. При этом с 1 апреля 1998 г. общее количество пациентов, пролеченных Актовегином, составило 575 тыс. человек (данные на 2009 г.).
Современные исследования направлены в том числе на изучение медикаментозных возможностей предотвращения развития когнитивных нарушений после инсульта. «Сейчас начинается большое рандомизированное двойное слепое плацебоконтролируемое исследование терапевтической эффективности Актовегина в течение 12 месяцев – ARTEMIDA (A Randomized Trial of Efficacy, 12 Months International Double-blind Actovegin). В исследовании примут участие 25 научных центров», – рассказала профессор А.Б. Гехт. В исследование планируется включить 500 пациентов с подтвержденным диагнозом первичного ишемического инсульта не позднее чем в течение 5–6 дней с момента сосудистой катастрофы. Пациенты будут рандомизированы в группу лечения и группу плацебо. В течение 6 месяцев лечения и 6 месяцев наблюдения будет изучена эффективность парентерального приема Актовегина 2000 мг в течение 20 дней, а затем длительного перорального приема Актовегина 1200 мг по сравнению с плацебо. 200 пациентов в каждой группе будет достаточно, чтобы с 90-процентной вероятностью продемонстрировать различия между группами по меньшей мере в 2,6 балла по когнитивной подшкале шкалы болезни Альцгеймера (Alzheimer Disease Assessment cognitive subscale, ADAS-cog+) через 6 месяцев. «Цель исследования – оценить не только безопасность применения препарата у больных с постинсультными когнитивными нарушениями, но и возможность влияния Актовегина на течение заболевания, предотвращение развития постинсультной деменции и улучшение исходов инсультов», – отметила профессор А.Б. Гехт.
В рамках симпозиума была рассмотрена важная медико-социальная и экономическая проблема – когнитивные нарушения разной средней степени тяжести, в том числе деменция, у людей, перенесших инсульт.
Доктор медицины И. Скуг отметил широкое распространение деменции в пожилом (старше 65) и особенно старческом (старше 80 лет) возрасте и большой вклад инсульта в развитие деменции. Он привел методы профилактики и оптимальной терапии инсульта и выразил убеждение в необходимости дальнейшего изучения такого перспективного препарата, как Актовегин.
Профессор Г.Е. Иванова еще раз напомнила, что после инсульта в распоряжении врачей есть всего 48 часов для начала восстановительных мероприятий, и подчеркнула опасность энергетического дефицита в развитии постинсультных осложнений. В таких случаях показано назначение Актовегина – высокоактивного стимулятора синтеза и утилизации кислорода и глюкозы в условиях ишемии и гипоксии.
Профессор А.Б. Гехт отметила, что на лечение болезней мозга уходит треть всех расходов на здравоохранение, и эти заболевания (в частности, постинсультная деменция) обусловливают большой процент инвалидности. Актовегин, содержащий до 200 органических компонентов, дает положительные результаты при лечении деменции, диабетической нейропатии и ряда других заболеваний. Изучение эффективности препарата продолжается, сейчас начинается новое крупное исследование эффективности и безопасности Актовегина у пациентов с постинсультными когнитивными нарушениями – ARTEMIDA.