Заболевания желудочно-кишечного тракта аутоиммунного генеза у пациентов с сахарным диабетом 1 типа
- Аннотация
- Статья
- Ссылки
- English
Заболевания желудочно-кишечного тракта аутоиммунной природы – аутоиммунный панкреатит (АИП) и аутоиммунный гастрит (АИГ) изучены недостаточно. Однако они нередко развиваются у пациентов с сахарным диабетом 1 типа.
Известно, что при АИП возможно поражение как экзокринной, так и эндокринной частей поджелудочной железы. Однако в случае своевременного установления диагноза и инициации терапии возможно полное восстановление экзокринной функции органа и значимое улучшение гликемического контроля.
АИГ длительное время может протекать бессимптомно, в то же время на поздних стадиях вызывает гематологические и онкологические осложнения. Это обусловливает необходимость проведения скрининга, ранней диагностики, профилактики и лечения.
В статье представлены современные данные по обозначенной проблеме.
Заболевания желудочно-кишечного тракта аутоиммунной природы – аутоиммунный панкреатит (АИП) и аутоиммунный гастрит (АИГ) изучены недостаточно. Однако они нередко развиваются у пациентов с сахарным диабетом 1 типа.
Известно, что при АИП возможно поражение как экзокринной, так и эндокринной частей поджелудочной железы. Однако в случае своевременного установления диагноза и инициации терапии возможно полное восстановление экзокринной функции органа и значимое улучшение гликемического контроля.
АИГ длительное время может протекать бессимптомно, в то же время на поздних стадиях вызывает гематологические и онкологические осложнения. Это обусловливает необходимость проведения скрининга, ранней диагностики, профилактики и лечения.
В статье представлены современные данные по обозначенной проблеме.
Сахарный диабет (СД) 1 типа – заболевание, обусловленное наследственными нарушениями механизмов аутотолерантности. Известно, что генетические маркеры HLA, предрасполагающие к развитию СД 1 типа, могут быть ассоциированы и с другими аутоиммунными заболеваниями [1, 2].
Пациенты с СД 1 типа страдают сопутствующими аутоиммунными патологиями практически в пять раз чаще, чем общая популяция [1, 3]. По разным данным, у лиц с СД 1 типа распространенность аутоиммунных заболеваний других органов и систем достигает 5–15%.
Заболевания желудочно-кишечного тракта аутоиммунной природы представляют особый интерес, поскольку их наличие существенно влияет на общий прогноз у таких пациентов.
В то же время приходится констатировать, что в настоящее время аутоиммунные заболевания желудочно-кишечного тракта изучены недостаточно.
Аутоиммунный панкреатит
Течение аутоиммунного панкреатита (АИП) имитирует опухолевые заболевания поджелудочной железы, что нередко приводит к необоснованному оперативному лечению. Так, около 5% панкреатодуоденальных резекций по поводу предполагаемой опухоли поджелудочной железы выполняется у пациентов с АИП [4]. В то же время панкреатобилиарная хирургия ассоциируется с высокой летальностью, а также риском интра- и послеоперационных осложнений.
Своевременно установленный диагноз АИП значительно улучшает прогноз у пациентов, так как консервативное лечение способно обеспечить регресс патологических изменений поджелудочной железы при АИП без оперативного вмешательства [5, 6].
На данный момент времени этиология и патогенез АИП точно не установлены. При этом в клинической практике часто встречается сочетанное течение аутоиммунного панкреатита с другими аутоиммунными заболеваниями, в частности с СД 1 типа [6].
В последние годы получены новые сведения о патофизиологии и диагностике АИП. Как следствие, в 2016 г. эксперты Европейской гастроэнтерологической ассоциации разработали рекомендации по диагностике и лечению хронического панкреатита, включая АИП. Хронический панкреатит – воспалительное заболевание поджелудочной железы, как правило, с длительным анамнезом, при котором собственные ткани замещаются фиброзной тканью и развивается эндокринная и/или экзокринная недостаточность поджелудочной железы. Установлено, что у пациентов с хроническим панкреатитом повышен риск развития рака поджелудочной железы. Поэтому, согласно последним рекомендациям, в случаях, когда не удается установить причину нарушений, необходимо исключить аутоиммунный панкреатит.
На долю АИП приходится около 5% всех случаев хронического панкреатита. Патология чаще встречается у мужчин, чем у женщин – соотношение 2:1. Как было отмечено ранее, примерно у 5% пациентов с подозрением на рак поджелудочной железы АИП устанавливается как окончательный диагноз.
Для АИП характерны повышенный уровень сывороточного иммуноглобулина (Ig) G4, наличие аутоантител к лактоферрину и карбоангидразе, а также соответствующих АИП признаков при использовании визуализирующих методов обследования [6].
К условно специфичным клиническим проявлениям относятся рецидивирующая боль в животе и механическая желтуха – наблюдаются примерно у 50% пациентов.
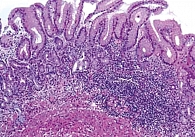
В настоящее время выделяют два типа АИП. При АИП 1 типа повышен сывороточный уровень IgG4, гистологическая картина соответствует лимфоплазмоцитарному склерозирующему панкреатиту с облитерирующим флебитом и перидуктулярным фиброзом (рис. 1) [5]. При АИП 2 типа сывороточный уровень IgG4 остается в пределах нормы, гистологически выявляются идиопатический протоково-концентрический панкреатит и гранулоцитарные эпителиальные поражения. Необходимо отметить, что именно АИП 1 типа часто сочетается с широким спектром IgG4-ассоциированных заболеваний. АИП 2 типа может сопровождаться язвенным колитом [7–9].
К наиболее часто используемым методам визуализации поджелудочной железы относятся ультразвуковое исследование (УЗИ), эндо-УЗИ, магнитно-резонансная томография (МРТ), компьютерная томография (КТ) и эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ). Результаты крупного метаанализа, посвященного оценке эффективности визуализирующих методов обследования хронического панкреатита [10], свидетельствуют, что при его первоначальной диагностике эндо-УЗИ, ЭРХПГ, МРТ и КТ обладают высокой точностью. При этом эндо-УЗИ и ЭРХПГ превосходят в этом другие методы визуализации. Наименее точным признано УЗИ, однако его также можно использовать на первичном этапе обследования. В настоящее время ЭРХПГ не рассматривается в качестве метода диагностики хронического панкреатита по причине инвазивности, малой доступности, высокой стоимости [11].
Сочетанное течение АИП с другими аутоиммунными заболеваниями может быть обусловлено наличием общих антигенов в поджелудочной железе и других органах. Высокая частота встречаемости антител к лактоферрину при АИП может свидетельствовать о том, что лактоферрин является антиген-мишенью и вызывает клеточно-опосредованный иммунный ответ при этом заболевании [4].
При АИП могут страдать как экзокринная, так и эндокринная функции поджелудочной железы. Консервативная терапия в большинстве случаев приводит к их нормализации. К препаратам первой линии относят глюкокортикостероиды (преднизолон и метилпреднизолон). Однако, согласно рекомендациям 2017 г., при наличии противопоказаний к их применению возможно назначение ритуксимаба [12].
Аутоиммунный гастрит
Аутоиммунный гастрит (АИГ) – хроническое воспаление слизистой оболочки тела желудка аутоиммунной природы, приводящее к развитию атрофического гастрита и гипосекреции [13].
По данным ряда авторов, распространенность АИГ в общей популяции составляет 5–10%. Более высокая частота его встречаемости отмечается у пациентов с СД 1 типа.
При АИГ аутоантитела к париетальным клеткам желудка и продукту их секреции – внутреннему фактору (фактору Касла) определяются в плазме крови и желудочном соке [14]. Аутоантитела к париетальным клеткам желудка направлены против H/K-аденозинтрифосфатазы. В результате их воздействия развиваются гипо- или ахлоргидрия, гипергастринемия, а также железо- и В12-дефицитная анемия.
Для оценки состояния слизистой оболочки желудка также проводят анализ крови на пепсиногены I и II, гастрин 17 [15, 16].
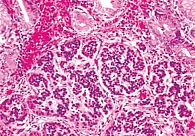
К морфологическим признакам АИГ относятся лимфоплазмоцитарная инфильтрация слизистой оболочки желудка, часто с формированием очаговых лимфоидных скоплений, и псевдогипертрофия париетальных клеток. С течением времени развиваются атрофические изменения: уменьшается количество желез тела желудка, появляются участки метаплазии в кишечнике (рис. 2) [13, 17, 18].
Этиология АИГ до конца не изучена, однако установлена его генетическая обусловленность. Так, существуют семейные формы АИГ, аутоантитела к париетальным клеткам желудка и АИГ выявляются у 30% родственников больных пернициозной анемией. Вероятна связь АИГ с определенными гаплотипами HLA – B8 и DR3 [14]. Нередко АИГ встречается в рамках аутоиммунного полигландулярного синдрома 2 и 3 типа, наряду с СД 1 типа, аутоиммунными заболеваниями щитовидной железы, надпочечниковой недостаточностью и другими аутоиммунными поражениями неэндокринных органов [15–17].
По мнению некоторых авторов, в качестве пускового фактора заболевания могут выступать инфекционные агенты, в частности Helicobacter pylori [18], вирус Эпштейна – Барр [19].
У большинства пациентов АИГ на ранней стадии протекает бессимптомно. По мере прогрессирования атрофических изменений в слизистой оболочке тела желудка и снижения концентрации витамина В12 появляются гиперхромная макроцитарная анемия и неврологическая симптоматика – атаксия, парестезии и слабость в ногах, когнитивные нарушения, деменция.
В большинстве случаев диагноз устанавливают только после развития В12-дефицитной анемии. Однако это свидетельствует уже о длительно существовавшей атрофии слизистой оболочки желудка. У пожилых пациентов В12-дефицитная анемия может приводить к декомпенсации сердечно-сосудистых заболеваний. Увеличение секреции гастрина на фоне атрофии слизистой оболочки тела желудка – к избыточной стимуляции роста энтерохромаффиноподобных клеток желудка и развитию карциноида желудка. Последний отмечается у 70–80% пациентов с АИГ (рис. 3) [13]. Течение карциноида, как правило, бессимптомное, редко приводит к метастазированию [13]. У пациентов с АИГ риск развития рака желудка в два – четыре раза выше, чем в общей популяции [13].
У пациентов с СД 1 типа риск развития АИГ увеличивается с возрастом и длительностью заболевания, пик заболеваемости приходится на возраст 60 лет и старше. Женщины заболевают в четыре-пять раз чаще мужчин [13].
В 2016 г. опубликованы данные о встречаемости аутоиммунного тиреоидита, АИГ, пернициозной анемии у больных CД 1 типа. В исследуемую группу входили 202 пациента, относящиеся к разным этническим группам. У всех больных были проведены исследования на наличие аутоантител к париетальным клеткам желудка. Таковые были обнаружены у 8,9% (17) больных. Дефицит витамина В12 выявлен у 3,5% (7) пациентов, железодефицитная анемия – у 19,3% (39) [20].
Другое недавнее исследование включало 3069 пациентов. Участников исследования разделили на две группы: без нарушения функции щитовидной железы и с ранее диагностированным диффузным токсическим зобом (болезнью Грейвса). У пациентов с болезнью Грейвса были выявлены другие аутоиммунные заболевания, в частности АИГ (2,8%), болезнь Аддисона (0,9%), витилиго (2,7%), ревматоидный артрит (2,4%), целиакия (1,4%). Сочетанное течение аутоиммунных заболеваний зафиксировано в 2,2 и 1,9% случаев – аутоиммунный тиреоидит + АИГ + витилиго + СД 1 типа и аутоиммунный тиреоидит + АИГ + ревматоидный артрит + СД 1 типа соответственно [21].
В 2017 г. представлены данные о взаимосвязи АИГ с аутоиммунными заболеваниями. В исследовании участвовали 138 пациентов: у 11 (7,8%) из них был впервые выявлен СД 1 типа, у 32 (23%) – аутоиммунный тиреоидит, у трех (2,8%) – витилиго. АИГ диагностирован у 90 (65%) больных, пернициозная анемия – у 35 (25%) [22].
Учитывая, что течение АИГ не имеет патогномоничных признаков и он проявляется на поздних стадиях развитием гематологических и онкологических осложнений, необходимо проводить скрининг, раннюю диагностику, профилактику и лечение.
В настоящее время этиологического и патогенетического лечения АИГ в отличие от АИП не существует. Поэтому основное значение отводится своевременной диагностике дефицита витамина В12 и профилактике В12-дефицитной анемии. Кроме того, пациентам с АИГ показано регулярное проведение эндоскопического исследования верхних отделов желудочно-кишечного тракта с биопсией слизистой оболочки желудка с целью ранней диагностики рака желудка [23].
Источник финансирования
Поисково-аналитическая работа по подготовке рукописи проведена при финансовой поддержке Российского научного фонда (проект № 17-75-30035).
Конфликт интересов
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
O.S. Derevyanko, L.I. Ibragimova, E.V. Pekareva, M.R. Ragimov, T.V. Nikonova
Endocrinology Research Centre, Moscow
Contact person: Olga Sergeyevna Derevyanko, Olgader14@mail.ru
The prevalence of autoimmune diseases has increased in recent decades. There are combinations of several autoimmune pathologies.
Autoimmune diseases of the gastrointestinal tract are poorly understood. A special place is occupied by autoimmune pancreatitis (AIP) and autoimmune gastritis (AIG), which develop in patients with type 1 diabetes.
AIP can affect both the exocrine and endocrine parts of the pancreas. Early diagnosis and initiation of therapy may lead to complete recovery of exocrine function and significant improvement in glycemic control.
AIG may be asymptomatic for a long time, however, in the later stages, hematological and oncological complications may occur. Therefore, it is necessary to do the screening, early diagnosis and treatment. This article provides an overview of current data on this issue.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.