Актуальная педиатрия без антибиотиков: от дыхательных путей до урогенитального тракта. XIX Конгресс педиатров России с международным участием «Актуальные проблемы педиатрии». Сателлитный симпозиум компании Bionorica
- Аннотация
- Статья
- Ссылки




Детский синусит: традиционная тактика и альтернатива
Доклад д.м.н., профессора кафедры болезней уха, горла и носа Первого Московского государственного медицинского университета им. И.М. Сеченова, заведующего ЛОР-отделением Научного центра здоровья детей (НЦЗД) Юрия Юрьевича РУСЕЦКОГО был посвящен лечению острого и хронического синусита у детей. Он рассказал о традиционной тактике лечения, принятой оториноларингологами, и об альтернативных методах.
Говоря о детском синусите, надо четко представлять, как формируются околоносовые пазухи у детей. У новорожденных они практически отсутствуют, имеется лишь большая клетка решетчатого лабиринта, которая постепенно начинает расти латерально и, расширяясь вниз, формирует просвет пазухи. К 12 годам он становится таким, как у взрослых. То же происходит с лобной пазухой, которая формируется к четырем годам.
В каждом возрасте лечение синусита имеет свои особенности. Когда речь идет о детях до трех лет, диагноз синусита сомнителен. В этом возрасте обычно сохраняется материнский иммунитет, происходит активное заселение слизистой оболочки микрофлорой. Поскольку пазухи не развиты, можно говорить только о рините и этмоидите (воспаление клеток решетчатого лабиринта). В этом периоде показано исключительно медикаментозное лечение.
У детей старше десяти лет пазухи развиты, глоточная миндалина претерпела инволюцию и уменьшилась в размерах. Соответственно аденоиды (гипертрофированная глоточная миндалина) у таких детей отсутствуют.
Проблемную группу составляют дети дошкольного и младшего школьного возраста – от трех до десяти лет. У них пазухи сформированы не полностью. Кроме того, имеет место диспропорция между объемом пазухи, размером соустья и работой мукоцилиарного аппарата. Местный иммунитет активно формируется через воспаление. Не случайно дети в таком возрасте часто болеют. Иногда аденоиды осложняют хронический бактериальный синусит.
Проблема бактериального синусита у детей в возрасте от трех до десяти лет чрезвычайно актуальна, ей посвящают целые конгрессы, симпозиумы. Но до сих пор единых стандартов лечения не разработано.
Согласно европейской позиции по риносинуситу EPOS (European Position Paper on Rhinosinusitis and Nasal Polyps), симптомами синусита являются назальная обструкция, то есть затруднение носового дыхания, или гнойные выделения из носа, в том числе постназальное стекание. К названным симптомам могут присоединяться боль/давление в проекции пазухи и кашель в течение двух и более недель. Этих симптомов педиатру достаточно, чтобы поставить диагноз синусита в отсутствие рентгенограммы и результатов других дополнительных исследований. Однако диагностика осложняется тем, что при воспалении аденоидов наблюдаются аналогичные симптомы. Без эндоскопии и выполнения дополнительных исследований дифференцировать в таком возрасте заболевания не представляется возможным. Определенный вклад в решение проблемы внесла обновленная редакция EPOS, а точнее, появившееся в ней понятие острого поствирусного риносинусита.
Все синуситы начинаются с воспаления слизистой оболочки. И при острых респираторных заболеваниях (ОРЗ), и при синусите симптомы одни и те же. Разница только в их продолжительности. Если продолжительность симптомов менее десяти дней, имеет место простуда, ОРЗ. Об остром поствирусном риносинусите говорят, если симптомы усиливаются через пять дней или продолжаются свыше десяти дней. После этого острый поствирусный синусит переходит в острый бактериальный. Если это положение европейских рекомендаций адаптировать к российским реалиям, то подобное заболевание можно назвать затяжным насморком. Такое состояние необходимо активно лечить, чтобы не допустить развития тяжелого синусита. Решающую роль играет консервативное лечение, направленное на устранение отека и воспаления для облегчения выведения секрета, эрадикацию возбудителя, профилактику осложнений.
Чтобы лечение было успешным, необходимо открыть соустья, восстановить функцию мукоцилиарного транспорта, эвакуировать отделяемое из пазухи и уничтожить бактерии.
В большинстве случаев при бактериальном риносинусите назначают амоксициллин. Между тем результаты многочисленных исследований показывают, что эффективность амоксициллина по сравнению с таковой плацебо крайне низкая. Иногда статистическая разница отсутствует совсем.
Рост устойчивости Moraxella catarrhalis и Haemophilus influenzae к пенициллинам за счет продукции бета-лактамаз, рост резистентности Streptococcus pneumoniae к пенициллину и другим бета-лактамазам, неэффективность стартового курса – аргументы в пользу того, что необходимо пересматривать лечебную тактику в отношении антибиотиков. При легком (монотерапия) и тяжелом (комбинированная терапия) синусите EPOS рекомендует применять интраназальные глюкокортикостероиды (иГКС). Они позволяют уменьшить отек и расширить соустья.
В европейских рекомендациях EPOS проанализированы все группы препаратов для лечения синусита. Ранее применялись системные антигистаминные препараты (АГП) первого поколения. В схему любого лечения входил Супрастин или Димедрол. С течением времени стало понятно, что эти препараты не уменьшают отек носовых раковин, если речь не идет об аллергическом рините, то есть ситуации, при которой синусит возник на фоне аллергического ринита. Других показаний к назначению АГП нет. Сосудосуживающие капли в качестве основного метода не рассматриваются, поскольку разрушают слизистую оболочку. Ирригационные процедуры, промывание носа демонстрируют ограниченный эффект.
В последней редакции EPOS отдельная глава посвящена изучению горячего увлажненного воздуха. В шести контролируемых рандомизированных исследованиях, соответствовавших принципам доказательной медицины, участвовали 394 пациента. Как показали результаты, применение горячего пара неэффективно при лечении простуды и синусита.
В качестве симптоматического лечения EPOS допускает использование нестероидных противовоспалительных препаратов (НПВП). Тем не менее на продолжительность и выраженность синусита НПВП не влияют.
Данные ряда работ показывают, что цинк сокращает продолжительность ОРЗ и предотвращает острый бактериальный риносинусит. Однако исследования, посвященные изучению этого вопроса, носили экспериментальный характер и оптимальные дозы и схемы применения до сих пор не определены.
Изучению роли витамина C в лечении острого синусита посвящено 30 исследований с участием 11 350 пациентов. Исследователи сделали однозначный вывод: назначение витамина C неоправданно.
В последней редакции EPOS закреплена позиция, подтверждающая эффективность фитотерапии с точки зрения доказательной медицины. Показана эффективность некоторых препаратов при лечении ОРЗ, поствирусного и бактериального синусита.
Основное направление растительных лекарственных препаратов, эффективных при синусите, – секретолитическое.
Хорошим секретолитическим препаратом признан Синупрет®. В ряде исследований его добавление к антибиотикам достоверно улучшало результаты лечения синусита. Отмечалась статистическая достоверность в отношении облегчения и уменьшения симптомов1.
R. Jund и соавт. изучали эффективность и переносимость трав, входящих в состав Синупрета, у больных острым вирусным риносинуситом. Результаты исследования продемонстрировали хорошую эффективность и переносимость экстракта2.
B. Glatthaar-Saalmüller и соавт. оценивали противовирусную активность препарата Синупрет® в виде сухого экстракта и пероральных капель. Противовирусная активность сухого экстракта значительно превосходила таковую пероральных капель3.
На фоне применения Синупрета отмечалось уменьшение выраженности заложенности носа4.
Если синусит не поддается лечению, проводят функциональную эндоскопическую синусовую операцию. Подобная операция у взрослых применяется давно. У детей раньше ее не выполняли из-за опасения, что нарушение внутренних структур среднего носового хода повлияет на рост и развитие лицевого черепа. Изучению именно этого вопроса было посвящено исследование M.R. Bothwell и соавт.5 В течение десяти лет они наблюдали за 67 прооперированными детьми (в начале наблюдения средний возраст пациентов составлял 3,1 года, по окончании – 13,2 года). Количественный и качественный анализ не показал статистической значимости роста лица как у детей, перенесших функциональную эндоскопическую синусовую операцию, так и у тех, кто не подвергался хирургическому вмешательству. Операция достаточно безопасна. Между тем, по данным H.H. Ramadan, 13% детей потребовали ревизионной операции6. В китайском исследовании у 40% детей продолжались гнойные выделения спустя три месяца, то есть эффективность операции отмечалась в 60% случаев7.
Сказанное подтверждает, что функциональная эндоскопическая синусовая операция полностью проблему хронического синусита у детей не решает. В то же время она абсолютно показана при антрохоанальных полипах, поскольку обеспечивает выздоровление в 95% случаев. Кроме того, хирургического лечения требуют такие формы синусита, как изолированный синусит с болевым синдромом, синусит при муковисцидозе, орбитальные осложнения синусита.
Резюмируя сказанное, докладчик подчеркнул, что основой лечения синусита у детей остается консервативная терапия. Назначение антибиотиков не всегда целесообразно. Секретолитическая терапия патогенетически оправданна и является обязательным условием успешного лечения. Адекватная терапия растительными лекарственными препаратами обеспечивает хороший секретолитический, противовоспалительный и противовирусный эффекты. При неэффективности лечения применяется функциональная эндоскопическая синусохирургия.
Фитотерапия в практике детского нефролога
Хроническая болезнь почек (ХБП) – повреждение почек либо снижение их функции в течение трех месяцев и более. Ключевая стратегия в детской нефрологии заключается в предотвращении прогрессирования болезни. По словам д.м.н. Ольги Викторовны КОМАРОВОЙ (НЦЗД), специалисты должны оценивать риск прогрессирования ХБП до терминальной почечной недостаточности. Важно понимать, когда заболевание носит хронический характер, а когда имеет место врожденная патология.
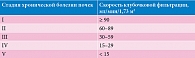
- структурные или функциональные повреждения почек со снижением скорости клубочковой фильтрации (СКФ) в течение трех и более месяцев или без снижения;
- снижение СКФ менее 60 мл/мин/1,73 м2 свыше трех месяцев.
В случае если наблюдается снижение почечных функций менее 60 мл/мин/1,73 м2 в течение более трех месяцев, можно говорить о прогрессировании заболевания, то есть 100%-ном риске дальнейшего снижения функции почек. Концепция ХБП помогает не только оценить риски, но и определить стадию процесса. Индикатором степени выраженности склеротических изменений в почке является СКФ. Стадии четко классифицируются в зависимости от СКФ (таблица).
Докладчик привела результаты исследования, продемонстрировавшие эффективность нефропротективной терапии у детей с различными неиммунными нефропатиями, сопровождавшимися выраженным повреждением тубулоинтерстициального аппарата почки. Ретроспективно были проанализированы истории болезни 44 пациентов, которые наблюдались в нефрологическом отделении НЦЗД. Это были дети с поликистозом почек, дети после перенесенного гемолитико-уремического синдрома с нефросклеротическими повреждениями. В 40% случаев наблюдалась рефлюкс-нефропатия. Иными словами, у участников исследования клинически и лабораторно были диагностированы признаки нефросклероза, прежде всего протеинурии – ключевого маркера наличия нефросклеротических изменений. При этом функция почек не была снижена. У пациентов была зафиксирована первая стадия ХБП, СКФ превышала 90 мл/мин/1,73 м2.
Период наблюдения за больными составил в среднем около восьми лет. Дети с врожденными пороками развития находились под наблюдением до 16 лет. В эту группу вошли пациенты с признаками нефросклероза: у них имела место умеренная протеинурия (в среднем 0,6 г/сут).
Согласно международным рекомендациям, основанным на результатах многочисленных контролируемых исследований, нефропротективную терапию у таких детей следует начинать до момента снижения почечной функции. Нефропротективным эффектом обладают несколько препаратов. Основными из них признаны ингибиторы ангиотензинпревращающего фермента (иАПФ) и блокаторы АТ1-рецептора ангиотензина. Они блокируют ключевые маркеры, активирующие или провоцирующие развитие нефросклероза.
В исследовании 22 пациента получали иАПФ фозиноприл в дозе 0,2 мг/кг. Исследователи оценили период до снижения СКФ менее 60 мл/мин/1,73 м2. Такое снижение считается необратимым. Если при этом зафиксирована гибель более половины почечных клубочков, прогрессирование болезни не остановить. Было показано, что в отсутствие терапии достижение точки невозврата происходило почти в два раза быстрее – через семь лет. На фоне применения фозиноприла в средней дозе 0,2 ± 0,05 мг/кг этот период увеличился до 12 лет. Полученные данные подтверждают, как важно своевременно выявлять факторы риска и применять нейропротективную стратегию.
К факторам формирования и прогрессирования нефропатии относятся:
- негативное уродинамическое воздействие – интраренальный рефлюкс;
- рецидивы инфекции мочевыводящих путей;
- протеинурия;
- вторичная артериальная гипертензия.
Наличие пузырно-мочеточникового рефлюкса (ПМР), особенно в сочетании с рецидивирующими инфекциями, – мощный механизм, способствующий повреждению почечной ткани и развитию нефросклеротических изменений.
Тактика ведения пациентов с ПМР и рефлюкс-нефропатией предусматривает медикаментозное лечение рецидивов инфекции мочевых путей (ИМП), антимикробную профилактику, коррекцию функции мочевого пузыря, хирургическое лечение, нефропротекцию с использованием иАПФ и блокаторов рецепторов ангиотензина II.
При выраженных нефросклеротических изменениях целесообразно использовать препараты, характеризующиеся антипротеинурическим и гипотензивным свойством. Задача специалиста – эффективно купировать наиболее активный воспалительный процесс в почках. Необходимо уменьшить частоту рецидивов ИМП, которые нередко возникают и в отсутствие структурных аномалий в почечной ткани. Раньше нефрологи придерживались единого мнения о необходимости проведения профилактических курсов антимикробными препаратами. В последние годы появились работы, в которых эта точка зрения подвергается сомнению.
В клинических рекомендациях национальных институтов здравоохранения США (National Institutes of Health, NIH), рекомендациях канадского педиатрического общества (Canadian Paediatric Society), ряде работ отмечается, что даже в отсутствие структурных аномалий, прежде всего ПМР, антимикробная профилактика способствует снижению частоты рецидивов ИМП8, 9. Наряду с этим существует и противоположная позиция. Ряд авторов отмечают отрицательные стороны длительного противомикробного применения препаратов10–12. На фоне длительной антимикробной терапии повышается процент антибиотикорезистентности. Проводить подобные профилактические курсы имеет смысл только при выраженной степени ПМР. У детей без структурных аномалий развития мочевыводящих путей длительная антимикробная терапия не снижает риск рецидивов инфекции.
Между тем результаты большинства исследований, в том числе проводимых в НЦЗД, свидетельствуют в пользу того, что на фоне профилактической антимикробной терапии число рецидивов сокращается.
Каждый новый рецидив – это новый рубец почечной ткани, новый очаг нефросклероза. Именно поэтому в определенных случаях целесообразны профилактические курсы. В федеральных клинических рекомендациях по оказанию медицинской помощи детям с ИМП, разработанных Союзом педиатров России и основанных на результатах доказательных исследований, метаанализах, клинических рекомендациях, перечислены показания к проведению профилактического лечения:
- наличие ПМР;
- рецидивы ИМП;
- первый эпизод ИМП до момента исключения аномалий развития мочевой системы (в среднем один месяц).
В целях длительной антимикробной терапии применяются традиционные препараты: нитрофурантоин (1 мг/кг один раз в день), триметоприм/ко-тримоксазол (2 мг/кг один раз в день), амоксициллин с клавулановой кислотой (10 мг/кг один раз в день).
В арсенале врача имеется еще один препарат – Канефрон® Н. В его состав входят трава золототысячника, корни любистока лекарственного, листья розмарина. Показано, что этот фитопрепарат подавляет активность Escherichia coli13. Как известно, в 90% случаев причиной ИМП в детском возрасте является именно E. coli.
В НЦЗД в 2007 г. было проведено сравнительное исследование эффективности нитрофурана и Канефрона Н с точки зрения частоты рецидивов. В целом эффективность была соизмеримой. Но если на фоне применения нитрофурана частота побочных эффектов достигала 21,5%, то при использовании Канефрона Н этот показатель составил всего 2,3%.
Докладчик отметила, что следует продолжать изучение эффективности длительной антимикробной профилактики, а также поиск новых подходов к ней в целях снижения антибиотикорезистентности. Необходимо проводить новые исследования и обмениваться опытом профилактического ведения пациентов с использованием различных антимикробных препаратов. Это позволит работать в рамках единых структур и стандартов.
Лечение инфекции мочевых путей у детей на фоне урологической патологии
В начале своего выступления д.м.н., профессор Сергей Николаевич ЗОРКИН (НЦЗД) напомнил, что ИМП является второй по распространенности бактериальной инфекцией у детей после инфекции верхних дыхательных путей.
ИМП у девочек встречается чаще, чем у мальчиков, – 3,1/1000 в год. Частота рецидивов у девочек также выше – 30% в течение года. У мальчиков эти показатели составляют 1,7/1000 в год и 15–20% соответственно. Однако на первом году жизни у мальчиков ИМП наблюдается значительно чаще, чем у девочек. Это обусловлено врожденной патологией, которая приводит к нарушению уродинамики.
ИМП подразделяют на инфекцию верхних (пиелонефрит, апостематозный нефрит, пионефроз, карбункул почки) и инфекцию нижних (цистит, уретрит, простатит) мочевых путей, а также на неосложненную и осложненную. При неосложненной ИМП отсутствуют нарушения уродинамики, морфологические изменения почек, серьезные сопутствующие заболевания. Осложненные инфекции обусловлены врожденными аномалиями, а точнее, пороками развития мочеполовой системы, что является распространенной проблемой (до 45% всех пороков). Яркими представителями пороков развития мочеполовой системы являются обструкция лоханочно-мочеточникового сегмента, гидронефроз, мегауретер, ПМР.
ИМП – настораживающий признак, особенно у детей первых двух лет жизни. Как показывает статистика, при первом эпизоде ИМП у 10% мальчиков и у 2% девочек в возрасте до года выявляют обструктивную уропатию. ПМР при первом эпизоде ИМП отмечается у 25–49% девочек и менее чем у 25% мальчиков.
Одна из причин возникновения осложненной ИМП – следствие хирургического вмешательства. При выполнении открытых эндоскопических операций часто требуется отведение мочи, дренирование мочевых путей. Для этого применяются пиелостомы, нефростомы, уретральные катетеры. В последнее время широко используются методы внутреннего стентирования. Стенты устанавливаются в среднем на период от семи до 14 дней, но иногда этот период затягивается до трех – шести месяцев. Несмотря на строгое соблюдение правил асептики и антисептики, профилактики распространения инфекционных заболеваний, не исключен риск инфицирования мочевых путей.
Урологический контингент больных представлен двумя группами. Первую группу составляют дети с проявлением ИМП, но без урологической патологии. Вторая группа – дети без проявления ИМП, но с выявленной урологической патологией. По результатам диагностического обследования пациентам подбирают метод лечения: консервативное, оперативное (открытые реконструктивно-пластические операции либо эндоскопические). Не следует забывать и о детях, которым выполняется периодическая очищающая катетеризация.
Что касается микробного пейзажа у больных ИМП, за последние 25 лет он не изменился. Как и прежде, имеет место устойчивая эпидемиология по типу бактерий. Наблюдается несколько региональных различий в наборе микроорганизмов.
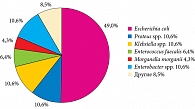
Согласно данным НЦЗД, у амбулаторных больных ИМП первое место занимает Escherichia coli – 49,0%, второе делят Enterobacter spp., Klebsiella spp. и Proteus spp. – по 10,6% (рис. 1).
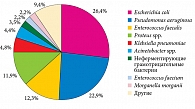
Дети, прошедшие стационарные исследования, имеют госпитальную флору. В спектре возбудителей лидирующие позиции занимают E. coli – 26,4% и Pseudomonas aeruginosa – 22,9% (рис. 2).
На стенках устанавливаемых катетеров и дренажей образуется биопленка, представляющая собой скопление микроорганизмов и фрагментов их нуклеиновых кислот в мукополисахаридной среде. Это так называемая катетер-ассоциированная флора. На сегодняшний день ни один антибиотик не способен уничтожить микровозбудитель, пока дренаж не будет изъят.
Результаты исследований микробного пейзажа при различных способах деривации мочи, проводимых в НЦЗД, показали преобладание Pseudomonas aeruginosa, особенно на уретральных катетерах вследствие их длительного использования.
Лечение осложненной ИМП предусматривает нормализацию уродинамики, то есть восстановление нормального пассажа мочи. Одновременно с этим проводится антибактериальная профилактика. Она касается не только рецидивов. Существует также периоперационная антибактериальная профилактика и антибактериальная профилактика при инвазивных (диагностических, эндоскопических) вмешательствах.
Антибактериальная терапия предусматривает применение в первую очередь бета-лактамных ингибиторозащищенных аминопенициллинов. За ними следуют цефалоспорины второго – четвертого поколения, аминогликозиды и карбапенемы. Их можно рассматривать как антибиотики группы резерва, используемые только в стационарах.
В целях периоперационной антибактериальной профилактики применяются бета-лактамные ингибиторозащищенные аминопенициллины (амоксициллин + клавулановая кислота, тикарциллин + клавулановая кислота), цефалоспорины второго и третьего поколения (цефуроксим, цефотаксим, цефтриаксон, цефтазидин, цефперазон). У детей, у которых в анамнезе присутствуют рецидивы ИМП, в целях антибактериальной профилактики при инвазивных манипуляциях используют нитрофураны, фосфомицин, бета-лактамные ингибиторы или цефалоспорины второго и третьего поколения.
Как известно, длительная антибиотикотерапия приводит к развитию антибиотик-ассоциированной диареи. Кроме того, в результате широкого применения антибиотиков появились устойчивые к ним возбудители болезней. Учитывая это, надо с осторожностью подходить к назначению антибиотиков.
Существует ли альтернатива антибиотикам? Возможно ли полное замещение антибактериальной терапии или ее дополнение к комплексному лечению? В случае осложненной ИМП альтернативы антибиотикам нет. Но можно говорить о применении бактериофагов (вирусы, избирательно поражающие бактериальные клетки) и фитотерапии. В одном из исследований, проведенных в НЦЗД, сравнивали эффективность такого комплексного лечения с эффективностью только антибактериальной терапии. При использовании указанного комплекса частота рецидивов пиелонефритов снижалась, увеличивалась продолжительность ремиссии. Показатели мочи приходили в норму в более короткие сроки. Это свидетельствовало о том, что комплекс был эффективнее монотерапии антибиотиками.
На сегодняшний день перечень фитопрепаратов обширен. Но наиболее широкое распространение при ИМП, причем не только во взрослой, но и в педиатрической практике, получил препарат Канефрон® Н. Он характеризуется антимикробным, противовоспалительным, диуретическим, спазмолитическим действием. Канефрон® Н повышает эффективность антибактериальной терапии, уменьшает количество повторных обострений (рецидивов) хронического цистита и пиелонефрита, способствует отхождению конкрементов и предотвращению появления новых камней при мочекаменной болезни. Препарат может быть использован в качестве монотерапии при рецидивирующей неосложненной инфекции нижних мочевых путей.
Изучению эффективности препарата Канефрон® Н при осложненной и неосложненной инфекции у взрослых и детей был посвящен ряд отечественных и зарубежных исследований. Полученные результаты однозначно подтверждают целесообразность использования препарата и его эффективность14–19.
Резюмируя сказанное, профессор С.Н. Зоркин подчеркнул, что золотым стандартом лечения осложненной ИМП остаются антибиотики. ИМП можно предотвратить с помощью профилактического лечения антибиотиками, но такое лечение следует назначать только в особых случаях. Результаты ряда исследований показывают положительное лечебное и профилактическое действие растительных препаратов, в частности препарата Канефрон® Н.
Современные подходы к диагностике и лечению тонзиллитов у детей
К ак отметила к.м.н., заведующая отделением восстановительного лечения ЛОР-органов и челюстно-лицевой области НИИ профилактической педиатрии и восстановительного лечения НЦЗД Татьяна Андреевна ПОЛУНИНА, тонзиллит не бывает изолированным поражением лимфоидной ткани и обычно сопровождается острым воспалением слизистой оболочки задней стенки глотки. Острый фарингит – диффузное воспаление слизистой оболочки глотки, как правило, является одним из клинических симптомов острых респираторных инфекций. Острый фарингит может протекать как самостоятельное заболевание, но чаще сочетается с тонзиллитом, что объясняет использование диагностического термина «острый тонзиллофарингит».
Международная классификация болезней 10-го пересмотра подразделяет острый фарингит на стрептококковый фарингит, острый фарингит, вызванный другими уточненными возбудителями, и острый фарингит неуточненный. Аналогично классифицируется и острый тонзиллит.
Предрасположенности к возникновению тонзиллита в зависимости от пола и возраста не существует. Тонзиллофарингитом, как и любым инфекционным заболеванием, чаще болеют жители городов, крупных населенных пунктов. Предрасполагающим фактором служит длительное нахождение в общественных местах (детских дошкольных учреждениях, школах, общественном транспорте).
Заболевание не имеет четкой сезонности, но обычно возникает в период эпидемии респираторных инфекций.
Тонзиллофарингит может возникнуть при контакте с больным в результате экзогенного инфицирования вирулентным возбудителем, способным вызывать заболевание у человека с нормальной реактивностью, а также в результате аутоинфекции, то есть активации возбудителей, вегетирующих на слизистой оболочке миндалин, при воздействии неблагоприятных факторов окружающей среды в условиях ослабления иммунных механизмов.
Острый тонзиллофарингит относительно нетяжелое заболевание, возможно самостоятельное разрешение без лечения через три – пять дней болезни.
Заболевание ассоциируется с тяжелыми гнойными осложнениями (паратонзиллярный абсцесс, флегмона шеи, лимфаденит, мастоидит, средний отит и т.д.) и негнойными иммунопатологическими болезнями (гломерулонефрит, ревматические пороки сердца, синдром PANDAS (Pediatric Autoimmune Neuropsychiatric Disorders Associated with Streptococcal Infections – детские аутоиммунные нервно-психические расстройства, ассоциированные со стрептококковыми инфекциями)).
При этом 60–90% острых тонзиллофарингитов имеют вирусную этиологию, 10–40% – бактериальную. Среди бактериальных возбудителей наибольшее значение имеет БГСА – бета-гемолитический стрептококк группы A (Streptococcus pyogenes)20.
Бактериальный тонзиллофарингит обычно наблюдается у пациентов в возрасте от пяти до 15 лет, сопровождается внезапным появлением боли в горле, температурой тела > 38 ºC, головной болью, тошнотой, симптомами интоксикации. При вирусном тонзиллите обычно отмечаются конъюнктивит, ларингит, осиплость голоса, кашель, ринит, диарея, афтозный стоматит, вирусная экзантема.
Для фарингоскопической картины при стрептококковых тонзиллитах, ассоциированных с БГСА, характерна выраженная гиперемия небных миндалин, иногда с мелкими наложениями в устьях лакун, шейный лимфаденит, экзантематозная сыпь на коже и слизистых оболочках. Характерным клиническим признаком скарлатины является «малиновый» язык у больного.
В свою очередь при вирусных тонзиллофарингитах фарингоскопическая картина несколько иная. Так, при вирусе Коксаки, относящемся к энтеровирусным инфекциям, или «герпангинам», на миндалинах и задней стенке глотки видны небольшие красноватые пузырьки. Через три-четыре дня пузырьки лопаются или рассасываются, слизистая оболочка приобретает нормальный вид. У детей могут быть высыпания на ладонях, подошвах и лице. Заболевание, вызванное вирусом Коксаки, отличается высокой контагиозностью, передается воздушно-капельным и редко фекально-оральным путем. Это заболевание не требует лечения.
Причиной возникновения тонзиллофарингита может быть инфекционный мононуклеоз, вызванный вирусом Эпштейна – Барр. При инфекционном мононуклеозе всегда наблюдаются воспалительные изменения небных миндалин по типу катаральной, фолликулярной или язвенной ангины, могут преобладать язвенно-некротические изменения. Наиболее характерным является увеличение поверхностных и глубоких лимфатических узлов. В связи с поражением носоглоточной миндалины у больных инфекционным мононуклеозом отмечаются выраженная заложенность носа, затрудненное носовое дыхание. При инфекционном мононуклеозе наблюдаются гипертермия, увеличение размеров печени (гепатоспленомегалия).
Для лечения детей с инфекционным мононуклеозом применяют местную терапию, обезболивающие, жаропонижающие препараты. Антибактериальную терапию назначают в случае присоединения бактериальной инфекции.
В клинической практике педиатров встречаются случаи тонзиллофарингита, ассоциированного с аутоиммунными болезнями человека (human autoinflammatory diseases – HAIDS). Синдром Маршалла характеризуется периодической (один раз в три – пять недель) лихорадкой, сопровождающейся афтозным стоматитом, фарингитом и шейным лимфаденитом. Болезнь также называют PFAPA-синдром (Periodic Fever, Aphtousis stomattis, Pharingitis, cervical Adenitis). Особенность этого синдрома заключается в том, что клинические проявления повторяются с достаточно регулярной периодичностью. Применение глюкокортикостероидов однократно или в течение двух-трех дней в снижающейся дозе приводит к быстрой нормализации температуры, хотя и не предотвращает рецидивов.
Далее докладчик рассказала об использовании маркеров бактериального воспаления для дифференцирования бактериального тонзиллофарингита. Следует отметить, что анализы крови не рекомендованы для рутинной дифференциальной диагностики этиологии тонзиллофарингитов. Чаще лейкоцитарная форма бывает в пределах нормы. Уровень С-реактивного белка также не является чувствительным показателем дифференциальной диагностики вирусных и бактериальных тонзиллитов21.
Золотым стандартом диагностики тонзиллофарингита остается культуральное исследование материала с небных миндалин. При соблюдении всех условий чувствительность метода достигает 90–95%. Однако в некоторых регионах отмечается недостаточная доступность этого метода. Поэтому разработаны экспресс-тесты для диагностики БГСА при остром тонзиллофарингите, позволяющие определить присутствие антигена этого микроорганизма в материале из ротоглотки. Чувствительность экспресс-тестов достигает 85–86%, специфичность у детей – 92–96%22, 23.
Исследование уровня антистрептолизина-О (АСЛ-О) сыворотки крови считается инструментом исключительно ретроспективной диагностики тонзиллофарингита, ассоциированного с БГСА. Уровень АСЛ-О в сыворотке крови в норме не должен превышать 200 ЕД. Повышение уровня АСЛ-О может быть обусловлено недавно перенесенной или текущей инфекцией БГСА, C и G, а также подтверждает диагноз осложнений инфекции (гломерулонефрита, ревматической лихорадки и др.).
На повышение уровня АСЛ-О может влиять прием антибактериальных препаратов. Негативный тест не исключает диагноза стрептококкового тонзиллита. Если необходимо подтверждение диагноза, следует повторить анализ уровня АСЛ-О через десять дней. Надо помнить, что уровень АСЛ-О снижается в течение 6–12 месяцев после перенесенной БГСА-инфекции.
Лечение острого тонзиллита подразумевает назначение системной антибактериальной терапии и препаратов местного действия (антисептиков, противовоспалительных, обезболивающих препаратов, растительных лекарственных средств с противовоспалительным и иммуномодулирующим действием). В случае острой БГСА-инфекции назначают системную антибактериальную терапию на десять дней. Препаратом первого выбора в этом случае считается амоксициллин. Если ребенка лихорадит и у него сильная боль, можно использовать НПВП. Симптоматическое лечение заключается в купировании болевого синдрома и местной терапии.
Среди растительных лекарственных препаратов для комплексной терапии следует выделить Тонзилгон® Н, обладающий противовоспалительным, антисептическим и иммуномодулирующим действием. Показаниями к применению препарата являются острые и хронические заболевания верхних дыхательных путей (тонзиллит, фарингит, ларингит). Его используют также для профилактики осложнений при респираторных вирусных инфекциях и как дополнение к терапии антибиотиками при бактериальных инфекциях.
Тонзилгон® Н – эффективный и безопасный растительный лекарственный препарат, разрешен к применению у детей с первого года жизни.
Подводя итог, Т.А. Полунина отметила, что при подозрении на развитие у детей с тонзиллофарингитом гнойных осложнений, при атипичной фарингоскопической картине, подозрении на новообразование или в случае решения вопроса о хирургическом вмешательстве необходима консультация оториноларинголога.
Заключение
К числу препаратов, продемонстрировавших эффективность в лечении острых инфекционных заболеваний у детей, относятся фитопрепараты. Современные фитопрепараты создаются с использованием многовековых традиций фитотерапии и применением новейших научных технологий.
Для лечения острого синусита у детей применяют препарат Синупрет® («Бионорика»). В состав препарата входит уникальная комбинация из пяти растений, обладающих различными терапевтическими эффектами: корня генцианы, первоцвета весеннего, щавеля обыкновенного, бузины черной и вербены лекарственной. Синупрет® уменьшает вязкость бронхиального секрета за счет стимуляции секреторных клеток слизистой оболочки бронхов и околоносовых пазух. Препарат характеризуется выраженным секретолитическим, противовоспалительным и иммуномодулирующим действием. По данным исследований, применение Синупрета в комплексной терапии острого синусита у детей способствует увеличению эффективности антибактериальной терапии.
Для эффективной терапии ИМП у детей применяют препарат Канефрон® Н, характеризующийся противовоспалительным, мочегонным, антибактериальным и сосудорасширяющим эффектами. Благодаря комплексному воздействию Канефрон® Н способствует устранению воспалительных заболеваний мочевыделительной системы как у детей, так и взрослых. В состав препарата входят лекарственные растения золототысячник, любисток, розмарин. К преимуществам препарата Канефрон® Н относится возможность его использования не только в качестве основной терапии, но и в комплексной. Препарат усиливает эффект базового противовоспалительного лечения.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.