количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Обзоры
Актуальные вопросы этиологии, эпидемиологии и лечения острого и хронического бактериального простатита – новые данные на 2013 год
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Урология и Нефрология" №2 (16)
- Аннотация
- Статья
- Ссылки
- English
В обзоре анализируются результаты новейших зарубежных и отечественных клинических исследований (2010–2012), касающихся проблем бактериального простатита.
Приводятся данные о возбудителях и особенностях клинического течения заболевания, эффективности антимикробных и небактериальных препаратов в терапии простатита.
Изложены ключевые положения современных клинических рекомендаций Европейской ассоциации урологов по антибактериальной терапии простатита, базирующихся на исследованиях, проведенных до 2010 г. включительно.
Даны рекомендуемые схемы лечения при остром бактериальном простатите, хроническом бактериальном простатите и воспалительном синдроме хронической тазовой боли.
В обзоре анализируются результаты новейших зарубежных и отечественных клинических исследований (2010–2012), касающихся проблем бактериального простатита.
Приводятся данные о возбудителях и особенностях клинического течения заболевания, эффективности антимикробных и небактериальных препаратов в терапии простатита.
Изложены ключевые положения современных клинических рекомендаций Европейской ассоциации урологов по антибактериальной терапии простатита, базирующихся на исследованиях, проведенных до 2010 г. включительно.
Даны рекомендуемые схемы лечения при остром бактериальном простатите, хроническом бактериальном простатите и воспалительном синдроме хронической тазовой боли.
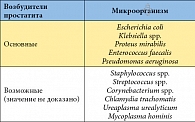
Таблица 1. Наиболее часто выявляемые возбудители простатита*

Таблица 2. Сравнительная характеристика антибактериальных препаратов, используемых для лечения хронического бактериального простатита
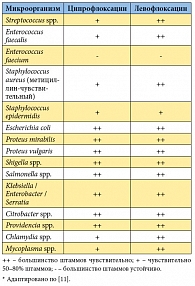
Таблица 3. Природная чувствительность бактерий к ципрофлоксацину и левофлоксацину*
Простатит – заболевание, которое характеризуется наличием клинических и/или лабораторных симптомов воспаления/инфекции предстательной железы, – является одним из наиболее частых урологических заболеваний у мужчин репродуктивного возраста. По различным данным, хроническим простатитом страдают от 8 до 35% мужчин в возрасте от 20 до 40 лет. Установлено также, что у мужчин хронический бактериальный простатит в большинстве случаев является причиной рецидивирующих инфекций мочевых путей. Понятие «простатит» в настоящее время включает острый или хронический бактериальный простатит, а также синдром хронической тазовой боли, при котором современные методы диагностики не способны выявить инфекционного агента.
Патогенез простатита
Основные возбудители простатита представлены в таблице 1 [1]. По обобщенным данным, доля острого и хронического бактериального простатита, вызываемого «основными» возбудителями, составляет 5–10% от всех случаев диагностики простатита. Роль так называемых атипических микроорганизмов (хламидий, уреаплазм, микоплазм) в возникновении простатита на сегодняшний день не считается доказанной. Современное состояние микробиологии пока не позволяет установить границу между нахождением данных микроорганизмов в уретре и инфицированием ими простаты.
У больных вирусом иммунодефицита человека (ВИЧ) этиологическими возбудителями могут также быть дрожжевые грибы (Candida spp.), микобактерии туберкулеза и такие редкие микроорганизмы, как Coccidioides immitis, Blastomyces dermatitidis и Histoplasma capsulatum. До появления антибиотиков большую роль в возникновении бактериального простатита, а в особенности абсцедирующей его формы, играли гонококки (Neisseria gonorrhoeae).
Считается, что бактериальный простатит (острый и хронический) в большинстве случаев вызывается бактериями семейства Enterobacteriaceae, в частности кишечной палочкой (E. coli).
Интересное исследование, проливающее свет на патогенез развития хронического простатита, было опубликовано американскими исследователями в 2011 г. [2]. Ученые выделили у больного хроническим простатитом штамм E. coli посредством мультиплексного анализа методом полимеразной цепной реакции (ПЦР), изучили его фенотип и гены – факторы вирулентности, а затем с использованием этого штамма исследовали молекулярный патогенез развития бактериального простатита на культуре клеток и на мышиной модели. Выделенный штамм кишечной палочки оказался атипичным CP1-штаммом, относящимся к группе В1 и отличающимся от большинства уропатогенных E. coli как филогенетически, так и по профилю факторов вирулентности. Другими словами, возбудителем хронического воспаления в простате у больного явился особенный с генетической точки зрения патоген. Чрезвычайно интересные данные были получены на этапе эксперимента на мышиной модели. Оказалось, что у мышей породы NOD после инфицирования данным штаммом кишечной палочки развивалось типичное хроническое бактериальное воспаление, при этом поведенческие реакции, характерные для синдрома хронической тазовой боли, сохранялись и после эрадикации возбудителя. В то же время у крыс другой породы (C57BL/6J) поведенческие реакции синдрома хронической тазовой боли после эрадикации возбудителя исчезали. Проанализировав результаты исследования, ученые пришли к следующим выводам: во-первых, хронический бактериальный простатит (в отличие от острого) вызывается атипичным штаммом E. coli, а во-вторых, бактериальная инфекция способна инициировать «абактериальный» синдром хронической тазовой боли у генетически предрасположенных млекопитающих.
В исследовании J.N. Krieger и соавт. [3] была изучена E. coli, вызвавшая острый простатит у ранее не страдавших данным заболеванием молодых мужчин (n = 18). Анализ генов – факторов вирулентности E. coli производился посредством ПЦР-анализа, филогенетическая группировка проводилась по результатам триплексной ПЦР. Кроме того, изучался профиль резистентности каждого микроорганизма. Из 18 выделенных штаммов 13 относилось к филогенетической группе В2, 5 штаммов – к группе D. Исследователи отметили, что выявленные возбудители первичного острого простатита были преимущественно представлены экстраинтестинальной патогенной E. coli (ExPEC) с высокой концентрацией генов – факторов вирулентности (hly, cdt1, clb, pap, sfa/foc, fyuA, iroN, kpsMT(II), traT). Более того, в группе штаммов В2 был обнаружен как минимум один токсин с канцерогенным потенциалом (в частности, колибактин, цитотоксический некротизирующий фактор и др.). Это может косвенно свидетельствовать о повышенном риске развития рака простаты у пациентов, инфицированных этим штаммом E. coli. В то же время все выявленные штаммы были чувствительны к стандартным антибактериальным препаратам.
V. Nagi и D. Kubej [4] в 2012 г. опубликовали результаты клинического исследования современного спектра и чувствительности возбудителей острого бактериального простатита к противомикробным препаратам (n = 192). По представленным данным, основным возбудителем острого простатита была E. coli – она выявлена у 53,7% больных, за ней по частоте следовали Pseudomonas aeruginosa и Klebsiella spp. У 8,3% пациентов было выявлено 2 уропатогена, а у 33,8% больных бактериальное исследование вообще не выявило возбудителя. Кроме того, в 7,3% случаев острый простатит прогрессировал и приводил к развитию уросепсиса.
T. Cai и соавт. [5] на базе одной итальянской клиники за период с января 1997 по декабрь 2008 г. провели крупное эпидемиологическое исследование (n = 6222). Ученые изучили спектр возбудителей хронического бактериального простатита, который существенно отличался от спектра возбудителей острого бактериального простатита, представленного в исследовании V. Nagi и D. Kubej [4]. Так, наиболее часто встречающимися (74%) возбудителями хронического простатита были грамположительные бактерии, в частности Enterococcus faecalis, а грамотрицательные бактерии выявлялись лишь в 26% случаев. Авторы также отметили, что при сравнении периодов 1997–1999 гг. и 2006–2008 гг. в структуре возбудителей увеличилась доля Enterococcus faecalis и снизилась доля E. coli, что сопровождалось снижением чувствительности уропатогенов к ципрофлоксацину при сохраняющейся чувствительности к левофлоксацину.
Клиническая картина простатита
За последние годы также был проведен ряд исследований, посвященных клиническим особенностям течения и эффективности антимикробной терапии бактериального простатита.
W.P. Zhao и соавт. [6] оценили эффективность антибактериального лечения хронического бактериального простатита в зависимости от наличия или отсутствия камней в предстательной железе. Всего в исследовании принял участие 101 пациент. В 1-ю группу включались пациенты (n = 39), у которых при УЗИ в простате были выявлены кальцинаты, во 2-ю группу (n = 62) – больные, не имевшие камней в предстательной железе. Всем пациентам в течение 4 недель проводилась антибактериальная терапия с последующим периодом наблюдения от 3 до 8 месяцев. Интересно, что микробиологическая эффективность в группах сравнения сразу по окончании лечения не имела статистически значимых отличий (82,1% и 87,1% соответственно). Однако при оценке в конце периода наблюдения у больных 1-й группы микробиологическая эффективность составила 43,6%, а у больных 2-й группы – 72,6% (различия между группами были статистически значимыми). Эти результаты позволили авторам сделать вывод, что наличие камней в предстательной железе негативно влияет на эффективность антибактериальной терапии хронического бактериального простатита.
B.I. Yoon и соавт. [7] провели исследование с целью выявления факторов риска хронизации инфекции после перенесенного острого бактериального простатита (n = 480). Больные, перенесшие острый простатит, наблюдались в течение более 3 месяцев после лечения: проводилась регистрация исходов в хронический бактериальный простатит, эпидидимоорхит, хронический абактериальный воспалительный синдром хронической тазовой боли (категория IIIa), частота выявления пиурии, бактериурии. Авторы обнаружили, что риск хронизации инфекции повышен:
Эффективность современных антибиотиков в терапии простатита
Во многих исследованиях последних 2–3 лет изучалась эффективность современной антибактериальной терапии простатита. F. Wagenlehner и соавт. [8] оценивали эффективность применения левофлоксацина для лечения больных хроническим бактериальным простатитом (n = 243). В качестве возбудителя простатита у 62,9% пациентов была диагностирована E. coli. Левофлоксацин назначался в стандартной дозировке 500 мг 1 р/сут в течение 4 недель. В конце терапии клиническое излечение или улучшение было отмечено у 93,5% пациентов, в то время как микробиологическая эффективность составила 94,9%. Авторы сделали вывод о высокой эффективности терапии левофлоксацином у больных хроническим бактериальным простатитом.
Интересны данные сравнения эффективности и безопасности различных дозировок левофлоксацина при варьирующей продолжительности курса лечения, опубликованные в 2010 г. М. Paglia и соавт. [9]. Пациенты с хроническим бактериальным простатитом (n = 241) были разделены на 3 группы: в 1-й группе больные получали левофлоксацин по 750 мг 1 р/сут в течение 2 недель, во 2-й группе – левофлоксацин по 750 мг 1 р/сут в течение 3 недель, а в 3-й – левофлоксацин по 500 мг 1 р/сут в течение 4 недель. Клиническая эффективность сразу после окончания лечения в группах не различалась (63%, 64,9% и 69,3% соответственно). Однако уже через 3 месяца между группами появились статистически значимые отличия (44,1%, 35,3% и 54,3% соответственно), которые стали еще более выраженными через 6 месяцев после окончания терапии (28,4%, 28,4% и 44,9% соответственно). Кроме того, доля пациентов, не завершивших исследование по причине развития нежелательных явлений, была выше в группе, принимавшей левофлоксацин в дозе 750 мг/сут в течение 2 или 3 недель (по сравнению с группой, принимавшей препарат в дозе 500 мг/сут в течение 4 недель). Таким образом, наиболее эффективным и безопасным режимом терапии при хроническом бактериальном простатите является прием левофлоксацина по 500 мг/сут в течение 4 недель.
Z.C. Zhang и соавт. [10] провели сравнительную оценку эффективности левофлоксацина и ципрофлоксацина в лечении хронического бактериального простатита у 408 пациентов в рамках открытого рандомизированного многоцентрового исследования. Ученые обнаружили, что как микробиологическая (86% по сравнению с 60%), так и клиническая (93,3% по сравнению с 71,8%) эффективность левофлоксацина выше аналогичных показателей для ципрофлоксацина. Объяснить столь значительные различия в эффективности препаратов одной группы можно более широким спектром активности левофлоксацина. Как известно [11], к нему, в отличие от ципрофлоксацина, достаточно высока природная чувствительность грамположительных (например, Enterococcus faecalis) и атипических микроорганизмов (например, микоплазм). Интересно, что в опубликованном ранее (2003) рандомизированном, двойном слепом многоцентровом исследовании (n = 377) W. Bundrick и соавт. [12] не обнаружили статистически значимых различий между левофлоксацином и ципрофлоксацином как по микробиологической (75% и 76,8% соответственно) и клинической (75% и 72,8% соответственно) эффективности, так и по частоте рецидивов через 6 месяцев. Различия в результатах этих двух крупных сравнительных исследований могут объясняться как дизайном (одно исследование – открытое, второе – двойное слепое), так и изменившимися за последние 10 лет спектром и чувствительностью уропатогенов (мы уже приводили подтверждающие этот факт данные исследования [5]). Учитывая имеющиеся противоречия, нами запланировано проведение в 2013–2014 гг. сравнительного исследования эффективности левофлоксацина и ципрофлоксацина у больных бактериальным простатитом. В рамках данного исследования мы предполагаем не только сравнить клиническую и микробиологическую эффективность сразу после проведенного курса терапии, но и частоту рецидивов в группах через 6 и 12 месяцев терапии.
Заслуживающие внимания данные были получены G.D. Qin и соавт. [13], исследовавшими в эксперименте на животных, влияет ли на фармакокинетику левофлоксацина одновременный прием тамсулозина. Крысы с острым бактериальным простатитом (n = 96) были разделены на 2 группы: 1-я группа получала левофлоксацин с тамсулозином, 2-я – левофлоксацин с плацебо. Оценка концентрации левофлоксацина в различных тканях производилась через 0,125, 0,25, 0,5, 1, 2, 4, 8, 12 часов после введения препаратов. Интересно, что в плазме, печени и почках концентрация левофлоксацина между группами не отличалась, в то время как в простате тамсулозин повышал Cmax и Т½ левофлоксацина, а также снижал клиренс последнего. Полученные результаты стали свидетельством синергического фармакокинетического действия тамсулозина и левофлоксацина.
Следует подчеркнуть тот факт, что клинически наличие синергизма антимикробных препаратов и альфа-1-адреноблокаторов было отмечено и в авторитетном систематическом обзоре и метаанализе, опубликованном T. Anothaisintawee и соавт. в JAMA в 2011 г. [14]. Авторы провели поиск исследований, посвященных лечению хронического простатита и синдрома хронической тазовой боли, в базах данных Medline (c 1949 по 2010 г.) и EMBASE (c 1974 по 2010 г.). Отвечающими требованиям метаанализа были признаны 23 из 262 рандомизированных плацебоконтролируемых исследований (включая исследования с фитотерапией, глюкозаминогликанами, финастеридом и нейромодуляторами). По сравнению с плацебо статистически значимое уменьшение степени выраженности симптомов простатита было установлено только при лечении альфа-адреноблокаторами (в среднем на 1,7 балла), антибиотиками (в среднем на 9,8 балла) и комбинацией альфа-1-адреноблокатора и антибиотика (в среднем на 13,8 балла). Таким образом, максимальной клинической эффективностью у больных простатитом, по результатам представленного метаанализа, обладала комбинация антибиотика с альфа-1-адреноблокатором. Другие группы препаратов пока не показали статистически значимых отличий в эффективности по сравнению с плацебо, и подобная комбинированная терапия требует дальнейшего изучения.
Небактериальные средства в терапии простатита
К сожалению, резистентность уропатогенов к широко используемым антибактериальным средствам постоянно растет. В то же время в ближайшей перспективе не ожидается появления новых групп антибиотиков, эффективных в отношении основных возбудителей простатита – грамотрицательных бактерий. К тому же общеизвестно, что только некоторые антимикробные препараты способны проникать в предстательную железу. Все это определяет актуальность поиска других средств и подходов для лечения и профилактики бактериального простатита. В последние годы было опубликовано несколько интересных экспериментальных и клинических исследований.
M. Inci и соавт. [15] изучили противовоспалительную и антиоксидантную активность тимохинона на модели острого бактериального простатита у крыс (n = 42). Тимохинон и его производные представляют собой группу дифенолов, содержащихся в эфирных маслах черного тмина. Крысы были разделены на 3 группы: в группе 1 производилось только инфицирование уропатогеном, в группе 2 – инфицирование и лечение тимохиноном, группа 3 (контрольная) получала плацебо. В результате исследования авторами был продемонстрирован защитный эффект тимохинона в ткани простаты за счет его антиоксидантных свойств, что проявлялось в повышении активности глутатионпероксидазы, снижении активности каталазы и супероксиддисмутазы.
S.H. Kim и соавт. [16] в 2012 г. опубликовали результаты исследования профилактического действия гинсеноидов (производных женьшеня) при хроническом бактериальном простатите. Гинсеноиды, или панаксозиды, – класс стероидных гликозидов и тритерпеновых сапонинов, содержащихся исключительно в женьшене. Исследователи сформировали и изучили 4 группы крыс породы Wistar: 1-я группа – контрольная (плацебо), 2-я – группа лечения ципрофлоксацином, 3-я – лечения гинсеноидом и 4-я – лечения комбинацией «ципрофлоксацин + гинсеноид». После 4 недель терапии производилось инфицирование крыс E. coli. При последующем бактериальном исследовании подавление роста бактерий в сравнении с группой плацебо было отмечено во всех группах лечения (2–4-я). В группе монотерапии гинсеноидом при сравнении с группой плацебо было отмечено существенное снижение степени воспалительной инфильтрации и интерстициального фиброза. Максимально эти эффекты были выражены в группе комбинированной терапии «ципрофлоксацин + гинсеноид». Таким образом, исследователи смогли сделать вывод о наличии профилактического действия производных женьшеня при хроническом бактериальном простатите.
B.I. Yoon и соавт. [17] исследовали эффекты катехина и нанокатехина при хроническом бактериальном простатите у крыс. Катехины экстрагируются из чайного листа, а нанокатехины – это катехины, упакованные в пищевую добавку гидроксипропилметилцеллюлозу (E464) посредством нанотехнологий. Четыре группы крыс с хроническим бактериальным простатитом (n = 40) получали следующие варианты терапии: группа 1 – плацебо, группа 2 – ципрофлоксацин, группа 3 – кахетин, группа 4 – нанокахетин. При бактериальном исследовании в группах активного лечения (2–4-я) было зарегистрировано подавление роста бактерий, а затем гистологически отмечалось снижение воспалительной инфильтрации по сравнению с группой плацебо. Подавление роста бактерий и уменьшение воспалительной инфильтрации было более выражено в группе терапии нанокахетином по сравнению с группой лечения кахетином, что авторы объясняют более высокой биодоступностью нанопрепарата.
В другом исследовании H.W. Kim и соавт. [18] на крысах Wistar был изучен профилактический эффект селена при хроническом бактериальном простатите. Было также сформировано 4 группы крыс: 1-я – контрольная (плацебо), 2-я – группа ципрофлоксацина, 3-я – группа селена, 4-я – группа комбинированной терапии «ципрофлоксацин + селен». После 4 недель профилактического лечения все крысы инфицировались E. coli. В группах терапии селеном (3-я и 4-я) по данным бактериального исследования отмечалось подавление роста бактерий. При гистологическом исследовании наименьшая воспалительная инфильтрация имела место у крыс из группы комбинированной терапии ципрофлоксацином и селеном.
C.B. Lee и соавт. [19] предприняли попытку ответить на вопрос, обладает ли финастерид профилактическим действием при хроническом бактериальном простатите. Исследователи изучили 4 группы крыс (n = 48): 1-я – контрольная (плацебо), 2-я – группа лечения ципрофлоксацином, 3-я – лечения финастеридом, 4-я – лечения ципрофлоксацином в комбинации с финастеридом. После 4 недель терапии производилось инфицирование крыс E. coli, а затем проводилась оценка результатов бактериального и гистологического исследований. В результате было установлено, что финастерид по сравнению с плацебо вызывал статистически значимое подавление роста бактерий и снижение степени воспалительной инфильтрации. Эффект ингибирования инфекции в ткани был максимально выражен в группе терапии ципрофлоксацином в сочетании с финастеридом.
Эта же группа авторов в 2011 г. опубликовала результаты пилотного исследования [20], посвященного оценке профилактического действия экстракта E. coli и экстракта клюквенного сока при хроническом бактериальном простатите. Снова было выделено 4 группы крыс (n = 48): 1-я – контрольная (плацебо), 2-я – группа ципрофлоксацина, 3-я – экстракта E. coli и 4-я – экстракта клюквенного сока. После 3 недель терапии урогенитальный тракт крыс инфицировался E. coli с последующим сравнением групп еще через 1 неделю. Частота возникновения инфекции была значимо ниже в группе ципрофлоксацина, чем в группе плацебо. Во всех группах активного лечения (2–4-я) имело место подавление роста бактерий и снижение воспалительной инфильтрации. Интересно, что в 2008 г. в Германии, Австрии и Португалии было начато рандомизированное плацебоконтролируемое клиническое исследование эффективности и безопасности коммерчески доступного экстракта E. coli – Уро-Ваксома – у больных хроническим простатитом (исследование продолжается). Результаты исследования пока ожидаются. В то же время Е.В. Кульчавеня и А.А. Бреусов в 2011 г. опубликовали результаты профилактического применения Уро-Ваксома у 23 больных хроническим бактериальным простатитом, прошедших перед этим курс антибактериальной терапии [21]. Исследователи установили, что после 1 курса терапии Уро-Ваксомом 6–12-месячный безрецидивный период наблюдается у 86,7% пациентов. В заключение можно сказать, что в настоящее время имеется ряд новых перспективных подходов к терапии и профилактике бактериального простатита. Однако эффективность и безопасность этих средств требует изучения в рамках проспективных, рандомизированных, предпочтительно плацебоконтролируемых клинических исследований.
Рекомендации Европейской ассоциации урологов по антибактериальной терапии простатита
Очевидно, что для рутинной клинической практики первостепенное значение имеют диагностические и лечебные подходы с доказанной высокой эффективностью и безопасностью. Такого рода стратегии лечения простатита изложены в ряде международных клинических рекомендаций, в частности, в рекомендациях Европейской ассоциации урологов по урологическим инфекциям [1].
Несомненно, что в лечении простатита большая роль отводится антибактериальным препаратам. Для достижения максимальной эффективности антибактериальной терапии при простатите необходимо выбирать препараты, отвечающие следующим условиям.
Во-первых, антибактериальные препараты должны быть высокоэффективными в отношении основных возбудителей простатита. Как отмечалось выше, наиболее частыми возбудителями простатита являются грамотрицательные бактерии: кишечная палочка (E. coli), клебсиелла (Klebsiella spp.), протей (Proteus spp.) и синегнойная палочка (Pseudomonas aeruginosa). У 80–90% больных бактериальным простатитом именно эти микроорганизмы являются возбудителями заболевания. Предпочтительно также, чтобы эмпирически назначаемый антибактериальный препарат имел достаточно высокую активность по отношению к энтерококку и к таким атипическим микроорганизмам, как хламидии и микоплазмы, хотя этиологическая роль последней группы возбудителей до настоящего времени не считается достаточно доказанной.
Во-вторых, антибиотики должны иметь хорошую биодоступность: проникать в предстательную железу и накапливаться в ней. Это существенно сужает выбор средств для терапии простатита, в особенности хронического. В связи с этим антибактериальная терапия при простатите обычно проводится длительно (обычно 4 недели, иногда до 8 недель) и высокими дозами препаратов. По данным фармакокинетических исследований, из имеющихся на сегодняшний день антибиотиков лучше всего проникают в ткань предстательной железы некоторые фторхинолоны и сульфаниламиды. Несколько хуже в предстательной железе накапливаются тетрациклины и макролиды. Следует подчеркнуть, что при остром простатите фармакокинетика препаратов в предстательной железе отличается от таковой при хроническом бактериальном простатите – помимо фторхинолонов отмечается хорошее накопление и высокая эффективность цефалоспоринов, аминогликозидов и карбапенемов.
В-третьих, существенное значение имеет наличие у антибиотика парентеральных и пероральных форм. У больных острым простатитом терапия всегда начинается парентеральными формами препаратов, которые после нормализации температуры и улучшения общего состояния больного должны замещаться пероральными формами, предпочтительно тех же препаратов.
В-четвертых, важна хорошая переносимость антибиотика при длительном применении. Учитывая, что при простатите минимальная продолжительность курса антибактериальной терапии составляет 4 недели, а препарат назначается в высокой дозировке, крайне важно, чтобы он хорошо переносился.
Рекомендуемые схемы антибактериальной терапии простатита
Преимущества и недостатки антибактериальных препаратов различных групп, используемых для лечения больных хроническим бактериальным простатитом, представлены в таблице 2. На сегодняшний день оптимальными характеристиками для лечения больных как острым, так и хроническим простатитом обладают некоторые фторхинолоны с преимущественно почечным путем выведения, в частности левофлоксацин и ципрофлоксацин. При этом левофлоксацин в качестве препарата для эмпирической терапии имеет ряд преимуществ перед ципрофлоксацином, обладая несколько более широким спектром активности (табл. 3) [11], большей способностью накапливаться в ткани простаты [22] и лучшей переносимостью [23]. Кроме того, комплаентность терапии левофлоксацином выше, так как его следует принимать 1 р/сут, по сравнению с ципрофлоксацином, который принимают 2 р/сут. Из дженериков левофлоксацина, имеющихся на российском рынке, отдельного внимания заслуживает препарат Флексид®, производимый швейцарской компанией «Сандоз». Флексид® имеет полную био- и терапевтическую эквивалентность с оригинальным левофлоксацином (Таваником), что позволило FDA (Food and Drug Administration) внести его в 2011 г. в «Оранжевую книгу» (Orange Book идентифицирует препараты, одобренные FDA на основании их безопасности и эффективности) [24].
Напомним, что антибактериальная терапия назначается при остром бактериальном простатите (I категории); хроническом бактериальном простатите (II категории) и воспалительном синдроме хронической тазовой боли (IIIa категории).
При остром бактериальном простатите (категория I) показана парентеральная эмпирическая антибактериальная терапия в высоких дозах вплоть до стихания общих проявлений инфекции (в первую очередь исчезновения высокой лихорадки). Препаратами выбора для парентерального лечения являются фторхинолоны (левофлоксацин, ципрофлоксацин) и цефалоспорины III поколения (цефтриаксон, цефтазидим) в сочетании или без аминогликозида (гентамицина); цефалоспорины и аминогликозиды обладают синергизмом в отношении многих грамотрицательных бактерий. После получения результатов посева при необходимости производится коррекция антибактериальной терапии в зависимости от чувствительности микроорганизма. При выявлении возбудителя, чувствительного к эмпирически назначенному антибиотику, весь курс терапии должен проводиться одним и тем же препаратом. Смена препарата в ходе лечения, вопреки распространенному заблуждению, может приводить к повышению резистентности микроорганизмов. Пероральная терапия антибиотиком (обычно высокими дозами фторхинолонов) назначается после парентерального лечения и обычно продолжается до 4 (иногда 6) недель суммарно. Такая продолжительность курса антибактериальной терапии обусловлена тем, что в предстательной железе достижение концентраций, необходимых для эрадикации патогенных микроорганизмов, происходит медленно. Назначение более коротких курсов терапии сопряжено с повышенным риском рецидивирования простатита.
Стандартные схемы антибактериальной терапии при остром бактериальном простатите:
Учитывая, что при остром простатите часто возникает инфравезикальная обструкция, целесообразен мониторинг количества остаточной мочи. При обструктивных симптомах и объеме остаточной мочи менее 100 мл показано назначение альфа-1-адреноблокаторов (теразозина, доксазозина, альфузозина или тамсулозина). При большом объеме остаточной мочи или при развившейся острой задержке мочи оптимальным методом дренирования мочевого пузыря считается пункционная цистостомия. В международных клинических рекомендациях также отмечается, что допустимым методом дренирования при острой задержке мочеиспускания является разовая катетеризация или кратковременная (продолжительностью до 12 часов) установка уретрального катетера Фолея малого диаметра.
Абсцесс предстательной железы осложняет течение острого простатита в 2–18% случаев и сопряжен с уровнем смертности от 3 до 30%. Подозрение на абсцесс должно возникнуть, если выявляется очаг флюктуации в ходе пальцевого ректального исследования простаты или при неэффективности корректно проводимой в течение 48 часов антибактериальной терапии. Для подтверждения диагноза абсцесса показано трансректальное ультразвуковое исследование простаты. Основными методами оперативного лечения абсцесса простаты в настоящее время являются:
При выявлении микроорганизма, устойчивого к фторхинолонам, но чувствительного к триметоприм-сульфометоксазолу, показана терапия этим препаратом сроком до 3 месяцев в дозировке 960 мг 2 р/сут [25]. Однако следует учитывать достаточно высокую токсичность препарата, риск развития синдрома Стивенса – Джонсона, нарушений почечной и печеночной функции, которые должны регулярно мониторироваться при длительном применении триметоприм-сульфометоксазола.
В настоящее время нет рекомендаций к терапии в случае выявления микроорганизма, устойчивого как ко фторхинолонам, так и к триметоприм-сульфометоксазолу.
Антибактериальную терапию у больных хроническим простатитом II категории целесообразно комбинировать с назначением альфа-1-адреноблокаторов (теразозина, доксазозина, альфузозина или тамсулозина), уменьшающих степень выраженности расстройств мочеиспускания и способствующих более быстрому улучшению состояния пациентов.
Лечение больных с воспалительным синдромом хронической тазовой боли (абактериальный хронический простатит категории IIIa), так же как при хроническом бактериальном простатите, включает назначение антибиотиков (пероральных фторхинолонов – левофлоксацина или ципрофлоксацина) в тех же дозировках. Данная рекомендация основана на допущении, что у ряда больных возможности бактериологического исследования не позволяют выявить имеющегося возбудителя. Антибиотик назначается на 2 недели, после чего оценивается состояние больного. Если на фоне антибактериальной терапии имеет место уменьшение выраженности симптомов простатита, то прием антибактериального препарата необходимо продолжить до прохождения полного 4–6-недельного курса лечения. Помимо терапии антибиотиком для уменьшения дизурических явлений показано назначение альфа-1-адреноблокаторов.
Заключение
Лечение больных бактериальным простатитом остается комплексной проблемой. По нашему мнению, перспективными можно считать исследования характеристик возбудителей заболевания, особенностей их вирулентности и частных патофизиологических механизмов развития воспалительных изменений в предстательной железе. Кроме того, интересным также представляется изучение небактериальных средств профилактики и лечения бактериального простатита. Среди антибактериальных средств основной группой препаратов для лечения больных простатитом остаются фторхинолоны, в частности левофлоксацин и ципрофлоксацин. В дополнение к антимикробной терапии при простатите, как минимум для уменьшения степени выраженности дизурических явлений, целесообразно применение альфа-1-адреноблокаторов.
Патогенез простатита
Основные возбудители простатита представлены в таблице 1 [1]. По обобщенным данным, доля острого и хронического бактериального простатита, вызываемого «основными» возбудителями, составляет 5–10% от всех случаев диагностики простатита. Роль так называемых атипических микроорганизмов (хламидий, уреаплазм, микоплазм) в возникновении простатита на сегодняшний день не считается доказанной. Современное состояние микробиологии пока не позволяет установить границу между нахождением данных микроорганизмов в уретре и инфицированием ими простаты.
У больных вирусом иммунодефицита человека (ВИЧ) этиологическими возбудителями могут также быть дрожжевые грибы (Candida spp.), микобактерии туберкулеза и такие редкие микроорганизмы, как Coccidioides immitis, Blastomyces dermatitidis и Histoplasma capsulatum. До появления антибиотиков большую роль в возникновении бактериального простатита, а в особенности абсцедирующей его формы, играли гонококки (Neisseria gonorrhoeae).
Считается, что бактериальный простатит (острый и хронический) в большинстве случаев вызывается бактериями семейства Enterobacteriaceae, в частности кишечной палочкой (E. coli).
Интересное исследование, проливающее свет на патогенез развития хронического простатита, было опубликовано американскими исследователями в 2011 г. [2]. Ученые выделили у больного хроническим простатитом штамм E. coli посредством мультиплексного анализа методом полимеразной цепной реакции (ПЦР), изучили его фенотип и гены – факторы вирулентности, а затем с использованием этого штамма исследовали молекулярный патогенез развития бактериального простатита на культуре клеток и на мышиной модели. Выделенный штамм кишечной палочки оказался атипичным CP1-штаммом, относящимся к группе В1 и отличающимся от большинства уропатогенных E. coli как филогенетически, так и по профилю факторов вирулентности. Другими словами, возбудителем хронического воспаления в простате у больного явился особенный с генетической точки зрения патоген. Чрезвычайно интересные данные были получены на этапе эксперимента на мышиной модели. Оказалось, что у мышей породы NOD после инфицирования данным штаммом кишечной палочки развивалось типичное хроническое бактериальное воспаление, при этом поведенческие реакции, характерные для синдрома хронической тазовой боли, сохранялись и после эрадикации возбудителя. В то же время у крыс другой породы (C57BL/6J) поведенческие реакции синдрома хронической тазовой боли после эрадикации возбудителя исчезали. Проанализировав результаты исследования, ученые пришли к следующим выводам: во-первых, хронический бактериальный простатит (в отличие от острого) вызывается атипичным штаммом E. coli, а во-вторых, бактериальная инфекция способна инициировать «абактериальный» синдром хронической тазовой боли у генетически предрасположенных млекопитающих.
В исследовании J.N. Krieger и соавт. [3] была изучена E. coli, вызвавшая острый простатит у ранее не страдавших данным заболеванием молодых мужчин (n = 18). Анализ генов – факторов вирулентности E. coli производился посредством ПЦР-анализа, филогенетическая группировка проводилась по результатам триплексной ПЦР. Кроме того, изучался профиль резистентности каждого микроорганизма. Из 18 выделенных штаммов 13 относилось к филогенетической группе В2, 5 штаммов – к группе D. Исследователи отметили, что выявленные возбудители первичного острого простатита были преимущественно представлены экстраинтестинальной патогенной E. coli (ExPEC) с высокой концентрацией генов – факторов вирулентности (hly, cdt1, clb, pap, sfa/foc, fyuA, iroN, kpsMT(II), traT). Более того, в группе штаммов В2 был обнаружен как минимум один токсин с канцерогенным потенциалом (в частности, колибактин, цитотоксический некротизирующий фактор и др.). Это может косвенно свидетельствовать о повышенном риске развития рака простаты у пациентов, инфицированных этим штаммом E. coli. В то же время все выявленные штаммы были чувствительны к стандартным антибактериальным препаратам.
V. Nagi и D. Kubej [4] в 2012 г. опубликовали результаты клинического исследования современного спектра и чувствительности возбудителей острого бактериального простатита к противомикробным препаратам (n = 192). По представленным данным, основным возбудителем острого простатита была E. coli – она выявлена у 53,7% больных, за ней по частоте следовали Pseudomonas aeruginosa и Klebsiella spp. У 8,3% пациентов было выявлено 2 уропатогена, а у 33,8% больных бактериальное исследование вообще не выявило возбудителя. Кроме того, в 7,3% случаев острый простатит прогрессировал и приводил к развитию уросепсиса.
T. Cai и соавт. [5] на базе одной итальянской клиники за период с января 1997 по декабрь 2008 г. провели крупное эпидемиологическое исследование (n = 6222). Ученые изучили спектр возбудителей хронического бактериального простатита, который существенно отличался от спектра возбудителей острого бактериального простатита, представленного в исследовании V. Nagi и D. Kubej [4]. Так, наиболее часто встречающимися (74%) возбудителями хронического простатита были грамположительные бактерии, в частности Enterococcus faecalis, а грамотрицательные бактерии выявлялись лишь в 26% случаев. Авторы также отметили, что при сравнении периодов 1997–1999 гг. и 2006–2008 гг. в структуре возбудителей увеличилась доля Enterococcus faecalis и снизилась доля E. coli, что сопровождалось снижением чувствительности уропатогенов к ципрофлоксацину при сохраняющейся чувствительности к левофлоксацину.
Клиническая картина простатита
За последние годы также был проведен ряд исследований, посвященных клиническим особенностям течения и эффективности антимикробной терапии бактериального простатита.
W.P. Zhao и соавт. [6] оценили эффективность антибактериального лечения хронического бактериального простатита в зависимости от наличия или отсутствия камней в предстательной железе. Всего в исследовании принял участие 101 пациент. В 1-ю группу включались пациенты (n = 39), у которых при УЗИ в простате были выявлены кальцинаты, во 2-ю группу (n = 62) – больные, не имевшие камней в предстательной железе. Всем пациентам в течение 4 недель проводилась антибактериальная терапия с последующим периодом наблюдения от 3 до 8 месяцев. Интересно, что микробиологическая эффективность в группах сравнения сразу по окончании лечения не имела статистически значимых отличий (82,1% и 87,1% соответственно). Однако при оценке в конце периода наблюдения у больных 1-й группы микробиологическая эффективность составила 43,6%, а у больных 2-й группы – 72,6% (различия между группами были статистически значимыми). Эти результаты позволили авторам сделать вывод, что наличие камней в предстательной железе негативно влияет на эффективность антибактериальной терапии хронического бактериального простатита.
B.I. Yoon и соавт. [7] провели исследование с целью выявления факторов риска хронизации инфекции после перенесенного острого бактериального простатита (n = 480). Больные, перенесшие острый простатит, наблюдались в течение более 3 месяцев после лечения: проводилась регистрация исходов в хронический бактериальный простатит, эпидидимоорхит, хронический абактериальный воспалительный синдром хронической тазовой боли (категория IIIa), частота выявления пиурии, бактериурии. Авторы обнаружили, что риск хронизации инфекции повышен:
- у пациентов с сахарным диабетом;
- при наличии инвазивных манипуляций на мочевых путях в анамнезе;
- при невыполнении цистостомии и при дренировании мочевого пузыря постоянным уретральным катетером у пациентов с задержкой мочи, возникшей на фоне острого простатита.
Эффективность современных антибиотиков в терапии простатита
Во многих исследованиях последних 2–3 лет изучалась эффективность современной антибактериальной терапии простатита. F. Wagenlehner и соавт. [8] оценивали эффективность применения левофлоксацина для лечения больных хроническим бактериальным простатитом (n = 243). В качестве возбудителя простатита у 62,9% пациентов была диагностирована E. coli. Левофлоксацин назначался в стандартной дозировке 500 мг 1 р/сут в течение 4 недель. В конце терапии клиническое излечение или улучшение было отмечено у 93,5% пациентов, в то время как микробиологическая эффективность составила 94,9%. Авторы сделали вывод о высокой эффективности терапии левофлоксацином у больных хроническим бактериальным простатитом.
Интересны данные сравнения эффективности и безопасности различных дозировок левофлоксацина при варьирующей продолжительности курса лечения, опубликованные в 2010 г. М. Paglia и соавт. [9]. Пациенты с хроническим бактериальным простатитом (n = 241) были разделены на 3 группы: в 1-й группе больные получали левофлоксацин по 750 мг 1 р/сут в течение 2 недель, во 2-й группе – левофлоксацин по 750 мг 1 р/сут в течение 3 недель, а в 3-й – левофлоксацин по 500 мг 1 р/сут в течение 4 недель. Клиническая эффективность сразу после окончания лечения в группах не различалась (63%, 64,9% и 69,3% соответственно). Однако уже через 3 месяца между группами появились статистически значимые отличия (44,1%, 35,3% и 54,3% соответственно), которые стали еще более выраженными через 6 месяцев после окончания терапии (28,4%, 28,4% и 44,9% соответственно). Кроме того, доля пациентов, не завершивших исследование по причине развития нежелательных явлений, была выше в группе, принимавшей левофлоксацин в дозе 750 мг/сут в течение 2 или 3 недель (по сравнению с группой, принимавшей препарат в дозе 500 мг/сут в течение 4 недель). Таким образом, наиболее эффективным и безопасным режимом терапии при хроническом бактериальном простатите является прием левофлоксацина по 500 мг/сут в течение 4 недель.
Z.C. Zhang и соавт. [10] провели сравнительную оценку эффективности левофлоксацина и ципрофлоксацина в лечении хронического бактериального простатита у 408 пациентов в рамках открытого рандомизированного многоцентрового исследования. Ученые обнаружили, что как микробиологическая (86% по сравнению с 60%), так и клиническая (93,3% по сравнению с 71,8%) эффективность левофлоксацина выше аналогичных показателей для ципрофлоксацина. Объяснить столь значительные различия в эффективности препаратов одной группы можно более широким спектром активности левофлоксацина. Как известно [11], к нему, в отличие от ципрофлоксацина, достаточно высока природная чувствительность грамположительных (например, Enterococcus faecalis) и атипических микроорганизмов (например, микоплазм). Интересно, что в опубликованном ранее (2003) рандомизированном, двойном слепом многоцентровом исследовании (n = 377) W. Bundrick и соавт. [12] не обнаружили статистически значимых различий между левофлоксацином и ципрофлоксацином как по микробиологической (75% и 76,8% соответственно) и клинической (75% и 72,8% соответственно) эффективности, так и по частоте рецидивов через 6 месяцев. Различия в результатах этих двух крупных сравнительных исследований могут объясняться как дизайном (одно исследование – открытое, второе – двойное слепое), так и изменившимися за последние 10 лет спектром и чувствительностью уропатогенов (мы уже приводили подтверждающие этот факт данные исследования [5]). Учитывая имеющиеся противоречия, нами запланировано проведение в 2013–2014 гг. сравнительного исследования эффективности левофлоксацина и ципрофлоксацина у больных бактериальным простатитом. В рамках данного исследования мы предполагаем не только сравнить клиническую и микробиологическую эффективность сразу после проведенного курса терапии, но и частоту рецидивов в группах через 6 и 12 месяцев терапии.
Заслуживающие внимания данные были получены G.D. Qin и соавт. [13], исследовавшими в эксперименте на животных, влияет ли на фармакокинетику левофлоксацина одновременный прием тамсулозина. Крысы с острым бактериальным простатитом (n = 96) были разделены на 2 группы: 1-я группа получала левофлоксацин с тамсулозином, 2-я – левофлоксацин с плацебо. Оценка концентрации левофлоксацина в различных тканях производилась через 0,125, 0,25, 0,5, 1, 2, 4, 8, 12 часов после введения препаратов. Интересно, что в плазме, печени и почках концентрация левофлоксацина между группами не отличалась, в то время как в простате тамсулозин повышал Cmax и Т½ левофлоксацина, а также снижал клиренс последнего. Полученные результаты стали свидетельством синергического фармакокинетического действия тамсулозина и левофлоксацина.
Следует подчеркнуть тот факт, что клинически наличие синергизма антимикробных препаратов и альфа-1-адреноблокаторов было отмечено и в авторитетном систематическом обзоре и метаанализе, опубликованном T. Anothaisintawee и соавт. в JAMA в 2011 г. [14]. Авторы провели поиск исследований, посвященных лечению хронического простатита и синдрома хронической тазовой боли, в базах данных Medline (c 1949 по 2010 г.) и EMBASE (c 1974 по 2010 г.). Отвечающими требованиям метаанализа были признаны 23 из 262 рандомизированных плацебоконтролируемых исследований (включая исследования с фитотерапией, глюкозаминогликанами, финастеридом и нейромодуляторами). По сравнению с плацебо статистически значимое уменьшение степени выраженности симптомов простатита было установлено только при лечении альфа-адреноблокаторами (в среднем на 1,7 балла), антибиотиками (в среднем на 9,8 балла) и комбинацией альфа-1-адреноблокатора и антибиотика (в среднем на 13,8 балла). Таким образом, максимальной клинической эффективностью у больных простатитом, по результатам представленного метаанализа, обладала комбинация антибиотика с альфа-1-адреноблокатором. Другие группы препаратов пока не показали статистически значимых отличий в эффективности по сравнению с плацебо, и подобная комбинированная терапия требует дальнейшего изучения.
Небактериальные средства в терапии простатита
К сожалению, резистентность уропатогенов к широко используемым антибактериальным средствам постоянно растет. В то же время в ближайшей перспективе не ожидается появления новых групп антибиотиков, эффективных в отношении основных возбудителей простатита – грамотрицательных бактерий. К тому же общеизвестно, что только некоторые антимикробные препараты способны проникать в предстательную железу. Все это определяет актуальность поиска других средств и подходов для лечения и профилактики бактериального простатита. В последние годы было опубликовано несколько интересных экспериментальных и клинических исследований.
M. Inci и соавт. [15] изучили противовоспалительную и антиоксидантную активность тимохинона на модели острого бактериального простатита у крыс (n = 42). Тимохинон и его производные представляют собой группу дифенолов, содержащихся в эфирных маслах черного тмина. Крысы были разделены на 3 группы: в группе 1 производилось только инфицирование уропатогеном, в группе 2 – инфицирование и лечение тимохиноном, группа 3 (контрольная) получала плацебо. В результате исследования авторами был продемонстрирован защитный эффект тимохинона в ткани простаты за счет его антиоксидантных свойств, что проявлялось в повышении активности глутатионпероксидазы, снижении активности каталазы и супероксиддисмутазы.
S.H. Kim и соавт. [16] в 2012 г. опубликовали результаты исследования профилактического действия гинсеноидов (производных женьшеня) при хроническом бактериальном простатите. Гинсеноиды, или панаксозиды, – класс стероидных гликозидов и тритерпеновых сапонинов, содержащихся исключительно в женьшене. Исследователи сформировали и изучили 4 группы крыс породы Wistar: 1-я группа – контрольная (плацебо), 2-я – группа лечения ципрофлоксацином, 3-я – лечения гинсеноидом и 4-я – лечения комбинацией «ципрофлоксацин + гинсеноид». После 4 недель терапии производилось инфицирование крыс E. coli. При последующем бактериальном исследовании подавление роста бактерий в сравнении с группой плацебо было отмечено во всех группах лечения (2–4-я). В группе монотерапии гинсеноидом при сравнении с группой плацебо было отмечено существенное снижение степени воспалительной инфильтрации и интерстициального фиброза. Максимально эти эффекты были выражены в группе комбинированной терапии «ципрофлоксацин + гинсеноид». Таким образом, исследователи смогли сделать вывод о наличии профилактического действия производных женьшеня при хроническом бактериальном простатите.
B.I. Yoon и соавт. [17] исследовали эффекты катехина и нанокатехина при хроническом бактериальном простатите у крыс. Катехины экстрагируются из чайного листа, а нанокатехины – это катехины, упакованные в пищевую добавку гидроксипропилметилцеллюлозу (E464) посредством нанотехнологий. Четыре группы крыс с хроническим бактериальным простатитом (n = 40) получали следующие варианты терапии: группа 1 – плацебо, группа 2 – ципрофлоксацин, группа 3 – кахетин, группа 4 – нанокахетин. При бактериальном исследовании в группах активного лечения (2–4-я) было зарегистрировано подавление роста бактерий, а затем гистологически отмечалось снижение воспалительной инфильтрации по сравнению с группой плацебо. Подавление роста бактерий и уменьшение воспалительной инфильтрации было более выражено в группе терапии нанокахетином по сравнению с группой лечения кахетином, что авторы объясняют более высокой биодоступностью нанопрепарата.
В другом исследовании H.W. Kim и соавт. [18] на крысах Wistar был изучен профилактический эффект селена при хроническом бактериальном простатите. Было также сформировано 4 группы крыс: 1-я – контрольная (плацебо), 2-я – группа ципрофлоксацина, 3-я – группа селена, 4-я – группа комбинированной терапии «ципрофлоксацин + селен». После 4 недель профилактического лечения все крысы инфицировались E. coli. В группах терапии селеном (3-я и 4-я) по данным бактериального исследования отмечалось подавление роста бактерий. При гистологическом исследовании наименьшая воспалительная инфильтрация имела место у крыс из группы комбинированной терапии ципрофлоксацином и селеном.
C.B. Lee и соавт. [19] предприняли попытку ответить на вопрос, обладает ли финастерид профилактическим действием при хроническом бактериальном простатите. Исследователи изучили 4 группы крыс (n = 48): 1-я – контрольная (плацебо), 2-я – группа лечения ципрофлоксацином, 3-я – лечения финастеридом, 4-я – лечения ципрофлоксацином в комбинации с финастеридом. После 4 недель терапии производилось инфицирование крыс E. coli, а затем проводилась оценка результатов бактериального и гистологического исследований. В результате было установлено, что финастерид по сравнению с плацебо вызывал статистически значимое подавление роста бактерий и снижение степени воспалительной инфильтрации. Эффект ингибирования инфекции в ткани был максимально выражен в группе терапии ципрофлоксацином в сочетании с финастеридом.
Эта же группа авторов в 2011 г. опубликовала результаты пилотного исследования [20], посвященного оценке профилактического действия экстракта E. coli и экстракта клюквенного сока при хроническом бактериальном простатите. Снова было выделено 4 группы крыс (n = 48): 1-я – контрольная (плацебо), 2-я – группа ципрофлоксацина, 3-я – экстракта E. coli и 4-я – экстракта клюквенного сока. После 3 недель терапии урогенитальный тракт крыс инфицировался E. coli с последующим сравнением групп еще через 1 неделю. Частота возникновения инфекции была значимо ниже в группе ципрофлоксацина, чем в группе плацебо. Во всех группах активного лечения (2–4-я) имело место подавление роста бактерий и снижение воспалительной инфильтрации. Интересно, что в 2008 г. в Германии, Австрии и Португалии было начато рандомизированное плацебоконтролируемое клиническое исследование эффективности и безопасности коммерчески доступного экстракта E. coli – Уро-Ваксома – у больных хроническим простатитом (исследование продолжается). Результаты исследования пока ожидаются. В то же время Е.В. Кульчавеня и А.А. Бреусов в 2011 г. опубликовали результаты профилактического применения Уро-Ваксома у 23 больных хроническим бактериальным простатитом, прошедших перед этим курс антибактериальной терапии [21]. Исследователи установили, что после 1 курса терапии Уро-Ваксомом 6–12-месячный безрецидивный период наблюдается у 86,7% пациентов. В заключение можно сказать, что в настоящее время имеется ряд новых перспективных подходов к терапии и профилактике бактериального простатита. Однако эффективность и безопасность этих средств требует изучения в рамках проспективных, рандомизированных, предпочтительно плацебоконтролируемых клинических исследований.
Рекомендации Европейской ассоциации урологов по антибактериальной терапии простатита
Очевидно, что для рутинной клинической практики первостепенное значение имеют диагностические и лечебные подходы с доказанной высокой эффективностью и безопасностью. Такого рода стратегии лечения простатита изложены в ряде международных клинических рекомендаций, в частности, в рекомендациях Европейской ассоциации урологов по урологическим инфекциям [1].
Несомненно, что в лечении простатита большая роль отводится антибактериальным препаратам. Для достижения максимальной эффективности антибактериальной терапии при простатите необходимо выбирать препараты, отвечающие следующим условиям.
Во-первых, антибактериальные препараты должны быть высокоэффективными в отношении основных возбудителей простатита. Как отмечалось выше, наиболее частыми возбудителями простатита являются грамотрицательные бактерии: кишечная палочка (E. coli), клебсиелла (Klebsiella spp.), протей (Proteus spp.) и синегнойная палочка (Pseudomonas aeruginosa). У 80–90% больных бактериальным простатитом именно эти микроорганизмы являются возбудителями заболевания. Предпочтительно также, чтобы эмпирически назначаемый антибактериальный препарат имел достаточно высокую активность по отношению к энтерококку и к таким атипическим микроорганизмам, как хламидии и микоплазмы, хотя этиологическая роль последней группы возбудителей до настоящего времени не считается достаточно доказанной.
Во-вторых, антибиотики должны иметь хорошую биодоступность: проникать в предстательную железу и накапливаться в ней. Это существенно сужает выбор средств для терапии простатита, в особенности хронического. В связи с этим антибактериальная терапия при простатите обычно проводится длительно (обычно 4 недели, иногда до 8 недель) и высокими дозами препаратов. По данным фармакокинетических исследований, из имеющихся на сегодняшний день антибиотиков лучше всего проникают в ткань предстательной железы некоторые фторхинолоны и сульфаниламиды. Несколько хуже в предстательной железе накапливаются тетрациклины и макролиды. Следует подчеркнуть, что при остром простатите фармакокинетика препаратов в предстательной железе отличается от таковой при хроническом бактериальном простатите – помимо фторхинолонов отмечается хорошее накопление и высокая эффективность цефалоспоринов, аминогликозидов и карбапенемов.
В-третьих, существенное значение имеет наличие у антибиотика парентеральных и пероральных форм. У больных острым простатитом терапия всегда начинается парентеральными формами препаратов, которые после нормализации температуры и улучшения общего состояния больного должны замещаться пероральными формами, предпочтительно тех же препаратов.
В-четвертых, важна хорошая переносимость антибиотика при длительном применении. Учитывая, что при простатите минимальная продолжительность курса антибактериальной терапии составляет 4 недели, а препарат назначается в высокой дозировке, крайне важно, чтобы он хорошо переносился.
Рекомендуемые схемы антибактериальной терапии простатита
Преимущества и недостатки антибактериальных препаратов различных групп, используемых для лечения больных хроническим бактериальным простатитом, представлены в таблице 2. На сегодняшний день оптимальными характеристиками для лечения больных как острым, так и хроническим простатитом обладают некоторые фторхинолоны с преимущественно почечным путем выведения, в частности левофлоксацин и ципрофлоксацин. При этом левофлоксацин в качестве препарата для эмпирической терапии имеет ряд преимуществ перед ципрофлоксацином, обладая несколько более широким спектром активности (табл. 3) [11], большей способностью накапливаться в ткани простаты [22] и лучшей переносимостью [23]. Кроме того, комплаентность терапии левофлоксацином выше, так как его следует принимать 1 р/сут, по сравнению с ципрофлоксацином, который принимают 2 р/сут. Из дженериков левофлоксацина, имеющихся на российском рынке, отдельного внимания заслуживает препарат Флексид®, производимый швейцарской компанией «Сандоз». Флексид® имеет полную био- и терапевтическую эквивалентность с оригинальным левофлоксацином (Таваником), что позволило FDA (Food and Drug Administration) внести его в 2011 г. в «Оранжевую книгу» (Orange Book идентифицирует препараты, одобренные FDA на основании их безопасности и эффективности) [24].
Напомним, что антибактериальная терапия назначается при остром бактериальном простатите (I категории); хроническом бактериальном простатите (II категории) и воспалительном синдроме хронической тазовой боли (IIIa категории).
При остром бактериальном простатите (категория I) показана парентеральная эмпирическая антибактериальная терапия в высоких дозах вплоть до стихания общих проявлений инфекции (в первую очередь исчезновения высокой лихорадки). Препаратами выбора для парентерального лечения являются фторхинолоны (левофлоксацин, ципрофлоксацин) и цефалоспорины III поколения (цефтриаксон, цефтазидим) в сочетании или без аминогликозида (гентамицина); цефалоспорины и аминогликозиды обладают синергизмом в отношении многих грамотрицательных бактерий. После получения результатов посева при необходимости производится коррекция антибактериальной терапии в зависимости от чувствительности микроорганизма. При выявлении возбудителя, чувствительного к эмпирически назначенному антибиотику, весь курс терапии должен проводиться одним и тем же препаратом. Смена препарата в ходе лечения, вопреки распространенному заблуждению, может приводить к повышению резистентности микроорганизмов. Пероральная терапия антибиотиком (обычно высокими дозами фторхинолонов) назначается после парентерального лечения и обычно продолжается до 4 (иногда 6) недель суммарно. Такая продолжительность курса антибактериальной терапии обусловлена тем, что в предстательной железе достижение концентраций, необходимых для эрадикации патогенных микроорганизмов, происходит медленно. Назначение более коротких курсов терапии сопряжено с повышенным риском рецидивирования простатита.
Стандартные схемы антибактериальной терапии при остром бактериальном простатите:
- левофлоксацин 500 мг 1 р/сут в/в (до исчезновения лихорадки), затем левофлоксацин 500 мг 1 р/сут per os до завершения 4−6-недельного курса;
- ципрофлоксацин 400 мг 2 р/сут в/в (до исчезновения лихорадки), затем ципрофлоксацин 500 мг 2 р/сут per os до завершения 4−6-недельного курса;
- цефтриаксон 500 мг 2 р/сут в/в + гентамицин в суточной дозе 3 мг/кг массы тела, разделенной на 2 введения в/в или в/м (до исчезновения лихорадки), затем фторхинолон per os (схему см. выше).
Учитывая, что при остром простатите часто возникает инфравезикальная обструкция, целесообразен мониторинг количества остаточной мочи. При обструктивных симптомах и объеме остаточной мочи менее 100 мл показано назначение альфа-1-адреноблокаторов (теразозина, доксазозина, альфузозина или тамсулозина). При большом объеме остаточной мочи или при развившейся острой задержке мочи оптимальным методом дренирования мочевого пузыря считается пункционная цистостомия. В международных клинических рекомендациях также отмечается, что допустимым методом дренирования при острой задержке мочеиспускания является разовая катетеризация или кратковременная (продолжительностью до 12 часов) установка уретрального катетера Фолея малого диаметра.
Абсцесс предстательной железы осложняет течение острого простатита в 2–18% случаев и сопряжен с уровнем смертности от 3 до 30%. Подозрение на абсцесс должно возникнуть, если выявляется очаг флюктуации в ходе пальцевого ректального исследования простаты или при неэффективности корректно проводимой в течение 48 часов антибактериальной терапии. Для подтверждения диагноза абсцесса показано трансректальное ультразвуковое исследование простаты. Основными методами оперативного лечения абсцесса простаты в настоящее время являются:
- чреспромежностное вскрытие абсцесса с установкой дренажа в полость открытым методом или под ультразвуковым наведением;
- трансректальная пункция абсцесса с установкой дренажа в полость под ультразвуковым наведением;
- трансректальная пункция абсцесса под ультразвуковым наведением с аспирацией содержимого;
- трансуретральная резекция или инцизия простаты.
При выявлении микроорганизма, устойчивого к фторхинолонам, но чувствительного к триметоприм-сульфометоксазолу, показана терапия этим препаратом сроком до 3 месяцев в дозировке 960 мг 2 р/сут [25]. Однако следует учитывать достаточно высокую токсичность препарата, риск развития синдрома Стивенса – Джонсона, нарушений почечной и печеночной функции, которые должны регулярно мониторироваться при длительном применении триметоприм-сульфометоксазола.
В настоящее время нет рекомендаций к терапии в случае выявления микроорганизма, устойчивого как ко фторхинолонам, так и к триметоприм-сульфометоксазолу.
Антибактериальную терапию у больных хроническим простатитом II категории целесообразно комбинировать с назначением альфа-1-адреноблокаторов (теразозина, доксазозина, альфузозина или тамсулозина), уменьшающих степень выраженности расстройств мочеиспускания и способствующих более быстрому улучшению состояния пациентов.
Лечение больных с воспалительным синдромом хронической тазовой боли (абактериальный хронический простатит категории IIIa), так же как при хроническом бактериальном простатите, включает назначение антибиотиков (пероральных фторхинолонов – левофлоксацина или ципрофлоксацина) в тех же дозировках. Данная рекомендация основана на допущении, что у ряда больных возможности бактериологического исследования не позволяют выявить имеющегося возбудителя. Антибиотик назначается на 2 недели, после чего оценивается состояние больного. Если на фоне антибактериальной терапии имеет место уменьшение выраженности симптомов простатита, то прием антибактериального препарата необходимо продолжить до прохождения полного 4–6-недельного курса лечения. Помимо терапии антибиотиком для уменьшения дизурических явлений показано назначение альфа-1-адреноблокаторов.
Заключение
Лечение больных бактериальным простатитом остается комплексной проблемой. По нашему мнению, перспективными можно считать исследования характеристик возбудителей заболевания, особенностей их вирулентности и частных патофизиологических механизмов развития воспалительных изменений в предстательной железе. Кроме того, интересным также представляется изучение небактериальных средств профилактики и лечения бактериального простатита. Среди антибактериальных средств основной группой препаратов для лечения больных простатитом остаются фторхинолоны, в частности левофлоксацин и ципрофлоксацин. В дополнение к антимикробной терапии при простатите, как минимум для уменьшения степени выраженности дизурических явлений, целесообразно применение альфа-1-адреноблокаторов.
1. Grabe M., Bjerklund-Johansen T.E., Botto H. Guidelines on Urological Infections // www.uroweb.org/gls/pdf/18_Urological%20infections_LR.pdf
2. Rudick C.N., Berry R.E., Johnson J.R. et al. Uropathogenic Escherichia coli induces chronic pelvic pain // Infect. Immun. 2011. Vol. 79. № 2. P. 628–635.
3. Krieger J.N., Dobrindt U., Riley D.E., Oswald E. Acute Escherichia coli prostatitis in previously healthy young men: bacterial virulence factors, antimicrobial resistance, and clinical outcomes // Urology. 2011. Vol. 77. № 6. P. 1420–1425.
4. Nagy V., Kubej D. Acute bacterial prostatitis in humans: current microbiological spectrum, sensitivity to antibiotics and clinical findings // Urol. Int. 2012. Vol. 89. № 4. P. 445–450.
5. Cai T., Mazzoli S., Meacci F. et al. Epidemiological features and resistance pattern in uropathogens isolated from chronic bacterial prostatitis // J. Microbiol. 2011. Vol. 49. № 3. P. 448–454.
6. Zhao W.P., Li Y.T., Chen J. et al. Prostatic calculi influence the antimicrobial efficacy in men with chronic bacterial prostatitis // Asian J. Androl. 2012. Vol. 14. № 5. P. 715–719.
7. Yoon B.I., Kim S., Han D.S. et al. Acute bacterial prostatitis: how to prevent and manage chronic infection? // J. Infect. Chemother. 2012. Vol. 18. № 4. P. 444–450.
8. Wagenlehner F., Roscher K., Naber K.G. Practice management of chronic bacterial prostatitis with levofloxacin // Aktuelle Urol. 2011. Vol. 42. № 3. P. 184–189.
9. Paglia M., Peterson J., Fisher A.C. et. al. Safety and efficacy of levofloxacin 750 mg for 2 weeks or 3 weeks compared with levofloxacin 500 mg for 4 weeks in treating chronic bacterial prostatitis // Curr. Med. Res. Opin. 2010. Vol. 26. № 6. P. 1433–1441.
10. Zhang Z.C., Jin F.S., Liu D.M. et al. Safety and efficacy of levofloxacin versus ciprofloxacin for the treatment of chronic bacterial prostatitis in Chinese patients // Asian J. Androl. 2012. Vol. 14. № 6. P. 870–874.
11. Яковлев С.В., Яковлев В.П. Микроорганизмы и вызываемые ими инфекционные заболевания // Consilium Medicum. 2005. Т. 7. № 1.
12. Bundrick W., Heron S.P., Ray P. et al. Levofloxacin versus ciprofloxacin in the treatment of chronic bacterial prostatitis: a randomized double-blind multicenter study // Urology. 2003. Vol. 62. Is. 3. P. 537–541.
13. Qin G.D., Xiao M.Z., Zhou Y.D. et al. Tamsulosin alters levofloxacin pharmacokinetics in prostates derived from rats with acute bacterial prostatitis // Asian J. Androl. 2013. Vol. 15. № 2. P. 254–260.
14. Anothaisintawee T., Attia J., Nickel J.C. et al. Management of chronic prostatitis/chronic pelvic pain syndrome: a systematic review and network meta-analysis // JAMA. 2011. Vol. 305. № 1. P. 78–86.
15. Inci M., Davarci M., Inci M. et al. Anti-inflammatory and antioxidant activity of thymoquinone in a rat model of acute bacterial prostatitis // Hum. Exp. Toxicol. 2012. [Epub ahead of print].
16. Kim S.H., Ha U.S., Sohn D.W. et al. Preventive effect of ginsenoid on chronic bacterial prostatitis // J. Infect. Chemother. 2012. Vol. 18. № 5. P. 709–714.
17. Yoon B.I., Ha U.S., Sohn D.W. et al. Anti-inflammatory and antimicrobial effects of nanocatechin in a chronic bacterial prostatitis rat model // J. Infect. Chemother. 2011. Vol. 17. № 2. P. 189–194.
18. Kim H.W., Ha U.S., Woo J.C. et al. Preventive effect of selenium on chronic bacterial prostatitis // J. Infect. Chemother. 2012. Vol. 18. № 1. P. 30–34.
19. Lee C.B., Ha U.S., Yim S.H. et al. Does finasteride have a preventive effect on chronic bacterial prostatitis? Pilot study using an animal model // Urol. Int. 2011. Vol. 86. № 2. P. 204–249.
20. Kim S.H., Ha U.S., Lee H.R. et al. Do Escherichia coli extract and cranberry exert preventive effects on chronic bacterial prostatitis? Pilot study using an animal model // J. Infect. Chemother. 2011. Vol. 17. № 3. P. 322–326.
21. Кульчавеня Е.В., Бреусов А.А. Эффективность Уро-Ваксома при рецидивирующих инфекционно-воспалительных заболеваниях мочеполовой системы // Урология. 2011. № 4. С. 7–11.
22. Bulitta J.B., Kinzig M., Naber C.K. Population pharmacokinetics and penetration into prostatic, seminal, and vaginal fluid for ciprofloxacin, levofloxacin, and their combination // Chemotherapy. 2011. Vol. 57. № 5. P. 402–416.
23. Lipsky B.A., Baker C.A. Fluoroquinolone toxicity profiles: a review focusing on newer agents // Clin. Infect. Dis. 1999. Vol. 28. № 2. P. 352–364.
24. Orange Book: approved drug products with therapeutic equivalence evaluations. active ingredient search results from «OB_Rx» table for query on «LEVOFLOXACIN» // www.accessdata.fda.gov/scripts/cder/ob/docs/queryai.cfm
25. Urogenital Infections / Ed. by K.G. Naber, A.J. Schaeffer, C.F. et al. EAU, 2010.
Current issues of etiology, epidemiology and management of acute and chronic bacterial prostatitis – new data as of 2013
K.L. Lokshin
I.M. Sechenov First Moscow State Medical University, Research Institute of Uronephrology and Human Reproductive Health
Contact person: Konstantin Leonidovich Lokshin, k_lokshin@hotmail.com
The results of the recent international and Russian clinical studies (2010–2012) on bacterial prostatitis are analyzed. Pathogens, clinical progression of the disease and efficacy of antimicrobial and non-antimicrobial treatments are discussed. The author summarizes key positions of the current clinical guidelines of the European Association of Urology on antibacterial therapy of prostatitis based on the recent studies results (up to 2010). The recommended treatment schedules for acute bacterial prostatitis, chronic bacterial prostatitis and inflammatory chronic pelvic pain syndrome are presented.
Key words: acute prostatitis, chronic prostatitis, chronic pelvic pain syndrome, fluoroquinolones, levofloxacin
K.L. Lokshin
I.M. Sechenov First Moscow State Medical University, Research Institute of Uronephrology and Human Reproductive Health
Contact person: Konstantin Leonidovich Lokshin, k_lokshin@hotmail.com
The results of the recent international and Russian clinical studies (2010–2012) on bacterial prostatitis are analyzed. Pathogens, clinical progression of the disease and efficacy of antimicrobial and non-antimicrobial treatments are discussed. The author summarizes key positions of the current clinical guidelines of the European Association of Urology on antibacterial therapy of prostatitis based on the recent studies results (up to 2010). The recommended treatment schedules for acute bacterial prostatitis, chronic bacterial prostatitis and inflammatory chronic pelvic pain syndrome are presented.
Key words: acute prostatitis, chronic prostatitis, chronic pelvic pain syndrome, fluoroquinolones, levofloxacin
Новости на тему
17.02.2023
Отправить статью по электронной почте
Ваш адрес электронной почты:
В обзоре анализируются результаты новейших зарубежных и отечественных клинических исследований (2010–2012), касающихся проблем бактериального простатита.
Приводятся данные о возбудителях и особенностях клинического течения заболевания, эффективности антимикробных и небактериальных препаратов в терапии простатита.
Изложены ключевые положения современных клинических рекомендаций Европейской ассоциации урологов по антибактериальной терапии простатита, базирующихся на исследованиях, проведенных до 2010 г. включительно.
Даны рекомендуемые схемы лечения при остром бактериальном простатите, хроническом бактериальном простатите и воспалительном синдроме хронической тазовой боли.
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
