количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Теория
Обзор новых клинических рекомендаций Европейской ассоциации урологов по лечению и ведению больных с ненейрогенными симптомами нижних мочевых путей и с доброкачественной простатической обструкцией
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Урология и Нефрология" №5 (53)
- Аннотация
- Статья
- Ссылки
- English
Представлен первый русскоязычный обзор клинических рекомендаций, подготовленных экспертным советом Европейской ассоциации урологов в 2013 г., по лечению и ведению больных с ненейрогенными симптомами нижних мочевых путей и доброкачественной гиперплазией предстательной железы. Рекомендации основаны на принципах доказательной медицины и касаются вопросов динамического наблюдения, а также медикаментозного и хирургического лечения данной группы больных.
Представлен первый русскоязычный обзор клинических рекомендаций, подготовленных экспертным советом Европейской ассоциации урологов в 2013 г., по лечению и ведению больных с ненейрогенными симптомами нижних мочевых путей и доброкачественной гиперплазией предстательной железы. Рекомендации основаны на принципах доказательной медицины и касаются вопросов динамического наблюдения, а также медикаментозного и хирургического лечения данной группы больных.

Таблица 1. Оксфордская классификация уровней доказательности

Таблица 2. Оксфордская классификация степени рекомендаций
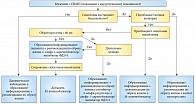
Рис. 1. Алгоритм выбора консервативного/медикаментозного метода лечения у пациента с СНМП
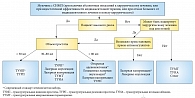
Рис. 2. Алгоритм выбора оперативного метода лечения у пациента с СНМП
В марте 2013 г. в официальном печатном органе Европейской ассоциации урологов – журнале European Urology – были опубликованы новейшие клинические рекомендации по лечению и ведению больных с доброкачественной гиперплазией предстательной железы (ДГПЖ) [1]. В этих клинических рекомендациях в отношении больных с гиперплазией простаты использовано определение: «больные с ненейрогенными симптомами нижних мочевых путей (СНМП) и с доброкачественной простатической обструкцией». Клинические рекомендации основаны на анализе исследований, опубликованных в медицинских базах данных PubMed/Medline, Web of Science и Cochrane в период с 1966 г. по 31 октября 2012 г. Как и прежде, в рекомендациях при анализе научной литературы были использованы Оксфордская классификация уровня доказательности (табл. 1) и градации/степени рекомендаций (табл. 2), которые зависят от уровня доказательности [2]. Экспертный комитет планирует производить обновление данных рекомендаций каждые 2 года. Нами подготовлен краткий обзор информации, представленной в оригинальной статье журнала European Urology, без собственных дополнений или комментариев.
Клинические рекомендации по динамическому наблюдению
Динамическое наблюдение показано при незначительных (количество баллов по Международной шкале оценки простатических симптомов International Prostate Symptom Score (IPSS) ≤ 7) или умеренных (8–19 баллов по IPSS) СНМП, не доставляющих пациенту ощутимого беспокойства.
Динамическое наблюдение противопоказано при наличии осложненной ДГПЖ (то есть абсолютных показаний к оперативному лечению, см. раздел рекомендаций, посвященный хирургическому лечению).
Динамическое наблюдение подразумевает периодическое обследование больного, образование/информирование пациента и предоставление рекомендаций по образу жизни, включая:
Клинические рекомендации по динамическому наблюдению
Динамическое наблюдение показано при незначительных (количество баллов по Международной шкале оценки простатических симптомов International Prostate Symptom Score (IPSS) ≤ 7) или умеренных (8–19 баллов по IPSS) СНМП, не доставляющих пациенту ощутимого беспокойства.
Динамическое наблюдение противопоказано при наличии осложненной ДГПЖ (то есть абсолютных показаний к оперативному лечению, см. раздел рекомендаций, посвященный хирургическому лечению).
Динамическое наблюдение подразумевает периодическое обследование больного, образование/информирование пациента и предоставление рекомендаций по образу жизни, включая:
- ограничение приема жидкостей (например, на ночь);
- cнижение потребления алкоголя и кофеинсодержащих напитков;
- использование методик расслабления при мочеиспускании и двойного мочеиспускания;
- «поддаивание» уретры во избежание подтекания мочи после мочеиспускания;
- методики отвлечения внимания и тренировка мочевого пузыря (при ургентных симптомах);
- оценку и смену времени приема сопутствующих препаратов (например, диуретиков);
- обеспечение помощи при нарушениях координации, подвижности или психического состояния;
- лечение запоров [3–6].
Клинические рекомендации по медикаментозной терапии
Антагонисты альфа-1-адренорецепторов (альфа-1-адреноблокаторы)
Альфа-1-адреноблокаторы – препараты первой линии, показанные при умеренных и выраженных СНМП (1а, А). В настоящее время в клинической практике используются 5 препаратов данной группы: альфузозин, доксазозин, силодозин, тамсулозин, теразозин. Препараты имеют сходную эффективность и быстрое начало действия, способны улучшать как симптомы накопления, так и симптомы опорожнения [7, 8].
При использовании альфа-1-адреноблокаторов имеет место снижение суммы баллов по IPSS в среднем на 30–40%, повышение максимальной скорости мочеиспускания (Qmax) в среднем на 20–25%. Размер простаты не оказывает существенного влияния на эффективность терапии. Альфа-1-адреноблокаторы не уменьшают размер простаты и не снижают риск острой задержки мочи (ОЗМ) [9–12]. При постоянном приеме антагонистов альфа-1-адренорецепторов снижение суммарного балла IPSS и повышение Qmax сохраняются на протяжении как минимум 4 лет.
Отличия в переносимости препаратов данной группы обусловлены их фармакокинетикой и степенью селективности. Наиболее часто регистрируются такие нежелательные явления, как астения, головокружение и ортостатическая гипотензия. Наличие сердечно-сосудистых заболеваний, а также прием вазоактивных препаратов повышают риск развития нежелательных явлений [13]. Установлено, что риск гипотензии при приеме силодозина сравним с таковым у плацебо, вследствие самой высокой его уроселективности из всех существующих альфа-1-адреноблокаторов. При использовании тамсулозина описано развитие интраоперационного синдрома атоничной радужки (этот синдром характерен для всех селективных альфа-блокаторов) [14].
В систематическом обзоре установлено, что альфа-1-адреноблокаторы не оказывают негативного влияния на либидо. Препараты способны несколько улучшать эректильную функцию, но иногда вызывают нарушения эякуляции (уменьшение объема или исчезновение эякулята) [15]. Наиболее часто нарушения эякуляции регистрируются при приеме силодозина, однако его прием из-за возникновения данного феномена прекращают всего 3,9% пациентов [16].
Ингибиторы 5-альфа-редуктазы
Ингибиторы 5-альфа-редуктазы показаны при умеренных и выраженных СНМП и при объеме простаты более 40 см³, уровне простатического специфического антигена (ПСА) > 1,4 нг/мл (1b, А). В настоящее время в клинической практике используются 2 препарата данной группы: дутастерид и финастерид. Финастерид ингибирует 5-альфа-редуктазу 2-го типа, дутастерид – как 2-го, так и 1-го типа. Препараты имеют сходную клиническую эффективность, и для них характерно медленное развитие эффекта [17–19].
После 2–4 лет лечения ингибитором 5-альфа-редуктазы имеет место уменьшение количества баллов по шкале IPSS в среднем на 15–30%, снижение объема простаты в среднем на 18–28%, повышение Qmax в среднем на 1,5–2,0 мл/с. При этом чем больше исходный объем простаты, тем выше эффективность препаратов данной группы. У больных с объемом простаты > 30 см³ эффективность дутастерида по уменьшению СНМП не уступает/превосходит таковую тамсулозина [10, 11, 20].
В отличие от альфа-1-адреноблокаторов, ингибиторы 5-альфа-редуктазы способны снижать риск прогрессирования ДГПЖ за счет уменьшения риска ОЗМ и риска хирургического лечения (1b, А) [12, 21, 22]. На фоне приема ингибиторов 5-альфа-редуктазы риск развития ОЗМ снижается на 57–68%, риск оперативного лечения – на 34–64% [12, 22–25].
К наиболее частым нежелательным явлениям, которые возникают на фоне приема ингибиторов 5-альфа-редуктазы, относятся снижение либидо, эректильная дисфункция, редко – гинекомастия, эякуляторные нарушения [11, 12].
Антагонисты мускариновых рецепторов (М-холиноблокаторы)
Антагонисты мускариновых рецепторов (М-холиноблокаторы) показаны при умеренных и выраженных СНМП – преимущественно при симптомах накопления (1b, B). В настоящее время в клинической практике используются 6 препаратов данной группы: дарифенацин, фезотеродин, оксибутинин, пропиверин, солифенацин, толтеродин и хлорид троспия. Препараты имеют сходную эффективность и переносимость. Однако исследований по длительному их применению пока не проводилось. Назначать М-холиноблокаторы надо с осторожностью, с регулярной оценкой IPSS и объема остаточной мочи.
Имеется небольшое количество исследований по изучению монотерапии антагонистами мускариновых рецепторов у больных с простатической обструкцией и гиперактивностью мочевого пузыря. В исследовании толтеродина и тамсулозина в группе толтеродина было отмечено только снижение частоты ургентного недержания [26]. Эффект от приема М-холиноблокаторов был выше у больных с небольшими размерами предстательной железы и при ПСА < 1,3 нг/мл [27].
Наиболее часто при приеме М-холиноблокаторов регистрируются такие нежелательные явления, как сухость во рту (< 16%), запоры (< 4%), затруднение мочеиспускания (< 2%), назофарингит (< 3%), головокружение (< 5%). При отсутствии простатической обструкции прием антагонистов мускариновых рецепторов сопряжен с частотой ОЗМ, не отличающейся от таковой при приеме плацебо (0–1,3% и 0–1,4% соответственно) [28].
Ингибиторы фосфодиэстеразы 5 типа (ФДЭ-5)
Ингибиторы ФДЭ-5 показаны при умеренных и выраженных СНМП (и накопления, и опорожнения) в сочетании с эректильной дисфункцией или без таковой (1b, А). В рандомизированных контролируемых исследованиях у больных с гиперплазией простаты изучались эффекты cилденафила, тадалафила и варденафила. Однако только тадалафил 5 мг зарегистрирован для лечения СНМП.
По данным метаанализа, терапия ингибитором ФДЭ-5 в сравнении с плацебо приводит к значимому снижению суммарного балла IPSS (-2,8 балла), без влияния на Qmax [29]. При использовании тадалафила субъективное улучшение отмечается достаточно быстро – через 1 неделю от начала приема. Тадалафил 5 мг у больных ДГПЖ снижает суммарный балл IPSS на 22–37% [30, 31]. В одном из последних исследований, не включенном в упомянутый метаанализ, при лечении тадалафилом имело место статистически значимое увеличение Qmax по сравнению с плацебо (+2,4 мл/с) [31]. Тадалафил не оказывал значимого влияния на объем остаточной мочи.
Наиболее выраженный эффект от терапии ингибиторами ФДЭ-5 отмечается у более молодых пациентов с низким индексом массы тела и с тяжелыми СНМП [29].
Влияние ингибиторов ФДЭ-5 на прогрессирование заболевания и на объем простаты пока не изучено.
Прием ингибиторов ФДЭ-5 может сопровождаться головными болями, болью в спине, головокружением, диспепсией. Препараты противопоказаны:
Наиболее широко в лечении СНМП используются экстракты Cucurbita pepo, Hypoxis rooperi, Pygeum afticanum, Secale cereale, Serenoa repens, Utrica dioica. Серьезным препятствием является тот факт, что разные производители используют различные методы экстрагирования, в связи с чем в препаратах могут быть неодинаковые концентрации активных компонентов [32].
По данным метаанализа, применение экстракта Pygeum afticanum способствовало симптоматическому улучшению в 2 раза чаще по сравнению с плацебо (в исследованиях, однако, результат не оценивался по IPSS) [33].
По данным метаанализа, на фоне приема экстракта Secale cereale (пыльцы) положительный эффект отмечался в 2 раза чаще, чем при приеме плацебо [34].
По данным метаанализа, экстракт Serenoa repens не превосходил плацебо, финастерид или тамсулозин по действию на суммарный балл IPSS (сходная эффективность в исследованиях с финастеридом и тамсулозином может расцениваться как эквивалентность лечебного эффекта) [35].
В связи с гетерогенностью препаратов, несовершенством регуляторной базы и существенными методологическими недостатками опубликованных исследований и метаанализов экспертный совет не может дать каких-либо определенных рекомендаций по использованию растительных экстрактов для лечения СНМП у мужчин.
Аналог вазопрессина (десмопрессин)
Десмопрессин может быть использован для лечения никтурии, обусловленной ночной полиурией (1b, А). По данным метаанализа, при приеме десмопрессина в сравнении с плацебо имеет место статистически значимое снижение количества ночных мочеиспусканий и увеличение продолжительности сна без пробуждения [36–39].
К наиболее частым нежелательным явлениям при приеме десмопрессина относятся головная боль, тошнота, диарея, боль в животе, головокружение, сухость во рту, гипонатриемия (5–7,6%), периферические отеки (2%), гипертензия (5%) [38, 40, 41].
При назначении десмопрессина необходимо ограничить прием жидкостей за 1 час до и в течение 8 часов после приема, а также контролировать уровень натрия в крови на 3-и и 7-е сутки после приема препарата и затем регулярно.
Комбинированная терапия
Комбинированная терапия альфа-1-адреноблокатором и ингибитором 5-альфа-редуктазы. Данная комбинация препаратов показана при умеренных и выраженных СНМП, увеличенной простате, сниженной Qmax (другими словами, при высоком риске прогрессирования гиперплазии простаты) (1b, А). Комбинированная терапия альфа-1-адреноблокатором и ингибитором 5-альфа-редуктазы эффективнее монотерапии каждым из препаратов в снижении суммарного балла IPSS и увеличении Qmax. Комбинированная терапия ингибитором 5-альфа-редуктазы и альфа-1-адреноблокатором в сравнении с монотерапией тамсулозином обеспечивает существенное снижение риска прогрессирования ДГПЖ (на 66%), ОЗМ (на 67,8%), необходимости хирургического лечения по поводу ДГПЖ (на 70,6%), симптоматического ухудшения (на 41,3%) (4 года наблюдения) [10–12].
Комбинированная терапия альфа-1-адреноблокатором и М-холиноблокатором. Данная комбинация может быть назначена при умеренных и выраженных СНМП, когда монотерапия альфа-1-адреноблокатором или М-холиноблокатором недостаточно эффективна в отношении симптомов накопления (2b, В). Эта комбинация препаратов более эффективна, чем монотерапия альфа-1-адреноблокатором или плацебо, в уменьшении частоты мочеиспусканий и эпизодов ургентного недержания, ночной поллакиурии и суммарного балла IPSS [42–47].
У больных с СНМП и гиперактивностью детрузора при сохранении СНМП на фоне терапии альфа-1-адреноблокатором добавление М-холиноблокатора существенно снижает степень выраженности симптомов [42–49].
На фоне комбинированного лечения несколько чаще, чем при монотерапии, встречаются сухость во рту и нарушения эякуляции. Кроме того, при комбинированном лечении установлено клинически незначимое увеличение объема остаточной мочи, при этом риск ОЗМ остается низким [48–50].
Данный вид терапии должен с осторожностью назначаться при инфравезикальной обструкции – рекомендуется динамический контроль объема остаточной мочи.
Клинические рекомендации по хирургическому лечению
Трансуретральная резекция простаты (ТУРП) и трансуретральная инцизия простаты
ТУРП – стандарт хирургического лечения умеренных/выраженных СНМП при объеме простаты 30–80 cм³ (1а, А). Трансуретральная инцизия простаты – стандарт хирургического лечения умеренных/выраженных СНМП при объеме простаты < 30 cм³ и при отсутствии средней доли (1а, А).
По данным метаанализа (20 рандомизированных исследований, до 5 лет наблюдения), эффективность ТУРП подтверждается улучшением основных показателей: увеличением Qmax (+162%), снижением суммарного балла IPSS (-70%), индекса качества жизни (Quality of Life index, QoL) (-69%), объема остаточной мочи (-77%) [51]. Отдаленные результаты после ТУРП хорошие. Неудачи лечения чаще связаны с гиперактивностью мочевого пузыря, а не с инфравезикальной обструкцией [52]. По данным метаанализа (включено 6 исследований), частота повторных операций составляет 18,4% после трансуретральной инцизии простаты и 7,2% после ТУРП [53].
До операции обязательно лечение мочевой инфекции.
Частота осложнений растет с увеличением объема простаты. Ближайшими осложнениями после ТУРП могут быть летальный исход (0,1%), ТУР-синдром (0,8%), необходимость гемотрансфузии (2%), ОЗМ (4,5%), тампонада (4,9%), мочевая инфекция (4,1%). Отдаленные осложнения после ТУРП – недержание мочи (2,2%), ОЗМ, инфекция, склероз шейки мочевого пузыря (4,7%), стриктура уретры (3,8%), ретроградная эякуляция (65,4%), эректильная дисфункция (6,5%). Ближайшие осложнения после инцизии: ТУР-синдром (0%), гемотрансфузия (0%); отдаленные – стриктура уретры (4,1%), ретроградная эякуляция (18,2%) [51, 54].
Биполярная трансуретральная резекция простаты
Ближайшие и среднесрочные результаты биполярной трансуретральной резекции простаты аналогичны таковым при монополярной ТУРП (1а, А). По сравнению с монополярной ТУРП у биполярной ТУРП меньшая частота ранних осложнений: нет ТУР-синдрома, кровотечений, тампонад, меньше продолжительность катетеризации (1а, А) [55–66].
Открытая аденомэктомия
Открытая аденомэктомия является стандартом хирургического лечения умеренных/выраженных СНМП при объеме простаты более 80 cм³ (1b, А). В то же время она является самым инвазивным и морбидным методом хирургического лечения гиперплазии простаты (1b, А). Только энуклеация гольмиевым лазером достигает сходной с открытой аденомэктомией результативности при меньшей частоте осложнений [67, 68].
При открытой аденомэктомии увеличивается Qmax (+375%), уменьшается сумма баллов IPSS (-63–86%), улучшается качество жизни QoL (-60–87%), уменьшается объем остаточной мочи (-86–98%) [67, 69].
К ближайшим осложнениям открытой аденомэктомии относится летальный исход (0,25%), необходимость гемотрансфузии (7–14%), к отдаленным – недержание мочи (10%), склероз шейки мочевого пузыря или стриктура уретры (6%) [67–69].
Трансуретральная микроволновая терапия
Трансуретральная микроволновая терапия позволяет достигать улучшения СНМП, сходного с ТУРП, при меньшей морбидности, но и при меньшем улучшении параметров мочеиспускания (1а, А). Продолжительность эффекта после микроволновой терапии короче, а частота повторных вмешательств выше по сравнению с ТУРП (1а, А).
Перед проведением трансуретральной микроволновой терапии обязательна уретроцистоскопия для исключения наличия средней доли предстательной железы и точного определения протяженности простатического отдела уретры. Для выполнения микроволновой терапии не требуется анестезия – манипуляция показана больным с высоким анестезиологическим риском. Результат вмешательства хуже при малых размерах предстательной железы и при невыраженной симптоматике. Трансуретральная микроволновая терапия приводит к увеличению Qmax (+75%) и снижению суммарного балла IPSS (-65%).
По сравнению с ТУРП после микроволновой термотерапии дольше продолжительность катетеризации, выше частота дизурии и ОЗМ. При этом ниже частота гематурии, тампонады, гемотрансфузии, ТУР-синдрома, стриктуры уретры, склероза шейки мочевого пузыря и эректильной дисфункции [70–73].
Трансуретральная игольная аблация простаты
Трансуретральная игольная аблация простаты позволяет достигать улучшения СНМП, сходного с ТУРП, при меньшей морбидности, но и при меньшем улучшении параметров мочеиспускания (1а, А). Продолжительность эффекта игольной аблации по сравнению с ТУРП меньше, а частота повторных вмешательств выше (1а, А).
Для проведения процедуры требуются местная анестезия и седация больного. При объеме простаты > 75 мл и при большой средней доле результаты данного вмешательства неудовлетворительные.
Трансуретральная игольная аблация позволяет увеличить Qmax (+70%) и снизить суммарный балл IPSS (-50%). Частота повторных вмешательств составляет 19,1%, ОЗМ – 13–42% (1–3 дня), в первые 4–6 недель имеет место высокая частота симптомов накопления.
По сравнению с ТУРП после игольной аблации ниже частота гематурии, инфекции, тампонады, гемотрансфузии, ТУР-синдрома, стриктуры уретры, недержания мочи, эректильной дисфункции и нарушений эякуляции [74–77].
Гольмиевая лазерная энуклеация
Гольмиевая лазерная энуклеация является стандартом хирургического лечения умеренных/выраженных СНМП при объеме простаты более 80 cм³ (1b, А). По объективным и субъективным параметрам эффективности у больных с умеренными и выраженными СНМП гольмиевая лазерная энуклеация является альтернативой ТУРП (1а, А). Данная операция имеет сходные с открытой аденомэктомией отдаленные результаты при существенно меньшей морбидности [67, 68]. По сравнению с ТУРП продолжительность гольмиевой энуклеации больше, степень улучшения симптоматики сходная или выше, а Qmax (через 1 год после операции) значительно выше [78–80]. Кроме того, при гольмиевой энуклеации, в отличие от ТУРП, короче время катетеризации, меньше кровопотеря и частота гемотрансфузии [67, 68].
Ближайшие осложнения гольмиевой энуклеации: летальный исход (0,05%), гемотрансфузия (1%), инфекция (2,3%), отдаленные – стриктура шейки мочевого пузыря (0,8%), стриктура уретры (3,2%), повторная операция (2,8%) [81]. Гольмиевая энуклеация безопасна при приеме антикоагулянтов [82].
Выпаривание простаты зеленым лазером
Выпаривание простаты зеленым (532 нм) лазером по объективным и субъективным параметрам эффективности у больных с умеренными и выраженными СНМП является альтернативой ТУРП (1а, А). Среднесрочные функциональные результаты выпаривания зеленым лазером сравнимы с таковыми после ТУРП (1b, A).
Интраоперационная безопасность выпаривания зеленым лазером выше, чем у ТУРП (1b, A); рассматриваемое вмешательство целесообразно у пациентов, получающих антикоагулянты и с высоким сердечно-сосудистым риском (3, В) [83–89]. Частота повторных вмешательств после выпаривания зеленым лазером составляет 8,9–14,8%. По сравнению с ТУРП при выпаривании дольше длится операция; однако меньше продолжительность катетеризации и госпитализации, а также ниже частота гемотрансфузии, тампонады. Частота ОЗМ, инфекции, стриктуры уретры, шейки мочевого пузыря при выпаривании зеленым лазером и ТУРП сходная [83, 90–98].
Выпаривание простаты диодным лазером
После операций с использованием диодного лазера в краткосрочной перспективе имеет место объективное и субъективное улучшение мочеиспускания (3, С). С использованием диодного лазера может производиться контактная или бесконтактная вапоризация, а также энуклеация гиперплазии простаты.
В настоящее время нет рандомизированных исследований по сравнению выпаривания простаты диодным лазером с ТУРП и открытой аденомэктомией. В одном рандомизированном исследовании получены сходные результаты диодной энуклеации и биполярной ТУРП [99].
При операциях с использованием диодного лазера нет интраоперационных кровотечений.
По сравнению с выпариванием зеленым лазером чаще дизурия из-за отхождения струпа, выше частота повторных вмешательств по поводу сужения шейки и обструкции струпом (33% против 4%), выше частота стрессового недержания мочи (9,1% против 0%) [100, 101].
Выпаривание простаты диодным лазером не может быть рекомендовано в качестве стандартного лечения гиперплазии простаты.
Хирургическое лечение с использованием тулиевого лазера
Вапорезекция тулиевым лазером может быть альтернативой ТУРП при простате малых и средних размеров (1b, A). В краткосрочной и среднесрочной перспективе после выпаривания тулиевым лазером имеет место объективное и субъективное улучшение мочеиспускания (3, С). Тулиевый лазер представляется безопасным с точки зрения интраоперационных осложнений и возможностей гемостаза (3, С). С использованием тулиевого лазера могут производиться вапоризация, вапорезекция, вапоэнуклеация и энуклеация аденомы простаты.
К настоящему времени проведено небольшое число рандомизированных исследований по сравнению операций с использованием тулиевого лазера с ТУРП и нет исследований по сравнению с открытой аденомэктомией [102–104]. Максимальный период наблюдения после операций составлял 18 месяцев.
Результаты тулиевой энуклеации (по параметрам IPSS, Qmax, объем остаточной мочи) сравнимы с таковыми после гольмиевой энуклеации. При тулиевой энуклеации отмечена сходная с гольмиевой энуклеацией продолжительность операции, при меньшей кровопотере [105].
Частота стриктур уретры после тулиевой вапорезекции составляет 1,6–1,9%, склероза шейки мочевого пузыря – 1,8%, повторных вмешательств (6–12 мес.) – 0–7,1% [102, 103, 105–107].
Простатические стенты
Простатические стенты являются альтернативой катетеризации у пациентов с противопоказаниями к оперативному лечению (3, С). При использовании стента UroLume суммарный балл IPSS снижается на 10–12,4, а Qmax повышается на 4,2–13,1 мл/с; при установке стента MemoCath IPSS уменьшается на 11–19 баллов, Qmax увеличивается на 3–11 мл/с. Применение простатических стентов сопряжено с высоким риском миграции, инкрустации и усиления СНМП [108–110].
Новые хирургические методики
Интрапростатическое введение этанола. Эта экспериментальная методика может быть использована только в клинических исследованиях с участием пациентов с умеренными/выраженными СНМП (3, С). Методика позволяет достигать снижения суммарного балла IPSS на 6,7–16,5 баллов, повышения Qmax на 3,2–11 мл/с [111–113]. Зарегистрирована высокая частота повторных вмешательств (41% в течение 1 года наблюдения) [114]. Для проведения вмешательства требуется местная анестезия с седацией, региональная или общая анестезия. Процедура осложняется болями в промежности, симптомами накопления (до 40%), гематурии (до 40%), инфекцией и ОЗМ [111].
Интрапростатическое введение ботулинического токсина. Эта экспериментальная методика также может использоваться только в клинических исследованиях при умеренных/выраженных СНМП (3, С). Метод способствует уменьшению объема простаты. Продолжительность эффекта от 3 до 30 месяцев [115]. В самом крупном рандомизированном исследовании не было определено отличий от плацебо по IPSS, QoL и Qmax [116–118]. Хорошо переносится [115–120]. Необходимы дополнительные исследования.
Выбор метода лечения
В заключение представим предлагаемые экспертами Европейской ассоциации урологов алгоритмы консервативного, медикаментозного (рис. 1) и оперативного лечения (рис. 2) больных с СНМП.
Оперативное лечение абсолютно показано больным c гиперплазией простаты и:
Антагонисты альфа-1-адренорецепторов (альфа-1-адреноблокаторы)
Альфа-1-адреноблокаторы – препараты первой линии, показанные при умеренных и выраженных СНМП (1а, А). В настоящее время в клинической практике используются 5 препаратов данной группы: альфузозин, доксазозин, силодозин, тамсулозин, теразозин. Препараты имеют сходную эффективность и быстрое начало действия, способны улучшать как симптомы накопления, так и симптомы опорожнения [7, 8].
При использовании альфа-1-адреноблокаторов имеет место снижение суммы баллов по IPSS в среднем на 30–40%, повышение максимальной скорости мочеиспускания (Qmax) в среднем на 20–25%. Размер простаты не оказывает существенного влияния на эффективность терапии. Альфа-1-адреноблокаторы не уменьшают размер простаты и не снижают риск острой задержки мочи (ОЗМ) [9–12]. При постоянном приеме антагонистов альфа-1-адренорецепторов снижение суммарного балла IPSS и повышение Qmax сохраняются на протяжении как минимум 4 лет.
Отличия в переносимости препаратов данной группы обусловлены их фармакокинетикой и степенью селективности. Наиболее часто регистрируются такие нежелательные явления, как астения, головокружение и ортостатическая гипотензия. Наличие сердечно-сосудистых заболеваний, а также прием вазоактивных препаратов повышают риск развития нежелательных явлений [13]. Установлено, что риск гипотензии при приеме силодозина сравним с таковым у плацебо, вследствие самой высокой его уроселективности из всех существующих альфа-1-адреноблокаторов. При использовании тамсулозина описано развитие интраоперационного синдрома атоничной радужки (этот синдром характерен для всех селективных альфа-блокаторов) [14].
В систематическом обзоре установлено, что альфа-1-адреноблокаторы не оказывают негативного влияния на либидо. Препараты способны несколько улучшать эректильную функцию, но иногда вызывают нарушения эякуляции (уменьшение объема или исчезновение эякулята) [15]. Наиболее часто нарушения эякуляции регистрируются при приеме силодозина, однако его прием из-за возникновения данного феномена прекращают всего 3,9% пациентов [16].
Ингибиторы 5-альфа-редуктазы
Ингибиторы 5-альфа-редуктазы показаны при умеренных и выраженных СНМП и при объеме простаты более 40 см³, уровне простатического специфического антигена (ПСА) > 1,4 нг/мл (1b, А). В настоящее время в клинической практике используются 2 препарата данной группы: дутастерид и финастерид. Финастерид ингибирует 5-альфа-редуктазу 2-го типа, дутастерид – как 2-го, так и 1-го типа. Препараты имеют сходную клиническую эффективность, и для них характерно медленное развитие эффекта [17–19].
После 2–4 лет лечения ингибитором 5-альфа-редуктазы имеет место уменьшение количества баллов по шкале IPSS в среднем на 15–30%, снижение объема простаты в среднем на 18–28%, повышение Qmax в среднем на 1,5–2,0 мл/с. При этом чем больше исходный объем простаты, тем выше эффективность препаратов данной группы. У больных с объемом простаты > 30 см³ эффективность дутастерида по уменьшению СНМП не уступает/превосходит таковую тамсулозина [10, 11, 20].
В отличие от альфа-1-адреноблокаторов, ингибиторы 5-альфа-редуктазы способны снижать риск прогрессирования ДГПЖ за счет уменьшения риска ОЗМ и риска хирургического лечения (1b, А) [12, 21, 22]. На фоне приема ингибиторов 5-альфа-редуктазы риск развития ОЗМ снижается на 57–68%, риск оперативного лечения – на 34–64% [12, 22–25].
К наиболее частым нежелательным явлениям, которые возникают на фоне приема ингибиторов 5-альфа-редуктазы, относятся снижение либидо, эректильная дисфункция, редко – гинекомастия, эякуляторные нарушения [11, 12].
Антагонисты мускариновых рецепторов (М-холиноблокаторы)
Антагонисты мускариновых рецепторов (М-холиноблокаторы) показаны при умеренных и выраженных СНМП – преимущественно при симптомах накопления (1b, B). В настоящее время в клинической практике используются 6 препаратов данной группы: дарифенацин, фезотеродин, оксибутинин, пропиверин, солифенацин, толтеродин и хлорид троспия. Препараты имеют сходную эффективность и переносимость. Однако исследований по длительному их применению пока не проводилось. Назначать М-холиноблокаторы надо с осторожностью, с регулярной оценкой IPSS и объема остаточной мочи.
Имеется небольшое количество исследований по изучению монотерапии антагонистами мускариновых рецепторов у больных с простатической обструкцией и гиперактивностью мочевого пузыря. В исследовании толтеродина и тамсулозина в группе толтеродина было отмечено только снижение частоты ургентного недержания [26]. Эффект от приема М-холиноблокаторов был выше у больных с небольшими размерами предстательной железы и при ПСА < 1,3 нг/мл [27].
Наиболее часто при приеме М-холиноблокаторов регистрируются такие нежелательные явления, как сухость во рту (< 16%), запоры (< 4%), затруднение мочеиспускания (< 2%), назофарингит (< 3%), головокружение (< 5%). При отсутствии простатической обструкции прием антагонистов мускариновых рецепторов сопряжен с частотой ОЗМ, не отличающейся от таковой при приеме плацебо (0–1,3% и 0–1,4% соответственно) [28].
Ингибиторы фосфодиэстеразы 5 типа (ФДЭ-5)
Ингибиторы ФДЭ-5 показаны при умеренных и выраженных СНМП (и накопления, и опорожнения) в сочетании с эректильной дисфункцией или без таковой (1b, А). В рандомизированных контролируемых исследованиях у больных с гиперплазией простаты изучались эффекты cилденафила, тадалафила и варденафила. Однако только тадалафил 5 мг зарегистрирован для лечения СНМП.
По данным метаанализа, терапия ингибитором ФДЭ-5 в сравнении с плацебо приводит к значимому снижению суммарного балла IPSS (-2,8 балла), без влияния на Qmax [29]. При использовании тадалафила субъективное улучшение отмечается достаточно быстро – через 1 неделю от начала приема. Тадалафил 5 мг у больных ДГПЖ снижает суммарный балл IPSS на 22–37% [30, 31]. В одном из последних исследований, не включенном в упомянутый метаанализ, при лечении тадалафилом имело место статистически значимое увеличение Qmax по сравнению с плацебо (+2,4 мл/с) [31]. Тадалафил не оказывал значимого влияния на объем остаточной мочи.
Наиболее выраженный эффект от терапии ингибиторами ФДЭ-5 отмечается у более молодых пациентов с низким индексом массы тела и с тяжелыми СНМП [29].
Влияние ингибиторов ФДЭ-5 на прогрессирование заболевания и на объем простаты пока не изучено.
Прием ингибиторов ФДЭ-5 может сопровождаться головными болями, болью в спине, головокружением, диспепсией. Препараты противопоказаны:
- при приеме нитратов, активаторов калиевых каналов и альфа-1-адреноблокаторов;
- при перенесенном менее 3 месяцев назад инфаркте миокарда или менее 6 месяцев назад инсульте;
- при сердечной недостаточности более чем 2-й стадии по классификации Нью-Йоркской ассоциации кардиологов (New York Heart Association, NYHA);
- при гипотензии и нестабильном артериальном давлении;
- при значительной печеночной или почечной недостаточности;
- при передней ишемической офтальмопатии в анамнезе.
Наиболее широко в лечении СНМП используются экстракты Cucurbita pepo, Hypoxis rooperi, Pygeum afticanum, Secale cereale, Serenoa repens, Utrica dioica. Серьезным препятствием является тот факт, что разные производители используют различные методы экстрагирования, в связи с чем в препаратах могут быть неодинаковые концентрации активных компонентов [32].
По данным метаанализа, применение экстракта Pygeum afticanum способствовало симптоматическому улучшению в 2 раза чаще по сравнению с плацебо (в исследованиях, однако, результат не оценивался по IPSS) [33].
По данным метаанализа, на фоне приема экстракта Secale cereale (пыльцы) положительный эффект отмечался в 2 раза чаще, чем при приеме плацебо [34].
По данным метаанализа, экстракт Serenoa repens не превосходил плацебо, финастерид или тамсулозин по действию на суммарный балл IPSS (сходная эффективность в исследованиях с финастеридом и тамсулозином может расцениваться как эквивалентность лечебного эффекта) [35].
В связи с гетерогенностью препаратов, несовершенством регуляторной базы и существенными методологическими недостатками опубликованных исследований и метаанализов экспертный совет не может дать каких-либо определенных рекомендаций по использованию растительных экстрактов для лечения СНМП у мужчин.
Аналог вазопрессина (десмопрессин)
Десмопрессин может быть использован для лечения никтурии, обусловленной ночной полиурией (1b, А). По данным метаанализа, при приеме десмопрессина в сравнении с плацебо имеет место статистически значимое снижение количества ночных мочеиспусканий и увеличение продолжительности сна без пробуждения [36–39].
К наиболее частым нежелательным явлениям при приеме десмопрессина относятся головная боль, тошнота, диарея, боль в животе, головокружение, сухость во рту, гипонатриемия (5–7,6%), периферические отеки (2%), гипертензия (5%) [38, 40, 41].
При назначении десмопрессина необходимо ограничить прием жидкостей за 1 час до и в течение 8 часов после приема, а также контролировать уровень натрия в крови на 3-и и 7-е сутки после приема препарата и затем регулярно.
Комбинированная терапия
Комбинированная терапия альфа-1-адреноблокатором и ингибитором 5-альфа-редуктазы. Данная комбинация препаратов показана при умеренных и выраженных СНМП, увеличенной простате, сниженной Qmax (другими словами, при высоком риске прогрессирования гиперплазии простаты) (1b, А). Комбинированная терапия альфа-1-адреноблокатором и ингибитором 5-альфа-редуктазы эффективнее монотерапии каждым из препаратов в снижении суммарного балла IPSS и увеличении Qmax. Комбинированная терапия ингибитором 5-альфа-редуктазы и альфа-1-адреноблокатором в сравнении с монотерапией тамсулозином обеспечивает существенное снижение риска прогрессирования ДГПЖ (на 66%), ОЗМ (на 67,8%), необходимости хирургического лечения по поводу ДГПЖ (на 70,6%), симптоматического ухудшения (на 41,3%) (4 года наблюдения) [10–12].
Комбинированная терапия альфа-1-адреноблокатором и М-холиноблокатором. Данная комбинация может быть назначена при умеренных и выраженных СНМП, когда монотерапия альфа-1-адреноблокатором или М-холиноблокатором недостаточно эффективна в отношении симптомов накопления (2b, В). Эта комбинация препаратов более эффективна, чем монотерапия альфа-1-адреноблокатором или плацебо, в уменьшении частоты мочеиспусканий и эпизодов ургентного недержания, ночной поллакиурии и суммарного балла IPSS [42–47].
У больных с СНМП и гиперактивностью детрузора при сохранении СНМП на фоне терапии альфа-1-адреноблокатором добавление М-холиноблокатора существенно снижает степень выраженности симптомов [42–49].
На фоне комбинированного лечения несколько чаще, чем при монотерапии, встречаются сухость во рту и нарушения эякуляции. Кроме того, при комбинированном лечении установлено клинически незначимое увеличение объема остаточной мочи, при этом риск ОЗМ остается низким [48–50].
Данный вид терапии должен с осторожностью назначаться при инфравезикальной обструкции – рекомендуется динамический контроль объема остаточной мочи.
Клинические рекомендации по хирургическому лечению
Трансуретральная резекция простаты (ТУРП) и трансуретральная инцизия простаты
ТУРП – стандарт хирургического лечения умеренных/выраженных СНМП при объеме простаты 30–80 cм³ (1а, А). Трансуретральная инцизия простаты – стандарт хирургического лечения умеренных/выраженных СНМП при объеме простаты < 30 cм³ и при отсутствии средней доли (1а, А).
По данным метаанализа (20 рандомизированных исследований, до 5 лет наблюдения), эффективность ТУРП подтверждается улучшением основных показателей: увеличением Qmax (+162%), снижением суммарного балла IPSS (-70%), индекса качества жизни (Quality of Life index, QoL) (-69%), объема остаточной мочи (-77%) [51]. Отдаленные результаты после ТУРП хорошие. Неудачи лечения чаще связаны с гиперактивностью мочевого пузыря, а не с инфравезикальной обструкцией [52]. По данным метаанализа (включено 6 исследований), частота повторных операций составляет 18,4% после трансуретральной инцизии простаты и 7,2% после ТУРП [53].
До операции обязательно лечение мочевой инфекции.
Частота осложнений растет с увеличением объема простаты. Ближайшими осложнениями после ТУРП могут быть летальный исход (0,1%), ТУР-синдром (0,8%), необходимость гемотрансфузии (2%), ОЗМ (4,5%), тампонада (4,9%), мочевая инфекция (4,1%). Отдаленные осложнения после ТУРП – недержание мочи (2,2%), ОЗМ, инфекция, склероз шейки мочевого пузыря (4,7%), стриктура уретры (3,8%), ретроградная эякуляция (65,4%), эректильная дисфункция (6,5%). Ближайшие осложнения после инцизии: ТУР-синдром (0%), гемотрансфузия (0%); отдаленные – стриктура уретры (4,1%), ретроградная эякуляция (18,2%) [51, 54].
Биполярная трансуретральная резекция простаты
Ближайшие и среднесрочные результаты биполярной трансуретральной резекции простаты аналогичны таковым при монополярной ТУРП (1а, А). По сравнению с монополярной ТУРП у биполярной ТУРП меньшая частота ранних осложнений: нет ТУР-синдрома, кровотечений, тампонад, меньше продолжительность катетеризации (1а, А) [55–66].
Открытая аденомэктомия
Открытая аденомэктомия является стандартом хирургического лечения умеренных/выраженных СНМП при объеме простаты более 80 cм³ (1b, А). В то же время она является самым инвазивным и морбидным методом хирургического лечения гиперплазии простаты (1b, А). Только энуклеация гольмиевым лазером достигает сходной с открытой аденомэктомией результативности при меньшей частоте осложнений [67, 68].
При открытой аденомэктомии увеличивается Qmax (+375%), уменьшается сумма баллов IPSS (-63–86%), улучшается качество жизни QoL (-60–87%), уменьшается объем остаточной мочи (-86–98%) [67, 69].
К ближайшим осложнениям открытой аденомэктомии относится летальный исход (0,25%), необходимость гемотрансфузии (7–14%), к отдаленным – недержание мочи (10%), склероз шейки мочевого пузыря или стриктура уретры (6%) [67–69].
Трансуретральная микроволновая терапия
Трансуретральная микроволновая терапия позволяет достигать улучшения СНМП, сходного с ТУРП, при меньшей морбидности, но и при меньшем улучшении параметров мочеиспускания (1а, А). Продолжительность эффекта после микроволновой терапии короче, а частота повторных вмешательств выше по сравнению с ТУРП (1а, А).
Перед проведением трансуретральной микроволновой терапии обязательна уретроцистоскопия для исключения наличия средней доли предстательной железы и точного определения протяженности простатического отдела уретры. Для выполнения микроволновой терапии не требуется анестезия – манипуляция показана больным с высоким анестезиологическим риском. Результат вмешательства хуже при малых размерах предстательной железы и при невыраженной симптоматике. Трансуретральная микроволновая терапия приводит к увеличению Qmax (+75%) и снижению суммарного балла IPSS (-65%).
По сравнению с ТУРП после микроволновой термотерапии дольше продолжительность катетеризации, выше частота дизурии и ОЗМ. При этом ниже частота гематурии, тампонады, гемотрансфузии, ТУР-синдрома, стриктуры уретры, склероза шейки мочевого пузыря и эректильной дисфункции [70–73].
Трансуретральная игольная аблация простаты
Трансуретральная игольная аблация простаты позволяет достигать улучшения СНМП, сходного с ТУРП, при меньшей морбидности, но и при меньшем улучшении параметров мочеиспускания (1а, А). Продолжительность эффекта игольной аблации по сравнению с ТУРП меньше, а частота повторных вмешательств выше (1а, А).
Для проведения процедуры требуются местная анестезия и седация больного. При объеме простаты > 75 мл и при большой средней доле результаты данного вмешательства неудовлетворительные.
Трансуретральная игольная аблация позволяет увеличить Qmax (+70%) и снизить суммарный балл IPSS (-50%). Частота повторных вмешательств составляет 19,1%, ОЗМ – 13–42% (1–3 дня), в первые 4–6 недель имеет место высокая частота симптомов накопления.
По сравнению с ТУРП после игольной аблации ниже частота гематурии, инфекции, тампонады, гемотрансфузии, ТУР-синдрома, стриктуры уретры, недержания мочи, эректильной дисфункции и нарушений эякуляции [74–77].
Гольмиевая лазерная энуклеация
Гольмиевая лазерная энуклеация является стандартом хирургического лечения умеренных/выраженных СНМП при объеме простаты более 80 cм³ (1b, А). По объективным и субъективным параметрам эффективности у больных с умеренными и выраженными СНМП гольмиевая лазерная энуклеация является альтернативой ТУРП (1а, А). Данная операция имеет сходные с открытой аденомэктомией отдаленные результаты при существенно меньшей морбидности [67, 68]. По сравнению с ТУРП продолжительность гольмиевой энуклеации больше, степень улучшения симптоматики сходная или выше, а Qmax (через 1 год после операции) значительно выше [78–80]. Кроме того, при гольмиевой энуклеации, в отличие от ТУРП, короче время катетеризации, меньше кровопотеря и частота гемотрансфузии [67, 68].
Ближайшие осложнения гольмиевой энуклеации: летальный исход (0,05%), гемотрансфузия (1%), инфекция (2,3%), отдаленные – стриктура шейки мочевого пузыря (0,8%), стриктура уретры (3,2%), повторная операция (2,8%) [81]. Гольмиевая энуклеация безопасна при приеме антикоагулянтов [82].
Выпаривание простаты зеленым лазером
Выпаривание простаты зеленым (532 нм) лазером по объективным и субъективным параметрам эффективности у больных с умеренными и выраженными СНМП является альтернативой ТУРП (1а, А). Среднесрочные функциональные результаты выпаривания зеленым лазером сравнимы с таковыми после ТУРП (1b, A).
Интраоперационная безопасность выпаривания зеленым лазером выше, чем у ТУРП (1b, A); рассматриваемое вмешательство целесообразно у пациентов, получающих антикоагулянты и с высоким сердечно-сосудистым риском (3, В) [83–89]. Частота повторных вмешательств после выпаривания зеленым лазером составляет 8,9–14,8%. По сравнению с ТУРП при выпаривании дольше длится операция; однако меньше продолжительность катетеризации и госпитализации, а также ниже частота гемотрансфузии, тампонады. Частота ОЗМ, инфекции, стриктуры уретры, шейки мочевого пузыря при выпаривании зеленым лазером и ТУРП сходная [83, 90–98].
Выпаривание простаты диодным лазером
После операций с использованием диодного лазера в краткосрочной перспективе имеет место объективное и субъективное улучшение мочеиспускания (3, С). С использованием диодного лазера может производиться контактная или бесконтактная вапоризация, а также энуклеация гиперплазии простаты.
В настоящее время нет рандомизированных исследований по сравнению выпаривания простаты диодным лазером с ТУРП и открытой аденомэктомией. В одном рандомизированном исследовании получены сходные результаты диодной энуклеации и биполярной ТУРП [99].
При операциях с использованием диодного лазера нет интраоперационных кровотечений.
По сравнению с выпариванием зеленым лазером чаще дизурия из-за отхождения струпа, выше частота повторных вмешательств по поводу сужения шейки и обструкции струпом (33% против 4%), выше частота стрессового недержания мочи (9,1% против 0%) [100, 101].
Выпаривание простаты диодным лазером не может быть рекомендовано в качестве стандартного лечения гиперплазии простаты.
Хирургическое лечение с использованием тулиевого лазера
Вапорезекция тулиевым лазером может быть альтернативой ТУРП при простате малых и средних размеров (1b, A). В краткосрочной и среднесрочной перспективе после выпаривания тулиевым лазером имеет место объективное и субъективное улучшение мочеиспускания (3, С). Тулиевый лазер представляется безопасным с точки зрения интраоперационных осложнений и возможностей гемостаза (3, С). С использованием тулиевого лазера могут производиться вапоризация, вапорезекция, вапоэнуклеация и энуклеация аденомы простаты.
К настоящему времени проведено небольшое число рандомизированных исследований по сравнению операций с использованием тулиевого лазера с ТУРП и нет исследований по сравнению с открытой аденомэктомией [102–104]. Максимальный период наблюдения после операций составлял 18 месяцев.
Результаты тулиевой энуклеации (по параметрам IPSS, Qmax, объем остаточной мочи) сравнимы с таковыми после гольмиевой энуклеации. При тулиевой энуклеации отмечена сходная с гольмиевой энуклеацией продолжительность операции, при меньшей кровопотере [105].
Частота стриктур уретры после тулиевой вапорезекции составляет 1,6–1,9%, склероза шейки мочевого пузыря – 1,8%, повторных вмешательств (6–12 мес.) – 0–7,1% [102, 103, 105–107].
Простатические стенты
Простатические стенты являются альтернативой катетеризации у пациентов с противопоказаниями к оперативному лечению (3, С). При использовании стента UroLume суммарный балл IPSS снижается на 10–12,4, а Qmax повышается на 4,2–13,1 мл/с; при установке стента MemoCath IPSS уменьшается на 11–19 баллов, Qmax увеличивается на 3–11 мл/с. Применение простатических стентов сопряжено с высоким риском миграции, инкрустации и усиления СНМП [108–110].
Новые хирургические методики
Интрапростатическое введение этанола. Эта экспериментальная методика может быть использована только в клинических исследованиях с участием пациентов с умеренными/выраженными СНМП (3, С). Методика позволяет достигать снижения суммарного балла IPSS на 6,7–16,5 баллов, повышения Qmax на 3,2–11 мл/с [111–113]. Зарегистрирована высокая частота повторных вмешательств (41% в течение 1 года наблюдения) [114]. Для проведения вмешательства требуется местная анестезия с седацией, региональная или общая анестезия. Процедура осложняется болями в промежности, симптомами накопления (до 40%), гематурии (до 40%), инфекцией и ОЗМ [111].
Интрапростатическое введение ботулинического токсина. Эта экспериментальная методика также может использоваться только в клинических исследованиях при умеренных/выраженных СНМП (3, С). Метод способствует уменьшению объема простаты. Продолжительность эффекта от 3 до 30 месяцев [115]. В самом крупном рандомизированном исследовании не было определено отличий от плацебо по IPSS, QoL и Qmax [116–118]. Хорошо переносится [115–120]. Необходимы дополнительные исследования.
Выбор метода лечения
В заключение представим предлагаемые экспертами Европейской ассоциации урологов алгоритмы консервативного, медикаментозного (рис. 1) и оперативного лечения (рис. 2) больных с СНМП.
Оперативное лечение абсолютно показано больным c гиперплазией простаты и:
- рецидивирующей инфекцией мочевых путей;
- повторившейся после удаления катетера или рецидивирующей острой задержкой мочи;
- парадоксальной ишурией;
- устойчивой к терапии макрогематурией;
- двусторонним уретерогидронефрозом c почечной недостаточностью (или без нее);
- камнями мочевого пузыря;
- дивертикулом мочевого пузыря больших размеров.
1. Oelke M., Bachmann A., Descazeaud A. et al. EAU guidelines on the treatment and follow-up of non-neurogenic male lower urinary tract symptoms including benign prostatic obstruction // Eur. Urol. 2013. Vol. 64. № 1. P. 118–140.
2. Levels of Evidence / Oxford Centre for Evidence-based Medicine // www.cebm.net/index.aspx?o=1025.
3. Flanigan R.C., Reda D.J., Wasson J.H. et al. 5-year outcome of surgical resection and watchful waiting for men with moderately symptomatic benign prostatic hyperplasia: a Department of Veterans Affairs cooperative study // J. Urol. 1998. Vol. 160. № 1. P. 12–16.
4. Netto N.R., de Lima M.L., Netto M.R. et al. Evaluation of patients with bladder outlet obstruction and mild international prostate symptom score followed up by watchful waiting // Urology. 1999. Vol. 53. № 2. P. 314–316.
5. Brown C.T., Yap T., Cromwell D.A. et al. Self management for men with lower urinary tract symptoms: a randomised controlled trial // BMJ. 2007. Vol. 334. № 7583. P. 25.
6. Yap T.L., Brown C., Cromwell D.A. et al. The impact of self-management of lower urinary tract symptoms on frequency-volume chart measures // BJU Int. 2009. Vol. 104. № 8. P. 1104–1108.
7. Djavan B., Chapple C., Milani S. et al. State of the art on the efficacy and tolerability of alpha1-adrenoceptor antagonists in patients with lower urinary tract symptoms suggestive of benign prostatic hyperplasia // Urology. 2004. Vol. 64. № 6. P. 1081–1088.
8. Michel M.C., Mehlburger L., Bressel H.U. et al. Comparison of tamsulosin efficacy in subgroups of patients with lower urinary tract symptoms // Prostate Cancer Prostatic Dis. 1998. Vol. 1. № 6. P. 332–335.
9. Roehrborn C.G. Three months’ treatment with the alpha1-blocker alfuzosin does not affect total or transition zone volume of the prostate // Prostate Cancer Prostatic Dis. 2006. Vol. 9. № 2. P. 121–125.
10. Roehrborn C.G., Siami P., Barkin J. et al. The effects of dutasteride, tamsulosin and combination therapy on lower urinary tract symptoms in men with benign prostatic hyperplasia and prostatic enlargement: 2-year results from the CombAT study // J. Urol. 2008. Vol. 179. № 2. P. 616–621.
11. Roehrborn C.G., Siami P., Barkin J. et al. The effects of combination therapy with dutasteride and tamsulosin on clinical outcomes in men with symptomatic benign prostatic hyperplasia: 4-year results from the CombAT Study // Eur. Urol. 2010. Vol. 57. № 1. P. 123–131.
12. McConnell J.D., Roehrborn C.G., Bautista O.M. et al. The long-term effect of doxazosin, finasteride, and combination therapy on the clinical progression of benign prostatic hyperplasia // N. Engl. J. Med. 2003. Vol. 349. № 25. P. 2387–2398.
13. Barendrecht M.M., Koopmans R.P., de la Rosette J.J. et al. Treatment of lower urinary tract symptoms suggestive of benign prostatic hyperplasia: the cardiovascular system // BJU Int. 2005. Vol. 95. Suppl. 4. P. 19–28.
14. Chang D.F., Campbell J.R. Intraoperative floppy iris syndrome associated with tamsulosin // J. Cataract. Refract. Surg. 2005. Vol. 31. № 4. P. 664–673.
15. van Dijk M.M., de la Rosette J.J., Michel M.C. Effects of alpha(1)-adrenoceptor antagonists on male sexual function // Drugs. 2006. Vol. 66. № 3. P. 287–301.
16. Roehrborn C.G., Kaplan S.A., Lepor H. et al. Symptomatic and urodynamic responses in patients with reduced or no seminal emission during silodosin treatment for LUTS and BPH // Prostate Cancer Prostatic Dis. 2011. Vol. 14. № 2. P. 143–148.
17. Rittmaster R.S., Norman R.W., Thomas L.N. et al. Evidence for atrophy and apoptosis in the prostates of men given finasteride // J. Clin. Endocrinol. Metab. 1996. Vol. 81. № 2. P. 814–819.
18. Naslund M.J., Miner M. A review of the clinical efficacy and safety of 5alpha-reductase inhibitors for the enlarged prostate // Clin. Ther. 2007. Vol. 29. № 1. P. 17–25.
19. Nickel J.C., Gilling P., Tammela T.L. et al. Comparison of dutasteride and finasteride for treating benign prostatic hyperplasia: the Enlarged Prostate International Comparator Study (EPICS) // BJU Int. 2011. Vol. 108. № 3. P. 388–394.
20. Roehrborn C.G., Boyle P., Nickel J.C. et al. Efficacy and safety of a dual inhibitor of 5-alpha-reductase types 1 and 2 (dutasteride) in men with benign prostatic hyperplasia // Urology. 2002. Vol. 60. № 3. P. 434–441.
21. Roehrborn C.G. BPH progression: concept and key learning from MTOPS, ALTESS, COMBAT, and ALF-ONE // BJU Int. 2008. Vol. 101. Suppl. 3. P. 17–21.
22. McConnell J.D., Bruskewitz R., Walsh P. et al. The effect of finasteride on the risk of acute urinary retention and the need for surgical treatment among men with benign prostatic hyperplasia // N. Engl. J. Med. 1998. Vol. 338. № 9. P. 557–563.
23. Andersen J.T., Nickel J.C., Marshall V.R. et al. Finasteride significantly reduces acute urinary retention and need for surgery in patients with symptomatic benign prostatic hyperplasia // Urology. 1997. Vol. 49. № 6. P. 839–845.
24. Roehrborn C.G., Boyle P., Nickel J.C. et al. Efficacy and safety of a dual inhibitor of 5-alpha-reductase types 1 and 2 (dutasteride) in men with benign prostatic hyperplasia // Urology. 2002. Vol. 60. № 3. P. 434–441.
25. Roehrborn C.G., Lukkarinen O., Mark S. et al. Long-term sustained improvement in symptoms of benign prostatic hyperplasia with the dual 5alpha-reductase inhibitor dutasteride: results of 4-year studies // BJU Int. 2005. Vol. 96. № 4. P. 572–577.
26. Kaplan S.A., Roehrborn C.G., Rovner E.S. et al. Tolterodine and tamsulosin for treatment of men with lower urinary tract symptoms and overactive bladder // JAMA. 2006. Vol. 296. № 19. P. 2319–2328.
27. Roehrborn C.G., Kaplan S.A., Kraus S.R. et al. Effects of serum PSA on efficacy of tolterodine extended release with or without tamsulosin in men with LUTS, including OAB // Urology. 2008. Vol. 72. № 5. P. 1061–1067.
28. Abrams P., Kaplan S., de Koning Gans H.J. et al. Safety and tolerability of tolterodine for the treatment of overactive bladder in men with bladder outlet obstruction // J. Urol. 2006. Vol. 175. № 3. Pt. 1. P. 999–1004.
29. Gacci M., Corona G., Salvi M. et al. A systematic review and meta-analysis on the use of phosphodiesterase 5 inhibitors alone or in combination with alpha-blockers for lower urinary tract symptoms due to benign prostatic hyperplasia // Eur. Urol. 2012. Vol. 61. № 5. P. 994–1003.
30. Porst H., McVary K.T., Montorsi F. et al. Effects of once-daily tadalafil on erectile function in men with erectile dysfunction and signs and symptoms of benign prostatic hyperplasia [published correction appears in Eur. Urol. 2011. Vol. 59. P. 1082] // Eur. Urol. 2009. Vol. 56. № 4. P. 727–736.
31. Oelke M., Giuliano F., Mirone V. et al. Monotherapy with tadalafil or tamsulosin similarly improved lower urinary tract symptoms suggestive of benign prostatic hyperplasia in an international, randomised, parallel, placebo-controlled clinical trial // Eur. Urol. 2012. Vol. 61. № 5. P. 917–925.
32. Habib F.K., Wyllie M.G. Not all brands are created equal: a comparison of selected compounds of different brands of Serenoa repens extract // Prostate Cancer Prostatic Dis. 2004. Vol. 7. № 3. P. 195–200.
33. Wilt T., Ishani A., Mac Donald R. et al. Pygeum africanum for benign prostatic hyperplasia // Cochrane Database Syst. Rev. 2002. Vol. 1. CD001044.
34. Wilt T., Mac Donald R., Ishani A. et al. Cernilton for benign prostatic hyperplasia // Cochrane Database Syst. Rev. 2000. Vol. 2. CD001042.
35. Tacklind J., Mac Donald R., Rutks I. et al. Serenoa repens for benign prostatic hyperplasia // Cochrane Database Syst. Rev. 2012. Vol. 12. CD001423.
36. Mattiasson A., Abrams P., van Kerrebroeck P. et al. Efficacy of desmopressin in the treatment of nocturia: a double-blind placebo-controlled study in men // BJU Int. 2002. Vol. 89. № 9. P. 855–862.
37. Van Kerrebroeck P., Rezapour M., Cortesse A. et al. Desmopressin in the treatment of nocturia: a double-blind, placebo-controlled study // Eur. Urol. 2007. Vol. 52. № 1. P. 221–229.
38. Lose G., Mattiasson A., Walter S. et al. Clinical experiences with desmopressin for long-term treatment of nocturia // J. Urol. 2004. Vol. 172. № 3. P. 1021–1025.
39. Cornu J.N., Abrams P., Chapple C.R. et al. A contemporary assessment of nocturia: definition, epidemiology, pathophysiology, and management. A systematic review and meta-analysis // Eur. Urol. 2012. Vol. 62. № 5. P. 877–890.
40. Rembratt A., Riis A., Norgaard J.P. Desmopressin treatment in nocturia: an analysis of risk factors for hyponatremia // Neurourol. Urodyn. 2006. Vol. 25. № 2. P. 105–109.
41. Weatherall M. The risk of hyponatremia in older adults using desmopressin for nocturia: a systematic review and meta-analysis // Neurourol. Urodyn. 2004. Vol. 23. № 4. P. 302–305.
42. MacDiarmid S.A., Peters K.M., Chen A. et al. Efficacy and safety of extended-release oxybutynin in combination with tamsulosin for treatment of lower urinary tract symptoms in men: randomized, double-blind, placebo-controlled study // Mayo Clin. Proc. 2008. Vol. 83. № 9. P. 1002–1010.
43. Yokoyama T., Uematsu K., Watanabe T. et al. Naftopidil and propiverine hydrochloride for treatment of male lower urinary tract symptoms suggestive of benign prostatic hyperplasia and concomitant overactive bladder: a prospective randomized controlled study // Scand J. Urol. Nephrol. 2009. Vol. 43. № 4. P. 307–314.
44. Lee K.S., Choo M.S., Kim D.Y. et al. Combination treatment with propiverine hydrochloride plus doxazosin controlled release gastrointestinal therapeutic system formulation for overactive bladder and coexisting benign prostatic obstruction: a prospective, randomized, controlled multicenter study // J. Urol. 2005. Vol. 174. № 4. Pt. 1. P. 1334–1338.
45. Kaplan S.A., McCammon K., Fincher R. et al. Safety and tolerability of solifenacin add-on therapy to alpha-blocker treated men with residual urgency and frequency // J. Urol. 2009. Vol. 182. № 6. P. 2825–2830.
46. Chapple C., Herschorn S., Abrams P. et al. Tolterodine treatment improves storage symptoms suggestive of overactive bladder in men treated with a-blockers // Eur. Urol. 2009. Vol. 56. № 3. P. 534–543.
47. Kaplan S.A., Roehrborn C.G., Rovner E.S. et al. Tolterodine and tamsulosin for treatment of men with lower urinary tract symptoms and overactive bladder: a randomized controlled trial // JAMA. 2006. Vol. 296. № 19. P. 2319–2328.
48. Kaplan S.A., Roehrborn C.G., Abrams P. et al. Antimuscarinics for treatment of storage lower urinary tract symptoms in men: a systematic review // Int. J. Clin. Pract. 2011. Vol. 65. № 4. P. 487–507.
49. Athanasopoulos A., Chapple C., Fowler C. et al. The role of antimuscarinics in the management of men with symptoms of overactive bladder associated with concomitant bladder outlet obstruction: an update // Eur. Urol. 2011. Vol. 60. № 1. P. 94–105.
50. Kaplan S.A., He W., Koltun W.D. et al. Solifenacin plus tamsulosin combination treatment in men with lower urinary tract symptoms and bladder outlet obstruction: a randomized controlled trial // Eur. Urol. 2013. Vol. 63. № 1. P. 158–165.
51. Ahyai S.A., Gilling P., Kaplan S.A. et al. Meta-analysis of functional outcomes and complications following transurethral procedures for lower urinary tract symptoms resulting from benign prostatic enlargement // Eur. Urol. 2010. Vol. 58. № 3. P. 384–397.
52. Thomas A.W., Cannon A., Bartlett E. et al. The natural history of lowerurinary tract dysfunction in men: minimum 10-year urodynamic follow up of transurethral resection of prostate for bladder outlet obstruction // J. Urol. 2005. Vol. 174. № 5. P. 1887–1891.
53. Lourenco T., Shaw M., Fraser C. et al. The clinical effectiveness of transurethral incision of the prostate: a systematic review of randomised controlled trials // World J. Urol. 2010. Vol. 28. № 1. P. 23–32.
54. Madersbacher S., Marberger M. Is transurethral resection of the prostate still justified? // BJU. Urol. 1999. Vol. 83. № 3. P. 227–237.
55. Rassweiler J., Schulze M., Stock C. et al. Bipolar transurethral resection of the prostate: technical modifications and early clinical experience // Minim. Invasive Ther. Allied Technol. 2007. Vol. 16. № 1. P. 11–21.
56. Mamoulakis C., Ubbink D.T., de la Rosette J.J. Bipolar versus monopolar transurethral resection of the prostate: a systematic review and meta-analysis of randomized controlled trials // Eur. Urol. 2009. Vol. 56. № 5. P. 798–809.
57. Burke N., Whelan J.P., Goeree L. et al. Systematic review and meta-analysis of transurethral resection of the prostate versus minimally invasive procedures for the treatment of benign prostatic obstruction // Urology. 2010. Vol. 75. № 5. P. 1015–1022.
58. Mamoulakis C., de la Rosette J., Omar M.I. et al. Bipolar versus monopolar transurethral resection of the prostate for lower urinary tract symptoms secondary to benign prostatic obstruction // Cochrane Database Syst. Rev. 2012. Vol. 2. CD009629.
59. Mamoulakis C., Skolarikos A., Schulze M. et al. Results from an international multicentre double-blind randomized controlled trial on the perioperative efficacy and safety of bipolar vs monopolar transurethral resection of the prostate // BJU Int. 2012. Vol. 109. № 2. P. 240–248.
60. Mamoulakis C., Schulze M., Skolarikos A. et al. Bipolar versus monopolar transurethral resection of the prostate: evaluation of the impact on overall sexual function in an international randomized controlled trial setting // BJU Int. 2013. Vol. 112. № 1. P. 109–120.
61. Autorino R., Damiano R., Di Lorenzo G. et al. Four-year outcome of a prospective randomised trial comparing bipolar plasmakinetic and monopolar transurethral resection of the prostate // Eur. Urol. 2009. Vol. 55. № 4. P. 922–929.
62. Chen Q., Zhang L., Fan Q.L. et al. Bipolar transurethral resection in saline vs traditional monopolar resection of the prostate: results of a randomized trial with a 2-year follow-up // BJU Int. 2010. Vol. 106. № 9. P. 1339–1343.
63. Michielsen D.P., Coomans D. Urethral strictures and bipolar transurethral resection in saline of the prostate: fact or fiction? // J. Endourol. 2010. Vol. 24. № 8. P. 1333–1337.
64. Fagerstrom T., Nyman C.R., Hahn R.G. Complications and clinical outcome 18 months after bipolar and monopolar transurethral resection of the prostate // J. Endourol. 2011. Vol. 25. P. 1043–1049.
65. Geavlete B., Georgescu D., Multescu R. et al. Bipolar plasma vaporization vs monopolar and bipolar TURP: a prospective, randomized, long-term comparison // Urology. 2011. Vol. 78. № 4. P. 930–935.
66. Xie C.Y., Zhu G.B., Wang X.H. et al. Five-year follow-up results of a randomized controlled trial comparing bipolar plasmakinetic and monopolar transurethral resection of the prostate // Yonsei Med. J. 2012. Vol. 53. № 4. P. 734–741.
67. Kuntz R.M., Lehrich K., Ahyai S.A. Holmium laser enucleation of the prostate versus open prostatectomy for prostates greater than 100 grams: 5-year follow-up results of a randomised clinical trial // Eur. Urol. 2008. Vol. 53. № 1. P. 160–166.
68. Naspro R., Suardi N., Salonia A. et al. Holmium laser enucleation of the prostate versus open prostatectomy for prostates > 70 g: 24-month follow-up // Eur. Urol. 2006. Vol. 50. № 3. P. 563–568.
69. Varkarakis I., Kyriakakis Z., Delis A. et al. Long-term results of open transvesical prostatectomy from a contemporary series of patients // Urology. 2004. Vol. 64. № 2. P. 306–310.
70. Mattiasson A., Wagrell L., Schelin S. et al. Five-year follow-up of feedback microwave thermotherapy versus TURP for clinical BPH: a prospective randomized multicenter study // Urology. 2007. Vol. 69. № 1. P. 91–96.
71. Hoffman R.M., Monga M., Elliott S.P. et al. Microwave thermotherapy for benign prostatic hyperplasia // Cochrane Database Syst. Rev. 2012. № 9. CD004135.
72. D’Ancona F.C., van der Bij A.K., Francisca E.A. et al. Results of high energy transurethral microwave thermotherapy in patients categorized according to the American Society of Anaesthesiologists operative risk classification // Urology. 1999. Vol. 53. № 2. P. 322–328.
73. D’Ancona F.C., Francisca E.A., Hendriks J.C. et al. High energy transurethral thermotherapy in the treatment of benign prostatic hyperplasia: criteria to predict treatment outcome // Prostate Cancer Prostatic Dis. 1999. Vol. 2. № 2. P. 98–105.
74. Boyle P., Robertson C., Vaughan E.D. et al. A meta-analysis of trials of transurethral needle ablation for treating symptomatic benign prostatic obstruction // BJU Int. 2004. Vol. 94. № 1. P. 83–88.
75. Bouza C., Loґpez T., Magro A. et al. Systematic review and meta-analysis of transurethral needle ablation in symptomatic benign prostatic hyperplasia // BMC Urol. 2006. Vol. 6. P. 14.
76. Chapple C.R., Issa M.M., Woo H. Transurethral needle ablation (TUNA). A critical review of radiofrequency thermal therapy in the management of benign prostatic hyperplasia // Eur. Urol. 1999. Vol. 35. № 2. P. 119–128.
77. Schatzl G., Madersbacher S., Lang T. et al. The early postoperative morbidity of transurethral resection of the prostate and of four minimally invasive treatment alternatives // J. Urol. 1997. Vol. 158. № 1. P. 105–110.
78. Lourenco T., Pickard R., Vale L. et al. Alternative approaches to endoscopic ablation for benign enlargement of the prostate: systematic review of randomised controlled trials // BMJ. 2008. Vol. 337. P. a449.
79. Tan A., Liao C., Mo Z. et al. Meta-analysis of holmium laser enucleation versus transurethral resection of the prostate for symptomatic prostatic obstruction // Br. J. Surg. 2007. Vol. 94. № 10. P. 1201–1208.
80. Yin L., Teng J., Huang C.J. et al. Holmium laser enucleation of the prostate versus transurethral resection of the prostate: a systematic review and meta-analysis of randomized controlled trials // J. Endourol. 2013. Vol. 27. № 5. P. 604–611.
81. Kuntz R.M. Current role of lasers in the treatment of benign prostatic hyperplasia (BPH) // Eur. Urol. 2006. Vol. 49. № 6. P. 961–969.
82. Elzayat E., Habib E., Elhilali M. Holmium laser enucleation of the prostate in patients on anticoagulant therapy or with bleeding disorders // J. Urol. 2006. Vol. 175. № 4. P. 1428–1432.
83. Brunken C., Seitz C., Tauber S. et al. Transurethral GreenLight laser enucleation of the prostate: a feasibility study // J. Endourol. 2011. Vol. 25. № 7. P. 1199–1201.
84. Ruszat R., Wyler S., Seifert H.H. et al. Photoselective vaporization of the prostate: subgroup analysis of men with refractory urinary retention // Eur. Urol. 2006. Vol. 50. № 5. P. 1040–1049.
85. Reich O., Bachmann A., Siebels M. et al. High power (80W) potassium-titanyl-phosphate laser vaporization of the prostate in 66 high risk patients // J. Urol. 2005. Vol. 173. № 1. P. 158–160.
86. Ruszat R., Wyler S., Forster T. et al. Safety and effectiveness of photoselective vaporization of the prostate (PVP) in patients on ongoing oral anticoagulation // Eur. Urol. 2007. Vol. 51. № 4. P. 1031–1038.
87. Rajbabu K., Chandrasekara S.K., Barber N.J. et al. Photoselective vaporization of the prostate with the potassiumtitanyl-phosphate laser in men with prostates of >100 mL // BJU Int. 2007. Vol. 100. № 3. P. 593–598.
88. Chung D.E., Wysock J.S., Lee R.K. et al. Outcomes and complications after 532 nm laser prostatectomy in anticoagulated patients with benign prostatic hyperplasia // J. Urol. 2011. Vol. 186. № 3. P. 977–981.
89. Woo H., Reich O., Bachmann A. et al. Outcome of GreenLight HPS 120-W laser therapy in specific patient populations: those in retention, on anticoagulants, and with large prostates (≥ 80 ml) // Eur. Urol. Suppl. 2008. Vol. 7. № 4. P. 378–383.
90. Thangasamy I.A., Chalasani V., Bachmann A. et al. Photoselective vaporisation of the prostate using 80-W and 120-W laser versus transurethral resection of the prostate for benign prostatic hyperplasia: a systematic review with meta-analysis from 2002 to 2012 // Eur. Urol. 2012. Vol. 62. № 2. P. 315–323.
91. Bouchier-Hayes D.M., van Appledorn S., Bugeja P. et al. A randomized trial of photoselective vaporization of the prostate using the 80-W potassiumtitanylphosphate laser vs transurethral prostatectomy, with 1-year follow up // BJU Int. 2010. Vol. 105. № 7. P. 964–969.
92. Capitán C., Blázquez C., Martin M.D. et al. GreenLight HPS 120-W laser vaporization versus transurethral resection of the prostate for the treatment of lower urinary tract symptoms due to benign prostatic hyperplasia: a randomized clinical trial with 2-year follow-up // Eur. Urol. 2011. Vol. 60. № 4. P. 734–739.
93. Skolarikos A., Alivizatos G., Chalikopoulos D. et al. 80W PVP versus TURP: results of a randomized prospective study at 12 months of follow-up // J. Urol. 2008. Vol. 179. № 4. P. 628.
94. Hai M.A. Photoselective vaporization of prostate: five-year outcomes entire clinic patient population // Urology. 2009. Vol. 73. № 4. P. 807–810.
95. Ruszat R., Seitz M., Wyler S.F. et al. GreenLight laser vaporisation of the prostate: single-center experience and long-term results after 500 procedures // Eur. Urol. 2008. Vol. 54. № 4. P. 893–901.
96. Al-Ansari A., Younes N., Sampige V.P. et al. GreenLight HPS 120-W laser vaporization versus transurethral resection of the prostate for treatment of benign prostatic hyperplasia: a randomized clinical trial with midterm follow-up // Eur. Urol. 2010. Vol. 58. № 3. P. 349–355.
97. Pereira-Correia J.A., de Moraes Sousa K.D., Santos J.B. et al. GreenLight HPSTM 120-W laser vaporization vs transurethral resection of the prostate (<60 mL): a 2-year randomized double-blind prospective urodynamic investigation // BJU Int. 2012. Vol. 110. № 8. P. 1184–1189.
98. Bachmann A., Muir G.H., Collins E.J. et al. 180-W XPS GreenLight laser therapy for benign prostate hyperplasia: early safety, efficacy, and perioperative outcome after 201 procedures // Eur. Urol. 2012. Vol. 61. № 3. P. 600–607.
99. Lusuardi L., Myatt A., Sieberer M. et al. Safety and efficacy of eraser laser enucleation of the prostate: preliminary report // J. Urol. 2011. Vol. 186. № 5. P. 1967–1971.
100. Ruszat R., Seitz M., Wyler S.F. et al. Prospective single-centre comparison of 120-W diode-pumped solid-state high-intensity system laser vaporization of the prostate and 200-W high-intensive diode-laser ablation of the prostate for treating benign prostatic hyperplasia // BJU Int. 2009. Vol. 104. № 6. P. 820–825.
101. Chiang P.H., Chen C.H., Kang C.H. et al. GreenLight HPS laser 120-W versus diode laser 200-W vaporization of the prostate: comparative clinical experience // Lasers Surg. Med. 2010. Vol. 42. № 7. P. 624–629.
102. Xia S.J., Zhuo J., Sun X.W. et al. Thulium laser versus standard transurethral resection of the prostate: a randomized prospective trial // Eur. Urol. 2008. Vol. 53. № 2. P. 382–390.
103. Fu W.J., Zhang X., Yang Y. et al. Comparison of 2-microm continuous wave laser vaporesection of the prostate and transurethral resection of the prostate: a prospective nonrandomized trial with 1-year follow-up // Urology. 2010. Vol. 75. № 1. P. 194–199.
104. Peng B., Wang G.-C., Zheng J.-H. et al. A comparative study of thulium laser resection of the prostate and bipolar transurethral plasma kinetic prostatectomy for treating benign prostatic hyperplasia // BJU Int. 2013. Vol. 111. № 4. P. 633–637.
105. Zhang F., Shao Q., Herrmann T.R. et al. Thulium laser versus holmium laser transurethral enucleation of the prostate: 18-month follow-up data of a single center // Urology. 2012. Vol. 79. № 4. P. 869–874.
106. Szlauer R., Gotschl R., Razmaria A. et al. Endoscopic vaporesection of the prostate using the continuous-wave 2-microm thulium laser: outcome and demonstration of the surgical technique // Eur. Urol. 2009. Vol. 55. № 2. P. 368–375.
107. Bach T., Netsch C., Haecker A. et al. Thulium: YAG laser enucleation (VapoEnucleation) of the prostate: safety and durability during intermediate-term follow-up // World J. Urol. 2010. Vol. 28. № 1. P. 39–43.
108. Armitage J.N., Cathcart P.J., Rashidian A. еt al. Epithelializing stent for benign prostatic hyperplasia: a systematic review of the literature // J. Urol. 2007. Vol. 177. № 5. P. 1619–1624.
109. Armitage J.N., Rashidian A., Cathcart P.J. et al. The thermo-expandable metallic stent for managing benign prostatic hyperplasia: a systematic review // BJU Int. 2006. Vol. 98. № 4. P. 806–810.
110. Vanderbrink B.A., Rastinehad A.R., Badlani G.H. Prostatic stents for the treatment of benign prostatic hyperplasia // Curr. Opin. Urol. 2007. Vol. 17. № 1. P. 1–6.
111. Grise P., Plante M., Palmer J. et al. Evaluation of the transurethral ethanol ablation of the prostate (TEAP) for symptomatic benign prostatic hyperplasia (BPH): a European multi-center evaluation // Eur. Urol. 2004. Vol. 46. № 4. P. 496–501.
112. Magno C., Mucciardi G., Galì A. et al. Transurethral ethanol ablation of the prostate (TEAP): an effective minimally invasive treatment alternative to traditional surgery for symptomatic benign prostatic hyperplasia (BPH) in high-risk comorbidity patients // Int. Urol. Nephrol. 2008. Vol. 40. № 4. P. 941–946.
113. El-Husseiny T., Buchholz N. Transurethral ethanol ablation of the prostate for symptomatic benign prostatic hyperplasia: long-term follow-up // J. Endourol. 2011. Vol. 25. № 3. P. 477–480.
114. Goya N., Ishikawa N., Ito F. et al. Transurethral ethanol injection therapy for prostatic hyperplasia: 3-year results // J. Urol. 2004. Vol. 172. № 3. P. 1017–1020.
115. Marchal C., Perez J.E., Herrera B. et al. The use of botulinum toxin in benign prostatic hyperplasia // Neurourol. Urodyn. 2012. Vol. 31. № 1. P. 86–92.
116. Crawford E.D., Hirst K., Kusek J.W. et al. Effects of 100 and 300 units of onabotulinum toxin A on lower urinary tract symptoms of benign prostatic hyperplasia: a phase II randomized clinical trial // J. Urol. 2011. Vol. 186. № 3. P. 965–970.
117. Arnouk R., Suzuki Bellucci C.H., Stull R.B. et al. Botulinum neurotoxin type A for the treatment of benign prostatic hyperplasia: randomized study comparing two doses // Scientific World Journal. 2012. Vol. 2012. ID 463574.
118. Marberger M., Chartier-Kastler E., Egerdie B. et al. A randomized double-blind placebo-controlled phase 2 dose-ranging study of onabotulinumtoxin A in men with benign prostatic hyperplasia // Eur. Urol. 2013. Vol. 63. № 3. P. 496–503.
119. Oeconomou A., Madersbacher H., Kiss G. et al. Is botulinum neurotoxin type A (BoNT-A) a novel therapy for lower urinary tract symptoms due to benign prostatic enlargement? A review of the literature // Eur. Urol. 2008. Vol. 54. № 4. P. 765–775.
120. Silva J., Pinto R., Carvalho T. et al. Intraprostatic botulinum toxin type A administration: evaluation of the effects on sexual function // BJU Int. 2011. Vol. 107. № 12. P. 1950–1954.
Overview of novel EAU clinical recommendations on treatment and maintenance of patients with non-neurogenic lower urinary tract symptoms and benign prostatic obstruction
K.L. Lokshin
Clinical Hospital “Lapino”, Department of Urology
I.M. Sechenov First Moscow State Medical University, The Research Institute of Uronephrology and Reproductive Health of Human
Сontact person: Konstantin Leonidovich Lokshin, k_lokshin@hotmail.com
First russified overview of clinical recommendations prepared by expert board of European Association of Urology in 2013 is presented that analyzes treatment and maintenance of non-neurogenic lower urinary tract symptoms and benign prostatic hyperplasia. These recommendations were designed according to principles of evidence based medicine and describe issues of dynamic follow-up as well as medicated and surgical treatment for such patients.
Key words: prostate, benign prostatic hyperplasia, lower urinary tract symptoms, European Association of Urology, clinical recommendations, dynamic follow-up, medicated treatment, surgical treatment
K.L. Lokshin
Clinical Hospital “Lapino”, Department of Urology
I.M. Sechenov First Moscow State Medical University, The Research Institute of Uronephrology and Reproductive Health of Human
Сontact person: Konstantin Leonidovich Lokshin, k_lokshin@hotmail.com
First russified overview of clinical recommendations prepared by expert board of European Association of Urology in 2013 is presented that analyzes treatment and maintenance of non-neurogenic lower urinary tract symptoms and benign prostatic hyperplasia. These recommendations were designed according to principles of evidence based medicine and describe issues of dynamic follow-up as well as medicated and surgical treatment for such patients.
Key words: prostate, benign prostatic hyperplasia, lower urinary tract symptoms, European Association of Urology, clinical recommendations, dynamic follow-up, medicated treatment, surgical treatment
Новости на тему
05.02.2024
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.