Введение
Несмотря на значительные успехи в лечении бронхиальной астмы (БА), достигнутые благодаря использованию ингаляционных глюкокортикостероидов (ИГКС) и их комбинаций с длительно действующими бета-2-агонистами (ДДБА), эпидемиологические и клинические исследования показывают, что у 38–74% больных не удается достичь контроля болезни даже на фоне постоянной поддерживающей терапии [1–3]. Особым фактором риска недостаточного контроля БА считается подростковый возраст, что, прежде всего, обусловлено низкой приверженностью к лечению у этой категории пациентов [4]. Наиболее серьезную проблему по-прежнему представляют пациенты с тяжелой персистирующей БА. Именно они относятся к группе высокого риска госпитализаций и летального исхода. Лечение пациентов с тяжелой неадекватно контролируемой астмой требует значительных расходов ресурсов здравоохранения [5].
Резистентность к терапии отмечается у 5–10% больных, несмотря на применение сверхвысоких доз ИГКС. Сегодня очевидна необходимость использования новых терапевтических подходов к лечению тяжелой рефрактерной БА. Одним из них является применение анти-IgE-терапии. На настоящий момент опыт длительного анти-IgE-лечения детей представлен в единичных публикациях авторов преимущественно из стран Европы, при этом период наблюдения в большинстве этих работ не превышает 1 годa. Все это не позволяет в полной мере оценить данный метод лечения, особенно его длительный эффект [6–8].
С научной и практической точек зрения особый интерес представляет изучение модифицирующего влияния анти-IgE-терапии на течение БА и функцию легких у детей. В этой связи целью нашего исследования явилась оценка эффективности и безопасности анти-IgЕ-терапии атопической тяжелой неконтролируемой БА у детей и подростков, а также анализ влияния анти-IgЕ-терапии на динамику функции легких.
Дизайн исследования
В ФГБУ «Научный центр здоровья детей» РАМН (НЦЗД РАМН) проведено открытое несравнительное исследование эффективности и безопасности терапии омализумабом у детей и подростков. Омализумаб назначался в соответствии с критериями отбора пациентов для проведения анти-IgE-терапии. Через 12 недель после первой инъекции препарата, согласно «Формуляру ЕС по увеличению потенциальной пользы и снижению потенциальных рисков при лечении омализумабом», принималось решение о целесообразности продолжения лечения. Максимальный период наблюдения составил 2 года на фоне терапии омализумабом.
Критериями эффективности терапии являлись снижение частоты клинически значимых обострений БА#; снижение частоты госпитализаций по поводу обострений БА (в течение одного года лечения); улучшение показателей функции легких (каждые 3 месяца); повышение показателей теста по контролю над БА (Asthma Control Test – АСТ-тест) (каждые 3 месяца); снижение дозы ИГКС на фоне лечения (по общепринятому стандарту, уменьшение объема базисной терапии при поддержании контроля БА в течение не менее 3 месяцев). Безопасность омализумаба оценивали по частоте развития серьезных нежелательных явлений, в том числе системных побочных реакций на препарат, а также по частоте развития местных реакций на введение препарата.
Характеристика пациентов
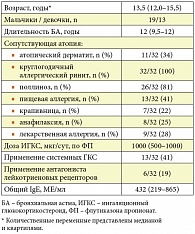
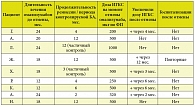
Анти-IgE-лечение получали 32 пациента (19 мальчиков и 13 девочек) в возрасте 9–17 лет с атопической БА тяжелого неконтролируемого течения. У большинства подростков первые симптомы БА появились уже в первые годы жизни, что характерно для тяжелого течения болезни (табл. 1). Все пациенты имели сочетанную аллергическую патологию: у 100% пациентов был диагностирован сопутствующий аллергический ринит, у 81% – поллиноз, более чем у трети – атопический дерматит и пищевая аллергия. Восемь детей (из 32) имели в анамнезе анафилактические реакции, в основном обусловленные пищевой аллергией.
Все больные получали базисную комбинированную терапию ИГКС и ДДБА в высоких дозах – не менее 500 мкг/сут по флутиказона пропионату (ФП). Средняя суточная доза ИГКС на момент начала анти-IgE-лечения составляла 863 мкг ФП. Шесть пациентов, помимо ингаляционной комбинированной терапии, получали монтелукаст натрия. Почти у половины больных применялись системные глюкокортикостероиды (ГКС) короткими курсами для купирования обострений БА в течение года, предшествующего началу лечения омализумабом.
Уровень общего IgE в сыворотке крови у 30 больных превышал 150 МЕ/мл, а у 2 пациентов был в пределах 70–150 МЕ/мл при подтвержденной специфической сенсибилизации к респираторным аллергенам. Согласно правилам дозирования, по причине высокого уровня IgE более половины наших пациентов получали омализумаб каждые 2 недели, причем 35% больных – в максимальной дозе 375 мг каждые 2 недели. Все больные имели верифицированную атопическую БА с широким спектром специфической сенсибилизации к респираторным и пищевым аллергенам. Для всех пациентов была характерна бытовая (клещевая) сенсибилизация, более половины больных имели поливалентную пыльцевую сенсибилизацию. В этой связи подчеркнем, что наличие атопии может рассматриваться в качестве основного предиктора успеха анти-IgE-терапии.
Результаты и их обсуждение
Анализ эффективности анти-IgE-лечения
На фоне лечения омализумабом частота клинически значимых обострений БА снизилась на 83% за первые 6 месяцев терапии (р < 0,001). Ко второму полугодию лечения значимо снизилась частота госпитализаций, потребность во внеплановых посещениях врача в связи с обострениями БА; на фоне длительного анти-IgE-лечения при отсутствии тяжелых обострений болезни резко сократилось применение системных ГКС (табл. 2).
Уже в течение первых 6 месяцев лечения количество больных с ночными симптомами БА сократилось в 3 раза, при более длительном лечении эпизодические ночные приступы сохранялись только у одного пациента. Анти-IgE-терапия положительно сказывалась не только на симптомах БА, но и в значительной степени уменьшала выраженность сопутствующей атопии. Уже после первых месяцев лечения до 45% больных отмечали облегчение симптомов аллергического ринита. На фоне лечения не было зарегистрировано ни одного случая проявлений пищевой аллергии. В результате терапии омализумабом потребность в применении назальных ГКС, антигистаминных препаратов уменьшилась в 3 раза (табл. 2).
Мы не отметили значимого снижения количества эозинофилов в крови на фоне лечения. У 6 из 7 детей с хронической крапивницей не было ни одного эпизода уртикарной сыпи. Интересным представляется факт полного купирования холодовой крапивницы у одного мальчика, стабильность этого эффекта мы наблюдаем уже на протяжении третьего года после начала лечения. У всех 11 пациентов с атопическим дерматитом отмечено значимое клиническое улучшение, через 6 месяцев лечения индекс тяжести атопического дерматита SCORAD (Severity scoring of atopic dermatitis) снизился с 32,81 до 6,66 балла (на 80%, р < 0,01), что позволило отказаться от применения топических ГКС. Доза ИГКС была постепенно снижена в среднем в 2 раза у 24 (75%) из 32 детей, получавших омализумаб более 6 месяцев. Ни в одном случае мы не форсировали снижение дозы ИГКС у наших пациентов, первые шаги в реализации принципа “step down” предпринимали обычно не ранее чем через 6 месяцев от начала анти-IgE-лечения при условии стабилизации состояния и хорошего контроля болезни. Новое повышение дозы ингаляционной базисной терапии оказалось необходимым у двух больных для улучшения контроля в период сезонного обострения болезни.
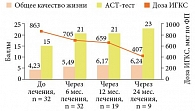
Субъективная оценка больными степени контроля симптомов БА на фоне лечения омализумабом была проанализирована на основании результатов АСТ-теста и опросника по качеству жизни больных БА AQLQ(S) (Asthma Quality of Life Questionnaire) в динамике. Суммарный балл в АСТ-тесте возрастает после первых трех месяцев лечения омализумабом с 15 до > 20, и в дальнейшем результат остается стабильно высоким (табл. 2).
Влияние анти-IgE-лечения на функцию внешнего дыхания
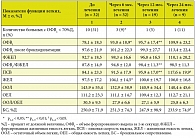
Уже после трех месяцев лечения омализумабом отмечался статистически значимый прирост скоростных показателей бронхиальной проходимости (табл. 3). Показатели ОФВ1 (объем форсированного выдоха за 1-ю секунду) и отношение ОФВ1/ФЖЕЛ (функциональная жизненная емкость легких) на фоне лечения нормализовались даже у тех больных, у которых явления бронхиальной обструкции уже в течение многих лет считались частично необратимыми, несмотря на постоянное лечение комбинированными противоастматическими препаратами. В дальнейшем, как через 1, так и через 2 года, функция легких оставалась стабильной, достоверно более высокой по сравнению с исходной.
Отмечено отсутствие существенных колебаний показателей бронхиальной проходимости, но в течение периода наблюдения многие больные пережили как минимум одно сезонное обострение (у 80% наших пациентов отмечался поллиноз).
Показатели бодиплетизмографии изменялись на фоне лечения в значительно меньшей степени, чем данные флоуметрии. Бронхиальное сопротивление (БС) достоверно снижалось у детей только на фоне длительного, более 1 года, лечения омализумабом. Но его величина оставалась значительно выше нормальной.
Влияние лечения на дозы препаратов
Доза ИГКС была постепенно снижена в среднем в 2 раза у 24 (75%) из 32 детей, получавших омализумаб более 6 месяцев (табл. 2, рис. 1). Средняя суточная доза ИГКС уменьшилась с 863 мкг/сут по ФП до 407 мкг/сут. Уменьшение дозы системных и ингаляционных ГКС является второстепенной, но значимой задачей анти-IgE-лечения. Логика базисной противоастматической терапии сегодня основана на следующей последовательности действий врача: сначала достижение и длительное поддержание контроля над болезнью, затем уменьшение объема базисной терапии. Ни в одном случае мы не форсировали снижение дозы ИГКС у наших пациентов. Первые шаги в реализации принципа “step down” предпринимали обычно не ранее чем через 6 месяцев от начала анти-IgE-лечения при условии стабилизации состояния и хорошего контроля болезни. Новое повышение дозы ингаляционной базисной терапии оказалось необходимым у двух больных для улучшения контроля в период сезонного обострения болезни.
Субъективная оценка больными степени контроля симптомов БА на фоне лечения омализумабом была проанализирована на основании результатов АСТ-теста в динамике. Суммарный балл в АСТ-тесте возрастал после первых трех месяцев лечения омализумабом – с 15 до > 20, в дальнейшем результат оставался стабильно высоким (табл. 2, рис. 1).
Оценка безопасности анти-IgE-лечения у детей и подростков
Безопасность анти-IgE-лечения оценивалась по наличию/отсутствию серьезных нежелательных явлений, связанных с введением препарата, а также местных и общих реакций, обусловленных, предположительно, препаратом. Мы не отмечали серьезных нежелательных явлений, связанных с терапией омализумабом, в течение всего периода применения этого лекарственного средства в нашей клинике. При общем небольшом количестве больных, получающих анти-IgE-терапию, количество инъекций омализумаба за 2 года работы превысило 2000. Не было отмечено ни одного случая анафилаксии, ангионевротического отека, бронхоспазма, а также общих неблагоприятных реакций. У одной пациентки была зарегистрирована крапивница через 6 часов после очередной инъекции препарата (предшествующее лечение в течение 5 месяцев), которая купировалась после приема антигистаминного препарата и при последующих инъекциях не возникала. У одного ребенка дважды возникали эпизоды необильной аллергической сыпи после инъекций. Выраженная местная реакция с развитием папулы диаметром ≥ 5 см отмечалась с частотой примерно 1/100 инъекций, разрешалась самостоятельно в течение часа.
Выраженные местные реакции свойственны в основном пациентам с хорошо развитой подкожно-жировой клетчаткой. Такие реакции возникают непосредственно в месте инъекционного введения препарата. Отметим, что омализумаб вводится подкожно в максимальном объеме 1,2 мл, препарат представляет собой вязкий густой раствор, медленно распределяющийся в подкожной клетчатке, поэтому образование небольшой папулы или уплотнения диаметром до 2–3 см в месте инъекции и сохранение ее в течение 20–60 минут вряд ли можно считать выраженной местной реакцией. Субъективных неприятных ощущений у больных в связи с этим, как правило, не возникает. Ни в одном случае лечение не было прекращено из-за развития нежелательных явлений.
Достижение контроля БА и его предикторы на фоне анти-IgE-терапии
На момент начала лечения омализумабом, согласно критериям включения в исследование, БА имела неконтролируемое течение у всех больных. Через 3 месяца анти-IgE-терапии полного контроля болезни удалось достичь у 12 больных (37%), частичного – у 14 больных (44%), астма оставалась неконтролируемой у 6 пациентов (19%). Спустя полгода лечения более половины больных полностью контролировали свою болезнь, при более длительном лечении омализумабом в среднем у 75% больных сохранялся полный контроль БА.
Для определения предикторов наилучшего ответа на анти-IgE-лечение и оценки влияния омализумаба на динамику показателей бронхиальной проходимости мы провели ретроспективный анализ исходных данных. Пациенты, достигшие полного контроля БА на фоне лечения омализумабом, имели меньшую тяжесть симптомов, чем пациенты, которые хуже ответили на проводившуюся анти-IgE-терапию. У подростков с хорошим ответом на лечение частота обострений болезни была ниже (4 против 6, р < 0,05), потребность в бета-2-агонистах меньше (применение > 1 раза в день у 16% против 43%, р < 0,05), такие пациенты реже госпитализировались (0–1 и 0–4 раз в год соответственно), и стартовая доза ИГКС у них составляла от 500 до 1000 мкг/сут по ФП (в группе с частичным ответом – 1000–1500 мкг/сут по ФП). Примечательно, что уровень общего IgE (основной предиктор успеха) в этих группах статистически значимо не различался (457 против 343 МЕ/мл).
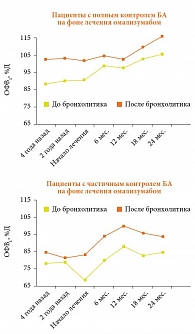
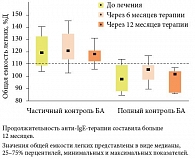
У пациентов с недостаточным ответом на лечение омализумабом показатели функции легких до начала анти-IgE-терапии были существенно ниже, чем у больных с контролируемой на фоне омализумаба БА (рис. 2). Кроме того, на графиках отчетливо видна тенденция к дальнейшему снижению функциональных возможностей легких. На фоне анти-IgE-терапии значительный прирост показателей функции внешнего дыхания отмечается в обеих группах.
Значимых различий в параметрах структуры общей емкости легких не выявлено. Однако у пациентов, не достигших хорошего контроля на омализумабе, наблюдаются признаки гиперинфляции легких. При этом признаки гиперинфляции легких у части пациентов практически не изменились на фоне лечения в течение года (рис. 3). Несмотря на лечение, оставался повышенным показатель ООЛ (остаточный объем легких), повышено и мало изменяется БС – важный маркер гиперреактивности дыхательных путей. Индекс ООЛ/ОЕЛ (общая емкость легких) у этих больных практически не изменился (33% против 30%), тогда как у больных с хорошим эффектом лечения он исходно был ниже (27%) и на фоне терапии имел тенденцию к снижению (24%).
Таким образом, полного контроля БА можно добиться у пациентов с исходно менее тяжелым течением заболевания, вне зависимости от степени выраженности атопии. Дети с низкой функцией легких, со снижением ФЖЕЛ, гиперинфляцией легких хуже достигают полного контроля болезни. Чем тяжелее протекает БА, тем труднее добиться оптимального результата. Тем не менее недостаточный эффект на фоне омализумаба, выражающийся в частичном контроле болезни, сопряжен у этих больных со значимым приростом легочной функции. На фоне лечения и в этой группе снижается частота обострений (с 6 до 1 в год, р < 0,05), уменьшается доза ИГКС (с 1000 до 750 мкг, p < 0,05), исчезает потребность в госпитализациях и системных ГКС. Омализумаб позволяет решить проблему контроля над болезнью для наиболее тяжелых, резистентных к стандартной терапии пациентов, а также отказаться от применения у них сверхвысоких доз ИГКС. Полного контроля болезни или выраженного улучшения удается достичь у 75% пациентов, эффект в большинстве случаев значимо нарастает в первые 6 месяцев лечения, является стабильным в дальнейшем на фоне лечения, обеспечивает хорошее качество жизни и нормальные показатели функции внешнего дыхания.
Отмена анти-IgE-терапии
Оптимальная продолжительность анти-IgE-лечения до настоящего времени не установлена. Опубликованные данные о длительности сохраняющегося эффекта анти-IgE-терапии немногочисленны и позволяют предположить зависимость продолжительности ремиссии болезни после отмены омализумаба от длительности курса лечения.
Российский опыт лечения взрослых пациентов с атопической БА показывает, что в течение 1,5–2 месяцев после перерыва в лечении у больных отмечались значимое нарастание частоты дневных и ночных симптомов БА, усиление кожной гиперчувствительности к респираторным аллергенам, значимое снижение качества жизни, тенденция к снижению показателей бронхиальной проходимости. При этом длительность курса предшествующей терапии составляла не менее 8 месяцев [9]. Эти данные позволили авторам предположить возможность лечения омализумабом в дискретном режиме с перерывами в терапии по 1,5–2 месяца с целью уменьшить количество визитов и снизить затраты на лечение.
Выбывшие по возрасту из-под наблюдения в нашем центре пациенты в ряде случаев продолжили анти-IgE-лечение в ФГУ «НИИ пульмонологии» ФМБА России (Москва). Однако у некоторых больных анти-IgE-терапия была прекращена. Наш опыт отмены омализумаба ограничен 9 наблюдениями, пациенты прекратили лечение по достижении 18 лет и окончании наблюдения в НЦЗД РАМН. Срок наблюдения за больными после отмены анти-IgE-лечения составил не менее 1 года. Данные о течении болезни и изменении объема последующей базисной терапии представлены в табл. 4.
Продолжительность периода контролируемой БА после отмены омализумаба у наших пациентов составила в среднем от 2 до 6 месяцев. У одной пациентки ремиссия сохранялась в течение года, новое обострение болезни было спровоцировано контактом со значимым аллергеном, после этого состояние значительно ухудшилось, возобновились частые приступы и госпитализации.
При начале анти-IgE-лечения у всех этих больных доза ИГКС составляла ≥ 1000 мкг/сут по ФП. Объем базисной терапии был уменьшен на фоне омализумаба у всех, за исключением одного пациента с частичным контролем БА. После отмены омализумаба увеличение дозы ИГКС в составе базисной терапии потребовалось у 6 из 9 больных, однако трое пациентов так и не вернулись к сверхвысоким дозам.
Очевидно, что двухлетнего срока терапии и наблюдения за больными после ее отмены в течение одного года недостаточно для оценки значимых отдаленных эффектов анти-IgE-терапии. Пока мы можем констатировать, что по окончании 12–24-месячного курса лечения омализумабом ремиссия БА непродолжительна, возобновление симптомов происходит у большинства больных и требует увеличения объема базисной терапии.
Фармакоэкономические аспекты анти-IgE-терапии
В современном мире экономическая оценка эффективности терапии стала значимой задачей клинической медицины. Необходимость экономического анализа эффективности медицинских вмешательств определяется несколькими причинами. Во-первых, быстрыми темпами роста стоимости лечения наиболее распространенных заболеваний и общим удорожанием медицинских услуг. Во-вторых, появлением альтернативных методов лечения заболевания, при выборе которых приходится учитывать не только их клиническую эффективность, но и стоимость. И наконец, в-третьих, отставанием возможностей финансирования высокотехнологичных и дорогостоящих методов лечения, которое существует во всех странах.
Лечение иммунобиологическими препаратами, к которым относится омализумаб, является довольно дорогостоящим. Оценки экономической эффективности данного вида лечения противоречивы [10]. Большинство публикаций на эту тему посвящено взрослым пациентам, течение болезни у которых более тяжелое, значительно чаще имеет место необратимая обструкция бронхов и хроническая дыхательная недостаточность, соответственно, возможности по модификации течения астмы уже снижены. Но и прямые затраты на анти-IgE-лечение взрослых обычно ниже, поскольку уровень IgE, определяющий дозу омализумаба, у них ниже, чем у пациентов детского возраста. По нашим данным, стандартная модель пациента 6–17 лет, получающего омализумаб, предполагает среднюю дозу 300 мг каждые 2 недели (у взрослого пациента доза обычно ниже в 2 раза). Поскольку мировой опыт длительного применения анти-IgE-препаратов у детей ограничивается последними 3 годами, фармакоэкономика омализумаба в педиатрии – это вопрос, еще ожидающий своего решения.
В настоящее время оптимальной считается экономическая оценка эффективности лечения, основанная на показателе, объединяющем данные о продолжительности жизни и ее качестве, – так называемый стоимостно-утилитарный анализ (анализ «затраты – полезность»). В большинстве фармакоэкономических исследований эффективности омализумаба показано, что с помощью данного метода лечения можно добиться высокого значения показателя QALY (Quality Adjusted Life Years), отражающего рост продолжительности жизни, соотнесенной с ее качеством, но затраты на анти-IgE-лечение также очень высоки [11]. Тем не менее по мере накопления опыта лечения анти-IgE-препаратами все больше исследований свидетельствует о фармакоэкономической эффективности омализумаба [12, 13].
В России опубликован анализ экономии средств (cost-saving) на фоне лечения омализумабом, в котором отмечается существенное сокращение затрат только лишь за счет снижения потребности в госпитализациях взрослых пациентов с тяжелой бронхиальной астмой [14]. Как показывают наши данные, на фоне терапии омализумабом у детей отсутствуют обострения БА, требующие госпитализации в стационар. Вместе с тем потребность в госпитализации у детей в целом не так высока, как у взрослых, поэтому подобный фармакоэкономический анализ экономии средств без учета QALY не будет полноценным.
В этой связи мы считаем целесообразным рассмотреть возможность получить собственные сведения об экономической эффективности использования дорогостоящего лечения, применяя в качестве критериев утилитарные показатели (качество жизни / годы сохраненной качественной жизни).
Заключение
В ходе проведенного в НЦЗД РАМН клинического исследования были получены следующие основные результаты. На фоне анти-IgE-лечения мы констатировали снижение частоты клинически значимых обострений и потребности в госпитализации на 75–80%. Средняя суточная доза ИГКС была снижена с 860 мкг по ФП до 400 мкг. Полного контроля болезни или выраженного улучшения удалось достичь у 75% больных, эффект в большинстве случаев значимо нарастал в первые 6 месяцев лечения и являлся стабильным в дальнейшем на фоне лечения, обеспечивая хорошее качество жизни и нормальные показатели функции внешнего дыхания.
Однако признаки гиперинфляции легких у детей и подростков, наиболее вероятно характеризующие тяжесть структурных изменений на фоне БА, сохраняются в течение длительного времени, несмотря на клиническое улучшение. Наш анализ показал, что полного контроля БА можно добиться у исходно менее тяжелых пациентов вне зависимости от степени выраженности атопии. Дети с низкой функцией легких, со снижением ФЖЕЛ, гиперинфляцией легких хуже достигают полного контроля болезни. Чем тяжелее течет БА, тем труднее добиться оптимального результата. Тем не менее недостаточный эффект на фоне омализумаба, выражающийся в частичном контроле болезни, сопряжен у этих больных со значимым приростом в легочной функции.
Основываясь на результатах нашего исследования и имеющихся данных о фармакоэкономике анти-IgE-терапии, мы считаем, что необходимо строго подходить к критериям отбора больных для проведения высокоэффективного, но дорогостоящего лечения. На наш взгляд, назначение омализумаба абсолютно оправдано, прежде всего, у детей и подростков со снижением функции легких, с высоким риском фатальной астмы, имеющих астматический статус в анамнезе, часто обращающихся за экстренной медицинской помощью, в том числе стационарной, а также нуждающихся в применении системных ГКС. Перед началом лечения необходимо провести ревизию диагноза БА и наличия коморбидных состояний, тщательно проанализировать и при необходимости скорректировать базисную терапию, оценить приверженность пациента к лечению.