Бионаивные пациенты и вторая линия биологической терапии: отдаленные результаты и эффективность ингибитора интерлейкина 23 гуселькумаба в реальной клинической практике
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – оценить долгосрочную эффективность терапии ингибитором ИЛ-23 (гуселькумабом), влияние на показатели качества жизни у пациентов со среднетяжелым и тяжелым псориазом и удержание ответа на проводимую терапию с учетом статуса бионаивности.
Материал и методы. Проведено одноцентровое экспериментальное неконтролируемое исследование 36 пациентов с диагнозом «распространенный вульгарный псориаз». Пациенты на исходном уровне были распределены на две группы, в зависимости от проводимой предшествующей системной терапии: первая – бионаивные пациенты, получавшие традиционную системную терапию; вторая – небионаивные пациенты, получавшие вторую линию биологической терапии. В настоящем исследовании представлены исходные демографические данные, включая пол, возраст, индекс массы тела, характеристики заболевания по индексам PASI, BSA, sPGA, NSR. Показатели качества жизни оценивали по шкалам DLQI и SF-36. Всем пациентам было назначено лечение ингибитором ИЛ-23 (гуселькумабом) по стандартной схеме. Оценку эффективности терапии осуществляли по динамике показателей PASI, BSA, sPGA, NSR, DLQI и SF-36 на исходном уровне и через 12, 24, 52 и 468 недель терапии с учетом статуса бионаивности.
Результаты. Биологическая терапия гуселькумабом привела к статистически значимому улучшению всех показателей через 12 недель, ответ сохранялся на 24-й, 52-й и 468-й неделях для каждого пациента (р < 0,001). Продемонстрирована высокая статистическая значимость разницы между исходным уровнем и после терапии гуселькумабом по индексам PASI, BSA, sPGA, NSR (p < 0,001). Все пациенты с «суперответом» достигли полного очищения кожи PASI 100 к 24-й неделе терапии. Изменение показателей индекса PASI привело к статистически значимому улучшению показателей качества жизни по шкалам DLQI (p < 0,001) и SF-36 (p < 0,001) до и после лечения гуселькумабом на 12, 24, 52 и 468-й неделях терапии, независимо от индекса массы тела и статуса бионаивности.
Заключение. Биологическая терапия ингибитором ИЛ-23 гуселькумабом высокоэффективна для достижения стойкой медикаментозной ремиссии в течение девятилетнего наблюдения с сохранением высоких показателей качества жизни больных псориазом независимо от статуса бионаивности.
Цель исследования – оценить долгосрочную эффективность терапии ингибитором ИЛ-23 (гуселькумабом), влияние на показатели качества жизни у пациентов со среднетяжелым и тяжелым псориазом и удержание ответа на проводимую терапию с учетом статуса бионаивности.
Материал и методы. Проведено одноцентровое экспериментальное неконтролируемое исследование 36 пациентов с диагнозом «распространенный вульгарный псориаз». Пациенты на исходном уровне были распределены на две группы, в зависимости от проводимой предшествующей системной терапии: первая – бионаивные пациенты, получавшие традиционную системную терапию; вторая – небионаивные пациенты, получавшие вторую линию биологической терапии. В настоящем исследовании представлены исходные демографические данные, включая пол, возраст, индекс массы тела, характеристики заболевания по индексам PASI, BSA, sPGA, NSR. Показатели качества жизни оценивали по шкалам DLQI и SF-36. Всем пациентам было назначено лечение ингибитором ИЛ-23 (гуселькумабом) по стандартной схеме. Оценку эффективности терапии осуществляли по динамике показателей PASI, BSA, sPGA, NSR, DLQI и SF-36 на исходном уровне и через 12, 24, 52 и 468 недель терапии с учетом статуса бионаивности.
Результаты. Биологическая терапия гуселькумабом привела к статистически значимому улучшению всех показателей через 12 недель, ответ сохранялся на 24-й, 52-й и 468-й неделях для каждого пациента (р < 0,001). Продемонстрирована высокая статистическая значимость разницы между исходным уровнем и после терапии гуселькумабом по индексам PASI, BSA, sPGA, NSR (p < 0,001). Все пациенты с «суперответом» достигли полного очищения кожи PASI 100 к 24-й неделе терапии. Изменение показателей индекса PASI привело к статистически значимому улучшению показателей качества жизни по шкалам DLQI (p < 0,001) и SF-36 (p < 0,001) до и после лечения гуселькумабом на 12, 24, 52 и 468-й неделях терапии, независимо от индекса массы тела и статуса бионаивности.
Заключение. Биологическая терапия ингибитором ИЛ-23 гуселькумабом высокоэффективна для достижения стойкой медикаментозной ремиссии в течение девятилетнего наблюдения с сохранением высоких показателей качества жизни больных псориазом независимо от статуса бионаивности.









Введение
Псориаз – это хроническое иммуноопосредованное воспалительное заболевание кожи с сопутствующими заболеваниями, такими как депрессия и метаболический синдром, что существенно сказывается на качестве жизни пациентов [1–3]. Среднетяжелый и тяжелый псориаз, характеризующийся распространенными высыпаниями, в том числе на открытых участках, а также наличием сопутствующих заболеваний [4], оказывает существенное влияние на качество жизни, при этом почти 90% пациентов нуждаются в длительном лечении [5].
Биологические препараты, влияющие на определенные компоненты иммунной системы, показывают устойчивые результаты лечения среднетяжелого и тяжелого псориаза, меняя подходы к лечению [6]. Однако биологическая терапия псориаза может быть прекращена из-за отсутствия ответа или потери эффективности, а также из-за развития побочных эффектов [7].
Постоянство проводимого лечения, так называемая выживаемость проводимой терапии, считается косвенным показателем переносимости и эффективности назначаемых препаратов [8]. Псориаз является хроническим системным воспалительным заболеванием, при котором для оптимального контроля клинических симптомов требуется непрерывное лечение, поэтому прекращение лечения не рекомендуется [9].
Исследования, проведенные в условиях реальной клинической практики, с описанием применения биологических препаратов при среднетяжелом и тяжелом псориазе, в том числе ингибитора интерлейкина (ИЛ) 23 гуселькумаба, у бионаивных пациентов и у пациентов с предшествующей биологической терапией, ограниченны [10]. Мы провели исследование долгосрочной эффективности ингибитора ИЛ-23 с сохранением 100% комплаенса проводимой терапии.
Цель исследования – оценить долгосрочную эффективность и безопасность терапии ингибитором ИЛ-23 гуселькумабом у пациентов со среднетяжелым и тяжелым псориазом в клинической практике с учетом статуса бионаивности.
Материал и методы
Проведено одноцентровое экспериментальное неконтролируемое исследование пациентов с распространенным бляшечным псориазом. Пациенты были включены в исследование в период с апреля 2015 г. по июнь 2024 г. и получали гуселькумаб 100 мг на 0-й, 4-й неделях и далее каждые 8 недель.
Критерии включения в исследование:
- письменное информированное согласие на участие в исследовании, с общим планом обследования и лечения;
- мужчины и женщины от 18 лет на момент подписания информированного согласия;
- пациенты с диагнозом «бляшечный псориаз», установленным как минимум за шесть месяцев до исследования.
Критерии невключения в исследование:
- наличие сопутствующих соматических, а также инфекционных заболеваний в стадии декомпенсации, онкологические заболевания, наркомания, алкоголизм, гипертиреоз;
- нарушения со стороны системы кроветворения в анамнезе (клинически значимая анемия, тромбоцитопения, лейкопения, гипоплазия костного мозга);
- беременность, период лактации.
Критерии исключения из исследования:
- добровольное желание пациента завершить участие в исследовании;
- несоблюдение пациентом режима, а также назначенной схемы диагностики и терапии.
Для установления диагноза осуществлялось клинико-анамнестическое обследование (сбор жалоб, анамнеза жизни и заболевания, полное физикальное обследование, оценка показателей жизненно-важных функций, сбор антропометрических данных (измерение массы тела и роста, определение индекса массы тела (ИМТ)), сбор информации о сопутствующих заболеваниях с определением времени с момента постановки диагноза, а также о предшествующей терапии, оценка клинических проявлений и определение их степени тяжести) c учетом индекса PASI (Psoriasis Area and Severity Index), BSA (Body Surface Area, %), sPGA (Static Physician Global Assessment), NAPSI (Nail Psoriasis Severity Index).
Индекс площади и тяжести псориаза PASI использовали для измерения площади пораженной области и оценки тяжести распространенного псориаза. Если показатель PASI менее 10, поражения кожи считается легким, от 10 до 20 – умеренным, выше 20 – тяжелым.
Индекс BSA определяли путем измерения ладони пациента до средних фаланг пальцев, при этом каждая единица равна 1% площади тела. Значение BSA менее трех указывает на легкую степень тяжести псориаза, от 3 до 10 – на среднюю, более 10 – на тяжелую степень тяжести.
Статическая глобальная оценка врача sPGA – это фиксированная шкала, используемая врачами для оценки тяжести псориаза. Она предполагает оценку трех факторов (инфильтрация, шелушение, эритема). Оценка 0 указывает на отсутствие признаков псориаза, а оценка 5 указывает на крайне тяжелое проявление заболевания.
Оценки степени тяжести псориаза и нежелательных явлений проводили на 0, 12, 24, 52 и 468-й неделях лечения.
До назначения инъекций гуселькумаба у всех пациентов получены образцы крови и мочи для лабораторных исследований: клинический и биохимический анализы крови, серологическое исследование на ВИЧ, антикардиолипиновый тест/исследование суммарных антител IgG, IgM к антигенам Treponema pallidum, качественный тест на HbsAg, определение суммарных антител к антигенам вируса гепатита С (Anti-HCV-total), общий анализ мочи. Всем пациентам была выполнена цифровая рентгенография грудной клетки в двух проекциях с описанием, проведена внутрикожная проба с туберкулезным аллергеном (диаскинтест)/квантифероновый тест для исключения туберкулезной инфекции до назначения терапии, на 24-й и 52-й неделях и далее в период последующего наблюдения один раз в год.
При каждом посещении на 0, 12, 24, 52 и 468-й неделях оценивали рутинные анализы крови (общий клинический анализ крови с лейкоцитарной формулой и СОЕ, биохимический анализ крови: показатели трансаминаз, гаммаглутамилтрансферазы, общего белка, щелочной фосфатазы, глюкозы, С-реактивного белка, липидограммы), общий анализ мочи для подтверждения безопасности ингибитора ИЛ-23 гуселькумаба.
Для измерения показателей качества жизни у больных псориазом были использованы две диагностические шкалы: дерматологический индекс качества жизни – ДИКЖ (DLQI) [11, 12] и универсальный опросник SF-36 (шкалы опросника объединены в два показателя – физический и психологический компоненты здоровья). Клинически значимые улучшения определяются как улучшение по шкале SF-36 на ≥ 5 баллов [13–15].
Оценку качества жизни больных псориазом проводили до назначаемой терапии и на 12, 24, 52-й и 468-й неделях лечения.
Эффективность терапии оценивали по динамике показателей PASI, BSA, sPGA, NSR, ДИКЖ и SF-36. Также были сделаны цифровые фотографии больных до начала и после окончания терапии.
Размер выборки предварительно не рассчитывали.
Сбор данных, их последующую коррекцию, систематизацию исходной информации и визуализацию полученных результатов осуществляли в электронных таблицах Excel (Microsoft Office 365). Статистическую обработку результатов проводили средствами языка Питон (Python 3.11). Количественные показатели оценивали на предмет соответствия нормальному распределению с использованием критерия Шапиро – Уилка. Проверка на нормальность распределения показала, что данные в исследовании не имеют нормального распределения. Поэтому в дальнейшем расчеты производились методами непараметрической статистики. В качестве центра распределения была посчитана медиана, а в качестве показателей вариации – квартили (Me [Q1; Q3]). Для проверки различий между двумя сравниваемыми парными выборками нами применялся W-критерий Уилкоксона. Результаты качественных признаков выражены в абсолютных числах с указанием долей (%).
С целью изучения взаимосвязи между явлениями, представленными количественными данными, использовали непараметрический метод – расчет коэффициента ранговой корреляции Спирмена (r). Интерпретацию полученных значений корреляции производили по шкале Чеддока, предполагающей качественную и количественную оценку от 0,1 до 0,99 балла. Слабая вероятность наступления рисков – 0,1–0,3 балла; умеренная вероятность наступления рисков – 0,3–0,5 балла; заметная вероятность наступления рисков – 0,5–0,7 балла; высокая вероятность наступления рисков – 0,7–0,9 балла; весьма высокая вероятность наступления рисков – 0,9–0,99 балла. Коэффициент корреляции дополнен 95%-ным доверительным интервалом (95% ДИ), который рассчитывали методом Бутстреп (Bootstrap) при выборке 1000 экземпляров. Различия считали статистически значимыми при р < 0,05.
Результаты
Под нашим наблюдением находились 36 пациентов, из них 30 (83%) мужчин и 6 (17%) женщин трудоспособного возраста от 18 до 60 лет, средний возраст – 41,5 [34,0; 50,25] года, возраст дебюта псориаза – от двух до 45 лет, в среднем – 27 [20,75; 37,25] лет, то есть манифестация псориаза преобладала у лиц молодого возраста, длительность заболевания варьировала от одного года до 44 лет, в среднем – 14 [8,0; 20,0] лет. Все пациенты до назначения гуселькумаба получали стандартную базисную противовоспалительную терапию, наиболее часто был назначен метотрексат – 22 (61%) пациента, циклоспорин – 3 (8%) пациента, неотигазон (ацитретин) – 4 (11%) пациента, тофацитиниб (ингибитор янус-киназ) – 5 (14%) пациентов, узкополосная средневолновая терапия с длиной волны 311 нм (УФB-311) – 7 (20%) пациентов, ПУВА-терапия – 9 (25%) пациентов. Предшествующая терапия генно-инженерными биологическими препаратами (ГИБП) была у 7 (20%) пациентов: лечение ингибиторами ФНО-α получали 5 (14%) пациентов, 2 (5%) пациента прекратили лечение из-за отсутствия ответа на проводимую терапию, 3 (8%) пациента прекратили лечение из-за ускользания ответа через шесть месяцев терапии. Предшествующая терапия ингибитором ИЛ-17 (иксекизумабом) не дала клинического ответа у 2 (5,0%) пациентов.
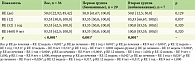
По данным предшествующей терапии, пациенты были разделены на две группы. Первую группу составили 29 (80%) пациентов, у которых биологическая терапия была первой линией терапии (бионаивные), из них 24 (83,0%) мужчин и 5 (17,0%) женщин, средний возраст – 40,0 [33,0; 49,0] года. Во вторую группу вошли 7 (20%) пациентов, из них 6 (86,0%) мужчин и одна (14,0%) женщина, средний возраст – 46,0 [42,0; 56,5] года, у которых назначенная биологическая терапия была второй линией терапии. Пациенты групп статистически значимо (p > 0,05) не различались по полу и возрасту (табл. 1).
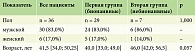
Пациенты статистически значимо различались по ИМТ (p = 0,006). В первой группе ИМТ = 27,8 [23,9; 30,7]: у 11 пациентов ИМТ = 18,5–25,9 (норма), у восьми пациентов ИМТ = 25–30 (предожирение), у восьми пациентов ИМТ = 30–35 (ожирение первой степени), у двух пациентов ИМТ = 35–40 (ожирение второй степени). Во второй группе ИМТ = 31,9 [30,7; 36,95]: у одного пациента ИМТ = 28 (предожирение), у четырех пациентов ИМТ = 30–35 (ожирение первой степени) и у двух пациентов ИМТ = 35–40 (ожирение второй степени) (табл. 2, рис. 1).
На фоне терапии гуселькумабом отмечалось снижение показателя ИМТ в обеих группах в срок 52 недели и данная динамика сохранялась на протяжении 468 недель.
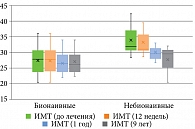
В процессе наблюдений было показано, что эффект, достигнутый в срок 52 недели, сохранялся на протяжении 468 недель (табл. 3, рис. 2).
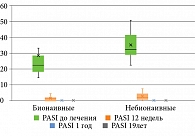
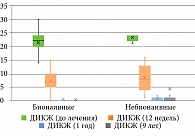
В процессе анализа по шкале ДИКЖ отмечались статистически значимые изменения (p < 0,001) (табл. 4, рис. 3).
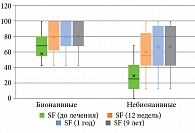
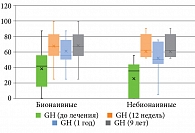
По показателям качества жизни достигнуты статистически значимые улучшения по всем восьми шкалам опросника SF-36 (p < 0,001*).
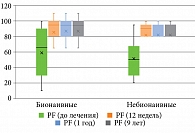
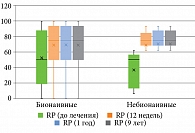
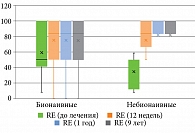
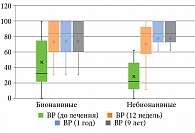
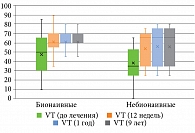
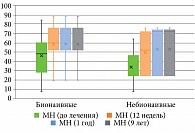
Анализ полученных результатов показал, что у пациентов с псориазом по шкале SF-36: физическое функционирование (Physical Functioning, PF); ролевое функционирование, обусловленное физическим состоянием (Role-Physical Functioning, RP); интенсивность боли (Bodily pain, BP); общее состояние здоровья (General Health, GH); жизненная активность (Vitality, VT); социальное функционирование (Social Functioning, SF); ролевое функционирование, обусловленное эмоциональным состоянием (Role-Emotional Functioning, RE); психическое здоровье (Mental Health, MH), – до и после лечения гуселькумабом отмечались статистически значимые изменения (p < 0,001) на 12, 24, 52 и 468-й неделях терапии без статистически значимой разницы между группами (табл. 5–12, рис. 4–11).
Обсуждение
Наше исследование было сосредоточено на качестве жизни пациентов с псориазом как на основной цели, признавая важность улучшения всех сфер жизни пациентов при лечении псориаза. На основании предшествующего лечения пациенты были распределены на две группы для оценки различий между результатами у пациентов, получавших традиционную системную терапию, и пациентов, получавших биологическую терапию. Также проводили сравнения между двумя группами до начала лечения гуселькумабом для получения четкой картины влияния предшествующего лечения на качество жизни.
Несмотря на различный анамнез в лечении, обе группы были сопоставимы по социодемографическим и клиническим характеристикам. Псориатический артрит чаще отмечали в группе пациентов с опытом биологической терапии (71%), что вполне ожидаемо, так как у пациентов с псориатическим артритом более тяжелое течение псориаза и им необходимо назначение биологической терапии. Международные данные показывают, что биологические препараты значительно улучшают состояние пациентов с псориатическим артритом, а раннее начало лечения предотвращает прогрессирование заболевания и разрушение суставов [16–20]. Однако в нашем исследовании значительное число пациентов в первой группе (48%) с псориатическим артритом, не получавших биологическую терапию, вызывает беспокойство. Это еще раз подтверждает, что диагностика и лечение псориатического артрита несвоевременны и необходимо повышенное внимание и раннее назначение биологической терапии. Коморбидные состояния, такие как ожирение, метаболический синдром, дислипидемия, сахарный диабет чаще встречались в группе предшествующего биологического лечения. По ИМТ пациенты групп статистически значимо различались (p = 0.006*): в группе бионаивных пациентов ИМТ = 27,8 [23,9; 30,7], в группе небионаивных ИМТ = 31,9 [30,7; 36,95]. Бремя общей сопутствующей патологии и отдельных коморбидных состояний увеличивается с увеличением тяжести заболевания у пациентов с псориазом [21], что наблюдалось и в нашем исследовании у пациентов обеих групп. Эту взаимосвязь необходимо учитывать при оказании комплексной помощи пациентам с псориазом, особенно с более тяжелым течением, что еще раз подтверждает необходимость своевременного назначения биологической терапии. По нашим данным, на фоне терапии гуселькумабом отмечалось снижение показателя ИМТ в обеих группах в контрольной точке 52 недели, и данная динамика сохранялась на протяжении всего периода наблюдения (468 недель) (p < 0,001).
Стоит отметить, что выбор наиболее эффективного метода лечения псориаза зачастую затруднен и может включать несколько терапевтических попыток с первоначальным назначением топических препаратов, в дальнейшем с сочетанием системных базисных противовоспалительных препаратов и, наконец, с переходом к ГИБП. С момента постановки диагноза псориаза до назначения системной терапии проходят годы, что существенно сказывается на качестве жизни пациентов и их семей, испытывающих трудности, такие как социальная разобщенность, финансовое бремя, супружеская дисгармония, физическая и умственная усталость. Поэтому большинству пациентов с псориазом необходимо длительное поддержание адекватного контроля заболевания и качества жизни, что обеспечивает биологическая терапия.
В нашем исследовании описана приверженность к терапии ингибитором ИЛ-23 гуселькумабом на протяжении всего периода наблюдения. По данным других исследований, гуселькумаб также продемонстрировал высокую эффективность, безопасность и переносимость среди пациентов с псориазом среднетяжелой и тяжелой степени [22, 23]. Исследование FINGUS с участием финских пациентов со среднетяжелым и тяжелым псориазом показало вероятность сохранения эффекта 86% в течение одного года при лечении гуселькумабом [24]. Аналогичным образом высокая вероятность сохранения эффекта от 65 до 94% была зарегистрирована для гуселькумаба в нескольких исследованиях в условиях реальной клинической практики с различными периодами наблюдения [25–27]. Недавние исследования в Европе также показали положительные результаты у пациентов, получавших лечение устекинумабом и гуселькумабом [28].
Эти результаты подчеркивают последовательность и сопоставимость наших результатов с результатами других крупномасштабных европейских исследований, основанных на регистрах. Кроме того, два проспективных когортных исследования пациентов с псориазом, в которых использовали данные регистра биологических препаратов, иммуномодуляторов Британской ассоциации дерматологов и Датских общенациональных реестров, сообщили, что гуселькумаб имел самые высокие показатели выживаемости при лечении среди всех биологических препаратов, включенных в исследование [29].
В американском ретроспективном исследовании, проведенном Fitzgerald и соавт., была отмечена более высокая частота сохранения эффекта гуселькумаба (через 24 месяца) по сравнению с другими биологическими препаратами [30]. Исследование Ruiz-Villaverde и соавт. подтвердило, что эффективность гуселькумаба по показателям индексов PASI, BSA, зуда и DLQI не зависела от ранее применявшихся биологических препаратов. Выживаемость при лечении, включая прекращение терапии из-за отсутствия эффективности или безопасности, составила 100, 92,7 и 92,1% для анти-ФНОα, анти-ИЛ-17 и анти-ИЛ-12/23 соответственно к 130 неделям терапии. Среднесрочная эффективность, безопасность и выживаемость при применении гуселькумаба не зависят от предшествующей биологической терапии, такой как анти-ФНОα, анти-ИЛ-17 и/или анти-ИЛ-12/23. Данные результаты свидетельствуют, что гуселькумаб может быть лучшей стратегией переключения при среднетяжелом или тяжелом псориазе у пациентов с неэффективностью или развитием нежелательных явлений [31]. Giordano и соавт. показали потенциальные преимущества переключения с анти-ИЛ-17A на гуселькумаб с высокой эффективностью и безопасностью [32].
Доказанная эффективность анти-ИЛ-23 стабильно сохраняется даже после предшествующего применения ингибиторов анти-ИЛ-17, о чем свидетельствуют многочисленные исследования, проведенные в условиях реальной клинической практики [33].
В относительно недавнем исследовании была показана более высокая выживаемость при применении ингибиторов ИЛ-23 [34]. Bonifati и соавт. в небольшой серии случаев сообщили об эффективности перехода на гуселькумаб и рисанкизумаб после неэффективности терапии иксекизумабом и секукинумабом [35].
В подтверждение предыдущих исследований Megna и соавт. выделили гуселькумаб как ценный вариант лечения для пациентов со среднетяжелым и тяжелым псориазом и неэффективностью предшествующей биологической терапии, что свидетельствует об эффективности и безопасности гуселькумаба в долгосрочной перспективе [36].
В представленном нами исследовании была подтверждена высокая эффективность гуселькумаба со статистически значимым снижением по показателям индексов PASI, BSA, sPGA, NSR (p < 0,001). Получено достоверно значимое снижение баллов по индексу PASI на фоне терапии гуселькумабом у всех пациентов, независимо от пола, возраста, длительности псориаза, коморбидного ожирения, псориатического артрита и статуса бионаивности. Изменение показателей индекса PASI привело к статистически значимому улучшению показателей качества жизни по шкале ДИКЖ и по шкале SF-36 по сравнению с периодом до назначения гуселькумаба и сохранялось в контрольных точках на 12, 24, 52 и 468-й неделях терапии. Статистически значимой разницы при межгрупповом сравнении (бионаивные и небионаивные) в скорости достижения PASI 90, PASI 100, а также нормализации показателей качества жизни по данным опросников ДИКЖ и SF-36 выявлено не было. Стойкий ответ сохранялся на протяжении всего периода наблюдения в течение девяти лет проводимой терапии гуселькумабом у всех включенных пациентов. Нежелательных явлений, как и опасных нежелательных явлений с необходимостью отмены назначения ингибитора ИЛ-23 гуселькумаба, не зарегистрировано. В нашем исследовании результаты по безопасности соответствовали хорошо изученному профилю безопасности гуселькумаба в рамках одобренных показаний. Особая настороженность существует в отношении туберкулезной инфекции. Согласно предшествующим объединенным анализам результатов нескольких клинических исследований, ни одного случая развития активного туберкулеза после пяти лет лечения гуселькумабом выявлено не было [37, 38].
По нашим данным, ни у одного пациента на протяжении всего периода наблюдения (девять лет) не было выявлено развития активного или латентно протекающего туберкулеза.
Сильными сторонами нашего исследования являются точность данных, длительный период наблюдения и однородность клинической оценки. Ограничением данного исследования является одноцентровой характер.
Безусловно, необходимо проведение широкомасштабных углубленных исследований сравнительной оценки применения ингибитора ИЛ-23 гуселькумаба и ГИБП различных классов у полиморбидных пациентов (сердечно-сосудистые заболевания, сахарный диабет, гепатокоморбидность и т.д.) со среднетяжелым и тяжелым течением псориаза, с учетом отдаленных результатов наблюдений.
В проведенном исследовании бионаивные и небионаивные пациенты, с коморбидными состояниями и без достигли высокого уровня ответа на лечение (чистая кожа), что подтверждает целесообразность раннего применения гуселькумаба у пациентов, в том числе с непродолжительным стажем псориаза.
Несмотря на то что для подтверждения полученных результатов необходимы дальнейшие исследования с использованием более крупных когорт, данное исследование предоставляет ценную информацию для врачей, занимающихся лечением псориаза.
Заключение
На 468-й неделе PASI 100 удерживали 97,0% пациентов, ДИКЖ 0 отмечалось у 100% пациентов, получавших терапию гуселькумабом, вне зависимости от коморбидностей, исходной массы тела и статуса бионаивности. Достигнутые в срок 52 недели показатели по шкале SF-36 сохранялись через 468 недель от начала терапии наблюдения.
Наше исследование подтвердило эффективность и безопасность гуселькумаба в долгосрочной перспективе, с учетом того что предшествующая биологическая терапия не влияет на эффективность гуселькумаба.
В течение девятилетнего наблюдения мы получили убедительные данные, доказывающие устойчивую эффективность гуселькумаба с превосходным профилем безопасности у пациентов со среднетяжелым и тяжелым течением псориаза. Необходимо продолжить дальнейшие исследования долгосрочной эффективности ингибитора ИЛ-23 гуселькумаба в реальной клинической практике.
Авторы заявляют об отсутствии конфликта интересов.
I.S. Vladimirova, PhD, L.S. Kruglova, PhD, Prof., A.Yu. Bermas
Skin and Venereal Diseases Dispensary No 10 – Clinic of Dermatology and Venereology, St. Petersburg
S.M. Kirov Military Medical Academy, St. Petersburg
Central State Medical Academy of the Presidential Administration of the Russian Federation, Moscow
Institute of Postgraduate Education named after V.M. Bekhterev, St. Petersburg
Contact person: Irina S. Vladimirova, ivladimirva@rambler.ru
Psoriasis is a chronic systemic immune-mediated, often relapsing disease that requires long-term treatment to control symptoms and achieve remission, which is associated with the need for long-term pharmacological intervention. Consistency in treatment reflects long-term efficacy and tolerability of the therapy. The publication presents data on the study of long-term efficacy (468 weeks) of the IL-23 inhibitor guselkumab on the activity of the psoriatic process and quality of life indicators of patients. The results are shown in the study groups: bio-naive and second-line biological therapy. The work also assessed the safety of long-term use of guselkumab.
Aim. To evaluate the long-term efficacy of therapy with an interleukin-23 inhibitor (guselkumab), the effect on quality of life in patients with moderate to severe psoriasis and maintenance of response to therapy, taking into account the status of bio-naivety.
Material and methods. A single-center experimental uncontrolled study of 36 patients diagnosed with widespread psoriasis vulgaris was conducted. At baseline, patients were divided into two groups depending on their previous systemic therapy: group I – bionaive, patients who received traditional systemic therapy, and group II – non-bionaive, patients who received biological therapy. This study presents baseline demographic data, including gender, age, body mass index, disease characteristics according to PASI, BSA, sPGA, NSR indices. Quality of life indicators were assessed using DLQI and SF-36 scales. All patients were prescribed treatment with an interleukin-23 inhibitor (guselkumab) according to the standard regimen. Therapy efficacy was assessed based on the dynamics of PASI, BSA, sPGA, NSR, DLQI and SF-36 indices at baseline and after 12, 24, 52 and 468 weeks of therapy, taking into account the bionaivety status.
Results. Biological therapy with guselkumab resulted in statistically significant improvement in all indices after 12 weeks, and the response was maintained at 24, 52 and 468 weeks for each patient (p < 0.001). High statistical significance of the difference between baseline and after guselkumab therapy was demonstrated for PASI, BSA, sPGA, NSR indices (p < 0.001). All patients with a “superresponse” achieved complete skin clearance PASI 100 by the 24th week of therapy. The change in PASI index values resulted in statistically significant improvement in quality of life indices according to the DLQI (p < 0.001) and SF-36 (p < 0.001) scales before and after treatment with guselkumab at 12, 24, 52 and 468 weeks of therapy, regardless of body mass index and bionaivety status.
Conclusion. Biological therapy with the interleukin-23 inhibitor guselkumab is highly effective in achieving stable drug remission during 9-year follow-up, while maintaining high quality of life indices in psoriasis patients, regardless of bionaivety status.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.