количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Обзоры
Бронхиальная астма и курение
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Пульмонология и оториноларингология" №1 (10)
- Аннотация
- Статья
- Ссылки
- English
Благодаря таким свойствам, как оптимальное распределение препарата в малых дыхательных путях, выраженный бронхолитический и противовоспалительный эффект, уменьшение воздушных ловушек, улучшение функции легких и контроля БА, наиболее оправданным у курящих пациентов с БА представляется применение экстрамелкодисперсной фиксированной комбинации беклометазона дипропионата и формотерола (препарат Фостер). В качестве аддитивной терапии возможно назначение антагонистов лейкотриеновых рецепторов (в комбинации с ИГКС или в монотерапии) или низких доз теофиллина.
Доля курильщиков среди больных бронхиальной астмой (БА) составляет 25–35%, что сопоставимо с распространенностью курения в популяции в целом. Активное и пассивное табакокурение ассоциируется с повышенным риском развития БА, увеличением частоты обострений, ускорением прогрессирования БА, потерей контроля над заболеванием, ухудшением или отсутствием ответа на терапию глюкокортикостероидами. Наряду с отказом от курения эффективной стратегией преодоления стероидной резистентности у курящих больных БА является назначение комбинированных препаратов ингаляционных глюкокортикостероидов (ИГКС) и бета-2-агонистов длительного действия.
Благодаря таким свойствам, как оптимальное распределение препарата в малых дыхательных путях, выраженный бронхолитический и противовоспалительный эффект, уменьшение воздушных ловушек, улучшение функции легких и контроля БА, наиболее оправданным у курящих пациентов с БА представляется применение экстрамелкодисперсной фиксированной комбинации беклометазона дипропионата и формотерола (препарат Фостер). В качестве аддитивной терапии возможно назначение антагонистов лейкотриеновых рецепторов (в комбинации с ИГКС или в монотерапии) или низких доз теофиллина.
Благодаря таким свойствам, как оптимальное распределение препарата в малых дыхательных путях, выраженный бронхолитический и противовоспалительный эффект, уменьшение воздушных ловушек, улучшение функции легких и контроля БА, наиболее оправданным у курящих пациентов с БА представляется применение экстрамелкодисперсной фиксированной комбинации беклометазона дипропионата и формотерола (препарат Фостер). В качестве аддитивной терапии возможно назначение антагонистов лейкотриеновых рецепторов (в комбинации с ИГКС или в монотерапии) или низких доз теофиллина.

Рис. 1. Факторы, влияющие на развитие и проявления БА
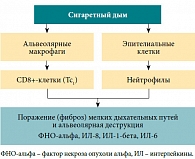
Рис. 2. Механизм повреждающего действия табачного дыма на дыхательные пути
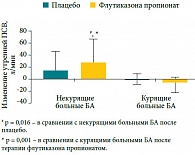
Рис. 3. Вариабельность ответа на ИГКС (изменения утренней ПСВ) у некурящих больных БА и курильщиков
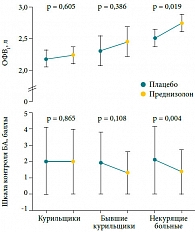
Рис. 4. Курение нарушает ответ на системные ГКС у пациентов с БА: изменения в ответ на 14-дневную терапию преднизолоном 40 мг/сут per os, по сравнению с плацебо
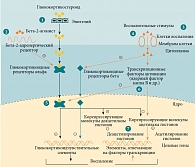
Рис. 5. Механизм противовоспалительной активности ГКС и возможные пути и механизмы развития стероидной резистентности у курящих пациентов с БА*
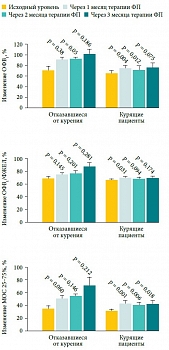
Рис. 6. Динамика изменения функции легких в результате терапии ФП 1000 мкг/день у отказавшихся от курения больных БА и продолжающих курить
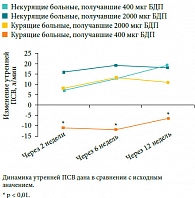
Рис. 7. Разница между курящими и некурящими пациентами с БА в отношении изменения утренней ПСВ в ответ на низкие и высокие дозы ИГКС
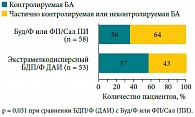
Рис. 8. Пропорция пациентов с разным уровнем контроля БА в зависимости от терапии различными фиксированными комбинациями ИГКС/ДДБА
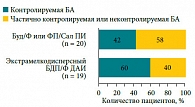
Рис. 9. Сравнительная эффективность контроля БА у курящих пациентов при лечении фиксированными комбинациями ИГКС/ДДБА
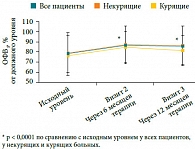
Рис. 10. Динамика ОФВ1 в процессе терапии экстрамелкодисперсным БДП/Ф (Фостером) у больных среднетяжелой и тяжелой БА
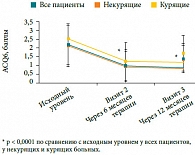
Рис. 11. Улучшение уровня контроля БА, оцениваемого по АСQ6, у больных в процессе терапии экстрамелкодисперсным БДП/Ф (Фостером)

Таблица. Состав табачного дыма*
Влияние активного и пассивного курения на течение БА изучалось в многочисленных работах. Показано, что курение способствует заболеваемости БА и увеличивает тяжесть БА [1]. Результаты проведенных исследований свидетельствуют о том, что распространенность курения среди лиц, страдающих БА, не отличается от распространенности курения в популяции в целом и колеблется в пределах 25–35% [2, 3]. А если учесть бывших курильщиков, доля которых среди больных БА составляет от 22 до 43% [3, 4], общее число курящих пациентов достигает почти 50% всех взрослых пациентов с БА.
Механизм повреждающего действия табачного дыма на дыхательные пути
Табачный дым содержит две фракции: газообразную и корпускулярную, в состав которых входят основные ингредиенты, представленные в таблице [5]. Важной характеристикой частиц табачного дыма является их размер. Как оказалось, многие частицы имеют средний аэродинамический размер менее 1 мкм [6], а стало быть, могут достигать не только крупных и средних, но и мелких бронхов, внутренний диаметр которых ≤ 2 мм. Патологическое воздействие табачного дыма на дыхательные пути человека многообразно (рис. 2). Прежде всего, это токсическое действие аммиака, диоксида серы, диоксида азота, цианистого водорода и акролеина на эпителий бронхов с развитием окислительного стресса [7]. Кроме того, курение приводит к существенному снижению двигательной активности ресничек мерцательного эпителия слизистой и нарушает работу мукоцилиарного транспорта.
Снижается биотрансформация химических соединений и, в первую очередь, токсических веществ табачного дыма клетками Клара. Это нецилиарные эпителиальные клетки, которых особенно много в терминальных отделах дыхательных путей. В таких условиях кадмий и формальдегид оказывают выраженное токсическое действие на все клетки аппарата дыхания. Наконец, табачный дым стимулирует высвобождение провоспалительных медиаторов (интерлейкин 8 (ИЛ-8), интерлейкин 6 (ИЛ-6), лейкотриен В4, простагландин E2, эотаксин-1 и др.), способствует повышению проницаемости эпителия и увеличению количества нейтрофилов в слизистой бронхов. Все эти изменения приводят к формированию преимущественно нейтрофильного типа воспаления слизистой оболочки дыхательных путей у курящих больных БА [8, 9].
Относительно недавнее клиническое исследование, включившее 147 больных БА, продемонстрировало более выраженный процесс ремоделирования бронхиальной стенки у курящих пациентов по сравнению с некурящими или бросившими курить больными БА [10]. При этом выраженность процесса ремоделирования коррелировала с выраженностью клинических симптомов БА. Кроме того, количество тучных клеток было больше, а число эозинофилов меньше в слизистой оболочке дыхательных путей курящих больных по сравнению с некурящими пациентами, что было показано с помощью бронхиальной биопсии.
Существуют исследования, доказывающие, что курение приводит к воспалительным изменениям и ремоделированию дыхательных путей независимо от наличия обструктивного синдрома, причем эти изменения развиваются как в центральных, так и в периферических бронхах [11, 12]. Таким образом, курение больных БА связано с индукцией воспаления (преимущественно нейтрофильного) в дыхательных путях (в основном в малых бронхах), развитием ремоделирования дыхательных путей (в том числе дистальных), формированием воздушных ловушек и гетерогенностью вентиляции легких [13, 14].
Курение и риск развития БА
Существует большая доказательная база исследований, в которых изучалось влияние курения женщины во время беременности на развитие БА у ребенка. Доказано, что курение беременных женщин приводит к снижению функции легких у детей и связано с заболеваниями, сопровождающимися свистящим дыханием у детей, как в первые годы жизни, так и после 16-летнего возраста [15–18]. У таких детей значимо выше частота развития БА и заболеваемость респираторными инфекционными болезнями. Курение матери во время беременности приводит к гиперпродукции иммуноглобулина класса Е (IgE), стимулирует синтез провоспалительных цитокинов и лимфопролиферативный ответ у новорожденного [19]. Это влияние может быть обусловлено развитием окислительного стресса в дыхательных путях ребенка в результате пассивного курения в раннем постнатальном периоде [20]. Именно поэтому мерами первичной профилактики аллергических заболеваний у детей, имеющих высокий риск их развития, являются:
- предупреждение патологического течения беременности;
- сохранение естественного вскармливания ребенка до 4–6 месяцев жизни;
- исключение влияния табачного дыма.
В популяционном исследовании R. Piipari и соавт. [22] изучили влияние активного курения в настоящем и в прошлом (бывшие курильщики) на развитие БА у взрослых. Как оказалось, случаи заболевания БА у активных курильщиков встречались значимо чаще (ОШ 1,33, ДИ 1,00–1,77) по сравнению с лицами, никогда не курившими. Среди бывших курильщиков заболеваемость БА тоже была в 1,5 раза выше (ОШ 1,49, ДИ 1,12–1,97). Примечательно, что у женщин влияние курения на развитие БА оказалось еще более значимым: частота развития БА была в 2,43 и 2,38 раза выше у курящих пациенток и бывших курильщиц соответственно. Результаты данного исследования поддерживают гипотезу о том, что курение может быть причиной БА у взрослых, с особым риском развития у женщин. Интересной представляется выявленная взаимосвязь между курением, в частности возрастом его начала, и разными фенотипами БА. Показано, что астма, развившаяся до начала курения, как правило, является атопической, а БА, начавшаяся после начала активного курения, чаще ассоциирована с низким показателем объема форсированного выдоха за 1-ю секунду (ОФВ1) [23].
Влияние курения на течение БА
Существует много исследований, бесспорно демонстрирующих, что курение ухудшает контроль БА. В исследовании отечественных авторов [24], проведенном среди подростков, показана высокая распространенность курения среди подростков с БА (55% против 44,3% в среднем у подростков). У курящих подростков с БА достоверно чаще отмечены жалобы со стороны органов дыхания, повышенный уровень оксида углерода в выдыхаемом воздухе и котинина в моче. Курящие больные БА имеют приблизительно в 2 раза выше риск развития эпизодов неконтролируемой БА и обострений по сравнению с некурящими пациентами [5, 25, 26]. Исследование, проведенное в США в 2007 г. с помощью телефонного опроса 11 962 больных БА, выявило, что в течение последних 30 дней у курящих больных была выше частота приступов БА (ОШ 1,2; 95% ДИ 1,0–1,4) и ночных симптомов БА (OШ 2,0; 95% ДИ 1,4–2,7) по сравнению с некурящими больными [27]. Как известно, у больных с ночными симптомами БА выявляются нарушения функции малых дыхательных путей: повышено периферическое сопротивление и увеличена инфильтрация воспалительными клетками стенки дистальных бронхов [28–30].
Выраженное воспаление в малых бронхах, способствующее их раннему закрытию во время выдоха и формированию воздушных ловушек, может служить объяснением появления ночных симптомов БА у курящих пациентов. Курение приводит к большему нарушению и потере функции легких у больных БА, чем у некурящих пациентов [31]. Не только активное, но и пассивное курение отрицательно влияет на течение БА. При пассивном курении выделяют основной поток табачного дыма, выдыхаемого курильщиком, который составляет 15% от общей экспозиции, и боковую струю дыма, выделяемую горящей сигаретой, которая составляет 85% экспозиции табачного дыма [32, 33]. Важно, что частицы боковой струи табачного дыма составляют одну десятую размера частиц, выдыхаемых курящим, а значит, могут достигать дистальных дыхательных путей пассивного курильщика, то есть даже при невольном, пассивном, курении возможно поражение мелких бронхов.
Курение родителей приводит к более частым обострениям БА у детей, потребности в неотложной помощи и интубации [34]. Пассивное курение детей связано с более выраженными симптомами и тяжестью БА, сниженной функцией легких, большей потребностью в препаратах неотложной помощи [35, 36]. Сокращение пассивного курения приводит к лучшему контролю БА и сокращению частоты визитов в отделение неотложной помощи и госпитализаций у детей с БА [37]. В исследовании S.K. Jindal и соавт. [38] проведено сравнение течения БА у 100 взрослых больных, имеющих частый контакт с табачным дымом вследствие пассивного курения, и 100 пациентов, не имеющих такой экспозиции. Оказалось, что частота экстренных обращений за медицинской помощью, обострений БА, потребность в глюкокортикостероидах (ГКС) и число пропущенных рабочих дней были статистически значимо (р < 0,01) выше у пассивных курильщиков, страдающих БА.
Существуют противоречивые данные о влиянии курения на риск развития угрожающих жизни и смертельных обострений БА, однако 6-летний уровень смертности в результате тяжелого обострения БА оказался выше среди курящих пациентов по сравнению с некурящими (ОШ 3,6, 95% ДИ 2,0–6,2) [39]. Таким образом, активное и пассивное курение существенно ухудшает контроль БА, увеличивает риск обострений и нарушает функцию легких, способствуя ее снижению с течением времени.
Влияние курения на эффективность фармакотерапии БА
Основу длительной терапии БА составляют ингаляционные глюкокортикостероиды (ИГКС), однако их эффективность существенно снижена у курящих пациентов. Впервые этот факт был отмечен в исследовании B. Pedersen в 1996 г. [40]. В этом исследовании изучали влияние низкой и высокой дозы будесонида или перорального теофиллина на легочную функцию, бронхиальную гиперреактивность (БГР) и воспалительные маркеры крови у 85 пациентов с БА. Последующий анализ, сравнивший эти показатели у курящих и некурящих больных, показал, что терапия будесонидом и в низкой, и в высокой дозах на протяжении 9 месяцев не привела к улучшению ОФВ1, БГР, уменьшению содержания эозинофилов и эозинофильного катионного белка в крови у курящих пациентов с БА. Последующие исследования подтвердили это явление. G.W. Chalmers и соавт. [41] в проспективном рандомизированном двойном слепом плацебоконтролируемом исследовании изучили эффективность высокой дозы флутиказона пропионата (ФП) (500 мкг дважды в день) или плацебо на протяжении 10 недель у пациентов с легкой БА.
Некурящие пациенты продемонстрировали статистически значимое увеличение утренней пиковой скорости выдоха (ПСВ) в ответ на терапию ФП по сравнению с плацебо и курящими больными, получавшими ФП и плацебо (рис. 3) [41]. У курящих больных не отмечено никаких изменений в функциональных показателях, уровне БГР и эозинофилии мокроты. Однако в другом клиническом исследовании высокие дозы ФП оказались эффективны у больных среднетяжелой и тяжелой БА, независимо от статуса курения [42]. Обратимость обструкции бронхов, наравне с эозинофилией крови и мокроты, являлись предикторами высокой эффективности ФП в этом исследовании. Вместе с тем даже применение высокой дозы пероральных ГКС (40 мг преднизолона) в течение 14 дней у курящих пациентов с БА не приводит к увеличению ОФВ1, что было показано в двойном слепом плацебоконтролируемом исследовании [43]. Как видно из рисунка 4, у курящих пациентов с БА, равно как и у бывших курильщиков, не улучшались функция легких и показатели контроля БА в ответ на короткий курс перорального приема высокой дозы преднизолона, в отличие от некурящих пациентов, что свидетельствует о формировании кортикостероидной резистентности у этих пациентов [43].
Противовоспалительное действие ГКС опосредовано активацией цитоплазматических глюкокортикоидных рецепторов (ГКР), действующих как лиганд-активированные факторы транскрипции, которые транслоцируются в ядро, где подавляют или стимулируют глюкокортикоидные гены-мишени. Существуют две изоформы ГКР. ГКР-альфа действуют, непосредственно связываясь с ДНК (трансактивация), или путем взаимодействия с провоспалительными факторами транскрипции (трансрепрессия). ГКР-бета, которые не связывают лиганд, в основном расположены в ядре и не могут трансактивировать глюкокортикоидчувствительные гены. Потенциальные пути и механизмы стероидной резистентности у курящих пациентов с БА (схематично представлены на рисунке 5) заключаются, по мнению N.C. Thomson и соавт. [9], в следующем:
- Происходит гиперсекреция слизи в дыхательных путях, нарушающая связывание ГКС с ГКР.
- Курение снижает экспрессию бета-2-адренергических рецепторов, а также их связь с лигандом, что за счет взаимосвязи ГКС и бета-2-адренергических рецепторов может приводить к снижению функции и ядерной транслокации ГКР.
- Изменяется фенотип воспаления дыхательных путей, например, происходит увеличение числа нейтрофилов и CD8+-лимфоцитов в дыхательных путях и уменьшение числа эозинофилов.
- Повышается уровень провоспалительных цитокинов и медиаторов, например, увеличивается уровень ИЛ-4, ИЛ-8, фактора некроза опухоли альфа, снижается продукция ИЛ-10, возрастает нитрозативный стресс.
- Наблюдается дисбаланс в экспрессии ГКР, например, сверхэкспрессия ГКР-бета и снижение экспрессии ГКР-альфа.
- Активируются провоспалительные факторы транскрипции, например, ядерный фактор каппа В, активирующий белок 1, фактор, активирующий передачу сигнала.
- Снижается активность деацетилазы гистонов и повышается активность митоген-активированной протеинкиназы p38 [9].
Возможные пути преодоления ГКС-резистентности у курящих пациентов с БА
Наиболее эффективным путем решения проблемы стероидной резистентности у курящих пациентов с БА является отказ от курения. В нескольких клинических исследованиях показано, что отказ от курения приводит к улучшению контроля БА, восстановлению эффективности ИГКС, уменьшению симптомов, увеличению функции легких в ответ на терапию ГКС, уменьшению БГР [46, 47]. На рисунке 6 представлена динамика функции легких в результате терапии ФП 1000 мкг/день у отказавшихся от курения и продолжающих курить больных БА. Отказ от курения привел к значимому улучшению функции легких в ответ на ИГКС, что сопровождалось улучшением качества жизни у этих больных [47].
Увеличение дозы ИГКС позволяет преодолеть резистентность к ГКС у курящих больных БА, что было продемонстрировано в исследовании J.E. Tomlinson и соавт. (2005) [48]. Низкая доза беклометазона дипропионата (БДП, 400 мкг/день) эффективно увеличивала утреннюю ПСВ у некурящих пациентов, в отличие от курящих больных, у которых только повышение дозы БДП в 5 раз (2000 мкг/день) вызвало положительную динамику ПСВ (рис. 7). В это исследование были включены пациенты с легкой БА, поэтому закономерно, что некурящие больные ответили на низкую дозу ИГКС, и назначение высокой дозы БДП у них в конечном итоге оказало такое же влияние на ПСВ. Полученные результаты демонстрируют возможность преодоления резистентности к ИГКС у курильщиков с БА путем назначения высоких доз препарата, но в этом случае возникает высокий риск развития нежелательных эффектов [48].
Этого риска удается избежать при терапии комбинациями ИГКС и длительно действующих бета-2-агонистов (ДДБА), лечение которыми является еще одной стратегией преодоления кортикостероидной резистентности у курящих больных БА. Комбинация ИГКС и ДДБА положительно влияет на соотношение «эффективность/безопасность лечения», поскольку в два раза увеличивает клинический эффект ГКС без увеличения частоты нежелательных побочных явлений. Кроме того, ИГКС и ДДБА показали способность оказывать синергизм на клеточном уровне при воздействии на рецепторы. Путем увеличения внутриклеточной концентрации циклического аденозинмонофосфата и, как следствие, активации протеинкиназы бета-2-агонисты увеличивают ядерную транслокацию ГКР и непрямым путем оказывают влияние на них через активацию митоген-активированной протеинкиназы. ДДБА активируют неактивные ГКР, делая их более чувствительными для стероидзависимой активации. ИГКС, в свою очередь, повышают экспрессию гена бета-2-адренорецептора, тем самым активируя синтез этих рецепторов и увеличивая их экспрессию на клеточной мембране. ИГКС также препятствуют десенситизации бета-2-адренорецепторов.
В нашей стране зарегистрированы четыре оригинальных препарата ИГКС и ДДБА, являющиеся фиксированными комбинациями: флутиказона пропионат/салметерол (ФП/Сал), будесонид/формотерол (Буд/Ф), беклометазона дипропионат/формотерол (БДП/Ф), мометазона фуроат/формотерол (МФ/Ф) и одна свободная комбинация Буд и Ф. Все эти препараты обладают доказанной эффективностью в лечении разных фенотипов БА, но, к сожалению, в настоящее время существуют очень скромные данные об эффективности комбинированных препаратов ИГКС и ДДБА у курящих пациентов с БА. Исследования, проводившиеся в реальной клинической практике, в которых оценивалась эффективность трех фиксированных комбинаций ФП/Сал (Серетид), Буд/Ф (Симбикорт) и БДП/Ф (Фостер) у взрослых больных БА, закономерно включали популяцию курящих пациентов. Как показали результаты исследования V. Müller и соавт. [49], пациенты, получавшие терапию БДП/Ф при помощи дозированного аэрозольного ингалятора (ДАИ), достоверно чаще имели контролируемую БА по сравнению с больными, лечившимися Буд/Ф или ФП/Сал, доставляемыми с помощью порошковых ингаляторов (ПИ) (57% против 36% соответственно, р = 0,031) (рис. 8) [49].
Доля курящих пациентов, включенных в данное исследование, составила 35%, а индекс курения у них – 19 ± 3,6 пачек/лет. Уровень контроля у курящих больных БА был примерно таким же, как у некурящих пациентов, но пропорция больных с неконтролируемой БА была среди курильщиков выше (23,1% против 11,0%, р < 0,05). Как видно из рисунка 9, терапия БДП/Ф приводила к лучшему контролю БА у курящих пациентов по сравнению с другими комбинациями [49]. Ключевое различие между представленными фиксированными комбинациями заключается в размере частиц. БДП/Ф (препарат Фостер) является единственным на сегодняшний день экстрамелкодисперсным комбинированным препаратом. Средний аэродинамический диаметр частиц ИГКС и ДДБА в нем составляет около 1,5 мкм, что позволяет им равномерно распределяться не только в проксимальных, но и в дистальных дыхательных путях и оказывать противовоспалительное и бронхолитическое действие на всем протяжении нижних дыхательных путей.
В свою очередь, это проявляется большей клинической эффективностью в сравнении c неэкстрамелкодисперсными фиксированными комбинациями, к которым относятся все остальные комбинированные препараты. Это свойство БДП/Ф (Фостер) имеет особое значение при активном и пассивном курении пациентов, когда поражение мелких бронхов может иметь существенное значение в нарушении функции легких и может препятствовать достижению контроля БА. Косвенным доказательством этого положения служит недавно проведенное в Бельгии в условиях реальной клинической практики многоцентровое открытое исследование эффективности БДП/Ф (Фостер) у взрослых больных БА [50]. В это исследование было включено 619 пациентов со среднетяжелой и тяжелой БА. Эффективность лечения оценивалась у 568 больных, имевших исходные результаты АСQ6-теста (Asthma Control Questionnaire – Опросник для определения уровня контроля астмы, состоящий из 6 вопросов). 445 пациентов не курили, а 123 являлись активными курильщиками или бывшими курильщиками (но прекратившими курить менее года назад).
В данное исследование включались пациенты, которые не достигали контроля БА на монотерапии ИГКС или комбинированной терапии ИГКС/ДДБА, причем решение назначить пациентам экстрамелкодисперсную фиксированную комбинацию БДП/Ф врач принимал независимо от включения пациента в исследование. Критериями эффективности терапии БДП/Ф являлись функциональные показатели (ОФВ1 и ПСВ) и оценка контроля БА по критериям GINA (Global Initiative for Asthma – Глобальная инициатива по борьбе с астмой) и по опросникам ACQ6 (6 вопросов) и ACQ7 (6 вопросов + результаты измерения ОФВ1 или ПСВ). Преимуществом этого исследования являлась длительность наблюдения. После включения пациентов в исследование и оценки исходного уровня контроля БА следующий визит с оценкой текущего контроля проводился через 2–8 месяцев (в среднем через 168 дней), а заключительный, третий, визит – через 8–14 месяцев (в среднем через 358 дней) терапии. Как показала оценка исходного уровня, курящие пациенты имели тенденцию к более низким показателям ОФВ1 и ПСВ по сравнению с некурящими больными (р > 0,05) и достоверно более низкий уровень контроля БА, оцениваемый по ACQ6 (p < 0,0001), по ACQ7 (p = 0,002) и по GINA (р = 0,021).
В результате лечения экстрамелкодисперсной фиксированной комбинацией БДП/Ф у всех пациентов, независимо от статуса курения, произошло значимое улучшение функции легких, оцениваемой по ОФВ1 (рис. 10) и ПСВ [50]. Контроль БА по АСQ6 и АСQ7 улучшился у всех пациентов в среднем на 1,22 и 1,16 балла (р < 0,0001) ко второму визиту и на 1,32 и 1,17 балла (p < 0,0001) к третьему визиту соответственно (рис. 11) [50]. Очень важно, что средняя суточная доза ИГКС (в пересчете на экстрамелкодисперсный БДП) при этом снизилась у больных с 489 ± 192 мкг БДП до 273 ± 122 мкг ко второму визиту и до 265 ± 125 мкг к третьему визиту. Таким образом, лечение экстрамелкодисперсной фиксированной комбинацией БДП/Ф (Фостером) у курящих и недавно прекративших курить пациентов с БА было не менее эффективным, чем у некурящих больных. Это может быть обусловлено оптимальным распределением препарата в малых дыхательных путях, выраженным бронхолитическим и противовоспалительным эффектами в зоне распределения препарата, уменьшением воздушных ловушек и, соответственно, улучшением функции легких и контроля БА.
Назначение антагонистов лейкотриеновых рецепторов в комбинации с ИГКС или, в случае легкой БА, в качестве монотерапии может быть полезно у курящих пациентов с БА. В 8-недельном двойном слепом исследовании с перекрестным дизайном изучалось влияние низкой дозы ИГКС (160 мкг БДП дважды в день) или монтелукаста (10 мг однократно вечером) на клинико-функциональные параметры (ОФВ1 и ПСВ) и маркеры воспаления (БГР и эозинофилы индуцированной мокроты) у курящих и некурящих пациентов с персистирующей БА. Курящие больные имели лучший функциональный ответ на терапию монтелукастом. Увеличение утренней ПСВ у них было значимо выше по сравнению с таковым в ответ на БДП, а прирост ОФВ1 был одинаков. Терапия антагонистами лейкотриеновых рецепторов может иметь приоритет у этой группы больных как в качестве монотерапии при легкой персистирующей БА у курящих подростков, так и в качестве аддитивной (добавочной) терапии, усиливающей эффекты ИГКС у курящих пациентов со среднетяжелой персистирующей БА [51].
Еще одной возможностью преодоления резистентности к ГКС у курящих пациентов может быть назначение низких доз теофиллина. Теофиллин вызывает шестикратное увеличение активности деацетилазы гистонов альвеолярных макрофагов, полученных от больных хронической обструктивной болезнью легких (ХОБЛ), и значительно усиливает супрессивную активность дексаметазона в отношении ИЛ-8 [52]. Таким образом, теофиллин может способствовать восстановлению нарушенной стероидной чувствительности у курящих пациентов с ХОБЛ и БА.
Заключение
Распространенность курения среди лиц, страдающих бронхиальной астмой, не отличается от распространенности курения в популяции в целом и составляет от 25 до 35%. Как активное, так и пассивное курение способствует развитию БА, увеличивает ее тяжесть и риск обострений, препятствует достижению контроля и нарушает адекватный ответ на фармакотерапию. Курящие пациенты с БА не отвечают или имеют сниженный ответ на ГКС. В настоящее время существует несколько путей преодоления кортикостероидной резистентности у курящих больных БА. Наиболее радикальным является отказ от курения, стимулировать к которому необходимо каждого курящего пациента. Назначение комбинированных препаратов ИГКС и ДДБА является эффективной стратегией преодоления кортикостероидной резистентности, причем наиболее оправдано назначение курящим больным БА экстрамелкодисперсной фиксированной комбинации БДП/Ф. Дополнительные возможности по преодолению кортикостероидной резистентности предоставляет назначение антагонистов лейкотриеновых рецепторов (в комбинации с ИГКС или в монотерапии) или низких доз теофиллина.
1. Глобальная стратегия лечения и профилактики бронхиальной астмы. Пересмотр 2011 г. Пер. с англ. М.: Российское респираторное общество, 2012.
2. Peters J.M., Avol E., Navidi W. et al. A study of twelve Southern California communities with differing levels and types of air pollution. I. Prevalence of respiratory morbidity // Am. J. Respir. Crit. Care Med. 1999. Vol. 159. № 3. P. 760–767.
3. Siroux V., Pin I., Oryszczyn M.P. et al. Relationships of active smoking to asthma and asthma severity in the EGEA study. Epidemiological study on the Genetics and Environment of Asthma // Eur. Respir. J. 2000. Vol. 15. № 3. P. 470–477.
4. Althuis M.D., Sexton M., Prybylski D. Cigarette smoking and asthma symptom severity among adult asthmatics // J. Asthma. 1999. Vol. 36. № 3. P. 257–264.
5. Гноевых В.В., Смирнова А.Ю., Нагорнов Ю.С. и др. Бронхиальная астма и табакокурение // Пульмонология. 2011. № 12. С. 261–289.
6. McCusker K.T., Hiller F.C., Mazumder M.K. et al. Effects of contemporary filters on cigarette smoke // Chest. 1981. Vol. 80. № 1. Suppl. P. 80–81.
7. Соодаева С.К. Окислительный стресс и антиоксидантная терапия при заболеваниях органов дыхания // Пульмонология. 2006. № 5. С. 122–126.
8. Chalmers G.W., MacLeod K.J., Thomson L. et al. Smoking and airway inflammation in patients with mild asthma // Chest. 2001. Vol. 120. № 6. P. 1917–1922.
9. Thomson N.C., Chaudhuri R., Livingston E. Asthma and cigarette smoking // Eur. Respir. J. 2004. Vol. 24. № 5. P. 822–833.
10. Broekema M., ten Hacken N.H., Volbeda F. et al. Airway epithelial changes in smokers but not in ex-smokers with asthma // Am. J. Respir. Crit. Care Med. 2009. Vol. 180. № 12. P. 1170–1178.
11. Kuschner W.G., D’Alessandro A., Wong H. et al. Dose-dependent cigarette smoking-related inflammatory responses in healthy adults // Eur. Respir. J. 1996. Vol. 9. № 10. P. 1989–1994.
12. Niewoehner D.E., Kleinerman J., Rice D.B. Pathologic changes in the peripheral airways of young cigarette smokers // N. Engl. J. Med. 1974. Vol. 291. № 15. P. 755–758.
13. Stănescu D., Sanna A., Veriter C. et al. Identification of smokers susceptible to development of chronic airflow limitation: a 13-year follow-up // Chest. 1998. Vol. 114. № 2. P. 416–425.
14. Contoli M., Kraft M., Hamid Q. et al. Do small airway abnormalities characterize asthma phenotypes? In search of proof // Clin. Exp. Allergy. 2012. Vol. 42. № 8. P. 1150–1160.
15. Martinez F.D., Wright A.L., Taussig L.M. et al. Asthma and wheezing in the first six years of life. The Group Health Medical Associates // N. Engl. J. Med. 1995. Vol. 332. № 3. P. 133–138.
16. Strachan D.P., Cook D.G. Health effects of passive smoking. 6. Parental smoking and childhood asthma: longitudinal and case-control studies // Thorax. 1998. Vol. 53. № 3. P. 204–212.
17. Kurukulaaratchy R.J., Waterhouse L., Matthews S.M. et al. Are influences during pregnancy associated with wheezing phenotypes during the first decade of life? // Acta Paediatr. 2005. Vol. 94. № 5. P. 553–558.
18. Lannerö E., Wickman M., Pershagen G. et al. Maternal smoking during pregnancy increases the risk of recurrent wheezing during the first years of life (BAMSE) // Respir. Res. 2006. Vol. 7. P. 3.
19. Magnusson C.G. Maternal smoking influences cord serum IgE and IgD levels and increases the risk for subsequent infant allergy // J. Allergy Clin. Immunol. 1986. Vol. 78. № 5. Pt. 1. P. 898–904.
20. Aycicek A., Erel O., Kocyigit A. Increased oxidative stress in infants exposed to passive smoking // Eur. J. Pediatr. 2005. Vol. 164. № 12. P. 775–778.
21. Gilliland F.D., Islam T., Berhane K. et al. Regular smoking and asthma incidence in adolescents // Am. J. Respir. Crit. Care Med. 2006. Vol. 174. № 10. P. 1094–1100.
22. Piipari R., Jaakkola J.J., Jaakkola N. et al. Smoking and asthma in adults // Eur. Respir. J. 2004. Vol. 24. № 5. P. 734–739.
23. Raherison C., Baldi I., Tunon-De-Lara J.M. et al. Asthma phenotypes according to the timing of smoking onset in young adults // Int. J. Tuberc. Lung Dis. 2003. Vol. 7. № 1. P. 84–92.
24. Батожаргалова Б.Ц., Мизерницкий Ю.Л. Влияние табакокурения на течение бронхиальной астмы у подростков // Бюллетень сибирской медицины. 2012. № 3. С. 108–115.
25. Schatz M., Zeiger R.S., Vollmer W.M. et al. Determinants of future long-term asthma control // J. Allergy Clin. Immunol. 2006. Vol. 118. № 5. P. 1048–1053.
26. McCoy K., Shade D.M., Irvin C.G. et al. Predicting episodes of poor asthma control in treated patients with asthma // J. Allergy Clin. Immunol. 2006. Vol. 118. № 6. P. 1226–1233.
27. Strine T.W., Balluz L.S., Ford E.S. The associations between smoking, physical inactivity, obesity, and asthma severity in the general US population // J. Asthma. 2007. Vol. 44. № 8. P. 651–658.
28. Kraft M., Pak J., Martin R.J. et al. Distal lung dysfunction at night in nocturnal asthma // Am. J. Respir. Crit. Care Med. 2001. Vol. 163. № 7. P. 1551–1556.
29. Martin R.J., Cicutto L.C., Smith H.R. et al. Airways inflammation in nocturnal asthma // Am. Rev. Respir. Dis. 1991. Vol. 143. № 2. P. 351–357.
30. Kraft M., Martin R.J., Wilson S. et al. Lymphocyte and eosinophil influx into alveolar tissue in nocturnal asthma // Am. J. Respir. Crit. Care Med. 1999. Vol. 159. № 1. P. 228–234.
31. Lange P., Parner J., Vestbo J. et al. A 15-year follow-up study of ventilatory function in adults with asthma // N. Engl. J. Med. 1998. Vol. 339. № 17. P. 1194–1200.
32. Reardon J.Z. Environmental tobacco smoke: respiratory and other health effects // Clin. Chest Med. 2007. Vol. 28. № 3. P. 559–573, vi.
33. Chan-Yeung M., Dimich-Ward H. Respiratory health effects of exposure to environmental tobacco smoke // Respirology. 2003. Vol. 8. № 2. P. 131–139.
34. LeSon S., Gershwin M.E. Risk factors for asthmatic patients requiring intubation. I. Observations in children // J. Asthma. 1995. Vol. 32. № 4. P. 285–294.
35. Mannino D.M., Homa D.M., Redd S.C. Involuntary smoking and asthma severity in children: data from the Third National Health and Nutrition Examination Survey // Chest. 2002. Vol. 122. № 2. P. 409–415.
36. Schwartz J., Timonen K.L., Pekkanen J. Respiratory effects of environmental tobacco smoke in a panel study of asthmatic and symptomatic children // Am. J. Respir. Crit. Care Med. 2000. Vol. 161. № 3. Pt. 1. P. 802–806.
37. Gerald L.B., Gerald J.K., Gibson L. et al. Changes in environmental tobacco smoke exposure and asthma morbidity among urban school children // Chest. 2009. Vol. 135. № 4. P. 911–916.
38. Jindal S.K., Gupta D., Singh A. Indices of morbidity and control of asthma in adult patients exposed to environmental tobacco smoke // Chest. 1994. Vol. 106. № 3. P. 746–749.
39. Marquette C.H., Saulnier F., Leroy O. et al. Long-term prognosis of near-fatal asthma. A 6-year follow-up study of 145 asthmatic patients who underwent mechanical ventilation for a near-fatal attack of asthma // Am. Rev. Respir. Dis. 1992. Vol. 146. № 1. P. 76–81.
40. Pedersen B., Dahl R., Karlström R. et al. Eosinophil and neutrophil activity in asthma in a one-year trial with inhaled budesonide. The impact of smoking // Am. J. Respir. Crit. Care Med. 1996. Vol. 153. № 5. P. 1519–1529.
41. Chalmers G.W., Macleod K.J., Little S.A. et al. Influence of cigarette smoking on inhaled corticosteroid treatment in mild asthma // Thorax. 2002. Vol. 57. № 3. P. 226–230.
42. Jang A.S., Lee J.H., Park S.W. et al. Factors influencing the responsiveness to inhaled glucocorticoids of patients with moderate-to-severe asthma // Chest. 2005. Vol. 128. № 3. P. 1140–1145.
43. Chaudhuri R., Livingston E., McMahon A.D. et al. Cigarette smoking impairs the therapeutic response to oral corticosteroids in chronic asthma // Am. J. Respir. Crit. Care Med. 2003. Vol. 168. № 11. P. 1308–1311.
44. Ito K., Caramori G., Lim S. et al. Expression and activity of histone deacetylases in human asthmatic airways // Am. J. Respir. Crit. Care Med. 2002. Vol. 166. № 3. P. 392–396.
45. Barnes P.J., Ito K., Adcock I.M. Corticosteroid resistance in chronic obstructive pulmonary disease: inactivation of histone deacetylase // Lancet. 2004. Vol. 363. № 9410. P. 731–733.
46. Chaudhuri R., Livingston E., McMahon A.D. et al. Effects of smoking cessation on lung function and airway inflammation in smokers with asthma // Am. J. Respir. Crit. Care Med. 2006. Vol. 174. № 2. P. 127–133.
47. Jang A.S., Park S.W., Kim D.J. et al. Effects of smoking cessation on airflow obstruction and quality of life in asthmatic smokers // Allergy Asthma Immunol. Res. 2010. Vol. 2. № 4. P. 254–259.
48. Tomlinson J.E., McMahon A.D., Chaudhuri R. et al. Efficacy of low and high dose inhaled corticosteroid in smokers versus non-smokers with mild asthma // Thorax. 2005. Vol. 60. № 4. P. 282–287.
49. Müller V., Gálffy G., Eszes N. et al. Asthma control in patients receiving inhaled corticosteroid and long-acting beta2-agonist fixed combinations. A real-life study comparing dry powder inhalers and a pressurized metered dose inhaler extrafine formulation // BMC Pulm. Med. 2011. Vol. 11. P. 40–45.
50. Brusselle G., Peché R., Van den Brande P. et al. Real-life effectiveness of extrafine beclometasone dipropionate/formoterol in adults with persistent asthma according to smoking status // Respir. Med. 2012. Vol. 106. № 6. P. 811–819.
51. Lazarus S.C., Chinchilli V.M., Rollings N.J. et al. Smoking affects response to inhaled corticosteroids or leukotriene receptor antagonists in asthma // Am. J. Respir. Crit. Care Med. 2007. Vol. 175. № 8. P. 783–790.
52. Cosio B.G., Tsaprouni L., Ito K. et al. Theophylline restores histone deacetylase activity and steroid responses in COPD macrophages // J. Exp. Med. 2004. Vol. 200. № 5. P. 689–695.
Asthma and smoking
N.M. Nenasheva
State Budget Educational Institution for Supplementary Professional Education ‘Russian Medical Academy for Postgraduate Education’
Contact person: Natalya Mikhaylovna Nenasheva, 1444031@gmail.com
The proportion of smokers among asthmatics is 25–35% which is equivalent to the smoking rate in the population. Active and passive tobacco smoking is associated with the increased risk of asthma, higher exacerbation rate, accelerated disease progression, uncontrolled asthma, and corticosteroid insensitivity. Smoking cessation and inhaled corticosteroid/long-acting beta-agonist combination therapy are effective ways for reducing of steroid resistance. Using of extrafine beclomethasone dipropionate/formoterol fixed combination inhaler (Foster) is justified in smoking asthmatics due to optimal distribution of the drug in the small airways, marked bronchodilatory and anti-inflammatory action, reducing of air-trapping, improved lung function and asthma control. Antileukotrienes (alone, or in combination with inhaled corticosteroids) and low-dose theophylline may be used as add-on therapy.
Key words: asthma, tobacco smoking, asthma control, corticosteroids, beclomethasone dipropionate, formoterol, fixed combination
N.M. Nenasheva
State Budget Educational Institution for Supplementary Professional Education ‘Russian Medical Academy for Postgraduate Education’
Contact person: Natalya Mikhaylovna Nenasheva, 1444031@gmail.com
The proportion of smokers among asthmatics is 25–35% which is equivalent to the smoking rate in the population. Active and passive tobacco smoking is associated with the increased risk of asthma, higher exacerbation rate, accelerated disease progression, uncontrolled asthma, and corticosteroid insensitivity. Smoking cessation and inhaled corticosteroid/long-acting beta-agonist combination therapy are effective ways for reducing of steroid resistance. Using of extrafine beclomethasone dipropionate/formoterol fixed combination inhaler (Foster) is justified in smoking asthmatics due to optimal distribution of the drug in the small airways, marked bronchodilatory and anti-inflammatory action, reducing of air-trapping, improved lung function and asthma control. Antileukotrienes (alone, or in combination with inhaled corticosteroids) and low-dose theophylline may be used as add-on therapy.
Key words: asthma, tobacco smoking, asthma control, corticosteroids, beclomethasone dipropionate, formoterol, fixed combination
Новости на тему
28.12.2023
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.