В своем докладе руководитель научно-клинической лаборатории пульмонологии Научно-исследовательского медико-стоматологического института МГМСУ им. А.И. Евдокимова, д.м.н. Кирилл Алексеевич ЗЫКОВ выделил такие нерешенные проблемы бронхиальной астмы, как недостаточная оценка контроля БА, трудности лечения БА тяжелого течения, неполный контроль воспалительного процесса у ряда пациентов. Среди первоочередных задач, стоящих перед пульмонологами, докладчик особенно отметил необходимость фенотипирования БА, которое даст возможность осуществлять персонифицированный подход к лечению пациентов. Для этого возможно использовать различные биомаркеры, позволяющие охарактеризовать особенности воспалительного процесса при астме и назначать новые лекарства, направленные на специфические биологические пути (анти-ИЛ-5, анти-ИЛ-13 и т.д.).
Фенотип определяется как все доступные для наблюдения характеристики организма, являющиеся результатом взаимодействия его генотипа и внешней среды [19]. С позиции клинициста при БА влияние окружающей среды на генотип при случайной вариабельности ведет к тому или иному проявлению патобиологии с определенными биомаркерами, от которых зависят клинические проявления, в том числе естественная история БА и ответ на терапию. Потенциальные фенотипы БА включают аспиринзависимую астму; астму, склонную к обострению; эозинофильную астму; неэозинофильную астму; возможно, астму у больных с коморбидными состояниями и другие варианты. Воспаление мелких бронхов ассоциировано с несколькими типами БА: ночная астма, тяжелая астма, аллергическая астма, легкая астма, астма физического усилия.
Неэозинофильная астма все чаще рассматривается как важный клинико-патологический фенотип БА у взрослых и описывается у детей. По данным J.L. Simpson и соавт. (2007) [20], а также ряда других исследователей, при неэозинофильной БА возможны нейтрофильные и лимфоцитарные подгруппы, при нейтрофильном типе – переактивация врожденного иммунного ответа, наблюдается ассоциация с курением, ожирением, внешними факторами, менопаузой, элитным спортом, возможен положительный эффект макролидов и характерна стабильность фенотипа. В этой связи д.м.н. К.А. Зыков остановился на вызывающей бурные споры так называемой голландской гипотезе, заключающейся в том, что различия между бронхиальной астмой и хронической обструктивной болезнью легких (ХОБЛ) не столь значительны и эти заболевания являются двумя сторонами одной медали. Патогенетические характеристики тяжелой БА имеют много общего с механизмами, определяющими ХОБЛ, – отсутствие выраженной эозинофилии при инфильтрации нейтрофилами, участие Tc₁, Th₁, Th₁₇ в индукции воспаления при ХОБЛ и тяжелой БА, повышение при обоих заболеваниях уровня ФНО-альфа и ИЛ-8, роль окислительного стресса в патогенезе и преимущественное поражение мелких дыхательных путей в обоих случаях. При среднетяжелой БА повышена роль эозинофилов, задействованы Th₂-лимфоциты, меньше значение окислительного стресса, наблюдается преимущественное поражение крупных воздушных путей, как при эозинофильной инфильтрации, а повышения ФНО-альфа и ИЛ-8, как при тяжелой форме, не происходит. Для БА средней тяжести характерен высокий ответ на ингаляционные ГКС, в то время как при ХОБЛ ответ на ГКС-терапию отсутствует, а при тяжелой БА может быть незначительным.
Для фенотипирования БА важна оценка выраженности эозинофильного воспаления. Типичный маркер эозинофильного воспаления дыхательных путей – эозинофилия мокроты. Для выявления эозинофильного воспаления также может быть полезным определение уровня сывороточного эозинофильного катионного протеина (ЭКП). Так, по данным V. Peona и соавт. (2010), уровень ЭКП был значительно выше в группе 441 больных с респираторной патологией, чем у 33 здоровых лиц (р = 0,0001), при этом не наблюдалось корреляции между количеством эозинофилов в периферической крови и уровнем ЭКП (р = 0,881; r = 0,007) [21]. Повышенный уровень ЭКП имел предиктивное значение для БА с чувствительностью 70% и специфичностью 74%. Комбинация маркеров – общее содержание IgE и ЭКП – более чувствительна, как предиктор свистящего дыхания у детей, чем только уровень IgE или уровень ЭКП [22]. Известно, что количество эозинофилов при БА больше в мелких дыхательных путях (диаметром < 2 мм) [23], которых могут достигать аллергены малого размера.
Говоря о лечении эозинофильной БА, д.м.н. А.К. Зыков отметил: данные ряда исследований показали, что изменение терапии БА с учетом количества эозинофилов в мокроте ведет к снижению количества обострений, однако для окончательной оценки такой тактики лечения, согласно результатам систематического Кокрановского обзора (H.L. Petsky и соавт., 2007) [24], необходимы дальнейшие исследования. Роль оценки оксида азота в выдыхаемом воздухе для коррекции дозы ингаляционного ГКС при БА остается не до конца ясной [25].
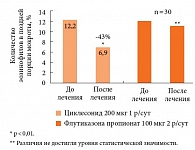
Подчеркивая преимущества экстрамелкодисперсных ингаляционных ГКС при лечении эозинофильной астмы, докладчик привел результаты исследования, показавшего, что циклесонид в дозе 200 мкг снижает количество эозинофилов в поздней порции мокроты при астме на 43% (р < 0,01), тогда как флутиказона пропионат в дозе 100 мкг 2 раза в день в течение 8 недель не дает достоверного снижения количества эозинофилов (рис. 2) [26]. В том же исследовании циклесонид достоверно снижал сопротивление в мелких воздушных путях (0,02 кПа/л/с), а статистически значимого влияния флутиказона пропионата на этот показатель не отмечено [26].
Еще одним важным достоинством терапии циклесонидом, по мнению д.м.н. К.А. Зыкова, является отсутствие системного влияния ингаляций циклесонида: по данным E. Derom и соавт. (2005), циклесонид в дозах от 320 мкг до 640 мкг 2 раза в день не влиял на уровень кортизола в моче [27].
Проблема ведения больных тяжелой астмой была рассмотрена в докладе д.м.н., профессора Александра Вячеславовича АВЕРЬЯНОВА (Федеральный научно-клинический центр специализированных видов медицинской помощи и медицинских технологий ФМБА России, Москва). Тяжелая БА составляет 5–10% всех случаев астмы. В последнее время все чаще признается, что тяжелая форма БА представляет собой несколько гетерогенных фенотипов, однако их иммунопатология, в особенности в дистальных воздушных путях и интерстиции, недостаточно хорошо изучена.
По дефиниции Американского торакального общества «тяжелая астма» означает сохранение симптомов БА у больных с подтвержденным диагнозом бронхиальной астмы, несмотря на приверженность адекватному лечению [28]. Термин «тяжелая астма» следует отличать от понятия «трудная астма», под которым понимают сохранение симптомов астмы несмотря на максимальное (4–5-я ступень) лечение (GINA 2006–2012). Критерии тяжелой астмы делятся на большие (потребность в курсах пероральных ГКС более 50% дней в году; высокие дозы ингаляционных ГКС) и малые (дополнительная к ингаляционным ГКС потребность в других лекарствах для контроля БА, дополнительная потребность в бета-2-агонистах короткого действия почти ежедневно, ОФВ₁ < 80%, уменьшение пиковой скорости выдоха (ПСВ) > 20%, одно или более обострений БА с госпитализацией, 3 или более курсов увеличения дозы пероральных ГКС, ухудшение состояния при снижении дозы ГКС системного действия или ингаляционных ГКС < 25%, эпизоды обострения с угрозой для жизни в анамнезе) [28].
Трудная для лечения БА может быть обусловлена недостаточной приверженностью терапии, наличием отягчающих факторов или бронхообструкцией, вызванной другим заболеванием, требующим дифференциального диагноза. При исключении этих составляющих мы имеем пациента с истинной тяжелой астмой. Профессор А.В. Аверьянов привел интересные наблюдения D.S. Robinson и соавт. (2003): из 100 больных с первоначальным диагнозом «трудная астма» у 12 пациентов БА не подтвердилась, у 28 больных имелась высокая степень тревожности, у 30 – риносинусит, 55 больных не выполняли врачебные назначения, у 3 были диагностированы бронхоэктазы и у 9 имелся постоянный контакт с домашними аллергенами [29]. Дифференциальный диагноз трудной астмы в первую очередь включает такие «маски» бронхиальной астмы, как ХОБЛ, бронхоэктазы, дисфункция голосовых связок, эозинофильные поражения (васкулиты, аллергический бронхолегочный аспергиллез), гипервентиляционный синдром, сердечная астма. Большое значение в определении возможных отягчающих бронхиальную астму факторов имеет применение компьтерной томографии (КТ). Анализ данных с применением КТ высокого разрешения среди 185 больных тяжелой астмой выявил утолщение стенок бронхов у 62% больных, бронхоэктазы у 40%, эмфизему легких у 8%, аллергический бронхолегочный аспергиллез у 5%, наличие воздушных ловушек у 7% и нормальную КТ только у 20% [30].
Ухудшать течение БА могут ринит, синусит, гипервентиляция, гастроэзофагеальный рефлюкс, неврозы, депрессии, курение, ожирение, апноэ во сне, ХОБЛ, респираторные инфекции, присутствие аллергенов. Тяжелая астма примерно в два раза вероятнее у больных с ожирением, чем у людей без избыточного веса. Исследование рефрактерной астмы в многоцентровом регистре Великобритании показало, что c тяжестью течения БА связаны астма в семейном анамнезе; атопия, аллергический ринит, операции на полости носа и гастроэзофагеальная рефлюксная болезнь в анамнезе; эозинофилия крови; повышенный уровень NO в выдыхаемом воздухе. При этом экзема, полипоз носа, эозинофилия мокроты, общий IgE, по данным этого регистра, не ассоциировались с тяжелым течением БА [31].
Недавно были опубликованы данные M.A. Rosenkranz и соавт. (2012) о влиянии эмоций на выраженность воспаления при БА и связи БА с нейрофенотипами. Установлено, что психический стресс и волнение усиливают не только выраженность симптомов БА, но и эозинофильную инфильтрацию слизистой бронхов, следовательно, связь между нервными сигналами мозга и легкими частично моделирует воспалительный ответ и функцию легких. Однако природа сигнальных путей, которые определяют такое влияние, пока не изучена. Результаты исследования функционального магнитно-резонансного изображения мозга в ответ на воздействие ряда факторов, способствующих обострению БА (эмоций, аллергенов), показали, что по нейрональной реактивности мозга можно идентифицировать нейрофенотипы, характерные для БА или отягощающие течение заболевания [32].
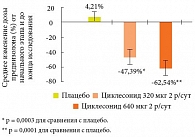
Профессор А.В. Аверьянов представил убедительные доказательства эффективности новых экстрамелкодисперсных ингаляционных ГКС для лечения тяжелой БА. В частности, в международном многоцентровом рандомизированном двойном слепом плацебоконтролируемом исследовании с периодом лечения 12 недель у взрослых с тяжелой персистирующей астмой (n = 141) было достигнуто достоверное уменьшение дозы преднизолона на 47% при лечении циклесонидом 320 мкг 2 раза в сутки и на 62,5% при лечении циклесонидом 640 мкг 2 раза в сутки (рис. 3). У 29,8% пациентов в группе лечения циклесонидом в дозе 640 мкг в сутки и у 31,1% в группе циклесонида 1280 мкг в сутки удалось полностью отменить преднизолон [33]. Рандомизированное двойное слепое плацебоконтролируемое исследование, в котором сравнивали эффективность и профиль безопасности циклесонида и будесонида у подростков с тяжелой БА, показало одинаковую эффективность циклесонида 320 мкг в день и будесонида 800 мкг в день у подростков с тяжелой астмой; циклесонид хорошо переносился и, в отличие от будесонида, не влиял на уровень кортизола в моче [34]. Международное многоцентровое рандомизированное открытое исследование эффективности циклесонида и флутиказона пропионата у 528 больных с персистирующей БА (от умеренной до тяжелой), распределенных в группы лечения циклесонидом 320 мкг 2 раза в день и флутиказона пропионатом 375 мкг 2 раза в день в течение 24 недель, показало, что динамика ОФВ₁ на протяжении 6 месяцев (выраженного как % от должного значения) и процент дней с контролем БА на фоне лечения обоими препаратами не различалась [35]. В ходе двойного слепого исследования эффективности и безопасности циклесонида у больных с тяжелой БА с периодом лечения 12 недель и отдаленным наблюдением в течение 1 года циклесонид в дозе 320 мкг 2 раза в день поддерживал функцию легких и сдерживал симптомы при тяжелой БА через 12 недель лечения и поддерживал функцию легких в течение 40 недель фазы продления; увеличение дозы циклесонида до 640 мкг 2 раза в день не дало дополнительных положительных эффектов. Длительное использование циклесонида не было связано с увеличением локальных побочных эффектов или негативными последствиями, выражавшимися в повышении уровня кортизола [36].
Возможно, что в ближайшее время наши взгляды на тяжелую астму будут пересмотрены. Недавно S.E. Wenzel и соавт. (2012) опубликовали результаты исследования биопсийного материала, полученного при торакоскопии, у пациентов с тяжелой астмой, у которых было исключено влияние известных модифицирующих факторов. Почти в половине случаев, наряду с признаками БА, были обнаружены множественные гранулемы в интерстиции. Назначение цитостатиков у таких больных позволило улучшить течение БА, уменьшить дозы системных стероидов. Эти данные позволили авторам предположить, что группа тяжелой БА включает не известную ранее гранулематозную патологию, которую они назвали астматический гранулематоз [37].
В заключение профессор А.В. Аверьянов подчеркнул, что тяжелая астма – редкое состояние, диагноз которого правомочен только после тщательного анализа сопутствующих факторов и приверженности терапии. Новые ингаляционные ГКС (циклесонид) могут помочь контролировать заболевание, уменьшить потребность в системных стероидах при снижении риска побочных эффектов.
Бронхиальная астма и инфекции у детей: есть ли связь?
Доклад заведующей кафедрой детских болезней Первого МГМУ им. И.М. Сеченова, заслуженного врача РФ, д.м.н., профессора Натальи Анатольевны ГЕППЕ (Москва) был посвящен роли инфекции в возникновении БА и влиянию инфекции на течение БА у детей. Инфекции могут быть пусковым механизмом развития БА в раннем возрасте и триггерным механизмом обострений БА у детей. Длительное многоцентровое исследование аллергии в Германии (MAS) у 1314 новорожденных (из них у 499 были факторы риска атопии) показало, что ≥ 4 инфекций нижних дыхательных путей в первые 3 года жизни имеют сильную положительную связь с диагнозом бронхиальной астмы и развитием бронхообструкции к 7 годам [38].
По сравнению с детьми с наследственностью, не отягощенной по атопии, дети с предрасположенностью к БА, предположительно, имеют бóльшую вероятность развития симптомов со стороны нижних дыхательных путей при инфицировании. Инфекции нижних дыхательных путей у таких детей могут иметь большее прогностическое значение, чем факторы риска БА. Частота инфекций нижних дыхательных путей значительно выше в группе детей с положительной семейной историей атопии.
Вирусы, которые наиболее часто вызывают инфекции у детей первого года, инфицируя эпителий бронхов, увеличивают образование интерлейкинов. В свою очередь повышенный уровень ИЛ-6 и ИЛ-8 приводит к изменению регуляции В- и Т-лимфоцитов, способствует накоплению нейтрофилов и эозинофилов, увеличивает образование IgE через воздействие на CD8 и увеличивает способность к высвобождению гистамина путем влияния на макрофаги и базофилы. По данным R.T. Stein и соавт. (1999), инфекции нижних дыхательных путей, вызванные респираторно-синцитиальным вирусом, повышают риск бронхообструкции и поздней аллергии [39]. Начало или персистирование обструктивного синдрома на 2-м году жизни может быть началом БА.
Из бактериальных агентов наиболее часто острые заболевания дыхательных путей у детей вызывает Streptococcus pneumoniaе (с частотой 22,8%) [40]. Streptococcus pneumoniaе выделяется бактериологически в 28,5% случаев острого обструктивного бронхита [41] и в 30,6% (7–76%) внебольничных пневмоний [42]. Другие частые возбудители внебольничных пневмоний у детей – Mycoplasma pneumoniae, Chlamydia pneumoniae, Haemophilus influenzae. Распространенность специфических антител к Chlamydia pneumoniae, по разным данным, у больных БА достоверно выше, чем у не болеющих астмой. Персистирование Chlamydia pneumoniae и реактивация этой инфекции способствуют усилению воспалительного ответа у больных БА. Mycoplasma pneumoniae способствует формированию гиперреактивности бронхов, вызывает супрессию синтеза гамма-интерферона с развитием склонности к хронизации и персистенции микроорганизма в эпителии. Дети, серопозитивные по Mycoplasma pneumoniae, статистически значимо преобладали в группе с неатопической (68%) и атопической БА (55,6%) по сравнению с группой контроля (30,8%) [41]. Частота инфекций, вызванных Haemophilus influenzae, одинакова среди больных с атопической и неатопической БА (27%) и не отличается у детей с респираторными инфекциями с астмой от таковой у детей с респираторными инфекциями без астмы. Важно, что частота других инфекционных заболеваний в первые три года жизни имеет обратную связь с диагнозом БА к 7 годам жизни. Вирусные инфекции, кроме респираторных инфекций нижних дыхательных путей, показали значительную обратную связь с БА к 7 годам. Также не выявлено связи между количеством курсов антибиотиков и БА к 7 годам.
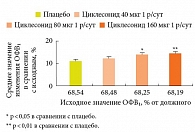
Пути терапевтических воздействий при БА у детей включают базисную терапию, адекватное назначение ГКС, симптоматическую терапию, антимикробную терапию и профилактику респираторных инфекций. Среди ингаляционных ГКС, рекомендуемых при лечении БА у детей, профессор Н.А. Геппе выделила циклесонид (Альвеско®) – пролекарство, которое быстро активируется непосредственно в легких, эффективно и безопасно у детей с БА. Плацебоконтролируемое исследование у 1018 детей 4–11 лет с персистирующей БА, которые были распределены в группы лечения циклесонидом 40 мкг 1 раз в сутки, циклесонидом 80 мкг 1 раз в сутки, циклесонидом 160 мкг 1 раз в сутки и плацебо в течение 12 недель, показало, что циклесонид достоверно увеличивает ОФВ₁ (рис. 4) и улучшает контроль симптомов БА, оцененных в баллах, где «0 баллов» – отсутствие симптомов, «4 балла» – симптомы астмы нарушают ночной сон и препятствуют нормальной дневной активности (рис. 5) [43].
Аналогичные данные были получены в ходе исследования RAINBOW – рандомизированное многоцентровое двойное слепое плацебоконтролируемое в параллельных группах у 1073 детей с персистирующей БА в возрасте 6–11 лет. Дети в течение 12 недель получали терапию циклесонидом 40 мкг (спейсер +/-), циклесонидом 80 мкг (спейсер +/-), циклесонидом 160 мкг (спейсер +/-) или плацебо (спейсер +/-). Было установлено, что циклесонид во всех исследуемых дозах значительно эффективнее плацебо для улучшения ОФВ₁ и уменьшения симптомов БА, оцениваемых в баллах (р < 0,01). Циклесонид в дозах 80 мкг и 160 мкг эффективно снижал объем (частоту) применения препаратов скорой помощи в сравнении с плацебо (p < 0,025). Циклесонид хорошо переносится и не оказывает значимого влияния на гипоталамо-гипофизарно-надпочечниковую систему у детей. Использование спейсера не оказывает значимого влияния на эффективность и безопасность применения циклесонида [44].
В связи с необходимостью лечения и профилактики инфекций дыхательных путей у детей с БА профессор Н.А. Геппе обратила внимание участников симпозиума на возможности использования бактериальных иммуномодуляторов в комплексной терапии детей, предрасположенных к частым респираторным заболеваниям. Применение таких препаратов позволяет уменьшить количество индуцированных ОРВИ приступов обструкции у детей в возрасте от 1 до 6 лет на 37,9% и респираторных инфекций у детей с приступами обструкции в анамнезе на 31,3% [45].
Заключение
Материалы, представленные в ходе симпозиума, убеждают: несмотря на существование «трудных» для лечения вариантов бронхиальной астмы, адекватное противовоспалительное лечение с применением новых экстрамелкодисперсных ингаляционных ГКС, действующих на уровне мелких бронхов, способно улучшить контроль БА и снизить потребность в системных ГКС у многих больных. Одним из наиболее эффективных препаратов при тяжелой БА, астме с воспалением мелких дыхательных путей и других трудных для лечения фенотипах БА является циклесонид (Альвеско®).