Диабет и мозг: вопросы и нерешенные проблемы*
- Аннотация
- Статья
- Ссылки
- English
Когнитивные нарушения и деменция, связанные с СД, также могут быть опосредованы сосудистыми факторами риска, в частности ишемией головного мозга, которая обладает синергизмом с сопутствующими нейродегенеративными процессами. Ни препарата, одобренного для лечения сосудистой деменции, ни фармакологических методов лечения и профилактики когнитивных нарушений у больных СД в настоящее время не существует. Именно поэтому внимание специалистов сосредоточено на способах контроля сосудистых факторов риска, хотя убедительных доказательств, что снижение артериального давления и уровня липидов или жесткий гликемический контроль способны замедлять развитие когнитивных нарушений, нет. Чтобы снизить риск развития и прогрессирования когнитивных нарушений, больным СД может потребоваться индивидуальная мультимодальная терапия. Плейотропные препараты разнонаправленного действия (например, церебролизин, Актовегин) способны сыграть определенную роль в терапии когнитивных нарушений. Это обосновывает целесообразность проведения исследований по применению данных препаратов у больных СД.
Когнитивные нарушения и деменция, связанные с СД, также могут быть опосредованы сосудистыми факторами риска, в частности ишемией головного мозга, которая обладает синергизмом с сопутствующими нейродегенеративными процессами. Ни препарата, одобренного для лечения сосудистой деменции, ни фармакологических методов лечения и профилактики когнитивных нарушений у больных СД в настоящее время не существует. Именно поэтому внимание специалистов сосредоточено на способах контроля сосудистых факторов риска, хотя убедительных доказательств, что снижение артериального давления и уровня липидов или жесткий гликемический контроль способны замедлять развитие когнитивных нарушений, нет. Чтобы снизить риск развития и прогрессирования когнитивных нарушений, больным СД может потребоваться индивидуальная мультимодальная терапия. Плейотропные препараты разнонаправленного действия (например, церебролизин, Актовегин) способны сыграть определенную роль в терапии когнитивных нарушений. Это обосновывает целесообразность проведения исследований по применению данных препаратов у больных СД.
Введение
Сахарный диабет (СД) сопровождается повышенным риском развития умеренных когнитивных нарушений, деменции и инсульта [1]. Значение СД как одного из факторов развития деменции будет неуклонно возрастать, особенно если учитывать, что по расчетам экспертов к 2030 г. количество больных СД в мире достигнет 552 млн [2].
Сосудистые нарушения головного мозга, лежащие в основе снижения когнитивной функции, неоднородны. Они могут приводить к развитию острой или хронической ишемии или и той и другой одновременно.
Болезнь Альцгеймера (БА) – наиболее частая причина деменции. Однако последние данные свидетельствуют, что сосудистые заболевания головного мозга являются не менее распространенным фактором снижения когнитивных функций. В то же время трудно установить природу деменции, и у большинства пациентов, особенно пожилого возраста, заболевание имеет смешанный характер [3]. В нескольких когортных исследованиях данные аутопсии показали смешанные изменения у большинства пациентов с деменцией, включающие изменения, характерные для БА (например, бета-амилоидные бляшки), и сосудистые очаги (инфаркты, лакуны, микрокровоизлияния и изменения белого вещества) [4].
Диабет и когнитивные функции
В ряде исследований с участием больных СД 2 типа (до 90%) показано, что СД является фактором риска развития когнитивных нарушений и деменции [5, 6]. Одномоментные поперечные исследования продемонстрировали снижение когнитивных функций в группе СД относительно контрольной группы [7]. Продольные исследования также показали снижение когнитивной функции у пациентов с СД [8, 9].
P.K. Crane и соавт. и L. Kerti и соавт. доказали, что повышение уровня глюкозы в крови связано с риском развития когнитивных нарушений или деменции даже у пациентов, не страдающих СД [10, 11]. C. Ruis и соавт. наблюдали умеренные когнитивные нарушения у пациентов на ранней стадии СД 2 типа [12]. K.F. Yates и соавт. отметили влияние метаболического синдрома на снижение когнитивных функций и риск развития деменции [13]. Тем не менее данные о причинно-следственной связи между СД и когнитивными нарушениями неоднозначны.
Предполагается, что между деменцией и СД при сосудистой природе когнитивных нарушений существует более тесная связь, чем при БА. Так, метаанализ, проведенный G. Cheng и соавт. (2012), показал, что при СД относительный риск умеренных когнитивных нарушений составляет 1,2, БА – 1,5, сосудистой деменции – 2,5 [14]. В отличие от пациентов, не страдающих СД, у пациентов пожилого возраста с СД отмечаются снижение содержания бета-амилоида и увеличение частоты инфарктов головного мозга [15].
Сахарный диабет может быть связан с развитием только умеренных когнитивных нарушений, которые медленно прогрессируют и приводят к едва заметным изменениям самооценки, настроения и самочувствия. При этом деменция не развивается. У некоторых пациентов СД сопровождается повышенным риском развития тяжелого когнитивного дефицита и деменции. Эти два процесса могут являться отражением непрерывного континуума с развитием умеренного поражения на раннем этапе. Однако при анализе с учетом возраста и характера развития нарушений выявлены различия между этими двумя типами нарушений. Скорее всего это самостоятельные процессы [16]. Если это так, то и факторы риска, и подходы к терапии будут различаться.
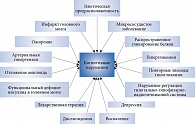
В патофизиологии когнитивных нарушений участвуют различные метаболические и сосудистые нарушения (рис. 1) [17]. Механизмы, посредством которых СД способствует развитию изменений головного мозга, пока не изучены, но скорее всего они включают и цереброваскулярные, и нейродегенеративные изменения. Определенную роль могут играть изменения сосудов головного мозга, нарушения в мозговой сигнальной системе инсулина, инсулинорезистентность, глюкозотоксичность, окислительный стресс, накопление конечных продуктов гликозилирования, эпизоды гипогликемии и нарушения метаболизма амилоида. В исследованиях, где использовались методы нейровизуализации, показано наличие структурных изменений в головном мозге у пациентов с СД. При проведении магнитно-резонансной томографии установлена связь между СД и бессимптомными инфарктами мозга [18]. Возможно, СД является фактором риска прогрессирования поражения белого вещества головного мозга [19]. Данные об этой связи противоречивы.
Диабет и острый ишемический инсульт
Когнитивные нарушения и деменция, связанные с СД, могут опосредоваться через ишемический инсульт, который обладает аддитивным действием или синергизмом с сопутствующими нейродегенеративными поражениями. Пациенты с СД подвержены высокому риску развития инсульта. В метаанализе с участием почти 700 000 пациентов показано, что СД повышает риск развития ишемического инсульта в два раза после таких факторов риска, как индекс массы тела, артериальное давление, уровень липидов (отношение рисков (ОР) 2,27 при 95%-ном доверительном интервале (ДИ) 1,95–2,65) [20]. С наличием СД также связаны неблагоприятные исходы инсульта, в частности увеличение смертности [21].
Очень часто у больных с острым инсультом выявляется СД, который ранее не был диагностирован. В когортном исследовании 238 пациентов с острым инсультом у 36% СД уже был в анамнезе, а у 16% диагностирован впервые. Еще 4% пациентов имели нарушение толерантности к глюкозе или повышенный уровень глюкозы в крови натощак [22]. Доля больных с острым инсультом и не диагностированным ранее СД, а не с преходящей стрессовой гипергликемией может быть выше, чем принято считать, поскольку в исследованиях инсульта критерием СД является наличие заболевания в анамнезе или факт приема антидиабетических препаратов [23].
Гипергликемия в период острой фазы инсульта связана с ухудшением краткосрочного прогноза. В систематическом обзоре показано, что ОР госпитальной или 30-дневной летальности после ишемического инсульта составил 3,3 у пациентов с гипергликемией без диагностированного СД и 2,0 у пациентов с диагностированным СД (по сравнению с пациентами, у которых уровень глюкозы был в норме) [24]. В работе J. Alvarez-Sabın и соавт. отмечено, что среди 268 пациентов с нелакунарным инсультом гипергликемия при поступлении в стационар отрицательно коррелировала со степенью улучшения неврологического статуса в первые 24 часа у пациентов с успешной реперфузией после введения рекомбинантного тканевого активатора плазминогена (recombinant tissue plasminogen activator – rt-PA), но не у больных, у которых реперфузия отсутствовала [25]. Вероятно, негативное влияние гипергликемии на размер инфаркта может быть связано с тем, происходит реперфузия или нет. Однако A. Bruno и соавт. показали, что более высокие уровни гликемии были связаны с меньшей вероятностью улучшения неврологического статуса и высоким риском симптоматического внутримозгового кровоизлияния независимо от лечения rt-PA [26].
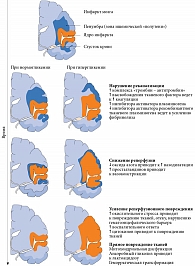
Механизмы неблагоприятного воздействия гипергликемии при ишемическом инсульте могут включать нарушение реканализации и увеличение реперфузионного повреждения (рис. 2) [27]. Связь между гипергликемией и неблагоприятным исходом после инсульта более выражена при крупных инфарктах головного мозга и менее – при лакунарном инсульте [28]. Возможно, это следствие того, что гипергликемия снижает вероятность сохранения жизнеспособности клеток ишемической «полутени», ишемизированной зоны, которая потенциально способна восстановиться в случае адекватной реперфузии через несколько часов после начала инсульта. При лакунарном инсульте «полутени» обычно нет.
Отрицательное влияние гипергликемии на исход инсульта обусловливает необходимость приема сахароснижающих препаратов в острой фазе. Результаты ранних исследований продемонстрировали, что интенсивная инсулинотерапия оказывает положительный эффект у тяжелобольных пациентов с гипергликемией (без инсульта) [29]. Результаты более поздних исследований не подтвердили этот вывод. В исследовании NICE-SUGAR (Normoglycaemia in Intensive Care Evaluation and Survival Using Glucose Algorithm Regulation – оценка нормогликемии при интенсивной терапии и выживания при использовании алгоритма регуляции уровня глюкозы) показано, что интенсивный контроль уровня глюкозы в крови повышает смертность среди взрослых пациентов. Авторы отмечают, что показатели смертности снижаются при уровне глюкозы в крови 180 мг/дл или менее и повышаются при уровне клюкозы 81–108 мг/дл [30]. Кроме того, интенсивную терапию сахароснижающими препаратами связывают с высоким риском развития тяжелой гипогликемии [31].
Доказательств, что снижение уровня глюкозы улучшает клинические исходы у пациентов с острым инсультом, пока нет. В исследовании GIST-UK (UK Glucose Insulin Stroke Trial – британское исследование глюкозы и инсулина при инсульте) у пациентов, рандомизированных в группу терапии глюкозой, калием, инсулином в переменной дозе, в первые 24 часа после инсульта отмечено статистически значимое снижение уровня глюкозы в плазме и систолического артериального давления. Однако значимого снижения показателей смертности в течение 90 дней по сравнению с контрольной группой не выявлено. Необходимо отметить, что исследование отличалось недостаточной масштабностью, более 20% пациентов перенесли лакунарный инсульт, а уровень глюкозы в крови во время 24-часового периода терапии в группе интенсивной терапии был только на 0,57 ммоль/л ниже [32].
В пилотном исследовании A. Bruno и соавт. пациенты были рандомизированы на две группы: группу интенсивной терапии инсулином (целевой уровень глюкозы – 7,2 ммоль/л) и группу стандартной терапии инсулином (целевой уровень глюкозы – 11,1 ммоль/л). Клинические исходы оказались лучше у пациентов, получавших интенсивный курс терапии инсулином, хотя различия между группами не были значимыми [33]. В настоящее время проводится исследование III фазы SHINE (Stroke Hyperglycemia Insulin Network Effort – сетевое исследование инсульта, гипергликемии и инсулина). Его результаты помогут сравнить стандартный контроль гликемии с интенсивным контролем гликемии у гипергликемических пациентов с острым ишемическим инсультом [34].
Подходы к лечению для профилактики или уменьшения тяжести когнитивных нарушений
На сегодняшний день специфические фармакологические методы лечения и профилактики когнитивных нарушений у больных СД отсутствуют, поэтому особое внимание уделяется строгому контролю сосудистых факторов риска с целью замедления прогрессирования когнитивного дефицита. Показано, что гипотензивная терапия уменьшает риск развития деменции в общей популяции, хотя результаты рандомизированных контролируемых исследований не вполне убедительны [35]. В исследовании PROGRESS (Perindopril pROtection aGainst REcurrent Stroke Study – исследование профилактики повторного инсульта при применении периндоприла) у 6105 пациентов с перенесенным инсультом или транзиторной ишемической атакой когнитивные функции были значимо меньше снижены на фоне применения периндоприла (в виде монотерапии или с индапамидом), чем у пациентов на фоне приема плацебо, и отмечено несущественное снижение частоты деменции [36].
В исследовании HYVET-COG (Hypertension in the Very Elderly Trial Cognitive function assessment – артериальная гипертензия в исследовании когнитивной функции у пациентов старческого возраста) прием индапамида в сочетании с периндоприлом или без него оказал незначительное влияние на риск развития деменции – ОР составил 0,86 (95% ДИ 0,67–1,09) [37]. Другие исследования не продемонстрировали влияния гипотензивной терапии на когнитивные функции или риск развития деменции [38, 39]. Эффективность гиполипидемической терапии в отношении снижения когнитивных функций также не доказана. Показано отсутствие эффекта при применении симвастатина [40] или правастатина [41]. Некоторые методологические недостатки могли помешать продемонстрировать уменьшение когнитивных нарушений при воздействии на факторы сосудистого риска (включение больных молодого возраста с низкой частотой когнитивных нарушений, недостаточная продолжительность последующего наблюдения, высокий уровень отсева из-за когнитивных нарушений) и дополнительные воздействия на факторы риска в группе плацебо и контрольной группе [35].
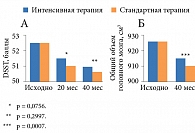
Неоднозначные данные получены и при анализе связи между жестким контролем гликемии у больных СД и когнитивными функциями. Одни исследования показали преимущество интенсивного контроля гликемии для когнитивных функций [42, 43], другие не продемонстрировали различий [44]. В исследовании ADDITION (Anglo-Danish-Dutch Study of Intensive Treatment in People with Screen-Detected Diabetes in Primary Care – англо-датско-голландское исследование интенсивной терапии у пациентов с выявленным при скрининге сахарным диабетом в учреждениях первичной медицинской помощи) выраженность когнитивных нарушений у пациентов с впервые выявленным при скрининге СД 2 типа через шесть лет наблюдения не различалась в группах интенсивного многофакторного и стандартного лечения [45]. Кроме того, когнитивные нарушения в обеих группах соответствовали таковым в контрольной группе (участники без СД). В самом крупном на сегодняшний день исследовании ACCORD-MIND (Action to Control Cardiovascular Risk in Diabetes – Memory in Diabetes – мероприятия по контролю сердечно-сосудистого риска у пациентов с сахарным диабетом – память при сахарном диабете) когнитивная функция за 40 месяцев наблюдения не улучшилась на фоне интенсивного гликемического контроля (HbA1с – 6,0%) по сравнению со стандартным (HbA1c – 7,0–7,9%) [46]. Тем не менее уменьшение объема мозга было значимо ниже в группе пациентов, получавших интенсивную терапию (рис. 3).
Структурные изменения в головном мозге могут начаться до того, как когнитивные различия между группами станут очевидными, и, следовательно, могут потребоваться долгосрочные наблюдения для выявления преимуществ более интенсивного контроля гликемии. Кроме того, было высказано предположение, что в среднем основные когнитивные функции остаются относительно стабильными в течение длительного периода в обеих группах, что ограничивает возможности терапии [6]. Тем не менее, учитывая высокую смертность у пациентов при интенсивной терапии, строгий контроль гликемии с целью уменьшения влияния СД на головной мозг не рекомендуется. Тяжелые гипогликемические эпизоды в анамнезе связаны с более выраженной деменцией, поэтому важно сопоставлять преимущества жесткого контроля гликемии и более высокий риск гипогликемии [47].
Эффективность пероральных противодиабетических препаратов для профилактики и лечения когнитивных нарушений сосудистой природы требует уточнения. Первоначально некоторые исследования позволили предположить, что тиазолидиндионы положительно влияют на когнитивные функции у пациентов с БА [48]. Однако крупные, более надежные исследования росиглитазона не продемонстрировали положительных результатов в этом отношении [49]. Данные исследования ACCORD-MIND показали, что терапия росиглитазоном связана с более быстрым снижением когнитивных функций после 40 месяцев [50], хотя эти результаты, возможно, были искажены различиями между пациентами. Не наблюдалось также связи между использованием инсулина и состоянием когнитивных функций. Терапия метформином сопровождалась накоплением амилоидных пептидов в нейронных культурах. Это указывает на возможность ускоренного развития клинических проявлений БА у пациентов с СД 2 типа на фоне приема данного препарата [51]. В недавнем ретроспективном исследовании использование метформина было связано с ухудшением когнитивных функций у больных СД [52]. В то же время исследования у животных показали, что метформин может уменьшать биохимические изменения, подобные изменениям при БА [53].
До сих пор не существует препарата, одобренного для лечения сосудистой деменции. Терапия БА такими препаратами, как ингибиторы холинэстеразы, донепезил и галантамин, сопровождалась некоторым улучшением когнитивной функции в клинических испытаниях, но воздействие на общее состояние и функционирование было менее очевидным [54, 55]. Не было отмечено очевидного положительного эффекта антагонистов N-метил-D-аспартатных рецепторов (например, мемантина) при сосудистой деменции. Незначительные когнитивные улучшения у некоторых пациентов при таком лечении могут быть результатом одновременного влияния на БА [56].
Плейотропные препараты с мультимодальными механизмами действия (например, церебролизин) обладают определенными положительными эффектами, хотя эти данные требуют подтверждения [57].
Еще одним препаратом с плейотропным нейропротективным и метаболическим влиянием является Актовегин. Эффекты Актовегина включают повышение поглощения и утилизации кислорода, улучшение метаболизма глюкозы и выживаемости нейронов, ингибирование поли(АДФ-рибоза)-полимеразной активности, уменьшение окислительного стресса, активацию ядерного фактора каппа-B (nuclear factor kappa B – NF-kappa B) и снижение апоптоза [58]. В рандомизированном двойном слепом плацебоконтролируемом исследовании у 567 пациентов прием Актовегина приводил к уменьшению симптомов диабетической полинейропатии [59]. Другие исследования позволили предположить, что Актовегин оказывает положительное влияние на когнитивные функции. Этот эффект Актовегина в настоящее время исследуется в рандомизированном контролируемом испытании [60]. Учитывая плейотропное нейропротективное и метаболическое действие препарата, необходимо исследовать влияние Актовегина на когнитивную функцию у больных СД.
Заключение
Актуальность проблемы когнитивных нарушений и деменции у больных СД возрастает. В настоящее время нет специфичных методов лечения когнитивных нарушений или профилактики дальнейшего снижения когнитивных функций в общей популяции или только у пациентов с СД. Для снижения риска развития и прогрессирования когнитивных нарушений у больных СД могут потребоваться индивидуализированные мультимодальные подходы к терапии. Использование плейотропных препаратов способно сыграть определенную роль в лечении когнитивных нарушений у данной категории больных, поэтому требуется дальнейшее их исследование в популяции больных СД.
Благодарность. В настоящем обзоре обобщены выступления и доклады экспертов на совещании, которое состоялось в Мюнхене (2012) при поддержке компании Takeda Pharmaceuticals International GmbH. Спонсор предоставил финансовую поддержку Энди Бонд из Spirit Medical Communications, чтобы составить проект этого обзора и определить его автора-координатора. За окончательный вариант статьи полностью ответственны указанные авторы.
Открытый доступ. Эта статья распространяется в соответствии с лицензией Creative Commons Attribution, которая позволяет ее любое использование, распространение и воспроизведение при условии, что автор(ы) оригинала и источник упоминаются.
* Переведено и опубликовано с разрешения правообладателя. Оригинал опубликован в Neurol. Sci. 2014. Vol. 35. № 7. P. 995–1001.
N.M. Bornstein, A. Korczyn, M. Brainin, A. Guekht, I. Skoog
Department of Neurology, Tel Aviv Medical School, Tel Aviv University
Department of Clinical Neurosciences and Preventive Medicine, Danube University Krems
Department of Neurology and Neurosurgery, Russian National Research Medical University, Moscow City Hospital № 8 for Neuropsychiatry
Sahlgrenska Academy, University of Gothenburg
Contact person: Amos Korczyn, amoskor@tau.ac.il
Abstract Diabetes mellitus (DM) is associated with an increased risk of mild cognitive impairment, dementia and stroke. The association between DM and dementia appears to be stronger for vascular cognitive impairment than forAlzheimer’s disease, suggesting cerebrovascular disease may be an important factor in cognitive impairment in DM. Although the exact mechanisms by which DM affects the brain remain unclear, changes to brain vasculature, disturbances of cerebral insulin signaling, insulin resistance, glucose toxicity, oxidative stress, accumulation of advanced glycation end products, hypoglycemic episodes, and alterations in amyloid metabolism may all be involved. Cognitive impairment and dementia associated with DM may also be mediated via vascular risk factors, in particular brain ischemia, the occurrence of which can have an additive or synergistic effect with concomitant neurodegenerative processes. To date, no drug has been approved for the treatment of vascular dementia and there are no specific pharmacological treatments for preventing or reducing cognitive decline in patients with DM. Most focus has been on tighter management of vascular risk factors, although evidence of reduced cognitive decline through reducing blood pressure, lipid-lowering or tighter glycemic control is inconclusive. Tailored, multimodal therapies may be required to reduce the risk of cognitive dysfunction and decline in patients with DM. The use of pleiotropic drugs with multimodal mechanisms of action (e.g., cerebrolysin, Actovegin) may have a role in the treatment of cognitive dysfunction and their use may warrant further investigation in diabetic populations.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.