Диабетическая нефропатия. Фокус на раннюю диагностику и терапию
- Аннотация
- Статья
- Ссылки
- English





![Таблица 6. Фармакологические эффекты сулодексида (Вессел Дуэ Ф) [19]](/upload/resize_cache/iblock/fb9/195_350_1/vesselduo_tab6.jpg)
Согласно данным Международной диабетической федерации (International Diabetes Federation – IDF), в 2013 г. в мире сахарным диабетом (СД) страдали более 382 млн человек, 85–95% из них – СД типа 2 (СД 2). Это составляет около 8,3% взрослого населения. По прогнозам Всемирной организации здравоохранения к 2030 г. количество больных удвоится и достигнет 582 млн [1, 2]. Следовательно, те или иные нарушения углеводного обмена будет иметь каждый десятый житель планеты.
Неблагоприятный прогноз у больных СД 2 обусловлен преимущественно развитием макро- и микрососудистых осложнений, которые выявляются уже на момент верификации диагноза. Принимая во внимание вышесказанное, а также сочетание и взаимное отягощение макро- и микрососудистых осложнений, одним из приоритетных направлений здравоохранения сегодня является профилактика осложнений, их раннее выявление и лечение.
Одно из наиболее серьезных осложнений СД – диабетическая нефропатия (ДН) [3]. С одной стороны, указанное состояние является осложнением СД, а с другой – может рассматриваться как хроническая болезнь почек (ХБП). Сочетание СД и ХБП вносит определенные коррективы в комплекс лечебных мероприятий.
ХБП – наднозологическое понятие, объединяющее повреждение почек или снижение скорости клубочковой фильтрации (СКФ) менее 60 мл/мин/1,73 м2, персистирующие в течение трех месяцев и более, вне зависимости от первичного диагноза. В 2007 г. этот термин был использован в Международной классификации болезней десятого пересмотра вместо термина «хроническая почечная недостаточность».
При СД выявляют следующие виды почечной патологии:
-
диабетический гломерулосклероз;
-
инфекции мочевых путей;
-
хронический гломерулонефрит;
-
лекарственный нефрит;
-
атеросклеротический стеноз почечных артерий;
-
тубулоинтерстициальный фиброз и др.
Стадия патологии почек определяется по СКФ – показателю, наиболее полно отражающему количество и суммарный объем работы нефронов, в том числе неэкскреторных функций почек (табл. 1) [3].
Для определения СКФ могут быть использованы простые методы расчета клиренса креатинина – формулы Кокрофта – Голта, MDRD (Modification of Diet in Renal Disease), CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration). Указанные методы позволяют обходиться без суточного сбора мочи. Поскольку данные, полученные по формуле CKD-EPI, наиболее точно соотносятся с данными, полученными референтными способами, ее можно рекомендовать для амбулаторной практики. СКФ может быть рассчитана и с помощью калькуляторов, представленных в Интернете [4, 5]. Однако для ее расчета могут потребоваться дополнительные данные, например расовая принадлежность, пол, возраст и уровень креатинина сыворотки, что позволяет избежать влияния на показатели различий в мышечной массе лиц разного возраста и пола, а также ошибки, связанной с активацией канальцевой секреции креатинина на поздних стадиях ХБП. Для определения СКФ у детей применяют формулы Швартца и Коунахана – показатели креатинина и роста. Золотым стандартом измерения СКФ остаются клиренсовые трудоемкие методики, предполагающие введение экзогенного гломерулотропного тест-агента.
Стандартное измерение клиренса эндогенного креатинина (проба Реберга – Тареева) или применение других клиренсовых методов необходимо в следующих случаях [6]:
-
беременность;
-
миодистрофии, миоплегии;
-
индекс массы тела > 40 или < 15 кг/м2;
-
нестандартные размеры тела (ампутированные конечности);
-
параплегия и тетраплегия;
-
острое почечное повреждение;
-
перед назначением нефротоксичных препаратов;
-
вегетарианство;
-
определение начала заместительной почечной терапии;
-
наличие почечного трансплантата и т.д.
Важным показателем для функциональной оценки работы почек считается также уровень экскреции альбумина с мочой. Он отражает системную эндотелиальную дисфункцию, состояние проницаемости гломерулярного барьера и реабсорбционную емкость проксимальных канальцев, то есть является важным показателем функции почек.
Для количественного определения экскреции альбумина с мочой используют радиоиммунные, иммуноферментные и иммунотурбидиметрические методы. Альтернативный метод, не подверженный влиянию гидратации, – измерение соотношения альбумин/креатинин (ал/кр) в нефиксированном по времени произвольном образце мочи. Предпочтительной для исследования является первая утренняя порция мочи, наилучшим образом коррелирующая с 24-часовой экскрецией белка. В настоящее время выделяют три уровня альбуминурии (табл. 2) [4–6].
Необходимо отметить, что возможно преходящее повышение экскреции альбумина:
-
при декомпенсации углеводного обмена;
-
на фоне высокобелковой диеты;
-
после тяжелых физических нагрузок;
-
на фоне лихорадки;
-
при мочевой инфекции;
-
сердечной недостаточности;
-
беременности;
-
активном росте в период пубертата.
У пациентов с СД исследование на наличие микроальбуминурии (МАУ) необходимо проводить в следующем порядке [3, 7]:
1) при СД 1 – через пять лет после дебюта заболевания. Согласно статистике, через пять лет МАУ выявляется у 3–4% пациентов, через десять лет – у 20%, а через 20 лет – у 34% пациентов и более;
2) при СД 2 – при верификации диагноза. По данным эпидемиологических исследований, на момент выявления СД 30–40% больных уже имеют МАУ.
МАУ ассоциируется с 20-кратным повышением риска прогрессирования поражения почек до стадии протеинурии (ПУ). Для установления МАУ необходимо подтверждение в двух из трех анализов мочи, сделанных с интервалом три – шесть месяцев, в отсутствие мочевой инфекции.
ПУ – еще один важный диагностический маркер. Появление даже незначительной ПУ свидетельствует о грубых, подчас необратимых изменениях в почечной ткани.
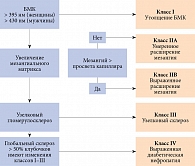
На рис. 1 представлена классификация патологических изменений почек, основанная на морфологическом принципе. В настоящее время выделяют четыре класса поражения почек:
-
класс I – утолщение базальной мембраны и небольшие неспецифические изменения по данным световой микроскопии;
-
класс II – мезангиальная экспансия (умеренная – IIА, выраженная – IIВ) без узелкового склероза или гломерулонефрита более 50% клубочков;
-
класс III – узелковый склероз (синдром Киммельстиля – Вильсона);
-
класс IV – диабетический гломерулосклероз (склероз более 50% клубочков).
У пациентов с СД поражение почек – ДН имеет ряд особенностей:
-
длительное бессимптомное течение;
-
первый доклинический признак – МАУ (с развитием ПУ функция почек снижается);
-
МАУ является маркером повышенной проницаемости эндотелиальных клеток для альбумина и проявлением системного повреждения микрососудистого русла.
Клиническими проявлениями ДН на начальных этапах являются общая слабость, снижение аппетита, головная боль. Такие неспецифические симптомы затрудняют раннюю диагностику патологии.
Таким образом, крайне важно проведение комплекса лабораторных исследований (табл. 3–5), позволяющих выявить различные стадии поражения почек – МАУ, ПУ или почечную недостаточность [3–7].
Необходимо отметить, что МАУ обусловливает и является маркером повышенного риска развития сердечно-сосудистых заболеваний, а также сердечно-сосудистой смерти у больных СД [8–10].
Длительная гипергликемия нарушает равновесие коагуляционных факторов:
-
повышается уровень фибриногена;
-
протромбина 1 и 2 (отражает уровень свободно циркулирующего в кровотоке тромбина);
-
факторов свертывания VII, VIII и vWF;
-
снижается активность антитромбина III.
Все вышеперечисленное инициирует высокий риск сердечно-сосудистых осложнений.
ПУ, как правило, развивается на 10–15-й год СД. Даже незначительная ПУ свидетельствует о наличии грубых, необратимых изменений в почечной ткани. Увеличение ПУ до 3,5 г/сут и более может привести к развитию нефротического синдрома, для которого характерны высокий ПУ, гипоальбуминемия, гиперхолестеринемия и гипоальбуминемические отеки вплоть до анасарки. Частота его развития у больных СД колеблется от 10 до 30%.
Нефротический синдром при СД имеет ряд особенностей:
-
отечность тканей развивается при более высоком уровне альбумина крови, чем у больных с первично-почечными заболеваниями;
-
высокая ПУ сохраняется даже на стадии ХПН, в то время как у больных с первичными гломерулонефритами при развитии ХПН она снижается;
-
отечный синдром резистентен к лечению диуретиками;
-
ПУ при ДН носит, как правило, изолированный характер, то есть не сопровождается измененным осадком мочи (микрогематурия, лейкоцитурия).
Тяжелая стадия ДН характеризуется быстрым подъемом уровня артериального давления (АД). С момента развития ПУ уровень АД в среднем повышается на 7% в год и отмечается приблизительно у 80–90% больных. Патологический процесс в почках теряет зависимость от уровня гипергликемии, поскольку отсутствует корреляция между темпом снижения СКФ и уровнем гликированного гемоглобина (HbA1с). Протеинурическая стадия ДН характеризуется нарастанием тяжести и других микро- и макрососудистых осложнений СД: ретинопатии, нейропатии, ишемической болезни сердца (ИБС). Частота ретинопатии у пациентов с ПУ достигает практически 100%. При этом в 70% случаев выявляются наиболее тяжелые стадии – препролиферативная и пролиферативная, влекущие за собой потерю зрения.
В ряде клинических исследований приводятся доказательства обратимости поражения почек у пациентов с СД на стадии МАУ [11, 12].
При СД важную роль в развитии ДН играют метаболические нарушения. Так, гипергликемия инициирует в почках изменения структурного характера: повышается образование и накопление мезангиального матрикса (коллагенов, фибронектина и др.) в клубочках с гиперпродукцией профибриногенных факторов роста. Это приводит к утолщению базальной мембраны клубочков (БМК), а также увеличению объема мезангия. Гипергликемия также способствует развитию внутриклубочковой гипертензии, гликированию белков БМК, нарушению синтеза гликозаминогликанов (ГАГ), которые обеспечивают селективную проницаемость почек, а также изменению зарядоселективности базальной мембраны [13, 14].
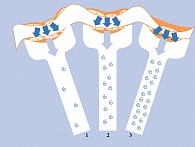
При СД основной проблемой считается поломка на уровне БМК [15, 16]. Так, согласно гипотезе Стено в условиях гипергликемии снижается активность N-деацетилаз. У крыс с стрептоциновым СД и МАУ активность перекисного окисления липидов была резко повышена в клетках канальцев, а не клубочков. Таким образом, реабсорбция белка проксимальными канальцами снижалась (рис. 2). Следовательно, основной биохимической поломкой БМК при СД является нарушение синтеза гепарансульфата (ГС) протеогликана. Это в свою очередь ведет к потере отрицательной заряженности БМК и развитию МАУ [17].
Таким образом, длительный оптимальный контроль гликемии является основополагающим. Это позволит предупредить и/или замедлить развитие осложнений СД. При этом важной составляющей патогенетического лечения ДН является терапия, направленная на коррекцию дисфункции эндотелия и структурных изменений гликокаликса и БМК почек с восстановлением уровня ГС [18], основного ГАГ в составе протеогликанов БМК.
Нефропротективная терапия в настоящее время представлена препаратами группы ГАГ с высоким тропизмом к сосудистой стенке, что является патогенетически обоснованным. Именно поэтому препараты данной группы включены в стандарты терапии ДН.
Общими рекомендациями для лечения МАУ, ХБП стадий 1–3 и ПУ, ХБП стадий 1–3 у больных СД являются [7]:
-
длительное и стабильное достижение целевых значений гликемии, АД и нормальных показателей липидограммы;
-
применение ингибиторов ангиотензинпревращающего фермента или блокаторов рецепторов ангиотензина;
-
коррекция анемии;
-
исключение или снижение приема препаратов, обладающих нефротоксическим действием;
-
применение ГАГ.
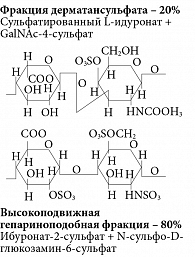
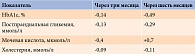
Среди препаратов ГАГ самая большая доказательная база собрана в отношении сулодексида (Вессел Дуэ Ф, компания «Альфа Вассерманн», Италия). Основные фармакологические эффекты препарата представлены в табл. 6 [19]. Многоплановость влияния сулодексида связана с двумя компонентами – быстродействующей среднемолекулярной гепариноподобной и дерматановой фракциями (рис. 3).
Эффективность и безопасность применения сулодексида была подтверждена результатами клинических исследований [20].
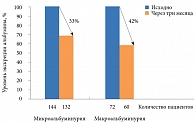
Данные многоцентрового исследования DAVET (31 исследовательская группа) также подтвердили эффективность применения cулодексида у пациентов с СД 1 и 2 [21]. 216 пациентов принимали сулодексид в капсулах по 250 ЛЕ два раза в cутки на фоне стандартной сахароснижающей терапии (пероральных сахароснижающих препаратов – пациенты с СД 2 и инсулина – пациенты с СД 1). Участники также получали антигипертензивные и гиполипидемические препараты. В данной работе применение препарата пролонгировалось: промежуточная точка наблюдения – три месяца, конечная – шесть. Через три месяца терапии отмечена положительная динамика в отношении проявлений ДН (статистически достоверное снижение (р < 0,0001)). Микроальбуминурия снизилась на 33%, макроальбуминурия – на 42% (рис. 4).
При этом положительная динамика была достигнута при применении капсулированной формы, что позволяет более широко использовать препарат в амбулаторной практике.
Положительная динамика наблюдалась в отношении таких показателей, как постпрандиальная гликемия, HbA1c, мочевая кислота (табл. 7)
Интерес представляют результаты исследования с участием 86 пациентов с СД 2 и ДН, опубликованные в 2015 г. [22]. На фоне терапии у пациентов была достигнута нормоальбуминурия, а также незначительная положительная динамика показателей гликемии и липидограммы. Серьезных побочных явлений отмечено не было.
Нефропротективное действие сулодексида заключается:
-
в восстановлении зарядоселективности БМК;
-
целостности и нормальной проницаемости БМК;
-
уменьшении нефросклероза (снижение синтеза межклеточного вещества).
Учитывая прогрессирующее течение СД, представляется крайне важным наличие у препаратов плейотропных эффектов. Таковыми у Вессел Дуэ Ф являются:
-
антитромботический – действует на гемостаз, фибринолиз, агрегацию тромбоцитов;
-
ангиопротективный – восстанавливает отрицательный заряд клеток эндотелия и функции базальной мембраны;
-
гемореологический – уменьшает количество фибриногена, триглицеридов, липопротеинов очень низкой плотности.
Таким образом, терапия СД предполагает не только применение современных сахароснижающих препаратов, но и раннее назначение лекарственных средств, оказывающих комплексное (межсистемное) воздействие, что способствует предотвращению развития и/или прогрессирования осложнений [23]. Использование сулодексида (Вессел Дуэ Ф) позволит оптимизировать лечение пациентов с нефропатией диабетического генеза.
Ye.V. Doskina
Russian Medical Academy of Postgraduate Education
Contact person: Yelena Valeryevna Doskina, elena-doskina@rambler.ru
Diaberic nephropathy is among the most serious complications of diabetes mellitus (DM). On one hand, this condition may be considered as a complication of DM, whereas, on the other hand, as a chronic renal disease (CRD). A combination of DM and CRD rises certain problems and makes some adjustments into a complex therapeutic interventions. Therapy of patients with type 1 and type 2 DM expects not only administration of contemporary sugar-lowering drugs, but early use of medicinal agents displaying a combined (inter-systemic) influence, thereby contributing to prevention of developing and/or progressing complications. Among them, sulodexide (Vessel Due F) is considered as one of such medicines for use in patients with type 1 and type 2 DM associated with diabetic nephropathy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


