Диабетическая сенсомоторная нейропатия и диабетическая стопа: новые данные о лечении Актовегином
- Аннотация
- Статья
- Ссылки
Диабетическая невропатия – это клиническое или субклиническое поражение нервной системы, развивающееся на фоне сахарного диабета при отсутствии других причин невропатии. Наибольшее клиническое значение среди всех диабетических невропатий имеет дистальная сенсорная или сенсомоторная нейропатия (ДСН), составляющая 80% клинических случаев.
По данным нового широкомасштабного популяционного обследования, проведенного среди жителей Аугсбурга (Германия) распространенность ДСН в Европе составляет 28% среди лиц больных сахарным диабетом, 13% – с нарушением толерантности к глюкозе, 11,3% – с нарушением гликемии натощак и 7,4% – с нормальной толерантностью к глюкозе (5). Основными факторами риска и прогрессирования нейропатии являются: неудовлетворительная компенсация сахарного диабета, висцеральное ожирение, длительность заболевания и рост. Также определенное значение оказывают артериальная гипертензия, возраст, курение, гипергликемия и дислипидемия (6).
Дистальная сенсомоторная невропатия приводит к повышению порогов «защитной» чувствительности нижних конечностей, что сопровождается высокой подверженностью тканей стопы травмам и развитию безболевых язв стоп и диабетической нейроостеоартропатии (стопы Шарко). Повышение порога вибрационной чувствительности является предиктором образования нейропатических язв стоп – наиболее частой причины госпитализации и ампутации нижних конечностей у больных сахарным диабетом (7).
Боль, связанная с диабетической нейропатией, нарушает сон, сопровождается депрессией и снижает качество жизни. Хроническая нейропатическая боль постоянно беспокоит 16-26% больных сахарным диабетом (8, 9). По данным российского исследования EPIC, невропатические боли при диабетической полиневропатии выявлены у 10% обследованных лиц и по распространенности уступают только болям в спине. Несмотря на этот факт, только 65% пациентов получают лечение в Великобритании, хотя 95% жаловались на боль своим врачам (8). Терапия боли включала антидепрессанты в 43% случаев, противосудорожные препараты в 17,4% случаев, опиоидные аналгетики в 39% и альтернативные препараты в 30% случаев.
В последние 5 лет наши знания в области патогенеза и ведения диабетической нейропатии значительно продвинулись. В настоящее время убедительно показано, что кроме неудовлетворительного контроля глюкозы традиционные сердечно-сосудистые факторы риска являются независимыми факторами риска диабетической и периферической нейропатии. Напротив, факторы риска развития болевой диабетической полинейропатии остаются неизвестными, хотя в исследовании когорты EURODIAB обнаружено, что женский пол может быть независимым фактором риска. Патогенез болевой формы нейропатии также неясен. Получены данные, демонстрирующие различия в эпиневральном кровотоке, микроциркуляции кожи стопы, интраэпидермальной плотности нервных волокон и результатах магнитно-резонансной спектроскопии таламических структур между лицами, страдающими болевой и безболевой формами диабетической нейропатии (3).
Примерно 1% пожилых людей в европейских странах имеют риск развития язвы стопы как проявление осложнения сахарного диабета. Когда к нейропатии присоединяется артериальная недостаточность, риск прогрессирования язвы в гангрену и ампутацию десятикратно увеличивается.
Диабетические язвы стоп при отсутствии заживления в течение длительного времени оказывают негативное влияние на качество жизни, увеличивают риск инфекции и ампутации. Больные сахарным диабетом, сопровождающимся язвенными дефектами стоп, требуют большего внимания и затрат.
Уровень заживления язв варьирует от 24 до 82% после 12 недель лечения. Стандартная помощь состоит из очищения язвы, контроля инфекции, разгрузки стопы и использования повязок, позволяющих осуществлять «влажное заживление» раны. Ответ на лечение в течение первых 4 недель лечения предопределяет прогноз. Если положительная динамика отсутствует в течение 4 недель, то применяется «продвинутое лечение», включающее применение цитокинов, биоэквивалентов кожи, терапию отрицательным давлением (4). Прямая стоимость лечения нейропатических язв стоп до момента заживления составляет около 5000 евро по данным Норвежского исследования (23). При этом стоимость амбулаторного лечения составила 29%, ортопедического обеспечения –28%, госпитализации – 20%, местного лечения – 11%, антибиотиков – 11% и домашнего ухода – 4%. Кроме высокой стоимости отмечается значительная длительность лечения, до момента заживления составляющая 19 (4, 61) недель.
Таким образом, диабетическая периферическая нейропатия является распространенным поздним осложнением сахарного диабета, приводит к развитию как болевой, так и безболевой невропатии с развитием хронических невропатических язв стоп. Данные осложнения значительно снижают качество жизни, сопровождаются высокими затратами на лечение в случае развития невропатической болевой формы невропатии или диабетической стопы и требуют необходимости оказания дорогостоящей междисциплинарной помощи, включая расходы на хирургию, реабилитацию и социальную поддержку в случае развития ограничений жизнедеятельности. Именно поэтому наилучшими перспективами является профилактика, включающая раннее выявление факторов риска, обучение и осуществление комплекса превентивных мероприятий, в том числе применение препаратов, модифицирующих факторы риска.
Лечение нейропатии
Прогрессирование ДСН во многом зависит от тяжести диабета и степени поддержания гликемического контроля во времени (10). В лечении боли применяют различные нелекарственные методы лечения (акупунктура, магнитотерапия, чрескожная электронейростимуляция, массаж и др.), эффективность которых остается недоказанной (11). В настоящее время в лечении нейропатической боли наиболее эффективной является лекарственная терапия. Следует сразу подчеркнуть, что простые анальгетики и нестероидные противовоспалительные препараты в лечении болей при ДСН не рекомендуются из-за их неэффективности и высокой частоты нежелательных явлений при длительном применении (осложнения со стороны ЖКТ, печени и крови). Основными группами препаратов для лечения нейропатической боли при ДСН являются: антидепрессанты, антиконвульсанты, опиоидные анальгетики.
В настоящее время обсуждаетcя возможность патогенетического лечения болевой невропатии.
Роль актовегина в лечении полинейропатии
Актовегин обладает широким спектром действия, оказывая преимущественное влияние на метаболизм клеток, ускоряя захват и потребление глюкозы. Кроме того, Актовегин активирует окислительный метаболизм, смещая баланс в сторону окисленных субстратов, что сопровождается повышением доступности макроэргических фосфатов, таких как АТФ и креатинфосфокиназа.
Исследования на животных показали, что Актовегин является универсальным антигипоксантом, влияя на дыхание митохондрий, повышая выделение кислорода. В различных экспериментах, проводимых на крысах, подтверждено, что Актовегин оказывает защитный эффект при гипоксическом повреждении клеток, что объясняется усилением захвата глюкозы клетками. Причем воздействие Актовегина универсально регистрируется в печени, сердце, головном мозге. Актовегин способен повышать концентрацию АТФ в различных тканях (12,13). Существуют прямые и косвенные доказательства в пользу инсулиноподобного эффекта Актовегина, который опосредуется влиянием фосфоинозитол-сахаридов, являющихся компонентами препарата, на транспорт глюкозы в клетку. Этот эффект осуществляется независимо от действия инсулина (14).
Клинические исследования Актовегина показали его протективный эффект в отношении диабетической невропатии, так как снижение кровотока в эндоневрии и ишемия нерва играют важную роль, наряду с метаболическими нарушениями, вызванными гипергликемией, в патогенезе этого осложнения (15, 16). В современных исследованиях in vivo с использованием свежеприготовленных нейронов крыс показано, что Актовегин повышает длину аксонов и количество синаптических связей нейрона, а также ингибирует апоптоз, путем влияния на активность каспазы-3, основного фермента, способствующего апоптозу (данные в процессе публикации).
В проведенном ранее плацебо-контролируемом клиническом исследовании, включавшем 70 пациентов с диабетической полинейропатией, показано, что Актовегин улучшал скорость нервной проводимости, аллодинию и субъективное самочувствие через 24 недели терапии (17).
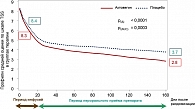
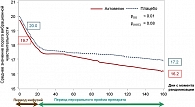
Учитывая длительный опыт работы с Актовегином в России, было проведено обсуждение и предложено проведение первого в мире мультицентрового слепого плацебо-контролируемого исследования по лечению симптоматической полинейропатии Актовегином больных сахарным диабетом типа 2, результаты которого опубликованы в журнале Diabetes Care (18). В исследовании принимали участие 26 исследовательских центров России, Украины и Казахстана под координацией Institute for Clinical Diabetology, German Diabetes Center, Leibniz Institute at the Heinrich Heine University, Düsseldorf, Germany (professor D. Ziegler). Исследование было направлено на оценку эффективности и безопасности терапии Актовегином в дозе 2000 мг/сут. внутривенно однократно в количестве 20 инфузий с последующим назначением препарата внутрь (1800 мг/сут.) в течение 140 дней. В качестве первичных критериев эффективности использовали шкалу общих симптомов (TSS, Total Symptom Score) для нижних конечностей и порог вибрационной чувствительности (VPT – Vibration Perception Threshold), рассчитанные как площадь под кривой (AUC, Area Under the Curve). Вторичные конечные точки включали отдельные симптомы шкалы TSS (стреляющая боль, жгучая боль, парестезия и онемение), оценку по комбинированной шкале нейропатических повреждений для нижних конечностей (NISS-LL, Neuropathy Impairment Score of the Lower Limb) и шкалу качества жизни (SF-36). При терапии Актовегином в сравнении с плацебо отмечалось значительное улучшение по шкале TSS спустя 160 дней по сравнению с исходной точкой (-0,86 балла, р < 0,0001) (рисунок 1). Порог вибрационной чувствительности снижался на 5% (р = 0,0017) более в группе терапии, чем в группе плацебо в оценке по AUC через 160 дней лечения (рисунок 2). В группе Актовегина против плацебо спустя 160 дней значительно улучшалась чувствительность, оцененная по шкале NIS-LL (- 0,25, р = 0,021), и психическое здоровье, оцененное по соответствующему разделу шкалы SF-36. Разницы в частоте нежелательных явлений между группами не было.
Таким образом, терапия Актовегином в виде внутривенных инфузий с последующим переходом на прием внутрь через 160 дней улучшала симптомы нейропатии, порог вибрационной чувствительности, сенсорную функцию и качество жизни у пациентов с сахарным диабетом 2 типа и клиническими проявлениями диабетической полинейропатии (18).
Отмечена эффективность лечения больных сахарным диабетом и нейроишемическим болевым синдромом при периферических ангиопатиях: уменьшение болевого синдрома в ногах, увеличение прогулочного расстояния, улучшение скорости проведения возбуждения по нервам (19). В результате проведенного открытого сравнительного исследования продемонстрировано, что последовательное лечение Актовегином в виде инфузий в дозе 2000 мг в сутки 1 раз в день с переходом на поддерживающий прием Актовегина в таблетках в дозе 1200 мг в сутки в 3 приема в течение 6 недель (всего 8 недель лечения) достоверно увеличивает функциональную способность к ходьбе у больных сахарным диабетом и перемежающей хромотой. При этом достоверно увеличивается время до появления болевых ощущений (PWT, peak walking time) при использовании теста ходьбы на тредмиле (протокол Gardner) и утомляемости в конечностях уже через 2 недели от начала лечения после окончания инфузионного курса и продолжает нарастать после 6 недель курса таблетированного лечения (22). При этом отмечено достоверное улучшение состояния периферических нервов (по шкале NDS, Neuropathy Disability Score).
Проведение пилотных открытых исследований в хирургических клиниках при включении Актовегина в комплекс лечения больных с синдромом диабетической стопы (хронические язвы, гнойно-некротические процессы) позволяют предположить возможность стимуляции процесса заживления язвенных дефектов при лечении Актовегином, что вполне объяснимо с точки зрения патофизиологического воздействия препарата (20, 21).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.