Тиоктацид БВ: анализ последних исследований
- Аннотация
- Статья
- Ссылки

Срок жизни больных СД 2 типа снижен на 5-10 лет. Диагноз этим больным, как правило, устанавливается на 5-7 году заболевания. В это время у 20-30% пациентов уже имеются такие осложнения, как ретинопатия, нефропатия, нейропатия и ангиопатии различной локализации (15).
Диабетическая невропатия (ДНП) является одним из наиболее частых и трудно поддающихся лечению поздних осложнений диабета, считается, что она развивается у 30% больных сахарным диабетом. В отличие от других хронических осложнений сахарного диабета (диабетической ретинопатии и нефропатии) диабетическая невропатия может сопровождаться активной клинической симптоматикой, нередко выраженной, например, развитием болевого синдрома, что значительно ухудшает качество жизни больных. Следует особо подчеркнуть, что до сих пор ДНП плохо диагностируется, только 35% врачей устанавливают правильно диагноз ДНП, поэтому около 50% больных с хронической болевой формой невропатии никогда не получали обезболивающего лечения (16).
В ряде исследований (DCCT, UKPDS) показано, что основным фактором профилактики диабетической невропатии является нормогликемия, однако жесткий контроль уровня сахара крови может сопровождаться значительным увеличением частоты тяжелых гипогликемий. Хорошо известно, что диабетическая невропатия характеризуется наличием признаков неврологического дефицита, которые в свою очередь могут являться пусковыми механизмами для развития язвенных поражений стопы с последующей ее ампутацией. Таким образом, современный вариант терапии должен заключаться в ликвидации симптомов болевой невропатии вместе с уменьшением неврологического дефицита (4). В настоящее время для лечения болевой формы невропатии применяются антидепрессанты, антиконвульсанты и другие препараты, однако все они направлены на снятие симптомов боли без влияния на патогенетические механизмы невропатии. Патогенетическая терапия базируется на воздействии на основные патогенетические компоненты ДПН. В частности, ингибиторы альдозоредуктазы замедляют полиоловый путь обмена глюкозы, снижая тем самым повреждающее воздействие побочных продуктов этого вида обмена на течение ДПН (5, 6). Антиоксиданты, такие как тиоктовая кислота, воздействуют на содержание свободных радикалов и оказывают влияние на оксидативный стресс. Факторы роста нерва предотвращают дефицит нейротрофов и аксонального транспорта (7). Аминогуанидин подавляет гликирование белков нервных окончаний и сосудистой стенки (8). В настоящее время большинство исследований по оценке эффективности того или иного вида патогенетической терапии на течение ДПН либо остановлены из-за развития побочных эффектов, либо не завершены
(10, 11, 12). Исключение составляют работы по эффективности препаратов тиоктовой (альфа-липоевой) кислоты.
Альфа-липоевая кислота (тиоктовая кислота) – естественный коэнзим митохондриального мультиэнзимного комплекса, катализирующего окисление декарбоксилирование альфа-кетокислот, таких как пируват и альфакетоглюторат. Тиоктовая кислота является мощным липофильным антиоксидантом, что определяет возможность терапевтического использования. Вводимая в организм тиоктовая кислота восстанавливается в основном до дигидролипоевой кислоты, которая и обеспечивает основные терапевтические эффекты, за счет действия в качестве ловушки основного свободного радикала-супероксида, формирующего поздние осложнения сахарного диабета. Сама же дигидролипоевая кислота не используется в качестве лекарственного препарата, т.к. при хранении легко окисляется (14).
Экспериментальные исследования на крысах со стрептозотоциновым и наследственным СД показали, что тиоктовая кислота уменьшает перекисное окисление липидов, увеличивает активность сепероксиддисмутазы, улучшает эндоневральный кровоток и скорость распространения возбуждения в седалищном нерве, увеличивает утилизацию глюкозы в кардиомиоцитах, ингибирует развитие катаракты, предотвращает поражение гломерулярного аппарата почек (19, 20).
Альфа-липоевая кислота используется для лечения отравлений металлами и грибами, неалкогольного стеатогепатита, алкогольной полинейропатии, однако наиболее широко и успешно препарат применяется в терапии диабетической полинейропатии (19, 20).
В клинических исследованиях с применением альфа-липоевой кислоты у больных с СД отмечены улучшение состояния микроциркуляции, эндотелийзависимых реакций сосудистой стенки, фильтрационной функции почек и утилизации глюкозы, уменьшение перекисного окисления липидов и нормализация содержания оксида и стресс-белков (21, 22).
Клиническое применение Тиоктацида для лечения диабетической нейропатии началось в 1950-е гг. и до 1980 г. применялись дозы от 30 до 300 мг (как внутривенно, так и перорально). С 1988 по 1995 г. дозы Тиоктацида были увеличены до 400-600 мг. Полученные результаты противоречивы, а для сравнения использовались группы больных, получавших витамины группы В. Создавалось впечатление, что эффективно только внутривенное введение Тиоктацида. Кроме того, не были определены сроки лечения. Для решения этих вопросов были проведены несколько плацебоконтролируемых рандомизированных двойных слепых исследований. Впервые широкую известность препараты тиоктовой кислоты получили после исследования ALADIN 1 (Alpha-Lipoic Acid in Diabetic Neuropathy). У 328 амбулаторных пациентов СД типа 2 была проведена оценка эффективности и безопасности внутривенного введения Тиоктацида (ТИО). Больные были разделены на 4 группы: получавшие ТИО в дозе 100, 600, 1200 мг и плацебо (14 инфузий в течение
3 недель). Основным критерием оценки нейропатии служила шкала ТSS (Total Symptom Score), которая позволяла оценить интенсивность основных позитивных неврологических симптомов, таких как стреляющая боль, жжение, онемение и парастезии. Исследование продемонстрировало, что в дозировке 600 мг/сут в виде внутривенных вливаний тиоктовая кислота приводит к достоверному снижению различных симптомов ДПН, включая боль, парестезии, онемение и т. д., по сравнению с плацебо, кроме того были предложены адекватные критерии оценки диабетической нейропатии, которые затем использовались в дальнейших работах, к ним в частности относится шкала ТSS. Побочные эффекты (головная боль, тошнота, рвота) чаще отмечались на дозе в 1200 мг (13). В исследовании ALADIN II
оценивались эффективность и безопасность продолжительного приема (в течение двух лет) тиоктовой кислоты в пероральном режиме. Таблетки Тиоктацида получали три группы больных: одна группа (18 человек) получали Тиоктацид в дозе 600 мг 2 раза в день, вторая (27 человек) – в дозе 600 мг 1 раз в день, третья группа (20 человек) – плацебо. В этом исследовании не удалось получить четкого ответа на вопрос об эффективности длительного приема препарата, но была доказана безопасность приема тиоктовой кислоты в дозах 600 и 1200 мг. В скором времени должны быть опубликованы данные исследования NATHAN I, в котором изучали динамику NIS и семи электрофизиологических тестов у больных с диабетической нейропатией при лечении таблетками Тиоктацида в течение 4 лет с целью предотвращения или замедления диабетической полинейропатии. В исследовании ALADIN III у двух амбулаторных групп больных СД 2 типа (167 и 174 пациентов соответственно) на первой стадии применялось внутривенное введение тиоктовой кислоты – 600 мг в течение трех недель по сравнению с плацебо, затем пероральный прием 1800 мг в течение 6 месяцев. В данном исследовании продемонстрированы достоверное снижение выраженности нейропатических симптомов при внутривенном введении тиоктовой кислоты и тенденция к улучшению при ее пероральном приеме. Однако данные, полученные при пероральном применении тиоктовой кислоты, не имели достоверных отличий от группы плацебо. Причиной могли быть выраженная вариабельность между центрами в оценке симптомов нейропатии, большое количество исследовательских центров (n = 70). В целом сделано заключение, что при длительном пероральном применении тиоктовой кислоты необходимо оценивать не воздействие на симптомы ДПН, а способность препарата замедлять прогрессирование нейропатии. В единственном исследовании по оценке эффективности тиоктовой кислоты на течение автономной кардиальной нейропатии DEKAN (73 пациента) было продемонстрировано, что ее пероральный прием по 800 мг в сутки в течение четырех месяцев приводит к достоверному уменьшению проявлений этого состояния у больных СД 2 типа по сравнению с плацебо. Интересно отметить, что в исследовании SYDNEY1 (2) было продемонстрировано влияние Тиоктацида 600Т на все 4 главных симптома невропатии, суммированных в шкале ТSS (боль, жжение, парастезии, онемение). Эти результаты имели очень важное значение, потому что такие препараты, как габапентин, карбазепин, трициклические антидепрессанты могут уменьшать либо чувство боли, либо парестезии, но не имеют выраженного эффекта на все 4 главных симптома ДПН. Другим важным моментом в исследовании был факт снижения кардиальных симптомов, а также зафиксировано улучшение признаков неврологического дефицита, оцененного по шкале NIS. Шкала NIS, предложенная профессором П. Диком для клинических исследований, позволяет получить более детальную информацию о виде неврологического нарушения. В этом исследовании принимало участие 120 больных с СД 1 и 2 типа с симптомами нейропатии, которые были разделены на 2 группы: пациенты первой группы получали внутривенно Тиоктацид, вторая группа – плацебо (0,04 мг рибофлавина) в течение 3 недель. Таким образом, было показано, что лечение Тиоктацидом 600Т внутривенно в течение трех недель является эффективным и безопасным. Безопасность препарата была подтверждена отсутствием побочных эффектов по сравнению с плацебо. Затем встал вопрос о продолжительности эффекта от внутривенного введения Тиоктацида 600Т, оказалось, что влияние на неврологические симптомы сохранялось в течение 6 месяцев, а на неврологический дефицит – в течение месяца. Кроме того, известно, что 25% пациентов не отвечают на пероральный препарат, а применение Тиоктацида 600Т внутривенно является более травматичным, чем пероральный прием, и такой вид применения не всегда возможен для работающих диабетиков, пациентов старшей возрастной группы и пациентов с выраженными явлениями ХПН. В связи с этим компания Viatris разработала новую технологию, которая обладает улучшенными параметрами биодоступности таблетированной формы. Эта форма была названа Тиоктацидом БВ, модифицированной лекарственной формой тиоктовой кислоты с улучшенной фармакокинетикой, имеющей ряд преимуществ перед обычной формой. Таблетированная форма Тиоктацида БВ имеет межиндивидуальную вариабельность – всего 22% , по сравнению с предыдущей формой – 59% (18). Перед компанией вновь встал вопрос о возможной эффективной дозировке Тиоктацида БВ, о возможности замены внутривенного введения на таблетированный курс. И, наконец, совсем недавно было проведено исследование SYDNEY II, которое дало ответы на все эти вопросы. Исследование SYDNEY II – мультицентровое, рандомизированное, двойное слепое, плацебоконтролируемое проводилось в 5 центрах (три центра в России и два центра в Израиле). Всего в исследовании принимал участие 181 пациент (1). Первоначально изучалась эффективность при помощи основных шкал TSS и NIS трех разных доз Тиоктацида БВ-600, 1200 и 1800 мг в течение 5 недель основного приема и одной недели приема плацебо, для выявления плацебозависимых пациентов. 45 пациентов получали Тиоктацид БВ в дозе 600 мг, 47 – 1200 мг, 46 пациентов – 1800 мг и 43 пациента получали плацебо в течение всего исследования. В результате
227 пациентов было скринировано, 40 из них имели гликированный гемоглобин выше 10%, 187 пациентов вошли в фазу приема плацебо в течение одной недели, в конце концов, 181 пациент был рандомизирован, 166 пациентов закончили исследование, 12 – имели побочные эффекты, 1 пациент – в группе плацебо, 5 – в группе 1200 мг и 6 – в группе 1800 мг.
Данные значений TSS в начале исследования и через 5 недель исследования представлены в таблице 1.
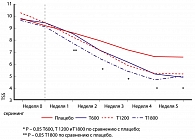
Как видно из таблицы 1, статистически достоверные различия в группах наблюдаются по сравнению с плацебо, общий счет был снижен за счет уменьшения боли и жжения, однако различий между группами нет. Это же подтверждают данные графика 1.
График 1 свидетельствует о том, что было отмечено достоверное снижение TSS во всех группах по сравнению с плацебо, начиная со второй недели, только в группе, принимающей Тиоктацид в дозе 1800 мг, было отмечено снижение TSS уже с первой недели приема. Кроме того, следует отметить, что в ходе исследования было отмечено достоверное снижение значений шкал, отвечающих за неврологический дефицит. Улучшение неврологического статуса было отмечено во всех трех группах, получающих Тиоктацид. Однако, как было отмечено выше, у 11 пациентов, получающих Тиоктацид, были отмечены побочные явления, наиболее частыми из которых явились тошнота и рвота, эти побочные эффекты оказались дозозависимыми (21% – у пациентов на дозе 1200 мг и 48% – на дозе 1800 мг). В этой связи хотелось упомянуть исследование, проведенное в Московском эндокринологическом диспансере. Исследование было открытым рандомизированным с наличием групп сравнения. Первую группу составили 15 больных ДПН, получавших Тиоктацид БВ внутрь по 600 мг три раза в сутки в течение четырех недель; вторую – 15 больных ДПН, получавших Тиоктацид БВ внутрь по 600 мг в сутки в течение трех месяцев. Прием препарата тиоктовой кислоты быстрого высвобождения (Тиоктацид БВ) по 1800 мг в сутки в течение четырех недель или по 600 мг в сутки в течение трех месяцев приводил к достоверному снижению выраженности нейропатических жалоб у больных СД. И прием Тиоктацида БВ по 600 мг три раза в день не приводил к возникновению побочных эффектов (17).
Это исследование продемонстрировало положительный эффект однократного приема Тиоктацида БВ в дозе 600-1800 мг в течение 5 недель. Использование дозы 600 мг в сутки приводит к снижению неврологической симптоматики через
3 недели приема (3), при применении более высоких доз препарата эффект может быть достигнут уже через 1-2 недели приема. Неврологический дефицит снижается при применении как доз 600 мг, так и 1200 мг и 1800 мг.
Остается открытым вопрос о возможности применения Тиоктацида при других осложнениях сахарного диабета. Плацебоконтролируемые исследования о влиянии Тиоктацида на диабетическую ретинопатию и нефропатию отсутствуют. Однако пилотные исследования продолжают проводиться. Такое исследование о влиянии Тиоктацида на диабетическую ретинопатию было проведено в МНТК «Микрохирургии глаза» им. академика С.Н. Федорова. Обследовано 17 пациентов с сахарным диабетом 2 и 1 типа (15/2), в возрасте от 22 до 71 года с длительностью диабета до 15 лет, с уровнем HbAlC 7,5±1,4. У всех пациентов было обследовано не только состояние глазного дна, но и периферическая нейропатия при помощи Шкалы TSS и Thio-Term теста. Все пациенты имели болевую периферическую нейропатию с TSS 8,66±1,2 балла и пролиферативную диабетическую ретинопатию. Обследуемые пациенты получали
1800 мг Тиоктацида БВ в течение 3-х недель. В результате все больные с диабетической пролиферативной ретинопатией не имели ухудшения течения диабетической ретинопатии, при этом был выявлен минимальный относительный риск (1,01) для прогрессирования пролиферативной диабетической ретинопатии на фоне применения Тиоктацида БВ в дозировке
1800 мг в сутки. Состояние нейропатии улучшилось значительно, шкала TSS снизилась до 5,4б±1,4 (р < 0,05) в основном за счет боли и жжения.
В проведенном исследовании были сделаны следующие выводы.
1. Тиоктацид БВ 1800 мг в сутки в течение 3 недель эффективен для лечения диабетической периферической нейропатии.
2. Риска прогрессирования пролиферативной диабетической ретинопатии при применении Тиоктацида БВ в дозе
от 600-1800 мг не отмечается.
В 2008 г. была защищена диссертация Солуяновой Т.А., основанная на данных исследования с применением Тиоктацида БВ. Было еще раз показано, что уменьшение боли происходило со второй недели приема Тиоктацида в суточной дозе
1800 мг, с четвертой недели приема – в дозе 1200 мг, только к пятой недели приема – в дозе 600 мг. Достоверное уменьшение неврологических симптомов в динамике выявлено в группе, принимающей Тиоктацид 600 мг, в группе, использующей Тиоктацид 1800 мг, отмечена тенденция к положительной динамике неврологической симптоматики (по данным миографии). При наличии боли как преобладающего симптома диабетической нейропатии целесообразно начинать лечение с 1800 мг Тиоктацида БВ, учитывая дозозависимый эффект развития побочных явлений, во всех остальных случаях оптимальной остается доза 600 мг в сутки (23).
Очевидно, что выбор режима терапии ДПН с использованием Тиоктацида БВ должен быть индивидуальным и зависеть от конкретной ситуации. Например, при выраженной болевой симптоматике, изнуряющей больного, отсутствии возможности внутривенного лечения можно назначить более короткий по продолжительности курс с достаточно высокой дозировкой препарата (1800 мг/сут в течение четырех недель). Напротив, при симптомах, выраженных не столь ярко, можно отдать предпочтение более длительному курсу с меньшей суточной дозировкой (600 мг/сут). Кроме того, Тиоктацид БВ может с успехом применяться при других осложнениях сахарного диабета без угрозы их дальнейшего прогрессирования.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.