количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Обзоры
Дифференцированное применение ферментных препаратов в лечении хронического панкреатита
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Гастроэнтерология" №1 (13)
- Аннотация
- Статья
- Ссылки
- English
Автором проведен обзор зарубежных и отечественных исследований по применению таблетированных и микронизированных форм ферментных препаратов у больных хроническим панкреатитом. Отмечается, что при легкой степени ферментной недостаточности, а также при выраженных болях наиболее эффективны таблетированные формы с высоким (10 000–20 000 ЕД) содержанием липазы. В лечении экзокринной недостаточности поджелудочной железы рекомендуется использовать микронизированные ферментные препараты.
![Рис. 1. Влияние пищевого протеина на механизм обратного торможения секреции поджелудочной железы [4]](/upload/resize_cache/iblock/a20/195_350_1/a20cc9a1406baf8a517a11ac5578040f.jpg)
Рис. 1. Влияние пищевого протеина на механизм обратного торможения секреции поджелудочной железы [4]

Таблица 1. Рекомендации по подбору дозы полиферментного препарата у больных хроническим панкреатитом в соответствии с данными фекальной эластазы
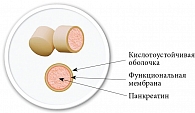
Рис. 2. Строение микротаблетки препарата Пангрол
![Таблица 2. Дозы микрокапсулированного панкреатина для коррекции экзокринной панкреатической недостаточности (рекомендации Немецкой гастроэнтерологической ассоциации) [44]](/upload/resize_cache/iblock/49e/195_350_1/49ea587cfef48e67419b797a70ba497c.jpg)
Таблица 2. Дозы микрокапсулированного панкреатина для коррекции экзокринной панкреатической недостаточности (рекомендации Немецкой гастроэнтерологической ассоциации) [44]
Купирование болей при хроническом панкреатите
Назначение ферментных препаратов при хроническом панкреатите может преследовать две цели:
1) обеспечение функционального покоя органа по механизму обратной связи и купирование болей;
2) коррекцию экзокринной панкреатической недостаточности [1–3].
В ходе многих исследований подтверждено, что панкреатические ферменты, попадая в проксимальные отделы двенадцатиперстной кишки, подавляют стимулированную секрецию поджелудочной железы посредством различных механизмов. В качестве основного механизма, обеспечивающего обратное торможение секреции, рассматривают разрушение трипсином холецистокинин-рилизинг-фактора и последующее снижение выработки холецистокинина [4]. Селективное или генерализованное торможение зависит от дозы вводимых ферментов и может вызываться не только протеиназами, но также липазой и амилазой [5].
Вопрос, в какой степени торможение секреции поджелудочной железы ферментными препаратами влияет на боль при хроническом панкреатите, остается дискуссионным. Долгое время для купирования боли при панкреатите рекомендовали таблетированные ферментные препараты без кишечнорастворимого покрытия в сочетании с блокаторами секреции в течение четырех – шести недель [6–8]. Оценка этих рекомендаций с позиций доказательной медицины [9, 10] показала недостаточное количество рандомизированных контролируемых испытаний по данному вопросу – с одной стороны, противоречивые результаты имеющихся исследований – с другой [11–16].
A. Brown и соавт. (1997) включили в метаанализ шесть проспективных рандомизированных плацебоконтролируемых испытаний с перекрестным дизайном [9]. В двух исследованиях [11, 12] было показано, что применение ферментных препаратов без кишечнорастворимого покрытия приводит к уменьшению болей, в четырех исследованиях [13–16] влияния ферментных препаратов в виде микросфер с кишечнорастворимым покрытием на боль не обнаружили. Проведенный статистический анализ позволил авторам сделать вывод, что ферментные препараты не влияют на боль, связанную с хроническим панкреатитом [9]. Работа была подвергнута резкой критике, поскольку рассматриваемая популяция больных была неоднородной (различная этиология заболевания, разное состояние внешнесекреторной функции поджелудочной железы), использовались разные методы оценки болевого синдрома, для лечения применялись ферментные препараты как с кишечнорастворимым покрытием (микросферы), так и без него (таблетки, гранулы). По мнению L. Somogyi и P. Toskes, метаанализ, проведенный на основании представленных данных, некорректен [17].
В обзоре Американской гастроэнтерологической ассоциации (American Gastroenterological Association – AGA, 1998) также рассматривались вышеупомянутые исследования. Эксперты AGA заключили, что роль ферментов в купировании боли при хроническом панкреатите остается неясной, необходимы дальнейшие исследования. Однако высока вероятность, что терапия ферментами будет полезна [18]. Вышедшее одновременно с обзором позиционное заявление AGA по ведению боли у больных хроническим панкреатитом утвердило положение о рутинном использовании таблетированных ферментов для купирования боли [8].
В обзоре 2009 г. (N.S. Winstead, C.M. Wilcox) [10] рассматривали результаты девяти клинических исследований [11–16, 19–21]. В пяти из них изменение выраженности боли на фоне приема ферментов не наблюдали [13–16, 19], в четырех отметили достоверное уменьшение болей на фоне компенсации ферментной недостаточности [11, 12, 20, 21]. Детально разбирая достоинства и недостатки каждого исследования, авторы отметили, что вся совокупность приведенных работ не позволяет с определенностью сказать, способны ли ферменты купировать боль. Тем не менее авторы, формулируя практические рекомендации, подтвердили положения AGA (1998) об использовании таблетированных ферментных препаратов без кишечнорастворимого покрытия (Viokase 16 или дженерики, предполагаемая доза 12 таблеток в сутки во время еды) в сочетании с кислотосупрессивной терапией. Применение ферментных препаратов с кишечнорастворимым покрытием для купирования болей было признано нецелесообразным [10].
На сегодняшний день в рекомендациях ряда зарубежных ассоциаций осталось положение о пробной терапии высокими дозами ферментов поджелудочной железы (в форме таблеток без защитной оболочки) продолжительностью до шести недель для купирования болей [8, 10, 22]. Итальянские гастроэнтерологи (2010) не приветствуют применение панкреатических ферментов для уменьшения частоты и тяжести рецидивов боли [23]. Рекомендации немецких гастроэнтерологов (2013) ориентируют на применение ферментных препаратов для коррекции экзокринной недостаточности и симптомов, ассоциированных с ней. При этом указывается на возможность эмпирического четырех-шести-недельного лечения ферментными препаратами при «неясных или сомнительных симптомах» [24]. В проекте рекомендаций Российской гастроэнтерологической ассоциации по диагностике и лечению хронического панкреатита (2013) при отсутствии эффекта от приема простых аналгетиков указана возможность «пробного шестинедельного лечения высокими дозами ферментов поджелудочной железы: минитаблетки/мини-микросферы в сочетании с антисекреторными препаратами (ингибиторами протонной помпы)» [25].
Таким образом, в настоящее время высказываются различные точки зрения о влиянии ферментных препаратов на боль при хроническом панкреатите: от полного отрицания до возможности использования минитаблеток/мини-микросфер в энтеросолюбильной оболочке в сочетании с ингибиторами протонной помпы для купирования боли.
Первоначальные исследования показали, что таблетированные ферментные препараты без кишечнорастворимого покрытия уменьшают боль в отличие от микронизированных форм в энтеросолюбильной оболочке, эффект которых был сравним с таковым плацебо. Это связывали с тем, что высвобождение ферментов (в первую очередь протеаз) в двенадцатиперстной кишке наблюдается при использовании таблетированных препаратов без кишечнорастворимого покрытия. В свою очередь наличие энтеросолюбильной оболочки у мини-микросфер приводит к тому, что ферменты высвобождаются в нижних отделах – тонкой и тощей кишке и поэтому не оказывают влияния на боль [26–29]. Данной точки зрения специалисты придерживаются и сегодня [30].
Не исключено, что причина более высокой эффективности препаратов без энтеросолюбильной оболочки заключается в том, что они представлены таблетированными формами. Благодаря максимальной площади соприкосновения и одновременному пассажу с химусом мини-микросфер ферменты, содержащиеся в них, максимально полно и быстро вступают во взаимодействие с пищей. При этом протеиназы, равномерно распределенные в химусе, активно задействованы в гидролизе пищевого белка, что существенно уменьшает (если не устраняет) возможность их контакта с холецистокинин-рилизинг-пептидом с последующим каскадом реакций, приводящих к уменьшению или купированию болей.
Значение взаимодействия между ферментом и субстратом подчеркивает Г.Ф. Коротько: «Считается, что свободные от связи с субстратом панкреатические протеиназы гидролизуют холецистокинин-рилизинг-пептид в полости двенадцатиперстной кишки, что препятствует высвобождению холецистокинина… Обратное торможение секреции вызывается „избытком“ ферментов относительно их субстратов, влияя на энтероциты и активность протеолитических ферментов» [5].
По мнению C. Owyang, пищевой белок взаимодействует с трипсином, предотвращая инактивацию холецистокинин-рилизинг-пептида. Повышение содержания холецистокинин-рилизинг-пептида в просвете кишки в свою очередь приводит к высвобождению холецистокинина и стимулирует секрецию панкреатических ферментов (рис. 1) [4].
Косвенное подтверждение данному предположению можно найти в ряде клинических исследований. Так, O.J. Rämö и соавт. использовали Панкреазу (микронизированный энтеросолюбильный препарат) в лечении двух групп больных хроническим панкреатитом. В первой группе использовались дозы, рекомендованные производителем (две капсулы во время основных приемов пищи и одна капсула во время перекусов), во второй группе пациенты сами определяли дозу препарата, добиваясь купирования симптомов. Срок лечения составлял четыре недели, проводили оценку боли (по трехбалльной шкале) и учитывали количество использованных капсул. Оказалось, что в первой группе среднее потребление Панкреазы составило 5,0 ± 1,3 капсулы, влияния препарата на боль пациенты не отметили, а пациенты второй группы при использовании препарата в дозе 11,4 ± 2,4 капсулы в день наблюдали достоверное уменьшение болей [31]. Таким образом, при избытке фермента относительно субстрата механизм обратной связи начинает действовать.
Е.А. Белоусова и соавт. (2008) показали, что применение Креона в дозе 25 000 ЕД за 20 минут до еды три раза в день наиболее оптимально по сравнению с другими исследованными схемами для снижения интенсивности боли [32]. Объяснением этому факту также может служить фермент-субстратное взаимодействие: в отсутствие субстрата трипсин гидролизирует холецистокинин-рилизинг-пептид, снижается секреция холецистокинина, уменьшается боль.
Трипсин, содержащийся в таблетированном ферментном препарате, не в состоянии сразу и полностью вступить в реакцию с белком пищи в отличие от микронизированных форм. При этом остается трипсин, свободный от взаимодействия с пищевым белком, который инактивирует холецистокинин-рилизинг-пептид. Именно этим можно объяснить тот факт, что при одинаковом содержании протеиназ в таблетированном и микронизированном ферментном препарате влияние таблетированного препарата на болевой синдром более выраженное. Это было продемонстрировано в ряде исследований, проведенных отечественными авторами.
Проводилось изучение клинической эффективности таблетированной (Мезим форте 10 000) и капсулированной микрогранулированной лекарственных форм панкреатина в одинаковых дозах (две таблетки или две капсулы три раза в день) в течение четырех недель лечения у 60 больных хроническим панкреатитом (болевая форма) с умеренными нарушениями экзокринной функции поджелудочной железы. По результатам исследования, таблетированный препарат панкреатина Мезим форте 10 000 достоверно чаще купировал или существенно уменьшал абдоминальную боль при хроническом панкреатите по сравнению с капсулированным микрогранулированным препаратом панкреатина (76,7 и 47% соответственно). Кроме того, Мезим форте 10 000 обеспечивал сравнимую с капсулированным микрогранулированным панкреатином в аналогичной дозировке компенсацию умеренной внешнесекреторной недостаточности функции поджелудочной железы [30].
По другим данным, болевой абдоминальный синдром панкреатического происхождения уменьшался достоверно (р < 0,05) быстрее (в среднем уже к пятым суткам) у больных, принимавших Мезим форте 10 000, чем в группе пациентов, лечившихся капсулированным препаратом панкреатина. Полное купирование болей к десятому дню лечения также достоверно чаще наблюдали в группе больных, получавших Мезим форте (86,7% по сравнению с 66,7%) [33].
Е.И. Ткаченко и соавт. (2007) проводили сравнение эффективности препаратов Мезим форте 10 000 (в дозе две таблетки три раза в день во время еды у 30 больных хроническим панкреатитом) и Креон 10 000 (в дозе две капсулы три раза в день во время еды в течение четырех недель у 15 больных хроническим панкреатитом). Уровень эластазы был достоверно снижен в обеих группах. При оценке динамики показателей качества жизни улучшение таких показателей, как интенсивность боли (Bodily pain, BP), физическое функционирование (Physical functioning, PF), ролевое эмоциональное функционирование (Role-emotional functioning, RE), оказалось достоверно выше (р < 0,05) на фоне лечения препаратом Мезим форте 10 000. Проведенное исследование также показало высокую эффективность препарата Мезим форте 10 000 в коррекции внешнесекреторной недостаточности поджелудочной железы [34].
Приведенные данные показывают преимущество таблетированных форм ферментных препаратов над микронизированными с учетом того, что и те и другие заключены в кислотоустойчивую оболочку. Высвобождение ферментов из кишечнорастворимого покрытия зависит от рН в двенадцатиперстной кишке. Установлено, что у здоровых добровольцев высвобождение трипсина в двенадцатиперстной кишке при использовании энтеросолюбильных мини-микросфер превышало 80% от принятой дозы [35]. По определению у здоровых людей в двенадцатиперстной кишке оптимальные условия для высвобождения ферментов в отличие от больных хроническим панкреатитом, у которых нередко наблюдается ацидификация двенадцатиперстной кишки [36]. При этом высвобождение ферментов происходит в дистальных отделах двенадцатиперстной кишки и ниже. Использование ингибиторов протонной помпы позволяет нормализовать значения рН в двенадцатиперстной кишке и делает наличие или отсутствие энтеросолюбильной оболочки в данной ситуации не столь значимым, поскольку при рН > 5,5 кислотоустойчивая оболочка будет растворяться в проксимальных отделах двенадцатиперстной кишки. Кроме того, антисекреторные препараты, уменьшая продукцию секретина, способствуют созданию «функционального покоя» и оказывают самостоятельный аналгетический эффект при хроническом панкреатите [36].
Следует отметить, что боли при хроническом панкреатите могут быть вызваны:
- воспалением поджелудочной железы (повреждение паренхимы и капсулы, оболочки нервных окончаний);
- повышением давления в протоковой системе;
- ишемией поджелудочной железы (как следствие отека, воспалительной инфильтрации и нарушения микроциркуляции);
- прогрессирующим фиброзом поджелудочной железы со сдавлением нервных образований, закислением двенадцатиперстной кишки;
- осложнениями хронического панкреатита: псевдокисты, стеноз дистального отдела холедоха, стеноз нисходящего отдела двенадцатиперстной кишки, обструкция протоков, тромбоз воротной и селезеночной вен с развитием подпеченочной портальной гипертензии;
- нарушениями моторики кишки вследствие мальдигестии и синдрома избыточного бактериального роста;
- наличием и обострением сопутствующих заболеваний;
- наркотической зависимостью (с наклонностью к спазму сфинктеров).
Разнообразие причин боли свидетельствует о том, что эффекта от проводимой терапии ферментными препаратами можно ожидать далеко не во всех случаях. Расширенное обследование пациентов выявляет состояния, подлежащие эндоскопическому или хирургическому лечению (псевдокисты, стриктуры и др.). Детализация клинических характеристик болевого синдрома далеко не всегда позволяет с уверенностью соотнести имеющийся у больного вариант боли с конкретным патогенетическим механизмом. Определить, нуждается ли пациент в лечении ферментами, можно по типу боли: тип А – короткие эпизоды боли продолжительностью до десяти суток с длительными безболевыми периодами (консервативная терапия); тип В – тяжелые болевые эпизоды, возникающие не реже двух дней в неделю в течение одного-двух месяцев (хирургическое лечение) [37].
Несмотря на существующие противоречия и недостаток доказательной базы, сохранение положения о пробном четырех-шести-недельном лечении больных хроническим панкреатитом для купирования болей ферментными препаратами в сочетании с блокаторами секреции в практических рекомендациях представляется важным и полезным, так как позволяет проводить терапию не только симптоматическую, но и патогенетическую. Таблетированные ферментные препараты по указанным выше причинам, по-видимому, имеют преимущество в купировании болей, в том числе и фармакоэкономическое. Оптимальными в этой ситуации следует считать препараты с высоким содержанием липазы (Мезим форте 10 000, Мезим форте 20 000), поскольку торможение секреции вызывают не только протеазы, но и липаза [5].
По мнению И.В. Маева (2010), «таблетированные формы панкреатина с кишечнорастворимой оболочкой обладают сравнимой клинической эффективностью в лечении умеренных проявлений хронического панкреатита по отношению к капсулированным препаратам, содержащим микросферы панкреатина, и сравнительно более высокой клинической эффективностью в купировании болевого синдрома панкреатического происхождения» [38].
Коррекция экзокринной панкреатической недостаточности
Препаратами выбора для лечения экзокринной недостаточности поджелудочной железы являются микронизированные ферментные препараты (минитаблетки, мини-микросферы, микропеллеты). Они устойчивы к действию соляной кислоты, полностью перемешиваются с химусом и попадают в двенадцатиперстную кишку, где при наличии оптимального рН ферменты высвобождаются из кислотоустойчивой оболочки и восстанавливают нарушенный процесс пищеварения, максимально приближая его к естественному. Этому способствуют и бóльшая (по сравнению с таблетками) площадь соприкосновения, и равномерное распределение панкреатина в химусе.
Эффективность заместительной терапии определяется разными факторами, среди которых наибольшее значение имеет соответствие дозы препарата степени эндокринной недостаточности. В качестве исходного ориентира в выборе дозы могут быть использованы градации экзокринной недостаточности, основанные на результатах определения эластазы кала [39] (табл. 1).
Высвобождение ферментов из кислотоустойчивой оболочки в двенадцатиперстной кишке происходит при условии, что интрадуоденальный рН ≥ 5,5.
Снижение секреции бикарбонатов в два раза приводит к уменьшению рН в двенадцатиперстной кишке до ≤ 3 в постпрандиальном периоде при нормальной желудочной секреции [36]. Следует учитывать, что снижение секреции бикарбонатов возникает раньше ферментной несостоятельности, поэтому применение блокаторов секреции соляной кислоты является оправданным и целесообразным. Это позволяет создать оптимальный рН для высвобождения ферментов в двенадцатиперстной кишке и предотвратить их инактивацию.
В настоящее время на отечественном фармацевтическом рынке появился новый препарат панкреатина Пангрол. Он представлен капсулами, содержащими минитаблетки, которые покрыты кишечнорастворимой оболочкой и инновационной функциональной мембраной (рис. 2). Пангрол изготовлен на основе инновационной технологии инкапсулированных минитаблеток Eurand Minitabs, благодаря которой увеличивается фармацевтическая доступность панкреатина. Наличие функциональной мембраны обеспечивает более полное и равномерное выделение ферментов, при этом высвобождение максимальной дозы липазы выше, чем в других микронизированных препаратах.
Так, высвобождение липазы из Креона, Панцитрата и Пангрола через 30 минут инкубации при рН = 6 происходило в 61,2, 77,1 и 95,6% случаев соответственно [40].
Сравнение динамики прохождения меченых мини-микросфер (1,2 мм) и минитаблеток (2 мм) из желудка в двенадцатиперстную кишку совместно с пищей показало, что разница между ними в отношении гастроинтестинального транзита отсутствует – обе формы эвакуируются одновременно с пищей [41].
Открытое контролируемое рандомизированное перекрестное исследование мини-микросфер и минитаблеток Пангрола у больных хроническим панкреатитом с тяжелой панкреатической недостаточностью показало сходную эффективность используемых препаратов: и в том и в другом случае наблюдали достоверное уменьшение объема фекалий и снижение стеатореи. Содержание жира в фекалиях до лечения составляло 55,1 г/сут. На пятый день лечения минитаблетками в дозе 20 000 ЕД липазы три раза в день оно составило 23,2 г/сут, при использовании мини-микросфер в аналогичной дозе – 22,7 г/сут [42].
В другом исследовании были показаны восстановление уровня сывороточного альбумина и нормализация массы тела у больных после панкреатодуоденальной резекции через 6 месяцев приема Пангрола [43].
Пангрол представлен двумя формами: 10 000 (липаза 10 000 ЕД, амилаза 9000 ЕД, протеазы 500 ЕД) и 25 000 (липаза 25 000 ЕД, амилаза 22 500 ЕД, протеазы 1250 ЕД). Это позволяет адаптировать дозу препарата к количеству принимаемой пищи и в конечном счете повысить приверженность лечению (табл. 2) [44]. Следует отметить, что минитаблетки имеют одинаковый размер – 2 мм. Одна минитаблетка содержит ~ 500 ЕД липазы. При необходимости применения меньших доз препарата (например, у детей) это способствует соблюдению точного режима дозирования.
Заключение
В терапии больных хроническим панкреатитом есть место как таблетированным, так и микронизированным формам ферментных препаратов. При выраженной экзокринной недостаточности поджелудочной железы предпочтение следует отдать минитаблеткам, мини-микросферам, которые следует использовать в адекватных дозах на постоянной основе. При легкой степени ферментной недостаточности, а также для купирования болей с эффектом могут применяться таблетированные формы с высоким (10 000–20 000 ЕД) содержанием липазы.
1. Симаненков В.И., Порошина Е.Г. Дифференцированное применение в клинической практике таблетированных и микронизированных ферментных препаратов // Consilium medicum. Гастроэнтерология. 2011. № 1. С. 83–88.
2. Маев В.И., Казюлин А.Н., Кучерявый Ю.А. Хронический панкреатит. М.: Медицина, 2005.
3. Губергриц Н.Б. Панкреатическая боль. Как помочь больному. М.: Медпрактика-М, 2005.
4. Owyang C. Negative feedback control of exocrine pancreatic secretion: role of cholecystokinin and cholinergic pathway // J. Nutr. 1994. Vol. 124. № 8. P. 1321S–1326S.
5. Коротько Г.Ф. Секреция поджелудочной железы. 2-е доп. изд. Краснодар: Изд-во КГМУ, 2005.
6. Калинин А.В., Хазанов А.И., Сесивцев В.Н. Хронический панкреатит: этиология, лечение и профилактика. Методические рекомендации. М.: Изд-во ГИУВ МО, 1999.
7. Маев И.В. Хронический панкреатит. Учебное пособие. М.: Изд-во ВУМНЦ, 2003.
8. American Gastroenterological Association Medical Position Statement: treatment of pain in chronic pancreatitis // Gastroenterology. 1998. Vol. 115. № 3. P. 763–764.
9. Brown A., Hughes M., Tenner S. et al. Does pancreatic enzyme supplementation reduce pain in patients with chronic pancreatitis: a meta-analysis // Am. J. Gastroenterol. 1997. Vol. 92. № 11. P. 2032–2035.
10. Winstead N.S., Wilcox C.M. Clinical trials of pancreatic enzyme replacement for painful chronic pancreatitis: a review // Pancreatology. 2009. Vol. 9. № 4. P. 344–350.
11. Isaksson G., Ihse I. Pain reduction by an oral pancreatic enzyme preparation in chronic pancreatitis // Dig. Dis. Sci. 1983. Vol. 28. № 2. P. 97–102.
12. Slaff J., Jacobson D., Tillman C.R. et al. Protease-specific suppression of pancreatic exocrine secretion // Gastroenterology. 1984. Vol. 87. № 1. P. 8744–8752.
13. Halgreen H., Pederson N.T., Worning H. Symptomatic effect of pancreatic enzyme therapy in patients with chronic pancreatitis // Scand. J. Gastroenterol. 1986. Vol. 21. № 1. P. 104–108.
14. Mössner J., Secknus R., Meyer J. et al. Treatment of pain with pancreatic extracts in chronic pancreatitis: results of a prospective placebo-controlled multicenter trial // Digestion. 1992. Vol. 53. № 1–2. P. 54–66.
15. Malesci A., Gaia E., Fioretta A. et al. No effect of long-term treatment with pancreatic extract on recurrent abdominal pain in patients with chronic pancreatitis // Scand. J. Gastroenterol. 1995. Vol. 30. № 4. P. 392–398.
16. Larvin M., McMahon M.J., Thomas W.E. et al. Creon (enteric coated pancreatin microspheres) for the treatment of pain in chronic pancreatitis: a double-blind randomised placebo-controlled crossover study // Gastroenterology. 1991. Vol. 100. P. A283.
17. Somogyi L., Toskes P. Can a meta-analysis that mixes apples with oranges be used to demonstrate that pancreatic enzymes do not decrease abdominal pain in patients with chronic pancreatitis? // Am. J. Gastroenterol. 1998. Vol. 93. № 8. P. 1396–1397.
18. Warshaw A.L., Banks P.A., Fernandez-Del Castillo P. AGA technical review: treatment of pain in chronic pancreatitis // Gastroenterology. 1998. Vol. 115. № 3. P. 765–776.
19. Campbell D., Jadunandan I., Curington C. et al. Alcoholic and idiopathic patients with painful chronic pancreatitis do not experience supression of CCK levels or pain relief following treatment with enteric coated pancreatin // Gastroenterology. 1992. Vol. 102. № 4. Pt. 2. P. A259.
20. Czako L., Takács T., Hegyi P. et al. Quality of life assessment after pancreatic enzyme replacement therapy in chronic pancreatitis // Can. J. Gastroenterol. 2003. Vol. 17. № 10. P. 597–603.
21. Kahl S., Zimmermann A., Leodolter B. et al. Quality of life in patients with chronic pancreatitis after medical treatment // Pancreatology. 2001. Vol. 1. № 2. P. 145.
22. Bornman P.C., Botha J.F., Ramos J.M. et al. Guideline for the diagnosis and treatment of chronic pancreatitis // S. Afr. Med. J. 2010. Vol. 100. № 12. Pt. 2. P. 845–860.
23. Frulloni L., Falconi M., Gabbrielli A. et al. Italian consensus guidelines for chronic pancreatitis // Dig. Liver Dis. 2010. Vol. 42. Suppl. 6. P. S381–S406.
24. Mayerle J., Hoffmeister A., Witt H. et al. Chronic pancreatitis: definition, etiology, investigation and treatment // Dtsch. Arztebl. Int. 2013. Vol. 110. № 22. P. 387–393.
25. Ивашкин В.Т., Маев И.В., Шифрин О.С. и др. Рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению хронического панкреатита (проект) // РЖГГК. 2013. Т. 23. № 1. С. 66–87.
26. Guarner L., Rodriguez R., Guarner F. et al. Fate of oral enzymes in pancreatic insufficiency // Gut. 1993. Vol. 34. № 5. P. 708–712.
27. Toskes P.P., Cintron M., Curington C. et al. Delivery of trypsin into the duodenum of chronic pancreatitis patients from conventional pancrealipase versus enteric-coated pancrealipase preparations // Gastroenterology. 1990. Vol. 98. № 5. Pt. 2. P. 237.
28. Dutta S.K., Rubin J., Harvey J. Comparative evaluation of the therapeutic efficacy of a pH-sensitive enteric coated pancreatic enzyme preparation with conventional pancreatic enzyme therapy in the treatment of exocrine pancreatic insufficiency // Gastroenterology. 1983. Vol. 84. № 3. P. 476–482.
29. Dutta S.K., Hubbard V.S., Appler M. Critical examination of therapeutic efficacy of a pH-sensitive enteric-coated pancreatic enzyme preparation in treatment of exocrine pancreatic insufficiency secondary to cystic fibrosis // Dig. Dis. Sci. 1988. Vol. 33. № 10. P. 1237–1244.
30. Шифрин О.С., Ивашкин В.Т. Роль ферментных препаратов в лечении пациентов с болевой формой хронического панкреатита // Клинические перспективы в гастроэнтерологии и гепатологии. 2009. № 3. C. 3–8.
31. Rämö O.J., Puolakkainen P.A., Sepällä K. et al. Self-administration of enzyme substitution in the treatment of exocrine pancreatic insufficiency // Scand. J. Gastroenterol. 1989. Vol. 24. № 6. P. 688–692.
32. Белоусова Е.А., Никитина Н.В., Цодиков Г.В. Оптимизация схем лечения хронического панкреатита ферментными препаратами // Фарматека. 2008. № 13. C. 103–108.
33. Гриневич В.Б., Саблин О.А., Богданов В.Б. Клинические и фармакоэкономические аспекты полиферментной заместительной терапии // Клинические перспективы в гастроэнтерологии и гепатологии. 2004. № 2. С. 16–23.
34. Ткаченко Е.И., Успенский Ю.П., Пахомова И.Г. Терапия экзокринной недостаточности поджелудочной железы у больных хроническим панкреатитом // Справочник поликлинического врача. 2007. № 1. С. 32–37.
35. Vantini I., Fioretta A., Brocco G. et al. Attivita enzimatica nel lume duodenale di un nuovo preparato contente enzimi pancreatici // Ter. Mod. 1987. Vol. 1. P. 145–150.
36. Маев И.В., Кучерявый Ю.А. Желудочное кислотообразование и хронический панкреатит: насколько сильна взаимосвязь? // РЖГГК. 2008. № 3. С. 4–14.
37. Owyang C., DiMagno M.J. Chronic pancreatitis // Textbook of Gastroenterology / Ed. by T. Yamada. 5th ed. Wiley-Blackwell, 2009. P. 1811–1852.
38. Маев И.В., Дичева Д.Т., Кулиева А.К. и др. К вопросу о клиническом применении ферментной терапии: Мезим форте 10 000 // Consilium medicum. Гастроэнтерология. 2010. № 2. С. 54–56.
39. Маев И.В., Вьючнова Е.С., Кучерявый Ю.А. Принципы заместительной ферментной терапии при экзокринной недостаточности поджелудочной железы // Доказательная гастроэнтерология. 2013. № 1. С. 68–74.
40. Böhm R., Kossowicz J., Müller W. Lipase release from pancreatin preparations // Therapiewoche. 1995. Vol. 45. № 33. P. 1949–1950.
41. Meyer J.H., Lake R. Mismatch of duodenal deliveries of dietary fat and pancreatin from enterically coated microspheres // Pancreas. 1997. Vol. 15. № 3. P. 226–235.
42. Lankisch P.G., Lembcke B., Kirchhoff S. et al. Therapy of pancreatogenic steatorrhea. Comparison of 2 acid-protected enzyme preparations // Dtsch. Med. Wochenschr. 1988. Vol. 113. № 1. P. 15–17.
43. Braga M., Zerbi A., Dal Cin S. et al. Postoperative management of patients with total exocrine pancreatic insufficiency // Br. J. Surg. 1990. Vol. 77. № 6. P. 669–672.
44. Layer P., Keller J. Lipase supplementation therapy: standards, alternatives, and perspectives // Pancreas. 2003. Vol. 26. № 1. P. 1–7.
Differentiated administration of enzymes in treatment of chronic pancreatitis
L.V. Maslovsky
Teaching and Research Medical Center of the Department for Presidential Affairs of the Russian Federation, Chair of Gastroenterology
Contact person: Leonid Vitalyevich Maslovsky, lemas3@yandex.ru
International and domestic studies on using tableted and micronized enzymatic preparations in patients with chronic pancreatitis are reviewed in the paper. It was noted that high-dose lipase tablets (10 000–20 000 U) were the most effective when administered in case of mild enzymatic insufficiency and if patient suffers from marked pain. It is recommended to use micronized enzymatic preparations for treatment of exocrine pancreatic insufficiency.
Новости на тему
17.12.2013
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.