количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Обзоры
Место блокаторов желудочной секреции в лечении хронического панкреатита
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Гастроэнтерология" №2 (28)
- Аннотация
- Статья
- Ссылки
- English
Хронический панкреатит – кислотозависимое заболевание: его течение и прогрессирование поддерживает соляная кислота. Закисление двенадцатиперстной кишки, с одной стороны, способствует развитию неэффективности ферментной терапии, с другой – вызывает повышенную стимуляцию деятельности поджелудочной железы, что поддерживает обострение хронического панкреатита и усиливает болевой синдром. Понимание механизмов, лежащих в основе этого явления, позволяет проводить медикаментозную коррекцию и повышать эффективность терапии данного заболевания.
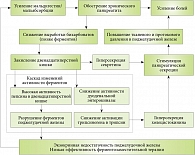
Рис. 1. Влияние закисления двенадцатиперстной кишки на течение хронического панкреатита
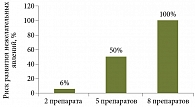
Рис. 2. Риск развития нежелательных явлений при одновременном приеме нескольких лекарственных средств
Физиология и патофизиология секреции поджелудочной железы
Поджелудочная железа в зависимости от объема и вида пищи за сутки вырабатывает 1,5–2,5 л секрета. Выделяют натощаковую (межпищеварительную) и постпрандиальную (послетрапезную) секрецию. Натощак выделяется 0,2–0,3 мл секрета в минуту, после приема пищи – 4,7–5,0 мл/мин. Продолжительность желудочной секреции составляет 3–4 часа.
Эпителий протоков в основном секретирует воду и электролиты (гидрокарбонаты), обеспечивающие панкреатическому секрету щелочной рН (7,5–8,8). Гидрокарбонаты сока поджелудочной железы ощелачивают кислое пищевое содержимое желудка при его эвакуации в двенадцатиперстную кишку, останавливая желудочное пищеварение. При этом инактивируется пепсин, который в условиях кислой среды (рН < 7) начал бы переваривать ферменты панкреатического сока. Щелочная реакция создает оптимальные условия для действия панкреатических и кишечных ферментов [1].
Ацинарные клетки за сутки выделяют в двенадцатиперстную кишку 6–20 г пищеварительных энзимов, гидролизующих белки, липиды и углеводы. Протеолитические ферменты синтезируются и выделяются в полость двенадцатиперстной кишки в неактивной форме в виде трипсиногенов, химотрипсиногенов, прокарбоксипептидаз и проэластаз. В зоне щеточной каемки энтероцитов фиксирована энтерокиназа, которая отщепляет гексапептид от молекулы трипсиногена, превращая его в трипсин. Под действием трипсина в активные формы переходят остальные протеолитические проферменты. Панкреатическая липаза – основной липолитический фермент, расщепляющий пищевые триглицериды, на долю которых приходится 90% всех поступающих в пищу жиров. Липаза действует на поверхности жира: чем больше его поверхность, тем активнее гидролиз. Эмульгирование жира, обеспечиваемое желчными кислотами и их солями, играет важнейшую роль в его переваривании. Большое значение в кишечном липолизе имеет коэнзим секрета поджелудочной железы – колипаза. Она связывается с липазой в присутствии желчных кислот, которые повышают активность липазы и снижают оптимум действия фермента с рН 9 до рН 6–7, то есть до реальных значений рН в начальном отделе тонкой кишки. Колипаза способствует адсорбции липазы на слизистой оболочке тонкой кишки, за счет чего повышается ее активность в зоне щеточной каемки и предотвращается аборальный транспорт в составе химуса [1].
Выделяют три фазы секреции поджелудочной железы. Мозговая фаза имеет сложнорефлекторный механизм. В этой фазе секреция составляет 10–15% от всей постпрандиальной секреции. Основным механизмом стимуляции являются холинергические влияния эфферентов блуждающих нервов на М-холинорецепторы панкреацитов [2]. Желудочная фаза секреции реализуется через два типа ваго-вагальных рефлексов – фундо- и антропанкреатический. При этом выделяется около 10% постпрандиального секрета. Кишечная фаза секреции имеет наиболее сложный механизм, на нее приходится 70–80% объема постпрандиальной секреции. Кишечная фаза реализуется за счет рефлекторного и гуморального механизмов и подразделяется на дуоденальную и подвздошно-ободочную [3]. Основной является дуоденальная фаза: под действием кислоты желудочного содержимого стимулируется большая по объему и количеству секреция гидрокарбоната. Основной стимулятор – секретин. Его высвобождение S-клетками двенадцатиперстной кишки начинается при рН 4,5, а при снижении рН усиливается. Высвободившийся под влиянием нутриентов холецистокинин (ХЦК) паракринно достигает рецепторов вагусных афферентов и реализует стимулирующий ваго-вагальный рефлекс. Поступление ХЦК в кровоток приводит к прямой стимуляции секреции панкреатических ферментов через соответствующие рецепторы ациноцитов. В кишечной фазе выражено взаимное потенцирование эффектов секретина и ХЦК, определяющее максимальный объем секреции [1].
Обратное торможение секреции поджелудочной железы имеет место, когда в просвете двенадцатиперстной кишки возникает избыток ферментов относительно их субстратов. Существует несколько механизмов реализации обратного торможения: холецистокининовый, секретиновый, М-холинергический, В-адренергический и др.
При хроническом панкреатите (ХП) возникает недостаточность секреции бикарбоната, что приводит к чрезмерной ацидификации дуоденального химуса кислым желудочным содержимым. Закисление двенадцатиперстной кишки может стать причиной серьезных нарушений полостного пищеварения с развитием мальдигестии и мальабсорбции. В кислой среде происходит инактивация ферментов поджелудочной железы (при рН < 3,5 инактивация достигает 50%) и разрушение их пепсинами желудочного сока. Кишечное полостное пищеварение зависит не только от секреции ферментов поджелудочной железой, но и от активации трипсиногена энтерокиназой с образованием трипсина и последующей активацией им других протеолитических ферментов. Эти процессы также рН-зависимые. Сбои в данных процессах приводят к нарушению пищеварения, пассажа по тонкой кишке и желчевыделения, к моторным расстройствам желудка. Кроме того, закисление двенадцатиперстной кишки может способствовать преципитации солей желчных кислот, что нарушает эмульгацию жиров и их расщепление липазой с последующим развитием стеатореи и синдрома избыточного бактериального роста.
В этих условиях реакция организма направлена на компенсацию нарушенного пищеварения – происходит стимуляция секреции поджелудочной железы, поскольку под влиянием кислоты выработка секретина продолжается, а нарушенная активация трипсина способствует сохранности ХЦК-рилизинг-фактора и выработке ХЦК. При ХП, когда секреторный потенциал поджелудочной железы снижен, избыточная нагрузка на сохранную паренхиму способна усугубить заболевание и привести к обострению ХП (рис. 1). Таким образом, недостаточность секреции бикарбоната усугубляет ферментную недостаточность (при экзокринной недостаточности поджелудочной железы) или вызывает ее посредством названных механизмов (относительная ферментная недостаточность).
Активация компенсаторных механизмов организма при ХП (гиперсекреция секретина и ХЦК) способствует повышению тканевого и протокового давления в поджелудочной железе и, как следствие, усилению болевого синдрома [4]. Закисление двенадцатиперстной кишки поддерживает развитие данного патологического цикла (рис. 1).
Коррекция ферментной несостоятельности поджелудочной железы ферментными препаратами, в том числе в кишечнорастворимой оболочке, вследствие закисления двенадцатиперстной кишки может быть неполной. Оболочка растворяется при рН ≥ 5,5. При низких значениях рН в двенадцатиперстной кишке экзогенно поступающие ферменты активируются в нижних отделах кишки. При этом разрушения рилизинг-пептидов ХЦК и секретина не происходит, механизм обратного торможения может оказаться несостоятельным. При растворении кишечнорастворимой оболочки ниже двенадцатиперстной кишки активации липазы желчными кислотами и колипазой также не будет. Кроме того, экзогенные ферменты в тонкой кишке подвергаются аутолизу. Как известно, собственные ферменты в составе химуса, поступившего в тощую кишку, имеют 74% амилолитической активности дуоденального содержимого, 22% протеолитической и только 1% липолитической активности. Таким образом, одной из причин низкой эффективности ферментозаместительной терапии может быть закисление двенадцатиперстной кишки.
Нельзя не вспомнить и о дискуссии по поводу влияния (или отсутствия такового) ферментных препаратов на боль у пациентов с ХП. Все рандомизированные исследования, посвященные этому вопросу, проводились без использования препаратов, нейтрализующих соляную кислоту или блокирующих ее продукцию [5–10]. Неоднозначность полученных результатов может быть обусловлена закислением двенадцатиперстной кишки и связанными с ним эффектами.
Диагностика ферментной и бикарбонатной недостаточности поджелудочной железы
Степень выраженности экзокринной недостаточности можно оценить с помощью инвазивных (прямых) тестов – секретинового, секретин-панкреозиминового (церулеинового), теста Лунда. При их использовании собирается секрет поджелудочной железы в базальном состоянии и после стимуляции с последующим определением содержания ферментов и бикарбоната. В настоящее время из-за трудоемкости, высокой стоимости и плохой переносимости пациентами инвазивные тесты ограниченно применяются в диагностике ХП.
В ранних исследованиях, проведенных с помощью секретинового или секретин-панкреозиминового теста, были получены четкие параметры объема и характера секреции поджелудочной железы у здоровых лиц и больных ХП. По данным М.М. Богера (1984), объем секреции и концентрация бикарбоната у больных ХП по сравнению со здоровыми лицами снижены. При этом продукция ферментов может быть как сниженной, так и повышенной. Повышенную концентрацию нередко фиксировали в начальных стадиях развития воспалительно-дистрофического процесса в поджелудочной железе [3]. Это свидетельствует о том, что развитие бикарбонатной недостаточности может опережать развитие ферментной недостаточности.
Результаты изучения внешнесекреторной функции поджелудочной железы с помощью интрадуоденального зондирования после введения солянокислого метионина c последующим забором трех 20-минутных порций панкреатического сока у 120 больных с умеренным или легким обострением ХП показали достоверное снижение количества панкреатического сока и его качественного состава (концентрации и дебита амилазы и бикарбонатов). Амилазу в секрете определяли методом Дж. Вольгемута (J. Wohlgemuth), бикарбонатную щелочность – методом обратного титрования по А.А. Шелагурову. После проведенного комплексного лечения наблюдали увеличение исходно сниженного уровня ферментов до уровня показателей контрольной группы и повышение концентрации бикарбонатов до субнормальных показателей. Отмечены также увеличение скорости и часового напряжения секреции, положительная тенденция роста стимулированного дебита основных компонентов [12]. Таким образом, даже легкое или умеренное обострение ХП сопровождается развитием как ферментной, так и бикарбонатной недостаточности.
Неинвазивные (непрямые) методы (бентираминовый тест, дыхательный тест с 13C-меченными триглицеридами, определение эластазы кала) низкочувствительны в определении ранних стадий внешнесекреторной недостаточности и не позволяют оценить секрецию бикарбоната, поскольку ориентированы исключительно на косвенную оценку выработки ферментов.
Частота выявления внешнесекреторной недостаточности по изучению ферментов зависит от метода определения. Так, по данным О.Н. Минушкина [13], при изучении внешнесекреторной функции поджелудочной железы у 260 больных ХП по эластазному тесту внешнесекреторная недостаточность в период обострения зафиксирована у 76% больных. Этот показатель оказался динамичным, по мере купирования обострения группа со стойкой недостаточностью внешнесекреторной функции поджелудочной железы составила 46%. Однако эластазный тест определяет умеренную и выраженную секреторную недостаточность. Выявление легких степеней – прерогатива прямых методов исследования.
По данным Ю.А. Кучерявого, суточное мониторирование рН желудка и двенадцатиперстной кишки у 81 больного с тяжелой внешнесекреторной недостаточностью поджелудочной железы (эластаза кала < 100 мкг/г) из 92 (88,0%) пациентов на фоне как нормацидности, так и гиперацидности выявило ацидификацию двенадцатиперстной кишки со среднесуточным дуоденальным рН от 1,8 до 4,4. Средний рН в двенадцатиперстной кишке составил 2,7 ± 0,31. У 11 из 92 обследованных отмечена гипоацидность [14].
Представленные данные свидетельствуют о том, что при сохраненной желудочной секреции соляной кислоты и тяжелой внешнесекреторной недостаточности закисление двенадцатиперстной кишки является практически облигатным. Однако и при легкой и умеренной экзокринной недостаточности можно наблюдать снижение выработки бикарбоната, особенно при обострении ХП. В практической деятельности для диагностики данного состояния необходимо проводить суточную рН-метрию желудка и двенадцатиперстной кишки, позволяющую констатировать выраженность и продолжительность закисления двенадцатиперстной кишки и проводить соответствующую медикаментозную коррекцию.
Медикаментозная коррекция закисления двенадцатиперстной кишки
В современных рекомендациях по ведению больных ХП блокаторы желудочной секреции упоминаются в основном как средства, предупреждающие инактивацию ферментов [15–18]. Это одна точка зрения. Другая точка зрения заключается в том, что применение этой группы препаратов имеет самостоятельное значение и патогенетически оправданно. Обсуждается использование Н2-блокаторов гистамина [19, 20] и ингибиторов протонной помпы (ИПП) [21–23]. Так, применение фамотидина в лечении больных острым и хроническим панкреатитом сопровождалось положительной динамикой в купировании болевого синдрома после первых инъекций. По мнению авторов, высокая терапевтическая эффективность фамотидина обусловлена не только подавлением кислой желудочной секреции, но и его выраженными антиоксидантными свойствами [19]. Однако применение Н2-блокаторов гистамина ограничено более низкой эффективностью по сравнению с ИПП, развитием феномена рикошета после отмены, достаточно быстрым снижением антисекреторного действия. Учитывая это, назначение ИПП для кислотоснижающей терапии при лечении ХП предпочтительнее.
Уменьшение боли у пациентов с ХП на фоне приема ИПП отмечено в ряде исследований. По данным И.В. Маева и соавт., введение ИПП в схему комплексного лечения ХП приводит к уменьшению интенсивности и купированию болевого абдоминального синдрома, позволяет раньше отменять анальгетики, устраняет явления гастродуоденита. Уменьшение болевого синдрома может быть объяснено снижением протокового и тканевого давления поджелудочной железы, а также позитивной динамикой сывороточных концентраций про- и противовоспалительных цитокинов, четко коррелирующей с уровнем подавления кислотообразования [21].
Вопрос продолжительности терапии ХП с использованием ИПП нуждается в дополнительном изучении. Приведенные выше данные свидетельствуют о целесообразности использования ИПП в период обострения ХП. В то же время ферментозаместительная терапия больным ХП с выраженной экзокринной недостаточностью показана пожизненно. Очевидно, что восстановление секреции как ферментов, так и бикарбоната у этой категории больных не произойдет. По этой причине им показано проведение суточного рН-мониторирования желудка и двенадцатиперстной кишки и вне обострения ХП. При закислении двенадцатиперстной кишки терапия ИПП должна быть продолжена. Другим основанием для их назначения является сопутствующая гастроэзофагеальная рефлюксная болезнь (ГЭРБ), которая часто встречается у больных ХП [24, 25].
Выбор препарата из группы ИПП представляет определенные сложности в связи с их разнообразием и противоречивыми данными об их сравнительной эффективности. Различия между ними определяются скоростью и продолжительностью кислотоблокирующего эффекта, а также влиянием на метаболизм других препаратов, проходящих через систему цитохрома Р450.
Под действием ИПП протонная помпа инактивируется, но затем ее активность возвращается на прежний уровень [26]. После приема лансопразола полупериод восстановления выработки кислоты составляет 12,9 часа, омепразола и рабепразола – 27,5 часа, а пантопразола – 45,9 часа [27]. Разница в продолжительности ингибирования обусловлена отличиями в длительности сохранения связей ИПП с остатками цистеина АТФазы. Омепразол и остальные препараты взаимодействуют с остатками цистеина в положении 813, лансопразол – с цистеином 321, пантопразол – с цистеином 822. Цистеин 822 обеспечивает устойчивость связывания, поэтому при использовании пантопразола секреция соляной кислоты возобновляется преимущественно из-за синтеза АТФазы, а не из-за разрушения химической связи ИПП с протонной помпой. Таким образом, продолжительность эффекта пантопразола больше по сравнению с таковой других ИПП [28].
Метаболизм всех ИПП происходит в печени при участии цитохрома Р450. Большинство ИПП ингибируют метаболизм многих лекарственных средств, таких как диазепам, фенитоин, варфарин, бета-адреноблокаторы, дигоксин, теофиллин, диклофенак, кларитромицин, клопидогрел и др. [29]. При необходимости сочетанного приема нескольких препаратов целесообразно использовать ИПП с минимальным влиянием на микросомальные ферменты гепатоцитов. Пантопразол по этому показателю превосходит другие ИПП. Полипрагмазия достаточно часто встречается у больных ХП, лечение которых может потребовать применения препаратов самых разных групп. При одновременном приеме двух лекарств риск развития нежелательных явлений, вызванных лекарственными взаимодействиями, достигает 6%, пяти – 50%, восьми – 100% (рис. 2) [30]. Чтобы снизить риск нежелательных последствий (независимо от количества одновременно принимаемых медикаментов), предпочтение следует отдавать препарату с низким потенциалом лекарственного взаимодействия – пантопразолу.
Одним из генерических препаратов пантопразола, представленных на отечественном фармацевтическом рынке, является препарат Панум® (пантопразол) (UNIQUE PHARMACEUTICAL Laboratories, Индия).
Нами оценивались эффективность и безопасность данного препарата в терапии ГЭРБ. Препарат Панум® в дозе 40 мг в сутки продемонстрировал высокую эффективность в лечении больных ГЭРБ 1–4-й степени: полное заживление эрозий в пищеводе к четвертой неделе и исчезновение симптоматики наблюдали в 91% случаев. Лечение препаратом Панум® приводило к достоверному увеличению уровня сывороточного гастрина-17 более чем в два раза. Это косвенно отражает эффективную кислотосупрессию при лечении данным препаратом [31].
Дополнительные преимущества препарата Панум®:
- длительное подавление кислотной продукции, что делает безопасным пропуск очередного приема препарата;
- низкая аффинность к цитохрому Р450, позволяющая эффективно и безопасно проводить необходимую сопутствующую терапию;
- наличие парентеральной формы, что обеспечивает быстрое повышение концентрации препарата в плазме крови и развитие антисекреторного эффекта.
Таким образом, закисление двенадцатиперстной кишки, с одной стороны, способствует развитию неэффективности ферментной терапии, с другой – вызывает повышенную стимуляцию деятельности поджелудочной железы, что поддерживает обострение ХП и усиливает болевой синдром. Блокада желудочной секреции является важной составляющей патогенетической терапии ХП. Продолжительное действие и низкий риск развития лекарственных взаимодействий делают пантопразол препаратом выбора. Одним из препаратов пантопразола с доказанной эффективностью является Панум®.
1. Коротько Г.Ф. Секреция поджелудочной железы. 2-е доп. изд. Краснодар: КГМУ, 2005.
2. Хендерсон Дж.М. Патофизиология органов пищеварения. Пер. с англ. Изд. 2-е. М.–СПб.: Бином, Невский диалект, 1999.
3. Niebergall-Roth E., Kramer H.-J., Radke R. et al. Extrinsic and intrincis innervation of the pancreas mediators of pancreatic exocrine secretion // J. Gastroenterol. 1997. Vol. 2. P. 47–57.
4. Маев И.В., Казюлин А.Н., Кучерявый Ю.А. Хронический панкреатит. М.: Медицина, 2005.
5. Isaksson G., Ihse I. Pain reduction by an oral pancreatic enzyme preparation in chronic pancreatitis // Dig. Dis. Sci. 1983. Vol. 28. № 2. P. 97–102.
6. Slaff J., Jacobson D., Tillman C.R. et al. Protease-specific suppression of pancreatic exocrine secretion // Gastroenterology. 1984. Vol. 87. № 1. P. 44–52.
7. Halgreen H., Pedersen N.T., Worning H. Symptomatic effect of pancreatic enzyme therapy in patients with chronic pancreatitis // Scand. J. Gastroenterol. 1986. Vol. 21. № 1. P. 104–108.
8. Mossner J., Secknus R., Meyer J. et al. Treatment of pain with pancreatic extracts in chronic pancreatitis: results of a prospective placebo-controlled multicenter trial // Digestion. 1992. Vol. 53. № 1–2. P. 54–66.
9. Malesci A., Gaia E., Fioretta A. et al. No effect of long-term treatment with pancreatic extract on recurrent abdominal pain in patients with chronic pancreatitis // Scand. J. Gastroenterol. 1995. Vol. 30. № 4. P. 392–398.
10. Larvin M., McMahon M.J., Thomas W.E.G., Puntis M.C.A. Creon (enteric coated pancreatin microspheres) for the treatment of pain in chronic pancreatitis: a double-blind randomised placebo-controlled crossover study (abstr) // Gastroenterology. 1991. 100:A283.
11. Богер М.М. Панкреатиты. Новосибирск: Наука, 1984.
12. Минушкин О.Н., Максимов В.А. Некоторые спорные вопросы патогенеза и лечения хронического панкреатита. Материалы 8-го съезда Научного общества гастроэнтерологов России со школой Американской гастроэнтерологической ассоциации. М., 2008.
13. Минушкин О.Н. Диагностика и терапия внешнесекреторной недостаточности поджелудочной железы у больных хроническим панкреатитом // www.eurolab.ua/encyclopedia/565/45755/
14. Кучерявый Ю.А. Оценка эффективности комбинированной антисекреторной и полиферментной терапии при хроническом панкреатите с тяжелой внешнесекреторной недостаточностью // Российский журнал гастроэнтерологии, гепатологии и колопроктологии. 2004. Т. 14. № 2. С. 78–83.
15. Frulloni L., Falconi M., Gabbrielli A. et al. Italian consensus guidelines for chronic pancreatitis // Dig. Liver. Dis. 2010. Vol. 42. Suppl. 6. P. S381–406.
16. Bornman P.C., Botha J.F., Ramos J.M. et al. Guideline for the diagnosis and treatment of chronic pancreatitis // S. Afr. Med. J. 2010. Vol. 100. № 12. Pt. 2. P. 845–860.
17. Mayerle J., Hoffmeister A., Werner J. et al. Chronic pancreatitis – definition, etiology, investigation and treatment // Dtsch. Arztebl. Int. 2013. Vol. 110. № 22. P. 387–393.
18. American Gastroenterological Association Medical Position Statement: treatment of pain in chronic pancreatitis // Gastroenterology. 1998. Vol. 115. № 3. P. 763–764.
19. Хомерики Н.М., Хомерики С.Г. Патогенетически обоснованные подходы к лечению панкреатита // Фарматека. 2007. № 13 (147). С. 74–78.
20. Белоусова Е.А., Златкина А.Р., Никулина И.В. и др. Квамател в лечении острого и хронического панкреатита // Клиническая медицина. 2000. № 9. С. 55–57.
21. Маев И.В., Кучерявый Ю.А. Желудочное кислотообразование и хронический панкреатит: насколько сильна взаимосвязь? // Российский журнал гастроэнтерологии, гепатологии и колопроктологии. 2008. № 3. С. 4–14.
22. Минушкин О.Н., Щеголев А.А., Масловский Л.В., Сергеев А.В. Результаты применения препарата ланзап у больных с острым и хроническим панкреатитом // Практикующий врач. 2002. № 1. С. 42–46.
23. Маев И.В., Кучерявый Ю.А., Пирогова А.И., Овсянникова Е.В. Эффективность париета в комплексной терапии обострения хронического панкреатита // Клинические перспективы гастроэнтерологии, гепатологии. 2003. № 3. С. 18–24.
24. Пахомова И.Г. Клинические и терапевтические аспекты сочетанного течения гастроэзофагеальной рефлюксной болезни и хронического панкреатита // Экспериментальная и клиническая гастроэнтерология. 2008. № 6. С. 68–73.
25. Янова О.Б., Машарова А.А. Гастроэзофагеальная рефлюксная болезнь, сочетающаяся с хроническим панкреатитом: особенности течения и лечение больных. Тезисы VI съезда Научного общества гастроэнтерологов России. М., 2006.
26. Gedda K., Scott D., Besancon M. et al. Turnover of the gastric H+,K(+)-adenosine triphosphatase alpha subunit and its effect on inhibition of rat gastric acid secretion // Gastroenterology. 1995. Vol. 109. № 4. P. 1134–1141.
27. Katashima M., Yamamoto K., Tokuma Y. et al. Comparative pharmacokinetic/pharmacodynamic analysis of proton pump inhibitors omeprazole, lansoprazole and pantoprazole, in humans // Eur. J. Drug. Metab. Pharmacokinet. 1998. Vol. 23. № 1. P. 19–26.
28. Sachs G., Shin J.M., Pratha V., Hogan D. Synthesis or rupture: duration of acid inhibition by proton pump inhibitors // Drugs Today (Barc.). 2003. Vol. 39. Suppl. A. P. 11–14.
29. Логинов А.Ф. Возможности использования пантопразола в терапии гастроэзофагеальной рефлюксной болезни // Фарматека. 2009. № 13 (187). С. 29–33.
30. Johnson А.G., Seidemann P., Рау R.О. NSAID-related adverse drug interactions with clinical relevance. An update // Int. J. Clin. Pharmacol. Ther. 1994. Vol. 32. № 10. P. 509–532.
31. Минушкин О.Н., Масловский Л.В., Логинов В.А. и др. Опыт применения препарата Панум (пантопразола) при лечении эрозивного и неэрозивного эзофагита // Эффективная фармакотерапия в гастроэнтерологии. 2010. № 1. С. 28–32.
Role for blockers of gastric secretion in treatment of chronic pancreatitis
L.V. Maslovsky
Educational and research medical center at the Department of Presidential affairs of the Russian Federation
Contact person: Leonid Vitalyevich Maslovsky, lemas3@yandex.ru
Chronic pancreatitis is an acid-related disease where its course and progression are maintained by hydrochloric acid. On one hand, duodenal acidification contributes to development of ineffective enzymatic therapy; on the other hand, it leads to an enhanced stimulation of pancreatic activity,
thus supporting exacerbations of chronic pancreatitis as well as aggravation of pain syndrome. Understanding of mechanisms underlying this phenomenon let to apply a medicated correction and enhance efficacy of therapy of chronic pancreatitis.
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.