Дископатия и спондилоартроз: общность патогенетических механизмов и новые возможности терапии
- Аннотация
- Статья
- Ссылки
- English
Актуальность проблемы
Существующие немногочисленные данные по распространенности спондилогенных заболеваний подтверждают значительное преобладание неспецифической боли (93%), меньшую часть составляют радикулярные синдромы (5%) и настораживающие симптомы (2%) [1, 2].
Остается открытым вопрос: какие неоднородные синдромы обобщает термин «неспецифическая боль в спине»? Данные противоречивы в основном из-за отсутствия единых подходов к диагностике и трактовке результатов. По-видимому, в полиморфную группу «неспецифической боли в спине» входят начальные изменения межпозвонкового диска, мышечно-связочные изменения, миофасциальный болевой синдром, дегенеративные изменения межпозвонковых суставов и др. Несмотря на объединение в одну группу, синдромы отличаются патогенетическими механизмами и клиническими проявлениями, которые влияют на лечебную тактику.
Какие патогенетические механизмы объединяют поражение различных структур позвоночно-двигательного сегмента, в частности межпозвонкового диска и межпозвонкового сустава?
Бытует мнение, что остеохондроз – это «наказание за прямохождение», обусловленное противоречием между «эволюционно-прогрессивной антигравитационной задачей человеческого позвоночного сегмента и неизбежностью механических перегрузок» [3]. Однако эта точка зрения представляется весьма спорной, поскольку дегенеративные изменения межпозвонкового диска сопутствуют старению не только человека, но и «братьев наших меньших» – четвероногих.
Первое подробное описание межпозвонкового диска принадлежит A. Vesalius (1543). Спустя три века в своей монографии H. von Luschka (1858) дает название «остеохондроз» дегенерации межпозвонкового диска. В XX в. эта же дефиниция ostheochondrosis interccorporalis, обозначавшая разрыхление диска, была использована немецким морфологом G. Schmorl в монографии «Здоровый и больной позвоночник».
Патогенез дископатии и артроза межпозвонковых суставов
Естественное течение дегенеративных изменений в позвоночно-двигательном сегменте, в том числе в межпозвонковом диске, заключается в неуклонном их прогрессировании в период с 20 до 50–60 лет. К этому времени дегенерация диска почти достигает финальной стадии, поэтому изменения на обычных рентгенограммах в виде снижения высоты диска и формирования остеофитов (остеохондроз, спондилез) считаются естественными спутниками старения и не признаются патологическими. Дегенеративные изменения межпозвонковых дисков обнаруживаются и в ходе аутопсии как норма, особенно в нижних шейных и нижних поясничных сегментах. Такие данные, представленные в работах G. Schmorl (1932), H. Junghanns (1968), были подтверждены современными исследователями. S.D. Boden и соавт. (1990) обнаружили на МРТ-снимках бессимптомные протрузии дисков у 20% здоровых людей в возрасте до 60 лет и у 36% старше 60 лет. Таким образом, о заболевании, связанном с дегенеративными изменениями, уместно говорить лишь при наличии функциональных нарушений или боли [4].
Корешок также может раздражаться и без механического воздействия грыжи диска вследствие попадания в эпидуральное пространство химических медиаторов и воспалительных цитокинов, образующихся вследствие микроповреждений дегенеративно измененного диска. Это ведет к развитию ирритативного болевого синдрома без признаков грыжи диска [4].
У лиц в возрасте 20–60 лет фиброкласты и хондроциты получают меньше питательных веществ. В результате клетки соединительной ткани вырабатывают волокна худшего, чем в детском возрасте, качества, уже не способные противодействовать тургорному давлению центральной, подвижной части диска, которая в этом периоде жизни еще интактна. В фиброзном кольце происходят радиальные и круговые разрывы, в которые вдается ткань пульпозного ядра. Могут сформироваться целые секвестры, образованные тканью из фиброзного кольца и хрящевых концевых пластинок, которые под действием асимметричной осевой нагрузки идут по пути наименьшего сопротивления, иногда выходя за пределы межпозвонкового диска. Результатом становятся протрузии и пролапсы диска. Пока наружные слои фиброзного кольца остаются интактными, смещенная ткань еще может вернуться в исходное положение. Однако в случае пролапса диска смещенная ткань проникает сквозь фиброзное кольцо и внутрь диска уже не возвращается. Пролапсы диска с дорсальной или дорсолатеральной направленностью вступают в контакт с задней продольной связкой, чувствительная иннервация которой обеспечивается менингеальной ветвью спинального нерва. Возникающие симптомы представлены локально ограниченным люмбаго, хронической дискогенной болью в пояснице и/или синдромом компрессии корешка.
Еще один фактор – уменьшение молекулярного веса мукополисахаридов. Способность диска к гидратации, то есть способность удерживать жидкость даже под высоким давлением, зависит в основном от количества и размеров содержащихся в нем молекул мукополисахаридов. По этой причине с возрастом внутридисковое онкотическое давление снижается и диск высыхает.
В диске взрослого человека нет кровеносных сосудов, а потому регенерация не может происходить самостоятельно. Дефект диска заполняется исключительно фиброзной тканью, которая разрастается после того, как в травмированный диск вторгается несущая сосуды грануляционная ткань. Сосуды прорастают из паравертебральных мягких тканей или тел позвонков и получают доступ к диску через травматический разрыв [4].
Первоначально приступы боли обычно длятся недолго и склонны разрешаться спонтанно. Их дальнейшее течение непредсказуемо. Приступы люмбаго в молодом и среднем возрасте могут оставаться единственным проявлением дегенерации дисков. Однако часто они знаменуют начало хронического, рецидивирующего поясничного синдрома, который выражается в прогрессировании заболевания с частыми приступами боли в нижней части спины и ишиаса. Возможность спонтанного выздоровления при заболеваниях межпозвонкового диска подтверждается двойными слепыми плацебоконтролируемыми исследованиями [4].
Изменение высоты и объема диска способствует развитию дегенеративных изменений межпозвонковых суставов – спондилоартрозу, который в современной литературе имеет различные дефиниции: фасеточный синдром, артроз межпозвонковых (дугоотростчатых) суставов, спондилоартропатический синдром и др.
Клинические симптомы боли, имеющей источником межпозвонковые суставы, впервые в 1936 г. описал M. Lange уже после того, как было обращено внимание на патологию межпозвонковых дисков. Спустя 40 лет после введения диагноза «спондилоартроз» для обозначения этого же синдрома V. Moone предложил термин «фасеточный синдром». Следует отметить, что в настоящее время термин «фасеточный синдром» чаще используется нейрохирургами, активно практикующими различные варианты денервации дугоотростчатых суставов (радиочастотную, пульсовую, криоденервацию и др.).
Источником болевой импульсации при этом является перерастяжение капсулы и/или повышенное давление на суставные поверхности межпозвонковых суставов, иннервируемых менингеальной ветвью спинального нерва.
Снижение высоты дисков, связанное с осевой компрессией позвоночника, приводит к повышению давления на межпозвонковые суставы. Если гипермобильность диска и перенапряжение суставов сохраняются, то развивается спондилоартроз. Такая перегрузка суставов ведет к последовательным изменениям: синовиту с накоплением синовиальной жидкости между фасетками, дегенерации суставного хряща, растягиванию капсулы суставов и подвывихам в них. Таким образом, межпозвонковые суставы и связки, подвергаясь чрезмерной или неадекватной нагрузке, становятся источниками болевых ощущений, обусловленных ирритацией менингеальной ветви спинального нерва. Кроме того, взаимодействие изменений в фасеточных суставах и диске ведет к увеличению суставных отростков с последующим развитием спинального стеноза [5]. Изменения суставных фасеток межпозвонковых суставов могут вызвать сужение межпозвонковых отверстий и создать неблагоприятные условия для нервных корешков нижних поясничных сегментов.
Болевой суставной синдром проявляется утренней скованностью и усиливается после нагрузки, симптоматика нарастает в течение дня. Боль облегчается в положении лежа на спине со слегка согнутыми ногами в коленных и тазобедренных суставах. Боль может иррадиировать в ягодицы, паховую область, нижнюю часть живота и иногда в мошонку. Пациенты описывают ее как диффузную и разлитую и указывают ее локализацию, прикладывая к больному месту ладонь, в отличие от пациентов с корешковыми синдромами, которые способны очертить границы пораженных дерматомов одним пальцем [4].
Перегрузке межпозвонковых суставов может способствовать слабость передней брюшной стенки, которая сопровождается наклоном таза кпереди и увеличением поясничного лордоза. С перегрузкой межпозвонковых суставов также связана боль при гиперлордозе поясничного отдела позвоночника. Она возникает после длительной ходьбы и стояния, особенно если человек носит обувь на высоких каблуках, в результате спуска по склону или деятельности, связанной с отклонением кзади (например, развешивание белья, рассматривание картин или выполнение действий над предметами, расположенными выше головы).
В последнее время для диагностики фасеточного синдрома рекомендуется выполнить блокаду медиальной ветви спинномозгового нерва или внутрисуставную блокаду местным анестетиком под контролем компьютерной томографии. Исчезновение боли после проведения манипуляции подтверждает диагноз. Есть мнение, что попадание местного анестетика при проведении блокады в венозное русло обусловливает воздействие не только на нервные окончания медиальной ветви, но и на нервные ветви, иннервирующие диск, мышцы.
Дегенеративные изменения и в диске, и в межпозвонковых суставах могут протекать бессимптомно и быть случайно обнаружены в ходе рентгенологического исследования. Объединяет эти заболевания также часто наблюдаемое несоответствие между рентгенологически выявленным анатомическим нарушением и симптоматикой. Структурные и функциональные нарушения позвоночного двигательного сегмента не всегда возникают одновременно, и не у всех пациентов морфологические дегенеративные изменения сопровождаются клиническими симптомами. Это относится и к другим заболеваниям, например, сколиозу, юношескому кифозу, анкилозирующему спондилоартриту, которые также часто не имеют симптомов.
Появление симптоматики определяется главным образом временем, в течение которого развивается структурная деформация двигательного сегмента. Принципиальное отличие врачебной тактики в данном случае заключается в том, что случайные «находки» – дегенеративные изменения позвоночника – не требуют лечения. Таким образом, о заболевании, связанном с дегенеративными изменениями, уместно говорить лишь при наличии функциональных нарушений или боли.
Лечение
Межпозвонковые суставы содержат большое число инкапсулированных и неинкапсулированных нервных окончаний. Наличие низкопороговых механорецепторов в капсуле сустава свидетельствует о том, что капсула выполняет и проприоцептивную функцию. При дегенеративном поражении межпозвонковых суставов в хряще и синовиальной капсуле определяются медиаторы воспаления: простагландины, интерлейкины 1, 6, фактор некроза опухоли альфа [6].
Дискогенной болью чаще страдают лица до 40 лет, а спондилоартрозом – пациенты более старшего возраста, которые часто имеют сопутствующую патологию со стороны сердечно-сосудистой системы, желудочно-кишечного тракта и др. В связи с этим необходимо более взвешенно подходить к выбору препаратов, учитывая профиль их безопасности. Именно поэтому особый интерес вызывает появившийся на российском рынке улучшенный НПВП, созданный на основе неселективного НПВП толметина и обладающий комплексом гастропротективных свойств, – Найзилат (амтолметин гуацил – АМГ).
АМГ как молекула был синтезирован в Италии в 1985 г. В его основу положен толметин – хорошо изученный неселективный НПВП, который никогда не был представлен в России, однако широко применялся во всем мире. Толметин характеризуется хорошим обезболивающим и противовоспалительным эффектом. Дополнительное преимущество ему дает способность влиять на таламические центры болевой чувствительности.
АМГ как молекула унаследовала все положительные свойства толметина, при этом получив дополнительные преимущества. От других НПВП этот препарат отличает наличие в его составе ванилиновой группы, которая имеет высокую аффинность к капсаициновым рецепторам слизистой оболочки желудка, двенадцатиперстной и тонкой кишки. В результате раздражения последних запускается локальная выработка оксида азота, который наравне с физиологическими простагландинами играет значимую роль в системе гастропротекции. Неизбежное снижение выработки физиологических простагландинов, вызванное приемом неселективного НПВП, в значимой степени компенсируется данным механизмом. Это позволяет значительно снизить частоту побочных эффектов со стороны желудочно-кишечного тракта.
Стоит отметить, что защитное действие препарата не ограничивается слизистой желудка, а распространяется и на тонкий кишечник. В то время как ингибиторы протонной помпы – основная группа препаратов для профилактики развития НПВП-гастропатий – работают только в желудке [6].
На экспериментальных моделях было продемонстрировано, что АМГ действительно уменьшает поражение желудка, индуцированное этанолом, и этот защитный эффект исчезает при применении ингибиторов NO-синтетазы [7]. Таким образом, АМГ как молекула сочетает в себе положительные качества неселективного НПВП (хорошее обезболивающее и противовоспалительное действие) и защитные свойства в отношении слизистой оболочки желудочно-кишечного тракта. Клинические исследования, проведенные в различных странах Европы, показали, что по своим «основным» свойствам АМГ не уступал таким препаратам, как диклофенак и индометацин, в то время как частота развития поражения желудочно-кишечного тракта при применении АМГ была несравненно ниже.
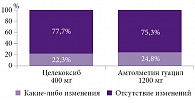
Представляет интерес исследование, проведенное на 180 пациентах, в котором сравнивали эффективность и безопасность АМГ и одного из самых безопасных НПВП целекоксиба. Курс лечения составил 24 недели. Пациенты получали АМГ в дозе 1200 мг или целекоксиб в дозе 400 мг. До и после курса лечения больным проводилось эндоскопическое исследование желудочно-кишечного тракта (рисунок). У подавляющего числа пациентов не было отмечено каких-либо изменений слизистой оболочки на фоне терапии, причем АМГ по уровню переносимости со стороны желудочно-кишечного тракта нисколько не уступал целекоксибу [8].
При остром болевом синдроме может быть использована максимальная суточная дозировка АМГ 1800 мг, при уменьшении интенсивности боли или хроническом болевом синдроме – 1200 мг (два раза в день по одной таблетке). Согласно инструкции по применению, Найзилат хорошо переносится при необходимости длительного применения (до шести месяцев), что дает серьезное преимущество в лечении пациентов с хроническими болевыми синдромами.
Таким образом, результаты экспериментальных и клинических исследований позволяют рекомендовать Найзилат для лечения острой и хронической боли, связанной с заболеваниями опорно-двигательного аппарата.
V.A. Shirokov
Yekaterinburg Medical Research Center for Prophylaxis and Health Protection in Industrial Workers
Contact person: Vasily Afonasyevich Shirokov, vashirokov@gmail.com
Pathogenesis, diagnostic tools and treatment of discopathy and osteoarthritis of the intervertebral joints are discussed. Opportunities of using non-steroid anti-inflammatory drugs in relieving acute and chronic pain related to musculoskeletal system diseases are considered after administering applying amtolmetin guacil.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


