Дулаглутид – эффективный контроль гликемии у больных сахарным диабетом 2 типа
- Аннотация
- Статья
- Ссылки
- English


Стремительное увеличение распространенности сахарного диабета (СД) 2 типа − одна из глобальных проблем мирового здравоохранения. Заболевание ассоциируется с преждевременной инвалидизацией и высокой смертностью вследствие сердечно-сосудистых осложнений. Однако установлено, что частоту указанных событий можно существенно сократить благодаря достижению гликемии, близкой к норме [1–3].
На сегодняшний день целью фармакотерапии СД 2 типа является снижение риска развития микро- и макрососудистых осложнений посредством достижения целевых параметров гликемического контроля. Однако в клинической практике добиться компенсации СД 2 типа бывает достаточно сложно. Многие пациенты не достигают целевого уровня гликированного гемоглобина (HbA1c): примерно у половины указанный показатель составляет более 7,0%, у трети – 7,5% и выше [4, 5]. Среди причин неудовлетворительного контроля заболевания указывают позднее начало фармакотерапии и ее интенсификации и использование недостаточно эффективных схем лечения [6]. Серьезную проблему представляют нежелательные эффекты сахароснижающей терапии. Один из них – гипогликемические состояния. Риск их развития является дополнительным препятствием для достижения метаболического контроля. Второй – увеличение массы тела, особенно при применении препаратов сульфонилмочевины (ПСМ) [7]. Большинство пациентов с СД 2 типа имеют избыточную массу тела, которая со временем, как правило, увеличивается.
Недостижение целевых значений гликемии также обусловлено недостаточной приверженностью пациентов назначенной терапии [8, 9].
Хроническая гипергликемия усугубляет ряд взаимосвязанных патофизиологических состояний. Речь, в частности, идет о нарушении функции бета-клеток, ухудшении чувствительности к инсулину, повышении гепатической продукции глюкозы, сопровождающемся неадекватно высокими уровнями глюкагона.
До недавнего времени основными патофизиологическими механизмами гипергликемии считались инсулинорезистентность и снижение секреции инсулина вследствие нарушения функции и/или уменьшения массы бета-клеток поджелудочной железы. В настоящее время принята концепция мультифакторного патогенеза СД 2 типа (рис. 1) [10]. Это служит обоснованием назначения такой фармакотерапии, которая бы одновременно воздействовала на различные нарушения, обладала высоким сахароснижающим потенциалом и поддерживала оптимальный контроль гликемии по мере прогрессирования заболевания [10].
С учетом новых данных о патофизиологии данного состояния, влиянии различных терапевтических стратегий на темпы прогрессирования заболевания разработаны принципиально новые сахароснижающие препараты [11, 12]. К таковым относятся агонисты рецепторов глюкагоноподобного пептида 1 (АР ГПП-1). Данные препараты воздействуют на максимальное количество звеньев патогенеза СД 2 типа и обладают хорошим профилем безопасности [13, 14]. Результаты исследований АР ГПП-1 свидетельствуют о потенциальных преимуществах препаратов этой группы в отношении прогноза заболевания.
Физиологические эффекты ГПП-1
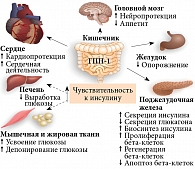
Энтероинсулярная ось имеет важное значение в регуляции углеводного обмена. Эффекты инкретинов являются неотъемлемой составляющей поддержания гомеостаза глюкозы (рис. 2). Речь идет о гормонах желудочно-кишечного тракта, стимулирующих секрецию инсулина и подавляющих секрецию глюкагона в ответ на прием пищи, – ГПП-1 и глюкозозависимом инсулинотропном полипептиде. Установлено, что инкретины ответственны за 60–70% секреции инсулина в постпрандиальный период [11, 15]. Их инсулинотропный эффект проявляется только при повышенной концентрации глюкозы в крови. Считается, что пептиды активируют накопление инсулина в бета-клетках. Они способствуют активации транскрипции гена проинсулина и инсулина с последующим повышением биосинтеза и стабильности мРНК [15].
ГПП-1 участвует во многих важных физиологических процессах, протекающих в тканях поджелудочной железы и других тканях, где представлены инкретиновые рецепторы: головного мозга, сердца, сосудов, костей и др. (рис. 2). ГПП-1 контролирует скорость опорожнения желудка, связываясь со специфическими рецепторами в головном мозге и стимулируя парасимпатические нервы. Это позволяет снизить экскурсию глюкозы в постпрандиальном периоде [14, 16].
Кроме того, ГПП-1 является анорексигенным гормоном. Его действие аналогично действию альфа-меланоцитстимулирующего гормона, пептида YY3-36 и антагонистов таких анорексигенных гормонов, как грелин, нейропептид Y. ГПП-1 воздействует на гипоталамические ядра, что способствует быстрому появлению чувства насыщения, уменьшению количества потребляемой пищи и, как следствие, массы тела [11].
Снижение эффектов инкретинов уже на стадии предиабета приводит к гипергликемии. Оно может быть обусловлено нарушением секреции ГПП-1, ускоренным метаболизмом или нечувствительностью рецепторов клеток к инкретинам [12, 16].
Инкретин-направленная терапия
Создание и внедрение в клиническую практику инкретин-направленной терапии стало поворотным моментом в лечении СД [17, 18]. Согласно российским алгоритмам оказания медицинской помощи больным СД использование АР ГПП-1 допускается на всех этапах лечения как в виде монотерапии, так и в составе комбинированной терапии, в том числе с инсулином, – в зависимости от исходного уровня HbA1c [2].
К преимуществам препаратов данного класса помимо высокой сахароснижающей активности относятся низкий риск развития гипогликемических состояний, снижение массы тела, артериального давления, а также потенциальный протективный эффект в отношении бета-клеток поджелудочной железы [14, 16].
Однако в клинической практике нередко возникают сложности проведения терапии АР ГПП-1. Они обусловлены главным образом необходимостью ежедневных инъекций препарата. Это в свою очередь уменьшает приверженность пациентов назначенному лечению и, как следствие, ухудшает его эффект [8]. Поэтому важным шагом стало создание пролонгированных форм АР ГПП-1.
Клинические возможности дулаглутида
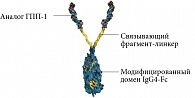
В 2016 г. в России был зарегистрирован препарат дулаглутида (Трулисити). Это первый зарегистрированный в России препарат для лечения СД 2 типа, который применяется один раз в неделю независимо от приема пищи. Молекула дулаглутида состоит из двух идентичных цепей [19] с дисульфидными связями. Каждая цепь содержит аналог модифицированного человеческого ГПП-1, ковалентно связанного с фрагментом тяжелой цепи (Fc) модифицированного человеческого иммуноглобулина G4 (IgG4) с помощью небольшой полипептидной цепи (рис. 3). Часть дулаглутида, которая является аналогом ГПП-1, приблизительно на 90% гомологична человеческому ГПП-1 [12].
Разработка дулаглутида преследовала следующие цели:
- увеличить длительность действия и сохранить необходимую инкретиновую активность;
- обеспечить хорошую растворимость препарата;
- уменьшить иммуногенность молекулы.
Особенности строения молекулы Трулисити обеспечивают увеличение периода полувыведения до 4,7 дня. В результате упрощается схема применения препарата – подкожное введение один раз в неделю [21].
Пролонгированное действие дулаглутида обусловлено несколькими особенностями структуры молекулы. Благодаря замене аланина на глицин в восьмой позиции молекулы ГПП-1 достигнута устойчивость к расщеплению дипептидилпептидазой 4. Вследствие ковалентного соединения двух молекул аналога ГПП-1 с тяжелой цепью человеческого IgG4-Fc молекула имеет большой размер, что замедляет абсорбцию и снижает почечный клиренс [12, 21]. Улучшение связывания с рецепторами достигнуто оптимизированным аминокислотным линкером.
Дулаглутид отличает сохранение устойчивости в растворимой форме. Улучшение растворимости достигнуто путем замены в 22-й позиции глицина аминокислоты на глутаминовую кислоту в ГПП-1, а также путем соединения с Fc-фрагментом IgG4.
Молекула дулаглутида обладает низкой иммуногенностью. Поскольку Fc-фрагмент IgG4 является частью антитела и ответствен за многие иммунные реакции с участием антител, для уменьшения иммуногенности и опосредованных антителами иммунных реакций используемый Fc-фрагмент был модифицирован. Снижение иммуногенности также было достигнуто в ходе аминокислотных замещений в молекулах ГПП-1 [19, 21].
После подкожного введения максимальная концентрация (Сmах) дулаглутида в плазме наблюдается через 48 часов. Равновесная концентрация в плазме – через две – четыре недели терапии дулаглутидом в дозе 1,5 мг/нед. Концентрации после подкожного введения однократной дозы дулаглутида в область живота, бедра или плеча были сопоставимыми [21].
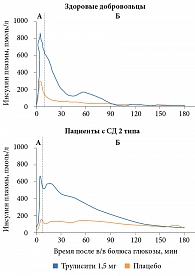
Исследование фармакодинамики дулаглутида показало, что у пациентов с СД 2 типа восстанавливалась первая фаза секреции инсулина до значений у здоровых лиц, получавших плацебо, и улучшалась вторая фаза секреции инсулина в ответ на внутривенное болюсное введение глюкозы (рис. 4) [22]. В исследовании также отмечено, что при однократном введении дулаглутида в дозе 1,5 мг увеличивалась максимальная секреция инсулина бета-клетками поджелудочной железы и улучшалась функция бета-клеток по сравнению с применением плацебо. В России доступны две дозы Трулисити: 0,75 и 1,5 мг/нед. Первая рекомендуется для монотерапии, а также для пациентов старше 75 лет, вторая – в составе комбинированной терапии СД 2 типа [21].
Программа международных клинических исследований дулаглутида фазы III (AWARD)
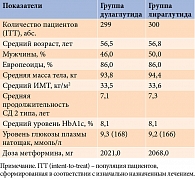
Эффективность, безопасность и переносимость дулаглутида подтверждены результатами нескольких масштабных клинических исследований (КИ) AWARD длительностью от 26 до 104 недель (табл. 1) [12]. В исследования был включен 5171 пациент с СД 2 типа, 3136 из них получали дулаглутид. Количество мужчин – 51%. Средний возраст участников составил 56 лет (доля лиц 75 лет и старше – 2%), средняя продолжительность заболевания – 8 лет.
Эффективность Трулисити была продемонстрирована как в монотерапии, так и в комбинации с пероральными сахароснижающими препаратами (ПСП) и инсулином (с метформином или без него). В КИ сравнивалась терапия Трулисити с приемом плацебо, терапией метформином, ситаглиптином, эксенатидом (применялся два раза в сутки), лираглутидом и инсулином гларгин.
Дизайн КИ был построен таким образом, чтобы показать не меньшую эффективность Трулисити относительно препарата сравнения в снижении уровня HbA1c (первичная конечная точка), а в дальнейшем его преимущество по данному показателю.
За основной критерий эффективности во всех исследованиях принято изменение HbA1c относительно исходного уровня в первоначальной временной точке – к 26-й или 52-й неделе. Оценивались также изменение HbA1c от исходного уровня в финальной временной точке, доля пациентов, достигших целевых значений HbA1c, глюкозы плазмы натощак, постпрандиальной гликемии, массы тела и других показателей [23–29].
Плацебоконтролируемые исследования проводились в двойном слепом режиме для двух доз дулаглутида – 0,75 и 1,5 мг [27].
Пациентам, включенным в исследования AWARD-1, -2, -4 и -5, сначала была подобрана оптимальная терапия фоновыми ПСП в максимально переносимой или эффективной дозе, после чего их состояние стабилизировали в течение 9–12 недель вводного этапа [23, 25, 26, 29].
В связи с невозможностью скрыть во время титрации дозы препаратов исследования с базальным инсулином (AWARD-2 и -4) [23, 25] и эксенатидом (AWARD-1) [29] были открытыми. Сравнение с лираглутидом (AWARD-6) также проводилось в открытом режиме, так как шприц-ручки не были коммерчески доступны [24].
Во всех исследованиях дулаглутид показал клинически значимое улучшение контроля гликемии (рис. 5). При этом лечение дулаглутидом было эффективным вне зависимости от схемы терапии [12].
Эффективность в виде монотерапии
Применение дулаглутида в монотерапии изучали в исследовании AWARD-3. Его продолжительность составила 52 недели. В качестве препарата сравнения выбрали метформин [27]. В отношении снижения уровня HbAlc дулаглутид в дозах 1,5 или 0,75 мг один раз в неделю оказался эффективнее метформина в дозе 1500–2000 мг/сут. Через 26 недель терапии во всех группах зафиксировано значимое снижение значений HbA1c (-0,78% в группе дулаглутида 1,5 мг, -0,71% в группе дулаглутида 0,75 мг, -0,56% в группе метформина, p < 0,025). При этом терапия дулаглутидом в дозе 1,5 мг или 0,75 мг один раз в неделю ассоциировалась с большим числом пациентов, достигших целевого показателя HbAlc < 7,0 и ≤ 6,5%.
Эффективность в составе комбинированной терапии
Безопасность и эффективность дулаглутида оценивали в плацебоконтролируемом и активно контролируемом клиническом исследовании AWARD-5 (ситаглиптин 100 мг/сут). Продолжительность исследования – 104 недели. Все препараты применяли в комбинации с метформином [26]. В исследовании приняли участие пациенты с СД 2 типа в возрасте от 18 до 75 лет с индексом массы тела (ИМТ) 25–40 кг/м². Продолжительность заболевания составляла ≥ 6 месяцев. У всех участников отмечался неудовлетворительный контроль гликемии – HbA1c от > 8,0 до ≤ 9,5% на фоне немедикаментозной терапии; от ≥ 7,0 до ≤ 9,5% на фоне монотерапии ПСП или комбинированной терапии (метформин в сочетании с другим ПСП).
Во время вводного периода (2–11 недель) пациенты получали метформин в дозе ≥ 1500 мг/сут (≥ 6 месяцев), другие сахароснижающие препараты отменялись.
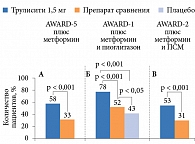
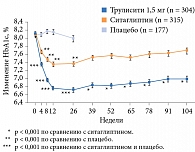
Результаты исследования показали, что применение дулаглутида в дозах 1,5 или 0,75 мг/нед через 52 недели способствовало большему снижению значений HbA1c по сравнению с применением ситаглиптина (p < 0,001) (см. рис. 5). Среднее снижение HbA1c в группе дулаглутида 0,75 мг составило 1,10 ± 0,06%, в группе дулаглутида 1,5 мг – 0,87 ± 0,06%, в группе ситаглиптина – 0,39 ± 0,06%. При этом значимо большее число пациентов, применявших дулаглутид, достигло целевого показателя HbA1c < 7,0 и ≤ 6,5% (рис. 6). Достигнутые результаты сохранялись до конца исследования (104 недели) (рис. 7), что свидетельствовало о долгосрочной эффективности дулаглутида. Снижение массы тела в группах дулаглутида в дозах 1,5 или 0,75 мг/нед было более выраженным, чем в группе ситаглиптина. Частота документированной симптоматической гипогликемии при применении дулаглутида в дозах 1,5 мг или 0,75 мг и ситаглиптина составила 0,19, 0,18 и 0,17 эпизода на одного пациента в год соответственно. Случаев тяжелой гипогликемии при применении дулаглутида не зафиксировано.
Сравнение эффективности и безопасности дулаглутида и эксенатида
В многоцентровом плацебоконтролируемом исследовании AWARD-1 оценивалась эффективность и безопасность дулаглутида по сравнению с эффективностью и безопасностью эксенатида у больных СД 2 типа с неудовлетворительным гликемическим контролем на фоне метформина и/или пиоглитазона [29]. В исследование включались пациенты старше 18 лет с ИМТ 23–45 кг/м² и уровнем HbA1c от 7 до 11% на фоне монотерапии или от 7 до 10% на фоне комбинированной терапии. Все участники (n = 976) были рандомизированы на четыре группы: дулаглутида 0,75 мг, дулаглутида 1,5 мг, эксенатида (в открытом режиме) и плацебо. Эксенатид принимался в дозе 5 мкг два раза в сутки в течение первых четырех недель, далее – в дозе 10 мкг два раза в сутки. Пациенты продолжали прием плацебо до 26-й недели, после чего переходили на дулаглутид 1,5 мг или 0,75 мг. Перед рандомизацией 86% пациентов получали метформин ≥ 2500 мг/сут и пиоглитазон ≥ 45 мг/сут.
При введении дулаглутида в дозах 1,5 (см. рис. 5) или 0,75 мг/нед наблюдалось достоверно более значимое снижение уровня HbA1c по сравнению с приемом плацебо и эксенатида. Через 26 недель исследования значения HbA1c в среднем снизились в группе дулаглутида 1,5 мг на 1,51 ± 0,06%, в группе дулаглутида 0,75 мг на 1,30 ± 0,06%, в группе эксенатида на 0,99 ± 0,06%, в группе плацебо на 0,46 ± 0,08%. Через 52 недели терапии среднее снижение уровня HbA1c было достоверно выше, чем в группе эксенатида. Разница составила 0,52% для дулаглутида 1,5 мг и 0,36% – для дулаглутида 0,75 мг (p < 0,001).
В группе дулаглутида число пациентов, достигших целевого показателя HbA1c < 7,0 и ≤ 6,5%, было значимо больше, чем в группе плацебо и эксенатида (см. рис. 6). К 26-й неделе наблюдения HbA1c < 7,0% достигли 78 и 66% пациентов, получавших дулаглутид 1,5 и 0,75 мг, против 52% получавших эксенатид и 43% получавших плацебо (см. рис. 6), HbA1c ≤ 6,5% – 63 и 53% получавших дулаглутид 1,5 и 0,75 мг, 38% получавших эксенатид и 24% получавших плацебо.
К концу исследования у 52% (группа дулаглутида 1,5 мг) и 48% (группа дулаглутида 0,75 мг) пациентов зафиксировано снижение HbA1c ≤ 6,5%. В группе эксенатида таковых было 35% (p < 0,001).
Оба препарата продемонстрировали статистически значимое снижение как тощаковой, так и постпрандиальной гликемии. В группе дулаглутида 1,5 мг среднее снижение глюкозы плазмы натощак оказалось достоверно выше, чем в группах плацебо или эксенатида. При этом лечение дулаглутидом приводило к снижению глюкозы плазмы натощак уже в первые две недели.
К 26-й неделе в группах дулаглутида 1,5 мг и эксенатида наблюдалось сопоставимое снижение массы тела (-1,30 против 1,07 кг, p = 0,474), подобная динамика сохранялась до конца исследования.
Анализ профиля безопасности показал, что частота документированных случаев симптоматической гипогликемии при применении дулаглутида 1,5 или 0,75 мг/нед и эксенатида составила 0,19, 0,14 и 0,75 эпизода на пациента в год соответственно. Случаев тяжелой гипогликемии на фоне терапии дулаглутидом не зафиксировано. Однако при применении эксенатида отмечено два случая тяжелой гипогликемии. Наиболее частым побочным эффектом дулаглутида и эксенатида была тошнота. При применении дулаглутида большинство приступов тошноты были легкой или средней степени тяжести. Их число сокращалось после первых двух недель терапии.
Сравнение эффективности и безопасности дулаглутида и лираглутида
В исследовании AWARD-6 получены данные о сопоставимой эффективности Трулисити и лираглутида 1,8 мг в снижении уровня HbA1c [24]. В исследование включали пациентов с СД 2 типа старше 18 лет и ИМТ ≤ 45 кг/м². Уровень HbA1c участников – от ≥ 7 до ≤ 10% как минимум через три месяца применения метформина не менее 1500 мг/сут. Исходные клинические характеристики пациентов представлены в табл. 2.
Начальная доза лираглутида составила 0,6 мг/сут, через неделю ее увеличили до 1,2 мг/сут, на третьей неделе – до 1,8 мг/сут.
Продолжительность наблюдения составила 26 недель. Оба препарата применяли в сочетании с метформином.
Через 26 недель в обеих группах фармакотерапии отмечалось значимое снижение HbA1c (-1,42% в группе дулаглутида и -1,36% в группе лираглутида, p < 0,0001) (см. рис. 5). Зафиксировано также сопоставимое снижение глюкозы плазмы натощак (-1,8 ммоль/л в группе дулаглутида и -2,4 ммоль/л в группе лираглутида) и глюкозы через два часа после приема пищи (-2,56 ммоль/л в группе дулаглутида и -2,43 ммоль/л в группе лираглутида).
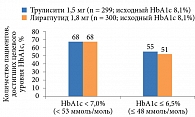
Количество пациентов, достигавших целевого показателя HbAlc < 7,0%, и в группе дулаглутида, и в группе лираглутида составило 68%. Количество пациентов, достигших HbA1c ≤ 6,5% в конце исследования, также было сопоставимо – 55% в группе дулаглутида, 51% в группе лираглутида (рис. 8). Однако в группе дулаглутида для достижения целевых уровней гликемии пациентам потребовалось в семь раз меньше инъекций по сравнению с группой лираглутида, что является значимым клиническим преимуществом первого.
В обеих группах наблюдалось снижение массы тела – -2,90 против -3,61 кг соответственно.
Дулаглутид и лираглутид продемонстрировали сопоставимые профили безопасности и переносимости. Наиболее частые нежелательные явления фиксировались со стороны желудочно-кишечного тракта и не различались между группами терапии по степени тяжести. Частота случаев тошноты составила 20 и 18% соответственно. Однако в дальнейшем частота этой реакции снижалась.
Сокращение случаев гипогликемических эпизодов является ключевым моментом в терапии СД 2 типа. В обеих группах отмечена низкая частота эпизодов гипогликемии; случаев тяжелой гипогликемии не наблюдалось. В частности, частота задокументированной симптоматической гипогликемии при применении дулаглутида составила 0,12 эпизода на пациента в год, лираглутида – 0,29.
Терапия в комбинации с метформином и производными сульфонилмочевины
В исследовании AWARD-2 дулаглутид сравнивали с инсулином гларгин. Продолжительность наблюдения – 78 недель. Оба препарата применяли с метформином и ПСМ [25]. Участники исследования – больные СД 2 типа с ИМТ 23–45 кг/м² и неудовлетворительным контролем гликемии на фоне монотерапии или комбинированной терапии ПСП (HbA1c 7,0–11,0%). Применение дулаглутида 1,5 мг/нед через 52 недели привело к достоверно большему снижению значений HbA1c, чем применение инсулина гларгин (см. рис. 5). Преимущество дулаглутида сохранялось и к 78-й неделе исследования. При этом снижение HbA1c на фоне дулаглутида 0,75 мг/нед и инсулина гларгин было сопоставимым. Так, уровень HbA1c в среднем в группе дулаглутида 1,5 мг снизился на 1,08 ± 0,06%, в группе дулаглутида 0,75 мг – на 0,76 ± 0,06%, в группе инсулина гларгин – на 0,63 ± 0,06%.
В группе дулаглутида 1,5 мг достоверно большее число пациентов достигло целевого значения HbA1c (< 7,0 и ≤ 6,5%) как через 52 (см. рис. 6), так и через 78 недель терапии. Немаловажно, что полученные результаты были достигнуты при меньшем количестве инъекций дулаглутида (по сравнению с инсулином гларгин). Инъекций инсулина гларгин было в семь раз больше.
Анализ результатов исследования показал положительное влияние терапии на массу тела пациентов. В обеих группах дулаглутида отмечено статистически значимое снижение массы тела по сравнению с группой инсулина гларгин (-1,33 и 1,85 кг в группах дулаглутида 0,75 и 1,5 мг против +1,44 кг в группе инсулина гларгин).
Кроме того, применение дулаглутида было более безопасным по сравнению с применением инсулина гларгин. Частота задокументированных случаев симптоматической гипогликемии при использовании дулаглутида 1,5 или 0,75 мг и инсулина гларгин составила 1,67, 1,67 и 3,02 эпизода на пациента в год. На фоне терапии дулаглутидом 1,5 мг/нед и инсулином гларгин наблюдалось одинаковое количество эпизодов тяжелой гипогликемии – по два случая.
Рассматривая эффективность и профиль безопасности дулаглутида на разных этапах терапии пациентов с СД 2 типа, следует отметить, что в пяти из шести исследований AWARD дулаглутид 1,5 мг/нед продемонстрировал значимое превосходство в снижении уровня HbA1c перед препаратами сравнения при сопоставимом или меньшем риске гипогликемий. При сравнении с лираглутидом в максимальной дозе была продемонстрирована не меньшая эффективность дулаглутида в дозе 1,5 мг/нед в отношении динамики HbA1c.
При этом по распространенности и частоте гипогликемий терапия дулаглутидом 1,5 мг/нед была сопоставима с терапией метформином, ситаглиптином, лираглутидом, но более безопасной по сравнению с терапией базальным инсулином в составе различных схем лечения.
Эффект дулаглутида на массу тела в большинстве исследований превосходил либо был сопоставимым с эффектом препаратов сравнения.
Дулаглутид и приверженность лечению
Последние научные достижения в области диабетологии привели к существенным изменениям в сахароснижающей терапии. Тем не менее решение проблемы эффективного лечения СД 2 типа в реальной клинической практике неразрывно связано с приверженностью пациентов рекомендованной терапии, что особенно касается инъекционных сахароснижающих препаратов [8, 30]. Важное преимущество дулаглутида заключается в удобстве применения – один раз в неделю в виде подкожной инъекции. Еще одно преимущество – инновационное средство введения – готовая к применению шприц-ручка. Шприц-ручка отличается простотой в использовании, наличием предварительно прикрепленной и скрытой от пациента иглы, отсутствием необходимости дополнительных манипуляций с иглой и необходимости ресуспензировать препарат, а также минимальной болезненностью инъекций и наличием сигнала, подтверждающего введение дозы препарата. Как продемонстрировали результаты исследования, 99% пациентов с СД 2 типа, которые впервые получали сахароснижающую терапию инъекционными препаратами, легко справлялись с введением инъекций дулаглутида. Более 96% пациентов отметили простоту использования устройства для его введения [31].
Перечисленные преимущества дулаглутида могут способствовать улучшению приверженности лечению. Так, в исследовании предпочтений пациентов большее число больных предпочитали дулаглутид лираглутиду [32].
Заключение
Эффективность и безопасность лечения СД 2 типа остается актуальным вопросом эндокринологии. Создание препарата Трулисити – пролонгированной формы АР ГПП-1 – с высокой сахароснижающей эффективностью и безопасностью открывает новые перспективы проведения патофизиологически обоснованной терапии СД 2 типа. Как следствие, достижение длительного контроля гликемии становится реальной целью.
A.M. Mkrtumyan, Ye.V. Biryukova
FSBEI HE ‘A.I. Yevdokimov Moscow State University of Medicine and Dentistry’
Contact person: Ashot Musaelovich Mkrtumyan, vagrashot@mail.ru
Type 2 diabetes mellitus (DM) is a chronic disease associated with development of severe complications. Causes of unsatisfactory treatment efficacy, major pathogenetic mechanisms underlying type 2 DM, new pathophysiologically-justified therapeutic approaches, particularly suggesting use of incretin mimetics are discussed in the paper. Among them is glucagon-like peptide-1 receptor agonist (GLP-1 RA). In addition, the results from the International Phase III AWARD Clinical Trial with dulaglutide (Trulicity), the first weekly applied GLP-1 RA in Russia, are presented.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.