Эффективность применения Церебролизина при последствиях тяжелой черепно-мозговой травмы
- Аннотация
- Статья
- Ссылки
Формирование последствий ЧМТ начинается уже в остром периоде (от 2 до 10 недель после травмы) и продолжается в промежуточном (при тяжелой ЧМТ – до 6 месяцев) и отдаленном периодах (до 2 лет и более). В основе отдаленных последствий ЧМТ лежит целый ряд патологических процессов, начиная с непосредственного повреждения мозгового вещества с развивающимся нарушением мозгового кровообращения с последующим формированием рубцово-спаечных, атрофических процессов и аутонейросенсибилизации [3, 12, 13].
В основе последствий ЧМТ лежат морфологические изменения (тканевые, ликворные и сосудистые нарушения), которые приводят к формированию клинических синдромов последствий, часть из которых становится дезадаптирующими. Реабилитации подлежат пациенты с дезадаптирующими синдромами последствий [2, 3, 7]. Особенностью последствий ЧМТ является сочетание тканевых, ликворных и сосудистых нарушений. У одного и того же пациента может быть сочетание различных клинических синдромов.
В этой работе мы не рассматриваем хирургическую тактику лечения больных, подлежащих оперативному вмешательству (посттравматические дефекты черепа, деформации черепа, соустья, ложные аневризмы и др.). Среди клинических форм тканевых последствий ЧМТ у наблюдаемых нами пациентов с дезадаптирующими синдромами чаще всего наблюдались посттравматическая атрофия мозга, посттравматический арахноидит и поражения черепных нервов. Клинические формы ликвординамических последствий были представлены в основном посттравматической гидроцефалией и наличием ликворных кист, а сосудистые – посттравматической ишемией головного мозга. Существенное значение имели также посттравматическая эпилепсия, посттравматические психические дисфункции и посттравматические вегетативныедизрегуляции [3, 6, 7, 8].
Посттравматическая атрофия мозга бывает диффузная и локальная. Следует отметить, что как характер, форма, так и степень выраженности атрофии обусловлены не только самой травмой, но и наличием и особенностями преморбидной патологии. Диффузная атрофия мозга обычно развивается при диффузном аксональном повреждении мозга. При прогрессировании процесса у пациентов нарастают когнитивные нарушения вплоть до деменции, мозжечковая и подкорковая симптоматика с псевдобульбарными нарушениями. Клинические проявления локальной посттравматической атрофии зависят от топики процесса [3, 8, 9, 14].
Посттравматический арахноидит бывает конвекситальный, базальный, может быть слипчивый, кистозный и слипчиво-кистозный. Ведущими симптомами конвекситального арахноидита являются выпадение и раздражение лобных, височных и теменных долей, включая эпилептические припадки. Для базального арахноидита характерны симптомы поражения черепных нервов. Обычно выделяют оптохиазмальный арахноидит и арахноидит заднечерепной ямки. При арахноидите заднечерепной ямки возможна окклюзия ликворопроводящих путей с развитием гипертензионно-гидроцефального синдрома [3, 7].
Посттравматическая гидроцефалия после тяжелой ЧМТ бывает как нормотензивная, так и гипертензионная и окклюзионная. Клинические проявления заключаются в наличии интеллектуально-мнестических нарушений и атактических расстройств, в далеко зашедших случаях развивается синдром Хакима-Адамса и гипертензионный синдром [7, 8].
Клинические проявления ишемии мозга могут быть как постдислокационными, так и обусловленными экстракраниальными факторами. Клиническая симптоматика соответствует локализации ишемических очагов с развитием очаговых симптомов выпадения.
Формирование посттравматической эпилепсии в большинстве случаев происходит в первые 18 месяцев после травмы, однако возможно появление эпилептических припадков через 5, а иногда и через 10 лет после травмы. Эпилептические припадки бывают как парциальные, так и первично и вторично генерализованные. Простые и комплексные парциальные припадки чаще всего развиваются после контузионных очагов и очагов размозжения головного мозга.
Посттравматические психические дисфункции или психопатологические синдромы встречаются в виде пограничных состояний (астения, неврозы) и в виде психоорганического синдрома с наличием грубых интеллектуально-мнестических нарушений [3, 7, 10].
Посттравматические вегетативные дизрегуляции, или вегетативно-сосудистый синдром, – одна из наиболее частых форм последствий ЧМТ, нередко приводящая к развитию дезадаптации; клиническая картина, как правило, полиморфна и требует длительной медикаментозной коррекции [10, 11, 15].
В системе реабилитации больных с тяжелой ЧМТ ключевое место принадлежит медикаментозной терапии. С учетом морфологических изменений, лежащих в основе клинических форм отдаленного периода ЧМТ, становится понятной необходимость применения препаратов с нейротрофическим, нейропротекторным и нейропластическим действием, проникающих через гематоэнцефалический барьер и способствующих выживанию нервных клеток, дифференциации, а также защищающих их от последствий травмы.
Именно таким действием обладает препарат Церебролизин, который имеет все свойства природных нейротрофических факторов. Первые сообщения об эффективности Церебролизина, в том числе и его высоких доз, появились в конце 70-х годов ХХ века. Церебролизин содержит кислоты и биологически активные пептиды, которые и действуют на головной мозг как нейротрофические факторы. Нейротрофическое действие Церебролизина проявляется в повышении жизнеспособности нейронов и улучшении трофики нервных клеток, что помогает избежать атрофии, гипофункции и клеточной смерти. Нейропротективное действие Церебролизина заключается в снижении воспалительных реакций (подавление активации микроглии, продукция гистамина, снижение клеточной смерти в гиппокампе, улучшение структурной интеграции путем редукции белка цитоскелета МАР2), уменьшении глутаматной эксайтотоксичности, ингибировании кальций-зависимых протеаз (кальпаин), торможении свободно-радикального и перекисного окисления липидов. Нейропластический эффект Церебролизина заключается в том, что он способствует адаптации клеток мозга путем «прокладки» новых нервных путей в ответ на повреждающие изменения, что в свою очередь позволяет регенерироваться поврежденным нервным волокнам, способствует формированию нейрональной сети и восстановлению поврежденных нейрональных процессов. Церебролизин действует как фактор роста нейронов и увеличивает количество нейрональных клеток-предшественников благодаря подавлению апоптоза.
Целью работы было оценить эффективность препарата Церебролизин при последствиях тяжелой ЧМТ в промежуточном и отдаленном периодах.
Материалы и методы
Проведен анализ эффективности применения препарата Церебролизин у 150 пациентов с последствиями тяжелой ЧМТ в промежуточном и отдаленном периодах травмы. Контрольная группа состояла из 50 больных с аналогичными последствиями тяжелой ЧМТ. Обе группы были сопоставимы по полу, возрасту и сроку катамнеза. Как в основной, так и в контрольной группе преобладали мужчины (105 и 36 наблюдений соответственно). Возраст больных от 24 до 62 лет, средний возраст 43 ± 9 лет. Катамнез до 10 лет, средний срок катамнеза 6 ± 4 года.
Результаты оценивались с помощью шкалы исходов Глазго, отечественной шкалы исходов ЧМТ [4, 3], шкалы MMSE, использовались также критерии эффективной реабилитации [3], ЭЭГ, КТ, МРТ, допплерография.
Результаты
Клиническая картина последствий тяжелой ЧМТ была полиморфной, как правило, у каждого пациента выявлялись два и более клинических синдрома последствий.
Наиболее распространенными были посттравматические вегетативные дизрегуляции, или вегетативно-сосудистый синдром, который выявлен в 132 наблюдениях в основной группе и в 39 – в контрольной.
Вторые по частоте – посттравматические психические дисфункции (75% (112 набл.) в основной группе и 73% (36 набл.) в контрольной). В этой группе клинических последствий доминировали синдромы пограничного уровня – по 80% в основной и контрольной группах. В 20% наблюдений как в основной, так и в контрольной группе имелся психоорганический синдром с выраженным снижением интеллектуально-мнестических функций, достигавшим 22–23 баллов по шкале MMSE.
Посттравматический арахноидит установлен в 51% наблюдений как в основной, так и в контрольной группах, причем конвекситальный арахноидит встречался несколько чаще, но статистически достоверной разницы в частоте встречаемости нами не установлено.
Обычно имело место сочетание базального и конвекситального процессов, но степень выраженности их была различной, что, собственно, и обуславливало клиническую картину этого вида последствий ЧМТ. Пирамидная симптоматика, достигавшая в ряде случаев моно- и гемипарезов, была в 70% в основной группе и в 65% – в контрольной. Оптохиазмальный арахноидит имелся в 8 наблюдениях в основной группе и в 2 – в контрольной. Арахноидит задней черепной ямки был в 10 наблюдениях в основной группе и в 1 – в контрольной; в основной группе в 2 наблюдениях развилась окклюзионная гидроцефалия, потребовавшая далее установки шунта среднего давления. Посттравматическая локальная атрофия мозгового вещества различной степени выраженности имелась в 75 наблюдениях в основной и в 23 – в контрольной группе и, как правило, сочеталась с конвекситальным арахноидитом. В 2 наблюдениях основной группы в остром периоде ЧМТ имелось диффузное аксональное повреждение мозга с исходом в диффузную атрофию; в контрольной группе было 1 такое наблюдение.
Посттравматическая верифицированная ишемия мозга была в 12 наблюдениях основной группы и в 2 наблюдениях – цв контрольной и проявляла себя пирамидной симптоматикой в обеих группах; афазия наблюдалась в 4 наблюдениях в основной группе при левополушарной локализации процесса.
Частота посттравматической эпилепсии достигала 17%, припадки были в основной группе в 25 наблюдениях, а в контрольной – в 8. У всех пациентов с посттравматической эпилепсией имелись рубцово-спаечные процессы головного мозга, и в остром периоде имелись сосудистые нарушения как фактор вторичного повреждения ЦНС.
Таким образом, у пациентов с тяжелой ЧМТ клиническими синдромами в 95% случаев являлись синдромы неврологического дефицита, синдромы психических дисфункций, синдромы вегетативных дизрегуляций, эпилептический и гипертензионно-гидроцефальный синдромы. К синдромам неврологического дефицита отнесены те наблюдения, в которых выраженность пирамидных, экстрапирамидных, мозжечковых нарушений и нарушений функций черепных нервов (I, III, VI и VIII п.) приводила к дезадаптации.
Обе группы пациентов, основная и контрольная, получали ноотропные препараты, дезаггреганты, антигипоксанты, нейротрофики и вазоактивные препараты, по показаниям – противосудорожные. В основной группе применялся еще и препарат Церебролизин. Терапия проводилась при наличии дезадаптирующих синдромов последствий, длительно, до 3–5 лет.
Препарат Церебролизин начинал применяться в промежуточном периоде курсами внутримышечно по 10 мл в сутки в течение 14 дней, затем по 2 мл внутримышечно 14 дней – 1 раз в три месяца, т. е. 2 раза в течение промежуточного периода. В дальнейшем, в отдаленном периоде, Церебролизин применялся по 2 мл внутримышечно в течение 4 недель 2 раза в год, как правило, весной и осенью.
У ограниченной группы пациентов (20 из 150 набл. основной группы) были применены более высокие дозы Церебролизина – по 20 мл внутривенно капельно курсом в течение 14 дней. Курсы повторялись 2 раза в год, весной и осенью. В этой группе до применения Церебролизина имелись выраженные когнитивные нарушения – 23,5 балла по шкале MMSE. Катамнез по этой группе составляет последние 2 года.
Контрольная группа состояла из 17 наблюдений (из 150 набл. основной группы), была сопоставима по всем параметрам и имела те же выраженные нарушения когнитивных функций, но пациенты этой группы получали те же дозы Церебролизина, что и в основном массиве наблюдений.
Проведена оценка результатов эффективности применения препарата Церебролизин.
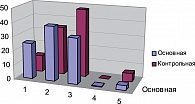
На рисунке 1 представлена сравнительная оценка результатов лечения в основной и контрольной группах по шкале исходов Глазго.
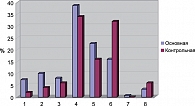
Как видим (рис.1), в основной группе, где длительно применялся препарат Церебролизин, получены достоверно лучшие результаты по сравнению с контрольной группой. Примечательно, что в градации 2 результаты лечения в основной и контрольной группах примерно одинаковы и полученная разница (*) статистически недостоверна. С целью более углубленного анализа мы использовали шкалу оценки НИИ им. Н.Н. Бурденко [4] (рис. 2).
Как следует из рисунка 2, в основной группе получены значительно более высокие результаты по 3 первым градациям. Сохраняется отсутствие статистической достоверности в разнице по градации 4. Разница по градации 5 невелика, хотя и статистически достоверна (P < 0,05), зато результаты по градации 6 существенно лучше в основной группе.
Применение препарата Цереболизин проводилось под динамическим электроэнцефалографическим контролем. ЭЭГ-исследование делали до и после курсов Церебролизина специально для оценки изменений судорожной активности головного мозга
Ни в одном наблюдении, даже при наличии эпилептического синдрома и эпилептических очагов на электроэнцефалограмме, не выявлено отрицательной динамики биоэлектрической активности головного мозга.
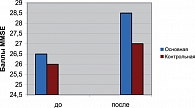
Была проведена оценка результатов в основной и контрольной группах по шкале MMSE.
На рисунке 3 показаны статистически достоверные результаты (P < 0,05), свидетельствующие о высокой эффективности применения препарата Церебролизин при когнитивных нарушениях.
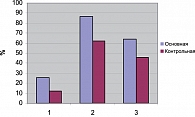
Как известно, критерием эффективности реабилитации больных, перенесших ЧМТ, служит динамика обратного развития дезадаптирующих клинических синдромов, уровень самообслуживания и бытовой активности, трудоспособность [3]. В нашей работе для краткости изложения мы приводим только совокупный результат (рис. 4).
У пациентов с гипертонической болезнью и сопутствующим атеросклерозом сосудов мозга при наличии синдромов неврологического дефицита (моно- и гемипарезы, афазия, мозжечковые нарушения, нарушения функции черепных нервов) нами дополнительно использовался допплерографический контроль с целью уточнения параметров кровотока в интра- и экстракраниальных артериях. При наличии допплерографических критериев недостаточности кровообращения усиливалась вазоактивная терапия.
На рисунке 4 представлены критерии эффективности реабилитации. Получена статистически достоверная разница (P < 0,01) между результатами в основной и контрольной группах, что свидетельствует о более высоком уровне социальной, трудовой и бытовой адаптации у пациентов, в комплексное лечение которых был включен препарат Церебролизин.
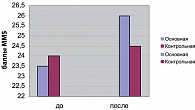
На рисунке 5 представлены результаты динамики когнитивных нарушений у пациентов, получавших в системе комплексного лечения препарат Церебролизин. Эта группа пациентов была специально отобрана в связи с наличием выраженных когнитивных нарушений (средний балл по шкале MMSE 23,5–24 балла).
Для сравнительного анализа у 20 из 37 пациентов были применены более высокие дозы препарата Церебролизин, эта группа на рисунке 5 обозначена как основная. У остальных 17 пациентов Церебролизин применялся в дозах, указанных в подразделе Материалы и методы.
Таким образом, благодаря анализу результатов можно сделать вывод о большей эффективности применения высоких доз Церебролизина.
Заключение
При последствиях тяжелой ЧМТ в группе больных, которым был назначен Церебролизин, отмечались достоверно лучшие результаты по сравнению с контрольной группой. Препарат Церебролизин статистически достоверно улучшал когнитивные, двигательные функции, а также социальную, бытовую и трудовую адаптацию пациентов. Церебролизин показал выраженный дозозависимый эффект. Не было отмечено увеличения частоты судорожных припадков и нарастания судорожной готовности при исследовании биоэлектрической активности головного мозга.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.