Экспериментальный и клинический опыт применения Ремаксола как препарата сопровождения при противоопухолевом лечении
- Аннотация
- Статья
- Ссылки
- English




Введение
За последние 15 лет значительно возросла доля низкодифференцированных форм абдоминального рака, характеризующихся агрессивным течением, инфильтративным типом роста, ранним лимфогенным и гематогенным метастазированием. Кроме того, увеличился удельный вес онкологических пациентов, получивших или получающих хирургическое лечение, химио-, иммунотерапию, таргетную, лучевую терапию, находящихся на длительной нутритивной поддержке и симптоматической терапии. Среди них возросло также количество пациентов пожилого и старческого возраста с диссеминированными формами рака. Почти у 2/3 оперированных онкологических пациентов зарегистрировано более одного сопутствующего заболевания. Данную группу пациентов отличает скомпрометированный гомеостаз, в частности супрессия иммунитета, подавление регенеративной способности тканей, анемия, тканевая гипоксия, нарушение функционального состояния органов, в том числе печени. Кроме того, имеют место специфические осложнения, связанные с особенностями применяемых лекарственных средств (гепатотоксичность, нефротоксичность, кожная токсичность и др.). Все это ухудшает качество жизни пациентов, течение заболевания и его прогноз [1–6].
Сопроводительная терапия у онкологических пациентов направлена:
- на выведение из организма токсических веществ;
- восполнение электролитного дефицита и дефицита нутриентов, необходимых для репаративных процессов не только в печени, но и других органах и тканях;
- улучшение обмена веществ во всех тканях организма, в том числе в гепатоцитах и почках (ключевой фактор, влияющий на исход);
- восполнение объема циркулирующей крови, в частности растворами электролитов;
- улучшение микроциркуляции паренхимы печени и других органов и тканей;
- защиту гепатоцитов от структурных повреждений и восстановление их функциональной активности до нормального уровня [2–4].
Развитие лекарственной гепатотоксичности у пациентов, которым химиопрепарат назначен по жизненным показаниям, представляет для врача задачу повышенной сложности [5].
Разработка, производство и внедрение в клиническую практику отечественных фармацевтических препаратов на сегодняшний день являются одной из приоритетных задач здравоохранения. В то же время поставленная правительством задача по совершенствованию оказания помощи онкологическим пациентам диктует необходимость поиска новых подходов к лечению, в том числе к сопроводительной терапии.
Особую значимость приобретают разработка и внедрение лекарственных средств, обладающих гепато-, нефро-, цитопротективным, дезинтоксикационным и антиоксидантным действием, а также свойствами метаболического корректора [4, 6]. К таким препаратам относятся препараты янтарной кислоты и ее соли – сукцинаты. В медицинской литературе упоминается о гепатопротекторных, цитопротективных и антиоксидантных свойствах сукцинатов. Кроме того, они являются энергетическими субстратами и метаболическими корректорами [6].
К настоящему моменту проведены многочисленные исследования эффективности и безопасности препарата Ремаксол®. Доказано, что Ремаксол® – сбалансированный инфузионный раствор с метаболическим действием. Под влиянием Ремаксола ускоряется переход анаэробных процессов в аэробные, улучшается энергетическое обеспечение гепатоцитов, увеличивается синтез макроэргов, повышается устойчивость мембран гепатоцитов к перекисному окислению липидов, восстанавливается активность ферментов антиоксидантной защиты. При инфузионном введении Ремаксола снижается цитолиз, что проявляется в уменьшении уровня индикаторных ферментов, активности щелочной фосфатазы и гамма-глутамилтранспептидазы, улучшается экскреция прямого билирубина в желчь, ускоряется окисление холестерина в желчные кислоты [6–9]. Основные компоненты Ремаксола – янтарная кислота, инозин, никотинамид и метионин. Янтарная кислота, будучи универсальным внутриклеточным метаболитом, выполняет по отношению к циклу Кребса каталитическую функцию, снижает содержание других интермедиаторов цикла, накапливающихся на ранних стадиях гипоксии. Преобразование янтарной кислоты связано с продукцией энергии, необходимой для обеспечения жизнедеятельности клеток. При увеличении нагрузки на какую-либо из систем организма ее работа обеспечивается в основном за счет окисления янтарной кислоты, а мощность этой системы энергопродукции в сотни раз превосходит таковую других систем энергообразования организма [6–9]. Антиоксидантные свойства янтарной кислоты обусловлены ее способностью ингибировать процессы перекисного окисления липидов. Таким образом, фармакологическая активность янтарной кислоты перекрывает основные патогенетические элементы повреждения клеток. Никотинамид активирует NAD-зависимые ферменты клеток, защищающие мембраны клеток от разрушения свободными радикалами.
Синтез макроэргических молекул усиливается под воздействием инозина – производного пурина – предшественника аденозинтрифосфата. Антиоксидантное действие инозина реализуется за счет:
- активации синтеза NAD в митохондриях из никотинамида, где инозин выступает в роли донора рибозы;
- стимуляции анаэробного гликолиза с образованием лактата и NAD+;
- ингибирования фермента ксантиноксидазы и подавления радикальных процессов.
Липотропный эффект метионина способствует синтезу холина, недостаточное образование которого приводит к нарушению синтеза фосфолипидов из жиров и отложению нейтрального жира в печени. Путем метилирования и транссульфирования метионин обезвреживает токсичные продукты. Согласно данным экспериментальных и клинических исследований, Ремаксол® может успешно применяться у пациентов с интоксикацией различного генеза в качестве сбалансированного инфузионного раствора [6–9]. В настоящее время в силу дезинтоксикационных и гепатопротекторных свойств Ремаксол® используют при проведении химиотерапии у онкологических пациентов [10–14].
Материал и методы
Экспериментальная часть работы выполнена на базе Национального исследовательского центра «Курчатовский институт» – Петербургского института ядерной физики и Института эволюционной физиологии и биохимии Российской академии наук. В эксперименте использованы 30 самцов мышей линии BALB/c (разведены в специализированном питомнике – филиале «Столбовая» Научного центра биомедицинских технологий Федерального медико-биологического агентства). Масса животных на момент включения в исследование составляла 24–28 г. Содержание, питание, выведение животных из эксперимента и утилизация биологических отходов проводились в соответствии с российскими и международными нормативными актами, регламентирующими работу с лабораторными животными, и правилами биоэтики.
Для моделирования опухолевого процесса использован штамм злокачественной аденокарциномы толстой кишки (АКАТОЛ). Выбор тест-системы обусловлен ее удовлетворительными темпами развития и распространения в организме животного с вовлечением в патологический процесс различных органов и систем, а также высокой биологической эквивалентностью с онкологическим заболеванием, регистрируемым у человека, – колоректальным раком (КРР). Новообразование воспроизводили общепринятым способом, путем прямой трансплантации злокачественных клеток, полученных от животных-опухоленосителей в объеме 0,2 мл взвеси опухолевой массы в 0,9%-ном растворе натрия хлорида в соотношении 1:10, подкожно в область правого бока.
Сформированы три экспериментальные группы по десять особей. Контрольную группу (АКАТОЛ) составили животные, которым трансплантирована опухоль с последующим анализом определяемых показателей ее роста и развития, группу цисплатина – животные, которым трансплантирована опухоль с анализом определяемых показателей ее роста и развития на фоне цитостатической терапии препаратом Цисплатин-Эбеве. В данной группе цисплатин стал препаратом выбора из-за практически отсутствующей эффективности при КРР и высокой токсичности [15]. В группу «цисплатин + Ремаксол®» вошли животные, которым трансплантирована опухоль с анализом определяемых показателей ее роста и развития на фоне цитостатической терапии препаратом Цисплатин-Эбеве и поддерживающей терапии препаратом Ремаксол®. Противоопухолевый препарат Цисплатин-Эбеве (Эбеве Фарма Гес.м.б.Х. Нфг. КГ А-4866, Унтерах, Австрия) вводили внутривенно, в растворе 0,9%-ного натрия хлорида однократно, через 48 часов после моделирования опухолевого процесса. Объем введения – 0,25 мл. Доза вводимого препарата – 5 мг/кг массы тела животного. Исследуемый препарат Ремаксол® (предоставлен ООО «НТФФ „ПОЛИСАН“», Россия) вводили интраперитонеально, медленно (скорость введения – до 0,5 мл/мин). Объем введения (доза) – 13 мл/кг массы тела животного. Терапию проводили в течение 14 суток от момента моделирования заболевания. Первое введение препарата осуществлялось через 45 минут после трансплантации опухоли.
Оценивали следующие показатели развития КРР:
- время выявления первичного опухолевого узла (визуально, пальпаторно; сутки);
- динамику роста опухолевого узла (изменение объема опухолевого узла в контрольных точках исследования, три взаимоперпендикулярных размера – a × b × c; см3);
- торможение роста опухоли (ТРО) по формуле: ТРО (%) = [(Vконтроль - Vопыт) / Vконтроль] × 100%, где V – объем опухоли в мм3. Клинически значимый уровень ТРО > 50%;
- среднюю продолжительность жизни (СПЖ) подопытных животных (сутки);
- увеличение продолжительности жизни (УПЖ) по формуле: УПЖ (%) = [(СПЖопыт - СПЖконтроль) / СПЖконтроль] × 100%. Клинически значимый уровень УПЖ > 25%.
Клиническая часть исследования выполнена на базе хирургического и онкологического отделений клиники госпитальной хирургии им. В.А. Оппеля Северо-Западного государственного медицинского университета им. И.И. Мечникова (заведующий кафедрой профессор, д.м.н. Э.Э. Топузов). В исследовании участвовали 175 пациентов (97 женщин, 78 мужчин), последовательно поступавших в клинику с 2008 г. по июль 2018 г. Возраст пациентов – старше 18 лет. У всех пациентов диагностирована аденокарцинома толстой кишки (127 пациентов) или желудка (48 пациентов). В зависимости от стадий КРР и рака желудка пациенты распределились следующим образом: 70 пациентов с III стадией и 105 – с IV стадией. Все пациенты перенесли оперативные вмешательства, в том числе повторные: на толстой кишке или желудке – 212 операций, на печени – 67 операций. Все пациенты получили платиносодержащую химиотерапию по схемам FOLFOX 4, FOLFOX 6, FLOX или XELOX при КРР и CF, XP, CapOX(XELOX) и DCF при раке желудка. У пациентов с КРР применялся адъювантный режим, у пациентов с КРР и раком желудка – терапия первой или второй линии. Химиотерапию прекращали в случае прогрессирования заболевания (для распространенного рака) или развития неприемлемой токсичности.
Всем 73 пациентам основной группы с учетом факторов риска развития токсических реакций в качестве премедикации перед каждым циклом химиотерапии и в течение последующих двух дней вводили Ремаксол® 800 мл/сут, что не противоречило утвержденной Минздравом России инструкции по применению препарата, а также Практическим рекомендациям по профилактике и лечению гепатотоксичности (препарат содержит метионин – предшественник S-аденозил-L-метионина) [14, 16]. При развитии гепатотоксичности пациенты этой группы продолжали получать Ремаксол® 800 мл/сут курсами от семи до 14 дней. Кроме того, они получали поддерживающую терапию в соответствии с рутинной практикой.
В контрольной группе 102 пациента не получали Ремаксол® 800 мл/сут при проведении химиотерапии, но получали поддерживающую терапию в соответствии с рутинной практикой.
При статистической обработке использовали пакет программ SPSS for Windows. Данные приведены в виде М ± m (среднее арифметическое ± ошибка среднего арифметического). Характер распределения данных оценивали с помощью критерия Колмогорова – Смирнова. Средние данные независимых выборок сравнивали на основании U-критерия Манна – Уитни. Корреляционный анализ с расчетом коэффициента корреляции (КК) проводили по критерию Спирмена. Достоверным уровнем отличий считали вероятность не менее 95% (р < 0,05), что является стандартом в медико-биологических исследованиях.
Результаты и их обсуждение
В экспериментальной части работы трансплантация подопытным животным аденокарциномы толстой кишки оказалась успешной в 100% случаев во всех исследуемых группах. АКАТОЛ характеризуется относительно медленным развитием. Первичный опухолевый узел в контрольной группе выявлялся в среднем на шестые-седьмые сутки (6,3 ± 0,47). При этом введение мышам цисплатина в режиме монотерапии не приводило к существенным изменениям показателя интенсивности опухолевого процесса (p = 0,507), в то время как сочетанное применение с исследуемым цитопротекторным препаратом (группа «цисплатин + Ремаксол®») способствовало значительному замедлению роста АКАТОЛ: первичный узел новообразования у животных этой группы определялся в среднем на 1,5 дня позже, чем у нелеченых мышей (р = 0,054).
Время обнаружения первичного опухолевого узла АКАТОЛ положительно коррелировало с продолжительностью жизни подопытных животных (КК = 0,768; р = 0,009) (табл. 1).
Представленные в табл. 1 данные указывают на незначительное влияние цитостатической терапии на среднюю продолжительность жизни мышей на АКАТОЛ, не достигающее клинически значимых показателей. Добавление к схеме экспериментальной химиотерапии препарата Ремаксол® потенцировало действие цисплатина на опухолевый процесс и способствовало достоверному увеличению изучаемого показателя по сравнению с контрольными значениями в среднем на 17,3 дня (37,5%; р = 0,041) и выраженной тенденции к увеличению продолжительности жизни мышей, получавших только цитостатик, в среднем на 12,1 дня (23,5%; р = 0,150).
СПЖ подопытных животных в обследованных группах обратно коррелировала с динамикой роста новообразования (КК = -0,783; р = 0,007) (табл. 2).
При использовании цисплатина отмечалось некоторое снижение темпов развития АКАТОЛ. Практически на всем протяжении эксперимента показатели торможения роста опухоли у подопытных мышей группы цисплатина лишь приближались к клинически значимому уровню (25%). Поддерживающая терапия Ремаксолом на фоне цитостатического лечения значительно усиливала эффективность цисплатина: степень торможения опухолевого роста у мышей группы «цисплатин + Ремаксол®» была выражена достоверно и клинически значимо во всех контрольных точках исследования (табл. 2). При этом высокие значения торможения роста опухоли в этой группе животных наблюдались не только на фоне применения Ремаксола, но и в отсроченный период – на 30-е и 40-е сутки эксперимента.
В клинической части научно-исследовательской работы всем пациентам назначали сопроводительную терапию с целью:
- коррекции анемии – как хронической, обусловленной развитием опухолевого заболевания и проведением химиотерапии, так и острой, связанной с кровопотерей;
- купирования тошноты и рвоты в зависимости от этиологии (химиопрепараты, парез кишечника);
- коррекции синдрома анорексии, кахексии и слабости;
- соблюдения баланса между профилактикой и лечением тромбоэмболических осложнений и послеоперационных кровотечений.
Кроме того, проводились лечение острого болевого синдрома, профилактика и лечение инфекционных осложнений, коррекция последствий сердечно-сосудистой и нефротоксичности, осложнений атеросклероза. Вид инфузионной терапии подбирали исходя из современных представлений [17, 18], с учетом фазы периоперационного периода, характера оперативного вмешательства и потребностей пациента, сроков начала химиотерапии и ее состава. Коррекция последствий поражения печени из-за истинной гепатотоксичности применяемых в терапевтических дозах лекарственных средств, билиарной гипертензии, воздействия прямых механических и физических факторов (резекция, радиочастотная аблация, эмболизация) и клинически значимого замещения паренхимы метастазами проводились с 2016 г. препаратом Ремаксол® 800 мл/сут, курсами от трех до 14 суток. Нежелательные явления на фоне лекарственного противоопухолевого лечения оценивали по критериям CTCAE Version 4.0 [19].
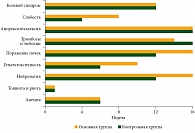
Как показали результаты наблюдения, нежелательные явления имели место в 100% случаев – как в группе Ремаксола (73 пациента), так и в контрольной группе (102 пациента) (табл. 3). Однако их структура, тяжесть, длительность и, что особенно важно, сроки возникновения существенно различались в группах. Отмечалось значительное уменьшение нежелательных явлений легкой степени в группе Ремаксола, прежде всего за счет снижения частоты развития гепатотоксичности. Аналогичная тенденция наблюдалась и при возникновении нежелательных явлений средней степени тяжести (Grade 2) в группе Ремаксола. Только у 46,6% пациентов, получавших Ремаксол®, зарегистрированы нежелательные явления второй степени. В контрольной группе этот показатель составил 69,6%. В контрольной группе побочные явления третьей степени фиксировались несколько реже, но в более ранние сроки (рисунок) и сохранялись более длительно, особенно при наличии у пациентов с различными повреждениями печени паренхиматозного компонента. С нашей точки зрения, интерес представляет разница между группами в развитии сроков периферической нейропатии, а также синдрома слабости, что, вероятно, связано с метаболическим характером компонентов Ремаксола.
Заслуживает внимания и структура хирургических осложнений, возникших на фоне химиотерапии (табл. 4) в обеих группах. Применение препарата Ремаксол® не повлияло на частоту развития механической желтухи, но уменьшило тяжесть проявлений ее цитолитического компонента у всех пациентов. Увеличение частоты встречаемости субкомпенсированного нарушения кишечной проходимости канцероматозной этиологии в группе Ремаксола, вероятно, можно объяснить некоторым увеличением продолжительности жизни пациентов на фоне удовлетворительной переносимости гепатотоксичных химиопрепаратов. Однако для подтверждения статистической достоверности обоих положений необходимы дальнейшие исследования.
Заключение
Эффективность цисплатина в дозе 5 мг/кг массы тела на модели экспериментальной аденокарциномы толстой кишки оказалась низкой. С учетом результатов предварительных испытаний, а также высокой частоты и тяжести развивавшихся на фоне химиотерапии системных осложнений увеличение дозы свыше 6 мг/кг считаем нецелесообразным. Инфузионный цитопротектор Ремаксол®, включенный в состав экспериментальной химиотерапии, оказал выраженное потенцирующее действие на биологическую активность цисплатина в отношении экспериментальной модели опухоли. У мышей группы «цисплатин + Ремаксол®» статистически и клинически значимо увеличился латентный период, предшествовавший формированию первичного пальпируемого опухолевого узла, замедлилось развитие новообразования, что закономерно привело к увеличению продолжительности жизни подопытных животных. Наряду с увеличением эффективности цисплатина на фоне введения Ремаксола® ухудшения профиля безопасности цитостатика не наблюдалось: средняя продолжительность жизни и динамика опухолевого процесса в группе «цисплатин + Ремаксол®» по всем исследуемым показателям были клинически более благоприятными, чем в группе только цисплатина.
Включение в состав сопроводительной терапии онкологических пациентов инфузионного препарата Ремаксол® статистически и клинически значимо увеличило латентный период, предшествовавший развитию токсичности на фоне химиотерапии у пациентов с распространенным КРР и раком желудка, и позволило сохранить разовые и курсовые дозы химиопрепаратов при проведении адъювантной химиотерапии у 46 (63,0%) пациентов (в контрольной группе – 57,8%).
Полученные результаты позволяют рекомендовать Ремаксол® в качестве препарата сопровождения при химиотерапии у пациентов с КРР и раком желудка.
E.I. Drogomiretskaya, A.P. Trashkov, A.L. Kovalenko, V.K. Balashov, M.A. Bobrakov, E.A. Yerokhina,
A.N. Kruglov, V.V. Stelmakh, E.E. Topuzov, D.M. Rizakhanov, S.N. Dzhanbulatov, Ya.D. Barakov,
A.M. Zaytseva, I.Ye. Sviridov, Yu.V. Sukhareva, O.A. Terentyeva
I.I. Mechnikov North-Western State Medical University
‘Kurchatov’s Institute᾿ National Research Center – St. Petersburg Institute of Nuclear Physics
Institute of Evolutionary Physiology and Biochemistry of Russian Academy of Sciences
Institute of Toxicology of FMBA of Russia
Contact person: Elena Ivanovna Drogomiretskaya, drogomir@yandex.ru
In the clinical and experimental work it is provided the experience of the domestic drug Remaxol®, intended for the treatment of patients with various liver lesions. Remaxol® is a balanced infusion solution with metabolic action. Under the influence of Remaxol® the transition of anaerobic processes in aerobic accelerates, the energy supply of the hepatocytes improves, the synthesis of makroergs increases, an increased resistance of membranes of hepatocytes to lipid peroxidation, restored the activity of antioxidant enzymes. The experimental part of the work was performed on the model of colorectal cancer with the use of platinum preparation. It is shown that Remaxol® does not potentiate tumor growth during chemotherapy and does not increase the side effects of platinum drugs. The clinical part of the work demonstrated the effectiveness of a balanced infusion drug Remaxol® as a hepatoprotector in patients suffering from colorectal cancer and gastric cancer and receiving chemotherapy with the inclusion of platinum drugs.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.