Эндотелиальная дисфункция как фактор прогрессирования неалкогольного стеатогепатита. Терапевтические подходы
- Аннотация
- Статья
- Ссылки
Неалкогольная жировая болезнь печени (НАЖБП) в последнее десятилетие стала одной из наиболее распространенных форм поражения гепатобилиарной системы. В западных странах распространенность данного заболевания в общей популяции достигает 20–30%. При этом почти у 15–25% этой группы больных (около 3–5% от общей популяции) выявляется неалкогольный стеатогепатит (НАСГ), который представляет собой активную стадию заболевания, прогрессирующую до цирроза печени и гепатокарциномы. В статье приводятся данные исследования по изучению особенностей эндотелиальной дисфункции у пациентов с НАЖБП на разных стадиях заболевания с оценкой эффективности медикаментозной коррекции выявленных нарушений.
Неалкогольная жировая болезнь печени (НАЖБП) в последнее десятилетие стала одной из наиболее распространенных форм поражения гепатобилиарной системы. В западных странах распространенность данного заболевания в общей популяции достигает 20–30%. При этом почти у 15–25% этой группы больных (около 3–5% от общей популяции) выявляется неалкогольный стеатогепатит (НАСГ), который представляет собой активную стадию заболевания, прогрессирующую до цирроза печени и гепатокарциномы. В статье приводятся данные исследования по изучению особенностей эндотелиальной дисфункции у пациентов с НАЖБП на разных стадиях заболевания с оценкой эффективности медикаментозной коррекции выявленных нарушений.






К факторам риска НАЖБП относятся абдоминальное ожирение, принадлежность к мужскому полу, инсулинорезистентность (ИР), сахарный диабет 2 типа и наличие диагностических признаков метаболического синдрома (МС) [5]. Так, НАЖБП выявляется у 80–90% лиц с ожирением, у 30–50% пациентов, страдающих сахарным диабетом, и в 90% случаев гиперлипидемии. В педиатрической практике важное значение имеет тот факт, что заболевание чаще диагностируется у детей, страдающих ожирением (40–70%), по сравнению с детьми с нормальной массой тела (3–10%). По сути, НАЖБП можно рассматривать как печеночную манифестацию МС – предиктор диабетических и сердечно-сосудистых осложнений, которые, по данным результатов последних исследований, у больных НАСГ развиваются в 3 раза чаще, чем у пациентов, не имеющих данной патологии [3, 4].
Согласно 3-й панели лечения взрослых в рамках Национальной образовательной программы США по холестерину (National Cholesterol Education Program (NCEP) Adult Treatment Panel (ATP) III) метаболический синдром диагностируется при наличии трех и более критериев (табл. 1).
В современной концепции патогенеза НАЖБП одно из ведущих мест занимает инсулинорезистентность тканей, что еще раз доказывает неразрывную связь понятий МС и НАЖБП [1, 8]. При этом, несмотря на большое количество работ, посвященных данной проблеме, роль ИР в развитии указанных заболеваний до конца не ясна. Одной из гипотез является предположение о том, что первичным дефектом, лежащим в основе ИР, является дисфункция эндотелиальных клеток сосудов, или эндотелиальная дисфункция (ЭД) [10].
Эндотелий представляет собой гормонально активную ткань, которая играет ведущую роль в регуляции тонуса сосудов и их проницаемости, свертываемости крови, адгезии лейкоцитов и ремоделировании сосудистой стенки [9].
Локализация эндотелиальных клеток на границе циркулирующей крови и тканей обусловливает их уязвимость для большого количества патогенных факторов, так как именно эндотелий первым подвергается воздействию высокого гидростатического давления при артериальной гипертензии, гипергликемии и гиперхолестеринемии, контактирует с окисленными липопротеидами низкой плотности и, в конечном счете, со свободными радикалами [16]. Мультифакторное воздействие повреждающих факторов на эндотелиоциты приводит к дисфункции эндотелиальной выстилки сосудов с формированием ангиопатии [24]. При этом функциональная перестройка эндотелия под воздействием патогенетических механизмов развивается постепенно, проходя несколько стадий [14].
Так, начальная, или первая, стадия ангиопатии характеризуется повышением синтетической активности эндотелиоцитов. Развернутая, или вторая, – дисбалансом секреции факторов, регулирующих сосудистый тонус, систему гемостаза и перицеллюлярного взаимодействия. На данном этапе нарушается естественная барьерная функция эндотелиальной выстилки с развитием повышенной проницаемости эндотелия для различных компонентов плазмы. Завершающая, или третья, стадия характеризуется дистрофией и истощением эндотелиальных клеток с ускорением апоптоза и замедлением процессов регенерации.
Наиболее важным субстратом, который синтезируется эндотелиоцитами и регулирует базовые функции эндотелия, является эндотелиальный фактор релаксации NO (оксид азота) – функционально очень нестабильная молекула, по сути представляющая собой свободный радикал [18]. NO играет триггерную роль в регуляции активности вырабатываемых эндотелием других биологически активных веществ, обладает вазодилатирующим эффектом и способностью блокировать пролиферацию гладкомышечных клеток, предотвращая адгезию клеток крови (антиагрегантное действие). NO вызывает не только релаксацию сосудистой стенки, но и подавляет макрофагальную активность, существенно влияя на процессы фиброгенеза, которые играют значительную роль в патологии печени [17, 19]. Следует заметить, что NO-продуцирующая функция эндотелия наиболее подвержена воздействию патогенных факторов.
В настоящее время активно обсуждаются две гипотезы развития эндотелиопатии при МС, которые можно отнести также к НАЖБП [6].
Первая состоит в том, что ЭД является следствием ИР и вторична по отношению к ней. Подтверждением гипотезы можно считать эффекты гипергликемии: активация протеинкиназы С в эндотелиоцитах, способствующая повышению проницаемости сосудистой стенки для белков и блокаде нормальной эндотелий-зависимой дилатации сосудов, усиление перекисного окисления липидов (ПОЛ), продукты которого еще больше угнетают вазодилатирующую способность эндотелиальной выстилки [7, 23].
Согласно второй гипотезе ЭД первична по отношению к ИР. Предположение основывается на том факте, что инсулин связывается с инсулиновыми рецепторами в тканях после прохождения через эндотелиальную выстилку сосуда в межклеточный матрикс, а значит, при повреждении эндотелия транспорт инсулина нарушается, вызывая проявления ИР.
Именно эта гипотеза, с точки зрения патогенеза и профилактики НАЖБП, объясняет необходимость более тщательного изучения состояния здоровья детей не только с избыточной массой тела, но и новорожденных менее 2,5 кг, которым свойственна недостаточная внутриутробная капилляризация развивающихся органов и тканей. Так, имеются данные, указывающие на достоверное снижение эндотелий-зависимой дилатации сосудов и ЛПВП у детей в возрасте 9–11 лет, родившихся с низкой массой тела [15]. При этом другие признаки ИР в этой группе наблюдаемых не выявлялись.
Такие хорошо известные метаболические предпосылки развития НАЖБП, как гипергликемия, гиперинсулинемия, первичная тканевая ИР, связаны с гиперлептинемией, тканевой лептинорезистентностью и дислипидемией. В этих условиях происходит активация процессов ПОЛ и формирование эндотоксикоза, усиливающего активность патологического процесса в печени. В свою очередь, дефицит NO, наряду с гиперпродукцией эндотелина-1, несомненно, участвует в прогессировании НАЖБП [20].
Таким образом, несмотря на отсутствие данных о приоритете дисфункции эндотелия перед ИР, отчетливо видна патогенетическая связь между данными процессами, формирующими порочный круг, который способствует прогрессированию как метаболических, так и сердечно-сосудистых осложнений.
Выявление данного факта обусловливает актуальность поиска новых терапевтических путей в коррекции эндотелиальных нарушений у больных НАЖБП.
Одной из первоочередных целей патогенетической терапии НАЖБП является подбор лекарственных средств, способствующих нормализации функций эндотелиоцитов (прямо или опосредованно) при различных проявлениях синдрома ИР.
Перспективными препаратами, значительно улучшающими функцию эндотелия, по-прежнему остаются антиоксиданты (в частности, липоевая кислота) и лекарственные средства, нивелирующие последствия оксидативного стресса [2, 21]. Важным патогенетическим вариантом терапии является L-аргинин, повышающий концентрацию эндогенного NO [21]. Описывают позитивное влияние на функцию эндотелия препаратов урсодезоксихолевой кислоты (УДХК) [12].
В случае развития выраженной дислипидемии при НАЖБП показаны статины, ингибиторы ангиотензинпревращающего фермента и антагонисты ангиотензиновых рецепторов (при формировании артериальной гипертензии в структуре МС), реализующие свои эффекты через улучшение функции эндотелия [22].
Несмотря на исследования, посвященные этой теме, некоторые вопросы медикаментозной коррекции и применения различных групп препаратов в терапии ЭД при НАЖБП до сих пор остаются неизученными.
Целью нашего исследования явилось изучение особенностей ЭД у пациентов с НАЖБП на разных стадиях заболевания с оценкой эффективности медикаментозной коррекции выявленных нарушений.
Материалы и методы
С целью диагностики ЭД у больных НАЖБП было обследовано 53 человека, средний возраст которых составил 51,4 ± 1,27 года. Все исследуемые были разделены на три группы. Первую группу составили 15 пациентов (8 мужчин и 7 женщин) с жировым гепатозом (ЖГ), получавших монотерапию базовым патогенетическим препаратом коррекции ИР метформином (Сиофор) в суточной дозировке 1000 мг в течение 6 месяцев. Вторая группа была представлена 16 больными НАСГ (9 мужчин и 7 женщин), получавшими Сиофор в суточной дозировке 1000 мг в течение 6 месяцев вместе с эссенциальными фосфолипидами в общепринятых дозах. Третья группа состояла из 16 пациентов (10 мужчин и 6 женщин) с НАСГ, которым наряду с метформином 1000 мг назначался препарат УДХК. Для оценки возможности медикаментозной коррекции ЭД изучалась эффективность патогенетического действия отечественного лекарственного препарата данной группы, относительно недавно появившегося на фармакологическом рынке Урдокса (ЗАО «Фармпроект»). Препарат назначался в дозировке 15 мг на килограмм массы тела 3 раза в день в течение 6 месяцев.
В зависимости от стадии фиброза и степени активности процесса по результатам Фибро/АктиТеста обследуемые II и III групп были подразделены на 3 сопоставимые подгруппы (1, 2, 3). Контрольная группа состояла из 15 здоровых волонтеров, по полу и возрасту соответствовавших исследуемым.
Изучение ЭД проводилось с помощью неинвазивного метода – тестирования реактивности плечевой артерии (ПА) с применением ультразвуковой техники высокого разрешения – путем измерения эндотелий-зависимой вазодилатации (ЭЗВД) в ПА, предложенной в 1992 г. D.S. Celermajer и соавторами [11]. Исследование проводилось по стандартам Руководства по ультразвуковой оценке эндотелий-зависимой, потоком обусловленной вазодилатации в ПА, опубликованного Международной рабочей группой по изучению реактивности плечевой артерии [13]. Результаты сопоставлялись с показателями эндотелий-независимой вазодилатации (ЭНВД) после сублингвального приема 5 мг нитроглицерина.
Метод основан на том, что под воздействием физического или химического стимула эндотелий регулирует сосудистый тонус путем высвобождения сосудосуживающих и сосудорасширяющих веществ, таких как эндотелин и NO соответственно. Механическая стимуляция эндотелия ПА в пробе с реактивной гиперемией дает представление о состоянии ЭЗВД. Оценка индуцируемой потоком вазодилатации проводится по динамике изменения диаметра ПА. Снижение ЭЗВД отражает дисфункцию эндотелия, которая обычно ассоциирована с наличием факторов сосудистого риска.
Оценка результатов ЭД проводилась до лечения, через 3 и 6 месяцев после проведенной терапии.
С целью выявления патогенетической взаимосвязи ЭД с прогрессированием НАЖБП всем пациентам проводилась неинвазивная диагностика – базовый фибротест, состоящий из собственно ФиброТеста, определяющего стадию фиброза, и АктиТеста, диагностирующего степень активности некровоспалительного процесса в печеночной ткани. Исследование Фибро/АктиТеста во II и III группах проводилось до лечения, через 3 и 6 месяцев после терапии.
Результаты исследования
Во всех группах проводилось исследование наиболее репрезентативных показателей вазодилатирующей функции эндотелия (табл. 2).
Как следует из таблицы 2, при исходном измерении диаметра ПА во всех группах достоверные отличия по сравнению с контрольной группой были выявлены только у больных на стадии НАСГ (II и III группы), у которых отмечалась тенденция к усилению нарушений вазодилатации с прогрессированием фиброза и повышением степени активности воспалительного процесса.
При оценке ЭЗВД у пациентов I группы достоверных отклонений от нормальных значений выявлено не было. У всех обследованных II и III групп было обнаружено нарушение прироста вазодилатации (< 10%). Изменения ЭНВД у всех наблюдаемых больных были недостоверны на протяжении всего исследования.
При оценке результатов проведенного всем обследованным лицам Фибро/АктиТеста в I группе были получены средние показатели: 0,19 ± 0,023, что соответствовало отсутствию фиброза (F0), и достоверной гистологической активности 0,17 ± 0,092 (А0).
Данные, полученные во II группе, распределились следующим образом: у 4 обследованных (25,0%, 1 подгруппа) был выявлен портальный фиброз без образования септ (F1 = 0,29 ± 0,059) и минимальная гистологическая активность (А1 = 0,32 ± 0,045); у 8 пациентов (50,0%, 2 подгруппа) – портальный фиброз с наличием единичных септ (F2 = 0,55 ± 0,079) и умеренная активность (А2 = 0,54 ± 0,040); у 4 человек (25,0%, 3 подгруппа) – множественные портоцентральные септы без цирроза (F3 = 0,69 ± 0,094) и высокая активность (А3 = 0,79 ± 0,091).
В результате исследования III группы были получены сходные результаты: наличие портального фиброза без образования септ (F1 = 0,31 ± 0,061) и минимальной гистологической активности (А1 = 0,35 ± 0,061) наблюдались у 4 обследованных (25,0% , 1 подгруппа); портальный фиброз с единичными септами (F2 = 0,58 ± 0,081) и умеренная активность (А2 = 0,57 ± 0,039) были диагностированы у 9 пациентов (56,3%, 2 подгруппа); формирование множественных портоцентральных септ без цирроза (F3 = 0,65 ± 0,087) и высокая активность (А3 = 0,83 ± 0,081) отмечены у 3 человек (18,75%, 3 подгруппа). Таким образом, результаты в указанных подгруппах II и III групп оказались сравнимыми.
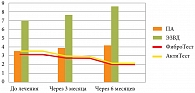
Исходные показатели ФиброТеста у больных II и III групп имели достоверную отрицательную корреляционную связь с параметрами динамики диаметра ПА и ЭЗВД на стадии НАСГ (рис. 1, 2).
Как следует из данных, представленных на рисунке 1, процент прироста диаметра ПА и показатели ЭЗВД достоверно снижались с усугублением фиброза и повышением активности патологического процесса в печени у пациентов II группы.
Данные, представленные на рисунке 2, отражают картину прогрессирующих нарушений вазодилатации пропорционально стадии фиброза и степени активности НАСГ у больных III группы.
Исходя из полученных результатов, можно заключить, что исследуемые группы оказались сопоставимыми для сравнения.
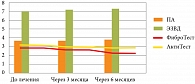
Результаты изучения динамики показателей ЭЗВД на фоне терапии НАСГ Урдоксой в подгруппе с минимальным фиброзом и активностью доказали достоверный положительный эффект через 3 и 6 месяцев (рис. 3).
Так, исходя из полученных результатов, представленных на рисунке 3, при оценке терапии больных III группы препаратом УДХК (Урдоксой) было выявлено достоверное увеличение диаметра ПА (р < 0,005), что является следствием вазодилатирующего действия препарата, а также улучшение релаксирующей функции сосудов за счет показателей ЭЗВД. При исследовании Фибро/АктиТеста отмечалась достоверная регрессия показателей фиброза и активности, причем у лиц со стадией фиброза F1 и минимальной активностью некровоспалительного процесса в ткани печени (1 подгруппа) наблюдалась нормализация показателей.
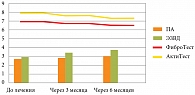
При исследовании показателей II группы, несмотря на положительную динамику в целом, достоверных результатов получено не было (рис. 4).
По данным, представленным на рисунке 4, видно незначительное позитивное влияние терапии на показатели диаметра ПА, ЭЗВД, не носящее достоверного характера.
У пациентов с НАСГ со стадией фиброза F2 и умеренной степенью активности, получавших 6-месячный курс терапии Сиофором и Урдоксой, также проводилась оценка динамики параметров ЭЗВД, фиброза и активности процесса (рис. 5).
На рисунке 5 видно, что у пациентов подгруппы 2 с портальным фиброзом с наличием септ и умеренной степенью активности процесса в результате проведенной комплексной терапии с включением Урдоксы отмечалась достоверная положительная динамика в виде улучшения функции эндотелия, а также уменьшения признаков воспаления и фиброзных изменений по данным Фибро/АктиТеста.
В результате динамического наблюдения пациентов, получавших Сиофор вместе с эссенциальными фосфолипидами, значимых изменений получено не было (рис. 6).
Результаты, представленные на рисунке 6, свидетельствуют, что во II группе у больных НАСГ на стадии портального фиброза и умеренной гистологической активности была достигнута незначительная положительная динамика по сравнению с группой получавших Урдоксу.
Данные по изменению ЭЗВД и регрессии фиброзных изменений и активности процесса в 3 подгруппе III группы представлены на рисунке 7.
Как следует из данных, представленных на рисунке 7, наиболее тяжелая стадия НАСГ с формированием фиброза F3 и высокой степенью активности процесса характеризовалась значимыми нарушениями ЭЗВД, однако применение комплексной терапии с включением Урдоксы привело к достоверному улучшению показателей Фибро/АктиТеста.
В заключение была проведена оценка динамики показателей ЭЗВД, фиброза и степени активности НАСГ у больных, получавших Сиофор и эссенциальные фосфолипиды (II группа, 3 подгруппа).
Из данных, представленных на рисунке 8, следует, что базовое лечение инсулинсенситайзером наряду со стандартной гепатопротективной терапией во II группе существенных результатов не дало.
Заключение
Таким образом, в результате проведенного пилотного исследования была выявлена достоверная патогенетическая связь ЭД с развитием фиброза и степенью активности процесса в ткани печени при НАЖБП на стадии стеатогепатита. Исходя из полученных результатов, мы заключили, что эндотелиальные нарушения можно рассматривать как предиктор прогрессирования данной патологии печени и усугубления сосудистых расстройств.
Учитывая, что эндотелиальная дисфункция является одним из триггеров формирования НАЖБП (наряду с ИР), базовым и патогенетически обоснованным подходом в терапии данного заболевания можно считать применение препарата желчных кислот – Урдоксы.
Урдокса выполняет роль эндотелиального корректора (как прямого, так и опосредованного действия), помимо того, что обладает такими хорошо известными эффектами препаратов данной группы, как гепатопротекция, гиполипидемическое, антиоксидантное и антифибротическое действие. Полученные предварительные результаты могут быть основанием введения в реестр программы обязательной терапии НАЖБП препаратов УДХК не только на стадии стеатогепатита при развернутой ЭД, но и на этапе стеатоза печени для профилактики прогрессирования заболевания. Дальнейшее изучение ЭД и путей ее коррекции является перспективным для разработки комплексной ступенчатой многокомпонентной программы терапии НАЖБП и МС.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.