Современный взгляд на перспективы терапии неалкогольной жировой болезни печени
- Аннотация
- Статья
- Ссылки
Неалкогольная жировая болезнь печени (НЖБП) является самой частой причиной нарушения функционального состояния печени на Земле. В большинстве случаев эта проблема формируется в виде хронического синдрома цитолиза, не связанного с вирусным, аутоиммунным и алкогольным поражением печени. Значительный интерес к НЖБП обусловлен рядом причин. Одной из них являются результаты нескольких исследований, опровергающих высказанное ранее утверждение о доброкачественном течении заболевания [1, 3, 5, 7, 11].
Неалкогольная жировая болезнь печени (НЖБП) является самой частой причиной нарушения функционального состояния печени на Земле. В большинстве случаев эта проблема формируется в виде хронического синдрома цитолиза, не связанного с вирусным, аутоиммунным и алкогольным поражением печени. Значительный интерес к НЖБП обусловлен рядом причин. Одной из них являются результаты нескольких исследований, опровергающих высказанное ранее утверждение о доброкачественном течении заболевания [1, 3, 5, 7, 11].

Согласно определению Американской ассоциации гастроэнтерологов, НЖБП представляет спектр гистологических изменений, включающих жировой гепатоз (ЖГ), неалкогольный стеатогепатит (НАСГ), стеатогепатит с фиброзом и цирроз печени, общей характеристикой которых является отсутствие употребления алкоголя в гепатотоксичных дозах (менее 20–40 г этанола в сутки) [1].
На сегодняшний день установлено, что выявление НЖБП связано с более высоким риском летального исхода не только от осложнений тяжелых форм заболевания печени, но и значимой угрозой возникновения сердечно-сосудистых катастроф (ССК), способных привести к инвалидизации и смерти пациента. Частота последних, по мнению экспертов, при активной форме заболевания – неалкогольном стеатогепатите (НАСГ) – может увеличиваться в 3 и более раз.
Высокий риск ССК у больных НЖБП укладывается в рамки общепризнанного мнения о том, что НЖБП представляет один из компонентов метаболического синдрома (МС), клиническая значимость которого заключается в значительном ускорении развития и прогрессирования атеросклеротического поражения сосудов и, что еще более важно, манифестации системной эндотелиальной дисфункции.
Отдельной проблемой является то, что общепринятых стандартов диагностики и лечения этой нозологической формы нет.
Эпидемиология
Распространенность НЖБП в популяции неизвестна, поскольку в большинстве исследований для верификации диагноза используются биохимическая оценка функционального состояния печени, визуализационные методы (ультразвуковое исследование (УЗИ), компьютерная томография (КТ), магнитно-резонансная томография (МРТ) печени). Исследования, где подтверждение диагноза осуществлялось на основании данных пункционной биопсии печени, как правило, проводились в определенных узких субпопуляциях, например у пациентов с сахарным диабетом (СД) 2 типа и ожирением.
Приблизительная распространенность НЖБП колеблется от 10 до 40%, тогда как частота НАСГ составляет 2–6% [2–6]. Наибольшая вероятность развития НЖБП зарегистрирована в группе лиц с МС. Частота НЖБП у больных СД 2 типа и ожирением, по данным различных исследований, варьирует от 70 до 96%. При этом СД 2 типа был отмечен у 10–75%, ожирение – у 30–100%, гипертриглицеридемия – у 20–92% пациентов с НЖБП [1–9]. Само по себе сочетание диабета и избыточной массы тела повышает риск развития НЖБП. При популяционном обследовании лиц с ожирением и СД 2 типа стеатоз печени был обнаружен у 100% пациентов, у 50% выявлялся НАСГ, а у 19% – цирроз печени [7].
Несмотря на то, что крупнокапельная жировая дистрофия гепатоцитов чаще выявляется при СД 2 типа и ожирении, у здоровых людей также могут обнаруживаться признаки НЖБП. Так, в США у 20% молодых лиц, рассматриваемых в качестве потенциальных доноров для трансплантации печени, были выявлены признаки НЖБП, а при проведении аутопсии жертв автокатастроф у 2,7% человек с нормальным весом обнаруживался НАСГ [1].
Следует заметить, что НЖБП встречается во всех возрастных группах, включая примерно 4% детей с нормальной массой тела и 22–53% детей с ожирением [1, 2, 7]. Однако чаще всего НЖБП, независимо от пола, выявляется в возрасте 40–60 лет [8, 9].
Этиология
Развитие НЖБП может носить первичный характер и быть следствием синдрома инсулинорезистентности (ИР), как и другие компоненты МС. Кроме того, причиной НЖБП может быть быстрое снижение массы тела вследствие голодания и после таких хирургических вмешательств, как гастропластика, еюноилеальное шунтирование, обширная резекция тощей кишки. К другим факторам, способствующим НЖБП, могут быть отнесены такие заболевания, как липодистрофии, абетолипопротеинемия, болезнь Вебера-Крисчена, синдром избыточной бактериальной пролиферации в тонкой кишке, СПИД [3–7].
Патогенез
Модель патогенеза НЖБП включает два основных этапа – «толчка» заболевания [12]. Первый связан с развитием ЖГ и синдромом ИР. Второй манифестирует в результате окислительного стресса, индуцируемого воздействием биологически активных веществ (свободных жирных кислот (СЖК), фактора некроза опухоли α (TNF-α), лептина и др.) на измененные вследствие стеатоза гепатоциты [11]. Образовавшиеся в результате окислительного стресса реактивные фракции кислорода (РФК) индуцируют перекисное окисление липидов (ПОЛ) клеточных мембран, дегенерацию и некроз гепатоцитов, клеточный апоптоз, экспрессию провоспалительных цитокинов, активацию звездчатых клеток (ЗКП) с последующим развитием воспаления и фиброза в ткани печени [7, 12]. Запуск воспалительных реакций осуществляется через активацию фактора транскрипции NF-kB (ядерный транскрипционный фактор kB), который отвечает за экспрессию генов целого ряда провоспалительных факторов (интерлейкины 2, 6, 8, внутриклеточная молекула адгезии 1 (ICAM 1), цитокин-индуцируемый хемоаттрактант нейтрофилов и др.) и ферментов (липоксигеназа, циклооксигеназа, iNOS (индуцируемая NO синтаза)) [7, 11, 12]. При этом воспаление становится дополнительным источником свободных радикалов в печени, усиливая окислительный стресс и способствуя развитию фиброзных изменений [11].
Клиника и диагностика НЖБП
Как правило, для НЖБП характерно бессимптомное течение. Жалобы, предъявляемые пациентами, неспецифичны. Наиболее частыми симптомами при НЖБП являются астения, неопределенный дискомфорт в правом верхнем квадранте живота. Появление кожного зуда, анорексии, диспепсического синдрома, наряду с развитием симптомокомплекса портальной гипертензии, свидетельствуют о далеко зашедшей стадии НАСГ [33]. Развитие цирроза печени характеризуется появлением асцита, печеночной энцефалопатии [1, 4].
При объективном осмотре пациентов с НЖБП обращают на себя внимание гепатомегалия, которая встречается у 50–75% больных, и спленомегалия, выявляемая у 25% больных [1, 2, 4, 5, 7]. Ожирение или избыточная масса тела отмечена у 30–100% пациентов с НАСГ [3, 6, 8, 9].
При лабораторном исследовании выявляются следующие характерные для НЖБП изменения:
- активности аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ) не более чем в 4–5 раз отмечено у 50–90% больных, индекс АСТ/АЛТ не более 2, чаще повышена активность АЛТ [1, 7];
- активности щелочной фосфатазы (ЩФ), гаммглютамилтранспептидазы (ГГТП) – не более чем у 50% больных [1, 4, 7];
- у 20–92% больных [5–9];
- нарушение толерантности к глюкозе (НТГ) или СД 2 типа) – у 30–50% больных [1–3, 7–9];
- гипоальбуминемия, повышение билирубина, увеличение протромбинового времени у пациентов с далеко зашедшей стадией НАСГ [4, 7];
- метаболизма железа (повышение уровня ферритина и насыщения трансферрина сыворотки) [3, 14].
Инструментальные методы (УЗИ, КТ, МРТ) дают возможность верифицировать гепатомегалию, косвенно оценить степень стеатоза печени и зарегистрировать формирование портальной гипертензии. УЗИ является самым недорогим инструментальным методом диагностики стеатоза печени.
Визуализационные методы диагностики при всей своей информативности не позволяют оценить наличие признаков стеатогепатита, степень НАСГ и стадию фиброза печени [15, 16]. Поэтому с целью верификации диагноза необходимо проведение пункционной биопсии.
Проведение пункционной биопсии печени у больных с подозрением на НЖБП и особенно НАСГ может быть рекомендовано:
- в возрасте старше 45 лет с хроническим синдромом цитолиза неустановленной этиологии;
- с хроническим синдромом цитолиза неустановленной этиологии и по крайней мере с двумя проявлениями МС независимо от возраста [13].
Морфологическая картина печени
Понятие НЖБП объединяет спектр морфологических изменений печени, каждое из которых имеет свои характерные черты. Основными морфологическими критериями НЖБП являются:
- стеатоз, преимущественно в 3-й зоне ацинуса, характеризующийся наличием крупных липидных капель в цитоплазме со смещением ядра к периферии дольки;
- дистрофия гепатоцитов;
- лобулярное воспаление, преимущественно представленное полиморфно-ядерными лейкоцитами, мононуклеарами;
- фиброз в 3-й зоне ацинуса [3, 7, 10, 17].
Помимо основных признаков при НЖБП могут обнаруживаться: гликогеноз ядер 1-й зоны, липогранулемы в дольках, ацидофильные тельца или PAS-позитивные глобулы в клетках Купфера, жировые кисты, тельца Маллори в гепатоцитах с баллонной дистрофией преимущественно в 3-й зоне ацинуса, отложения железа в гепатоцитах 1-й зоны или рассеянные вдоль синусоид, мегамитохондрии в гепатоцитах. Нехарактерными для НЖБП являются мелкокапельный стеатоз, вено-окклюзионные повреждения, флебосклероз, перивенулярный фиброз, преобладание портального воспаления или фиброза, острый или хронический холестаз [17].
Течение НЖБП
Ранее принято было считать, что НЖБП протекает доброкачественно. Однако последние исследования показали, что пациенты с НЖБП имеют более высокий риск летального исхода, чем в общей популяции, что обусловлено прогрессированием поражения печени и развитием ССК [5, 18].
Высокий риск ССК у пациентов с НЖБП подтверждается рядом данных, указывающих на большую выраженность субклинических признаков атеросклероза. Одним из таких показателей является толщина интимы (ТИ) сонной артерии, достоверное увеличение которой было обнаружено у больных НЖБП по сравнению с группой здоровых лиц [19–21]. При этом у пациентов с НАСГ увеличение ТИ сонной артерии было более выраженным, чем у больных НЖБП без воспалительно-деструктивных изменений, и, что более важно, гистологическая степень НЖБП влияла на ТИ сонной артерии, независимо от таких классических факторов риска атеросклероза, как ИР и компоненты МС [22, 23]. Полученные данные подтверждаются также популяционным исследованием, продемонстрировавшим у больных НЖБП более высокую встречаемость атеросклеротических бляшек в сонной артерии, чем в группе здоровых [24].
Другим субклиническим признаком атеросклероза, обнаруженным у пациентов с НЖБП, стало выявление эндотелиальной дисфункции. Ряд работ продемонстрировал значимое снижение эндотелийзависимой вазодилатации плечевой артерии у больных НЖБП как с СД 2 типа, так и без него. При этом снижение данного показателя коррелировало со степенью морфологических изменений в печени независимо от пола, возраста пациентов, выраженности ИР и других компонентов МС [25, 26] .
Тем не менее факторы, способствующие прогрессированию НЖБП с развитием гепатита и цирроза печени, требуют уточнения. В качестве основных предикторов прогрессирования заболевания рассматривается возраст старше 45 лет, мужской пол, ожирение и СД 2 типа. Это было продемонстрировано в двух исследованиях, в которых были проанализированы 187 человек с криптогенным циррозом печени: 73% из этой группы страдали одновременно ожирением и СД 2 типа [27, 28].
Возраст является не менее важным фактором риска. Так, в клинике Mayo было показано, что фиброз развивается лишь у 4% больных моложе 45 лет, а у пациентов с нормальной массой тела моложе 45 лет не было зарегистрировано ни одного случая фиброза [28].
Анализ 105 больных НЖБП, подвергнувшихся пункционной биопсии, выявил факторы, способствующие развитию НАСГ:
- артериальная гипертензия;
- индекс ИР;
- активность АЛТ.
Сочетание этих 2 или 3 критериев позволяет прогнозировать прогрессирование заболевания с формированием НАСГ (чувствительность и специфичность при этом составляют 80 и 89% соответственно) [29].
При аналогичном исследовании с морфологическим контролем были установлены предикторы формирования фиброза у больных НЖБП:
- массы тела 28 кг/м2 и более;
- старше 50 лет;
- активности АЛТ более чем в 2 раза;
- триглицеридов (ТГ) более 1,7 ммоль/л.
Выявление менее 2 критериев позволяет со 100-процентной уверенностью исключить возможное развитие фиброза и цирроза печени [30].
Лечение НЖБП
В настоящее время все лечебные мероприятия, используемые в терапии больных НЖБП, можно классифицировать в зависимости от патогенеза заболевания.
- Лечение синдрома ИР (МС):
- снижение массы тела (диета и физические нагрузки);
- чувствительности клеточных рецепторов к инсулину (метформин, тиазолидиндионы);
- уровня ТГ (фибраты, статины);
- концентрации TNF-α (пентоксифиллин) [31].
- Лечение окислительного стресса:
- антиоксиданты и гепатопротекторы (витамин Е, силимарин, бетаин, N-ацетилцистеин, урсодеоксихолевая кислота, α-липоевая кислота (АЛК));
- трансплантация печени.
Снижение массы тела
Снижение массы тела оказывает положительный эффект на течение НЖБП, так как приводит к уменьшению ИР, увеличивает утилизацию глюкозы клетками, ингибирует окисление липидов. Снижение массы тела только на 5–10% уже приводит к уменьшению гепатоспленомегалии, симптомов НЖБП и активности АЛТ, АСТ и, как правило, коррелирует с уменьшением стеатоза печени [9, 13, 32, 33]. Однако стоит помнить, что быстрая потеря веса может привести к развитию «острого» НАСГ с формированием портального фиброза, центральных некрозов на фоне значительного повышения воспалительной активности за счет увеличения поступления СЖК в печень [9, 34]. Наиболее актуальна эта проблема для использования хирургических методов лечения (гастропластика, еюноилеальное шунтирование, обширная резекция тощей кишки) у пациентов с НЖБП и ожирением. Это связано с тем, что после подобных оперативных вмешательств вероятность слишком быстрой потери веса, способствующей прогрессированию НАСГ с формированием цирроза и печеночной недостаточности, очень высока. Наиболее опасным с точки зрения развития «острого» НАСГ считается метод еюноилеального шунтирования [9, 35]. Поэтому в настоящее время у пациентов с резко выраженным ожирением (индекс массы тела (ИМТ) более 40 кг/м2) предпочтение отдается методу гастропластики и лапароскопическому бандажированию желудка [35, 36]. Доказано, что для больных ожирением и НЖБП безопасным и эффективным является снижение массы тела на 500 г в неделю для детей и на 1600 г в неделю для взрослых [34].
В настоящее время активно обсуждается использование в лечении НЖБП и ожирения препаратов, которые применяются в медицине для снижения веса, в частности орлистата.
Физическая активность
Обязательным условием лечения больных НЖБП является физическая нагрузка. Она оказывает положительный эффект на снижение массы тела и чувствительность к инсулину, при этом увеличивает поступление СЖК в мышечную ткань, где происходит их окисление, тем самым обеспечивается уменьшение ИР. Степень снижения ИР, как правило, коррелирует с интенсивностью физических упражнений, которые рекомендуется проводить не менее 3 раз в неделю, общей продолжительностью 8–10 часов. Однако не у всех пациентов физическая нагрузка приводит к уменьшению массы тела и улучшению показателей липидного обмена. Поэтому сочетание гипокалорийной диеты и физической нагрузки у больных НЖБП является не только базисной терапией заболевания, но и важным диагностическим фактором. Так, при отсутствии нормализации воспалительных изменений в печени на фоне соблюдения диетических рекомендаций и активного образа жизни необходимо дифференцировать другие заболевания печени [1].
Для больных СД 2 типа и НЖБП важным остается хороший метаболический контроль (оптимальными считаются нормальные уровни гликемии натощак и после еды).
Лекарственная терапия
Для уменьшения ИР у пациентов с НЖБП могут быть использованы препараты, широко применяемые в диабетологии для лечения СД 2 типа. Одним из таких средств является метформин. Его положительные эффекты на состояние печени обусловлены следующими механизмами действия:
- уменьшение продукции глюкозы в печени за счет подавления глюконеогенеза и окисления липидов и СЖК;
- повышение чувствительности периферических тканей к инсулину на 18–50% путем усиления связывания инсулина с рецепторами, нормализации активности тирозинкиназы, улучшения транспорта глюкозы белками – переносчиками ГЛЮТ-1 и ГЛЮТ-4;
- анорексигенный эффект периферического типа;
- снижение концентрации ТГ в плазме;
- подавление липолиза в жировой ткани;
- подавление экспрессии TNF-α в печени [37].
В двух исследованиях назначение метформина в суточной дозе 1500 мг больным с НАСГ в течение 4–6 месяцев привело к снижению массы тела, нормализации активности трансаминаз, уменьшению размеров печени, снижению концентраций в крови ТГ и холестерина. Эти результаты были связаны с уменьшением явлений ИР у наблюдаемых пациентов [38, 39]. Назначение метформина в суточной дозе 1000 мг на протяжении 24 недель приводило к снижению показателей цитолитического синдрома, индекса ИР (НОМА) и уменьшению стеатоза печени по данным МРТ [40]. Однако не существует единого мнения о влиянии метформина на морфологические изменения в печени у пациентов с НЖБП, поскольку не во всех исследованиях были получены данные, подтверждающие положительное действие метформина на показатели воспаления и фиброза [14]. Анализ работ по изучению эффективности метформина у больных НЖБП, проведенных до настоящего времени, показал, что полученных в них данных недостаточно для стандартизации назначения метформина в качестве одного из базисных препаратов в лечении НЖБП [38].
Кроме этого, метформин не рекомендуется применять у пациентов с далеко зашедшими формами НЖБП, протекающими с синдромом печеночной недостаточности, из-за риска развития лактат ацидоза [41]. Наблюдались также случаи идиосинкразической гепатотоксичности метформина с развитием острого гепатита на фоне его приема [38].
Вторая группа лекарственных средств, влияющих на ИР у пациентов с НАСГ, представлена тиазолидиндионами (пиоглитазон, розиглитазон). Эти препараты, действуя через ядерные PPAR-γ, изменяют транскрипцию генов, регулирующих метаболизм глюкозы и липидов, что в присутствии эндогенного инсулина приводит к повышению захвата глюкозы периферическими тканями, снижению глюконеогенеза в печени, уменьшению липолиза, снижению концентрации в плазме крови ТГ и СЖК. Активация PPAR-γ в ЗКП тормозит синтез коллагена и фиброгенез in vitro и in vivo [42]. Таким образом, агонисты PPAR-γ могут найти применение в лечении НЖБП благодаря своим механизмам действия. Есть сообщения об улучшении биохимических показателей крови, уменьшении воспаления и стеатоза в печени у пациентов с НАСГ, принимавших тиазолидиндионы в течение 3–12 месяцев [13, 38, 43]. Но в целом вопрос применения этой группы препаратов у больных НЖБП требует проведения дальнейших исследований.
Учитывая патогенез заболевания, у пациентов с НЖБП может оказаться эффективным применение гиполипидемических средств, снижающих уровень ТГ. К таким препаратам относятся, в первую очередь, фибраты. Однако не существует общепринятого мнения в отношении их применения у пациентов с НЖБП. В проспективном рандомизированном плацебоконтролируемом исследовании было отмечено снижение уровня ТГ, нормализация биохимических показателей крови у пациентов с НАСГ, принимавших гемофиброзил в течение 4 недель [44]. В другой работе была продемонстрирована неэффективность клофибрата [45]. Несмотря на кажущуюся безопасность этих препаратов, не следует забывать о возможности развития фибрат-индуцированных гепатитов. Есть данные о применении у больных НАСГ статинов, в частности аторвастатина. Его назначение пациентам с НАСГ и дислипидемией в дозе 10 мг в сутки в течение 38 недель было связано с достоверным снижением активности АЛТ, ГГТП, уровней общего холестерина и ТГ, а также с гистологическим уменьшением степени стеатоза. При этом не было получено положительной динамики воспалительных изменений и фиброза [46].
Назначение антиоксидантов у больных НЖБП оправдано наличием такого важного патогенетического звена в развитии НАСГ, как окислительный стресс, однако имеющихся данных недостаточно, для того чтобы оценить эффективность того или иного препарата.
Применение при НЖБП урсодеоксихолевой кислоты, обладающей цитопротектив-ным, иммуномодулирующим и антиапоптозным эффектами, в дозе 13–15 мг/кг/сут в течение года оказало положительное влияние на биохимические показатели и стеатоз, но ее влияние на гистологические характеристики НАСГ требуют дальнейшего изучения [45].
Давно известно, что АЛК является мощным антиоксидантом, обладая рядом эффектов, способствующих нормализации метаболических процессов в печени:
- повышение содержания детоксицирующих субстанций в гепатоците (глутатион, цистеин);
- подавление ПОЛ;
- восстановление структур и функций мембран гепатоцитов;
- повышение окисления жирных кислот и ацетата (предупреждение развития стеатоза гепатоцитов);
- снижение продукции провоспалительных цитокинов;
- антифибротический эффект [47].
Кроме этого, применение АЛК у пациентов с НЖБП оправдано ее влиянием на жировой и углеводный виды обменов, что обусловлено торможением синтеза холестерина, подавлением высвобождения СЖК из жировой ткани и ускорением их окисления, а также усилением захвата и утилизации глюкозы клеткой через активацию глюкозных транспортеров и внутриклеточный транспорт глюкозы, повышением чувствительности клеточных рецепторов к инсулину [47].
В целом отсутствие однозначных данных по вопросу использования того или иного препарата в лечении НАСГ требует разработки стандартов диагностики и лечения этого заболевания для практической медицины.
В связи с этим нами было проведено исследование по оценке эффективности комбинированной терапии метформином и АЛК у больных НАСГ.
Материалы и методы
В исследование было включено 29 пациентов с СД 2 типа и НАСГ (средний возраст 57,6 ± 0,6 лет, 16 мужчин, 13 женщин). Диагноз заболевания был подтвержден данными пункционной биопсии. Группы сравнения в данном исследовании не было ввиду сложности набора пациентов на инвазивное исследование.
Адекватный метаболический контроль был достигнут диетой и приемом метформина (препарат Сиофор производства «Берлин-Хеми», Германия) в индивидуально подобранной дозировке до начала исследования (гликозилированный гемоглобин менее 6,5%).
Всем пациентам проводился курс АЛК (препарат Берлитион производства «Берлин-Хеми», Германия): по 600 мг Берлитиона внутривенно капельно ежедневно в течение 14 дней, в дальнейшем пероральный прием препарата в суточной дозе 600 мг однократно в течение 6 месяцев. Период наблюдения за больными составил 6 месяцев с проведением контрольных клинико-лабораторных, инструментальных исследований через 90 и 180 дней.
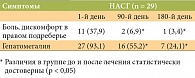
На фоне проводимого лечения у большинства пациентов уже к 90-му дню наблюдения отмечался регресс клинических проявлений НАСГ, а к моменту окончания терапии в большинстве наблюдений отсутствовали клинические проявления болевого, диспепсического и астеновегетативного синдромов, практически полностью купировалась гепатомегалия (табл. 1).
На 90-й день приема препарата наблюдалось снижение активности АЛТ, АСТ, ЩФ, ГГТП и уровня общего билирубина. Положительная динамика в изменении биохимических показателей сохранялась и к 180-му дню исследования (табл. 2).
Не менее важной для пациентов с СД 2 типа явилась положительная динамика показателей углеводного и липидного обменов на фоне лечения Берлитионом. После 6-месячной терапии у больных НАСГ было зарегистрировано достоверное улучшение показателей углеводного обмена. Так, статистически достоверно снизились уровень глюкозы плазмы натощак (ГПН) на 0,6 ± 0,5 ммоль/л (с 6,1 ± 0,1 до 5,5 ± 0,06 ммоль/л), уровень гликозилированного гемоглобина (HbAc1) на 0,84 ± 0,07% (с 6,4 ± 0,1 до 5,6 ± 0,07) и показатель НОМА-IR на 2,4 ± 0,3 (с 6,9 ± 0,7 до 4,5 ± 0,2) (р < 0,05). Кроме того, наблюдалось достоверное снижение уровня иммунореактивного инсулина (ИРИ) – на 7,1 ± 0,5 мкЕд/мл (с 25,1 ± 1,2 до 18,1 ± 0,7 мкЕд/мл).
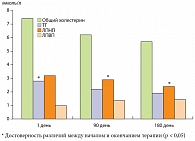
Применение Берлитиона оказало положительное влияние на профиль липидов в сыворотке крови. В частности, на фоне проводимого лечения отмечалось статистически достоверное увеличение содержания липопротеидов высокой плотности (ЛПВП) от исходного уровня на 44% (с 1,0 ± 0,04 до 1,44 ± 0,03 ммоль/л, р < 0,05). Наблюдалась общая тенденция в снижении уровней общего холестерина, ТГ и ЛПНП. Снижение уровня ТГ произошло в среднем в 1,5 раза по сравнению с исходными данными (с 2,8 ± 0,1 до 1,9 ± 0,06 ммоль/л, р < 0,05). Уровень общего холестерина уменьшился в среднем на 23% (с 7,4 ± 0,2 до 5,7 ммоль/л, р < 0,05), что свидетельствовало о гиполипидемическом действии Берлитиона, связанном с угнетением синтеза эндогенного холестерина (рис. 1).
Влияние Берлитиона на уровень ЛПВП у больных данной категории имеет особое значение, так как этот показатель является одной из базисных характеристик метаболического синдрома. При этом применение комбинированного с Берлитионом лечения способствовало достоверному росту этого показателя, преимущественно за счет улучшения функционального состояния печени. Полученный эффект в перспективе может рассматриваться как отдельное направление терапии у пациентов НЖБП.
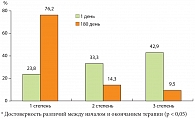
Наиболее важным в оценке эффективности проводимого лечения являлось повторное гистологическое исследование биоптатов печени, которое было выполнено у 21 пациента. После окончания курса по результатам контрольной пункционной биопсии было установлено, что лечение больных СД 2 типа и НАСГ Берлитионом сопровождалось значимым уменьшением степени стеатоза в печени. Так, отмечалось достоверное уменьшение 2-й и 3-й степени за счет возрастания 1-й (рис. 2).
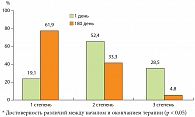
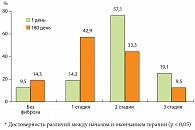
Аналогично степени стеатоза была отмечена регрессия воспалительных изменений в печени, что выражалось в снижении активности деструктивного процесса (рис. 3).
Оценка стадии фиброзных изменений в печени свидетельствовала об отсутствии дальнейшего прогрессирования фиброза и значимого увеличения числа пациентов с перипортальным фиброзом (рис. 4).
Результаты исследования показали положительное влияние комбинированной терапии Берлитионом и Сиофором не только на клинико-лабораторные синдромы у больных НАСГ, но и на степень морфологических изменений в печени, выраженность которых имеет значение как для течения НЖБП, так и для формирования системной ИР, являющейся основной причиной развития МС. Поэтому Берлитион, наряду с другими антиоксидантами, может рассматриваться, как основной препарат базисной терапии НЖБП.
Таким образом, НЖБП представляет серьезную междисциплинарную проблему не только в разделе гепатологии, но и затрагивает интересы кардиологии и эндокринологии. Именно больные СД 2 типа, ожирением и МС имеют наибольший риск развития НЖБП и связанных с ней осложнений в виде раннего атеросклероза и ССК. Одной из главных задач в изучении НЖБП должна стать разработка практических стандартов диагностики и лечения этого заболевания, направленных на улучшение качества жизни пациента и снижение риска летального исхода.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.