Эволюция подкожной иммунотерапии аллергенами (часть 1): от первых разработок до концепции терапии, управляемой иммунным ответом
- Аннотация
- Статья
- Ссылки
Введение
Подкожная иммунотерапия аллергенами (пкАСИТ) — классический метод лечения IgE-опосредованного аллергического респираторного заболевания. Растущее понимание основ иммунологических механизмов определяет путь к дальнейшему клиническому совершенствованию этого лечения. Нововведения в пкАСИТ включают как схемы лечения, так и новые формы применяемых экстрактов аллергенов. Немодифицированные препараты аллергенов в форме водных или физически связанных (продленного высвобождения) экстрактов, а также химически модифицированные аллергены (аллергоиды) в настоящее время представлены на рынке для проведения пкАСИТ в Германии. Однако на сегодняшний день клиническая документация препаратов для поведения пкАСИТ в клинических исследованиях неоднородна.
Методы
Направленный поиск литературы был проведен в PubMed и Medline, а также были проанализированы недавние публикации в немецкоязычных журналах, отсутствующие в этих базах данных. Этот поиск литературы включал оригинальные и обзорные статьи на немецком и английском языках.
Результаты
пкАСИТ - это давно зарекомендовавший себя и хорошо задокументированный метод лечения аллергии различными аэроаллергенами и ядами насекомых, эффективность и безопасность которого продемонстрирована как у взрослых, так и у детей. В соответствии с Постановлением Германии о лечении аллергенами (TAV) несколько препаратов для поведения пкАСИТ в настоящее время проходят клинические исследования. Схемы лечения являются непрерывными круглогодичными (многолетними), предсезонными и комбинированными пред- и межсезонными. Первоначальный этап дозирования может быть выполнен посредством стандартных, кластерных или ускоренных методов. Подкожная АСИТ особенно хорошо зарекомендовал себя для таких часто встречающихся вдыхаемых аллергенов, как пыльца трав, Betula sp. (береза, ольха, лещина), клещи домашней пыли (Dermatophagoides sp.) и яды насекомых (пчелиный яд и яд ос). Хорошие результаты получены и по ряду других терапевтических аллергенов, например по пыльце таких сорняков, как амброзия, полынь и т.д., плесени (Alternaria, Cladosporium и др.), амбарным клещам, перхоти животных (например, кошачьей). Более того, в настоящее время продолжаются дальнейшие клинические исследования по новым показаниям, таким как синдром оральной аллергии и атопический дерматит (АтД).
Выводы
При адекватном назначении врачами, имеющими опыт в аллергологии, препараты пкАСИТ безопасны, хорошо переносятся и клинически эффективны.
Введение
Подкожная иммунотерапия аллергенами (пкАСИТ) — классический метод лечения IgE-опосредованного аллергического респираторного заболевания. Растущее понимание основ иммунологических механизмов определяет путь к дальнейшему клиническому совершенствованию этого лечения. Нововведения в пкАСИТ включают как схемы лечения, так и новые формы применяемых экстрактов аллергенов. Немодифицированные препараты аллергенов в форме водных или физически связанных (продленного высвобождения) экстрактов, а также химически модифицированные аллергены (аллергоиды) в настоящее время представлены на рынке для проведения пкАСИТ в Германии. Однако на сегодняшний день клиническая документация препаратов для поведения пкАСИТ в клинических исследованиях неоднородна.
Методы
Направленный поиск литературы был проведен в PubMed и Medline, а также были проанализированы недавние публикации в немецкоязычных журналах, отсутствующие в этих базах данных. Этот поиск литературы включал оригинальные и обзорные статьи на немецком и английском языках.
Результаты
пкАСИТ - это давно зарекомендовавший себя и хорошо задокументированный метод лечения аллергии различными аэроаллергенами и ядами насекомых, эффективность и безопасность которого продемонстрирована как у взрослых, так и у детей. В соответствии с Постановлением Германии о лечении аллергенами (TAV) несколько препаратов для поведения пкАСИТ в настоящее время проходят клинические исследования. Схемы лечения являются непрерывными круглогодичными (многолетними), предсезонными и комбинированными пред- и межсезонными. Первоначальный этап дозирования может быть выполнен посредством стандартных, кластерных или ускоренных методов. Подкожная АСИТ особенно хорошо зарекомендовал себя для таких часто встречающихся вдыхаемых аллергенов, как пыльца трав, Betula sp. (береза, ольха, лещина), клещи домашней пыли (Dermatophagoides sp.) и яды насекомых (пчелиный яд и яд ос). Хорошие результаты получены и по ряду других терапевтических аллергенов, например по пыльце таких сорняков, как амброзия, полынь и т.д., плесени (Alternaria, Cladosporium и др.), амбарным клещам, перхоти животных (например, кошачьей). Более того, в настоящее время продолжаются дальнейшие клинические исследования по новым показаниям, таким как синдром оральной аллергии и атопический дерматит (АтД).
Выводы
При адекватном назначении врачами, имеющими опыт в аллергологии, препараты пкАСИТ безопасны, хорошо переносятся и клинически эффективны.





Введение
Помимо мер по предотвращению контактов с аллергенами, аллерген-специфическая иммунотерапия (АСИТ) остается единственным доступным этиотропным методом лечения таких IgE-опосредованных аллергических заболеваний, как аллергический риноконъюнктивит и аллергическая астма. Механизм, лежащий в основе АСИТ, включает индукцию специфических (блокирующих) антител, индуцирующих толерантность клеток, и иммуномодуляторов. Активация регуляторных Т-клеток (Treg) подавляет опосредованную Т-клетками активацию особых В- и Т-клеток. Treg мигрируют из места входа аллергена в лимфатические узлы и продуцируют IL-10 и трансформирующий фактор роста (TGF-β), нацеленные на ослабление воспаления.
С момента первоначальных открытий Noon и Freeman более 100 лет назад, в настоящее время на фарм. рынке ЕС представлены немодифицированные (в форме замедленного высвобождения) экстракты и химически модифицированные экстракты (аллергоиды), разработанные различными производителями для подкожной иммунотерапии аллергенами (пкАСИТ) [ 1 ].
Адъюванты для пкАСИТ включают гидроксид алюминия (Al (OH)3), микрокристаллический тирозин (MCT) и агонист толл-подобного рецептора (TLR-4), монофосфориллипид A (МФЛ). Клиническая эффективность всех этих инновационных агентов была продемонстрирована в исследованиях. [ 2 ]. На сегодняшний день адъювантные аллергены для АСИТ могут применяться только при подкожном введении. Другая новая группа препаратов - CpG-олигодезоксинуклеотиды (CpG-ODN), класс синтетически полученных одноцепочечных олигонуклеотидов ДНК с высоким содержанием CpG-мотива или так называемых вирусоподобных частиц (VIP) в качестве капсидных белков вирусов или бактериофагов. Последние не содержат вирусной РНК или ДНК и поэтому не могут реплицироваться, что уже подтвердили предварительные исследования [ 3, 4 ].
Клинические исследования также были проведены с рекомбинантной пыльцой трав, пыльцой березы и белками аллергенов кошек. В рамках дальнейших разработок они были дополнительно модифицированы как гипоаллергенные варианты путем модификации их молекулярной укладки. Есть надежда, что за счет уменьшения сайтов связывания IgE будет достигнута его более низкая реактивность, что должно привести к снижению частоты побочных эффектов. Однако возможно также повышение иммунологической эффективности посредством других модификаций.
Проблема связана с огромными затратами на разработку новых препаратов, которая требует значительных усилий для соблюдения требований TAV (Постановление о лечении аллергенами), что в определенной степени препятствует новым инновациям в отношении иммунологически измененных препаратов.
Тем не менее, ниже изложены некоторые многообещающие достижения и дальнейшие пути развития пкАСИТ.
Методы
Направленный поиск литературы был проведен в PubMed и Medline, а также проанализированы недавние публикации в немецкоязычных журналах, отсутствующие в этих базах данных. Этот анализ включил оригинальные и обзорные статьи на немецком и английском языках. Синонимы, а также переводы на английский язык были приняты во внимание при выборе подходящих условий поиска на немецком языке с помощью логических операторов и/или с использованием следующих ключевых терминов: аллергический ринит; бронхиальная астма, яд, аллергия на яд насекомых, аллергия на яд осы, аллергия на пчелиный яд, аллергия; ингаляционная аллергия; иммунотерапия, гипосенсибилизация; десенсибилизация; подкожная иммунотерапия, сублингвальная иммунотерапия, терапевтические аллергены.
Историческое развитие пкАСИТ
Аллергенспецифическая иммунотерапия (АСИТ) используется уже более 100 лет и, с исторической точки зрения, основана на предпосылке, что защитный эффект может быть достигнут путем введения небольших количеств вредного вещества [ 5 ]. Впервые в истории этот терапевтический метод был описан в исторической хронике царя Понта Митридата, опасавшегося отравления [ 6 ].
Еще один источник можно увидеть в гомеопатии Самуэля Ганемана, основанной на принципе « similia similibus ». Однако наиболее важным основанием АСИТ является принцип вакцинации, введенный в 1798 году Эдуардом Дженнером, который использовал коровью оспу (Vaccinia) для предотвращения натуральной оспы ( Variola vera ) [ 6 ]. В 1807 году Бавария была первым государством, принявшим закон, установившим «профилактическую вакцинацию против оспы» обязательной.
В 1911 году исследователям Леонарду Нуну и Джону Фримену (удалось провести «профилактическую прививку» экстрактами пыльцы, что привело к явному уменьшению глазных и назальных симптомов [ 7 ]. На Нуна и Фримена повлияла экспериментальная работа Александра Безредко, который проводил аналогичные эксперименты на животных, используя термин «анти-анафилаксия» [ 6 ].
Впоследствии этот метод получил распространение после значительных достижений иммунологии в активной вакцинации и пассивной иммунизации, так что его можно найти в качестве стандартной процедуры в ранних учебниках по аллергологии, изданных в 20-30-ые годы прошлого столетия [ 6 ].
Ранние проспективные клинические исследования были проведены в 50-х годах и прошлого столетия и тесно связаны с именем Уильяма Франкленда [ 6 ]. В 1970-х годах были предприняты попытки изменить экстракты аллергенов путем химической модификации с использованием формальдегида и глутаральдегида или путем полимеризации для получения так называемых «аллергоидов», которые, как полагали, были более эффективными и характеризовались меньшим количеством побочных эффектов [ 6 ]. В то же время использовались разные адъювантные аллергены, некоторые из которых должны были действовать как депо-медиаторы, а также как усилители иммунного ответа. Сегодня с этой целью используют гидроксид алюминия, L ‑ тирозин и МФЛ (монофосфорил липид А). Более того, связанные с полиэтиленгликолем аллергены и нуклеотиды (CpG) также использовались в исследованиях в качестве адъювантов [ 6 ].
В течение десятилетий подкожное введение было единственным приемлемым способом; но на научных конгрессах стали появляться ожесточенные дебаты между сторонниками подкожной и «оральной гипосенсибилизации». В конце 80-х годов прошлого века от перорального приема отказались и заменили его сублингвальным. Достаточное количество исследований, некоторые из которых были выполнены на высоком научном уровне, в том числе на клещах, пыльце березы, амброзии и домашней пыли, теперь доступны и демонстрируют эффективность метода, являясь основанием для проведения сублингвальной иммунотерапии (слАСИТ) препаратами в форме капель и таблеток.
Механизмы пкАСИТ
Влияние АСИТ на аллерген-специфические клетки TH2 и Treg, по-видимому, имеет решающее значение для модуляции иммунного ответа. В то время как из трех аллергенспецифических Т-клеток (TH1, TH2 и Treg), Treg преобладают у здоровых не сенсибилизированных людей, клетки TH2 преобладают у людей, страдающих аллергией [ 8 ]. Однако толерантность Т-клеток в значительной степени опосредуется аллерген-специфическими Treg, которые подавляют пролиферацию и продукцию цитокинов периферическими Т-клетками против соответствующего аллергена. Существует две основные группы Treg: это физиологически встречающиеся CD4+ CD25+ Foxp3+-nTregs, которые образуются в тимусе и запускают ингибирование посредством механизма, зависимого от клеточного контакта; а также индуцированные iTreg клетки, такие как Tr1, которые характеризуются высокой продукцией IL-10 (в дополнение к интерферону (IFN-γ). Было продемонстрировано, что толерантность к периферическим Т-клеткам за счет индукции Treg является важным механизмом эффективности пкАСИТ [ 8 ]. CD4+ -Т-клетки в периферической крови пациентов, получавших пкАСИТ, меньше реагируют на аллерген уже через 1 неделю после начала лечения. Аллерген-специфическая пролиферация и выработка цитокинов снижается, а продукция IFN-γ повышается соответственно сдвигу равновесия TH1 / TH2 в сторону TH1 [ 8 , 9]. Кроме того, пкАСИТ также подавляет индукцию важной ко-стимуляторной молекулы, индуцируемого ко-стимулятора T-лимфоцитов (ICOS), что особенно важно для эффекторных клеток TH2 [ 10 ].
Однако наиболее важным механизмом, по-видимому, является индукция Treg, запускаемая пкАСИТ [ 9 , 11 ]. Аллерген-специфические Т-клетки, продуцирующие IL-10 и TGF-ß, выявляются уже через 1 неделю после инициации пкАСИТ и тем более через 8 недель [ 9 , 12 , 13 ]. Значение этих клеток теперь выяснено, и подавление IL-10 и TGF-β путем нейтрализации антител частично устраняет их действие [ 9 , 12 , 13 ]. CD4+ CD25+ nTreg у аллергиков функционально нарушены [ 8 , 14 , 15 ].
У пациентов, у которых nTreg полностью отсутствует из-за мутации фактора транскрипции Foxp3, который важен для nTreg (синдром IPEX: иммунная дисрегуляция, полиэндокринопатия, Х-сцепленная энтеропатия), продуцируются высокие уровни IgE в сыворотке, имеет место выраженная эозинофилия и аллергические симптомы.
Подкожная АСИТ в первую очередь активирует местные антиген-презентирующие клетки (APC); например, дендритные клетки (DC). Они выделяют, в частности, IL-10 и TGF-β. Оба цитокина могут оказывать местное противовоспалительное действие и ингибировать пролиферацию Т-клеток. Кроме того, высвобождение IL-10 способствует усилению выработки блокирующих антител IgG. При активации новых и усилении существующих антител, которые блокируют опосредованный аллергеном иммунный ответ, образуются в первую очередь антитела IgG, которые способны предотвращать связывание комплексов аллергенов IgG с B-клетками и DC.
Выделяемые локально цитокины также ослабляют локальную активность тучных клеток и активацию других эффекторных клеток, которые способствуют аллергическому воспалению.
Было показано, что пкАСИТ приводит к снижению уровня IL-4-зависимого аллерген-специфического IgE и увеличению выработки аллерген-специфического IgG (особенно IgG4) [ 8 , 9 , 16 ]. Индуцированные антитела IgG конкурируют с антителами IgE за эпитопы аллергена, оказывая тем самым блокирующий эффект. Эта блокирующая активность не зависит от количества антител IgG [ 17 ]. Однако способность антител IgG блокировать антитела IgE может значительно варьироваться.
После воздействия аллергена антигенпрезентирующие клетки (APC) способны управлять иммунным ответом в направлении TH1 и, следовательно, развивать иммунную толерантность [ 18 ], что, вероятно, имеет решающее значение для эффекта пкАСИТ.
Подкожная АСИТ не только снижает количество тучных клеток в слизистой оболочке [ 19 ], но и ингибирует высвобождение множества медиаторов, которое происходит вследствие стимуляции базофилов и тучных клеток аллергеном. Ингибирование высвобождения медиатора частично зависит от IL-10; IL-10 также напрямую ингибирует IgE-зависимую активацию тучных клеток и выработку ими цитокинов [ 8 , 20 ].
В результате воспалительные клетки — эозинофилы и нейтрофилы, мигрируют к пораженной слизистой оболочке в гораздо меньшей степени.
Качество терапевтических экстрактов
Препараты для АСИТ обычно трудно сравнивать из-за их неоднородного состава. На сегодняшний день определение характеристик и стандартизация экстрактов аллергенов проводится в соответствии со стандартами компании. Даже если указана концентрация основных аллергенов, это все равно не позволяет проводить прямое сравнение препаратов разных производителей, равно как и нельзя делать прямых выводов об их потенциальной эффективности, поскольку не используются единые аналитические методы для анализа основных аллергенов и большинство экстрактов содержат несколько основных аллергенов (иногда неизбежно).
Схемы проведения пкАСИТ
Практические рекомендации по проведению пкАСИТ опубликованы в национальных и международных руководствах [ 1 , 21 , 22 , 23 ]. Аллергены в форме депо в основном используются при АСИТ аэроаллергенами, при этом алюминий и тирозин служат носителями аллергенов, обеспечивая их пролонгированное высвобождение.
В принципе, для пкАСИТ можно использовать нативные аллергены или аллергоиды. По своей трехмерной структуре аллергоиды представляют собой модифицированные молекулы или мультимеры аллергенов. Целью модификации является уменьшение IgE-связывающих эпитопов (обычно конформационных эпитопов) при сохранении эпитопов Т-клеток (обычно последовательных эпитопов).
Клинические исследования эффективности аллергоидов проведены для экстрактов пыльцы трав [ 24 , 25 , 26 ], пыльцы деревьев [ 27 ] и клещей [ 28 ].
Аллергоиды обычно имеют более короткую фазу эскалации дозы, при этом поддерживающая доза достигается в течение нескольких дней лечения после начала лечения. Режим повышения дозы нативных аллергенов обычно значительно длиннее (до 3 месяцев) в случае классического лечения (см. ниже).
В зависимости от препарата лечение может проводиться круглогодично или предсезонно; обе схемы лечения одобрены для некоторых аллергоидов. Tworek et al. в проведенном исследовании показал, что лечение по многолетней круглогодичной схеме значимо превосходит предсезонное лечение на третьем году, а также дает полезное сравнение различных схем лечения [ 29 ].
По сути, существует ряд режимов, которые можно применять при выполнении различных схем лечения пкАСИТ:
Непрерывное, круглогодичное (многолетнее) лечение
Предсезонная терапия (до начала сезона опыления)
Комбинированное предсезонное / межсезонное лечение (например, за 4–6 месяцев до и во время сезона)
Предсезонное краткосрочное лечение - всего 4–7 инъекциями вне сезона
Подкожная АСИТ обычно делится на две фазы: фазу инициации и фазу поддержания эффекта. Поддерживающую дозу подбирают на этапе эскалации дозы. После достижения поддерживающей дозы в фазе эскалации интервалы между инъекциями можно увеличить до 4-8 недель, в зависимости от препарата. Затем проводится пкАСИТ этой поддерживающей дозой в течение как минимум 3 лет. Необходимо учитывать индивидуальные характеристики каждого препарата и каждого пациента. Теперь доступны индивидуальные режимы лечения различными аллергенами, есть возможность учитывать предпочтения пациентов; эти режимы могут быть адаптированы после консультации с пациентом в соответствии с его/ее потребностями.
Предсезонная краткосрочная терапия является самой короткой схемой пкАСИТ и используется только для лечения пациентов с аллергией на цветочную пыльцу. Это особая представленная здесь форма лечения, поскольку она по существу соответствует фазе эскалации дозы без последующей фазы поддержания. С этой целью пкАСИТ инициируют своевременно, до начала сезона опыления. Как только максимальная доза пациента или индивидуальная поддерживающая доза достигнута, ее вводят только до начала опыления. Затем лечение прекращают (в зависимости от препарата планируют от четырех до семи инъекций с недельными интервалами).
Таким образом, предсезонная краткосрочная пкАСИТ особенно подходит пациентам с аллергией на пыльцу, для которых приоритетом является меньшее время лечния.
Кластерная иммунотерапия возникла из-за стремления достичь поддерживающую дозу в кратчайшие сроки. Поэтому кластерная иммунотерапия включает в себя введение серии (= кластера) от двух до трех кумулятивных инъекций пкАСИТ в день лечения. Это требует меньших затрат времени на каждого пациента.
В случае бустерной иммунотерапии используется сжатый режим эскалации дозы в течение нескольких недель после ранее завершенной пкАСИТ за несколько лет до этого. Таким образом, пкАСИТ подходит пациентам, которые уже получали АСИТ в прошлом и у которых эффект снизился и симптомы возобновились [ 30 ]. Было показано, что сверхкороткая бустерная пкАСИТ эффективна у лиц с аллергией на пыльцу трав [ 30 ].
Эффективность коммерческих препаратов для проведения пкАСИТ в клинических исследованиях
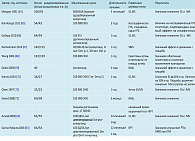
Клиническая эффективность пкАСИТ при аллергическом риноконъюнктивите основана на результатах многочисленных двойных слепых плацебо-контролируемых исследований (DBPC); однако они весьма разнородны по объему и качеству [ 1 , 31 ]. Ниже представлен ряд опубликованных результатов DBPC исследований по наиболее актуальным ингаляционным аллергенам, проведенным в Центральной Европе. В частности, Руководство S2k по АСИТ, опубликованное в Германии, содержит превосходный обзор имеющихся данных о препаратах для АСИТ, доступных в Германии, а также о препаратах для пкАСИТ [ 1]. Исследования аллергенов в соответствии с требованиями TAV, опубликованные в этом документе, а также дополнительная информация и детали исследования обобщены в табличном формате в Приложении к Руководству, которое обновляют каждые два года и публикуют на домашней странице Немецкого общества аллергологии и клинической иммунологии. (Deutsche Gesellschaft für Allergologie und klinische Immunologie, DGAKI; http://www.dgaki.de/leitlinien/s2k-leitlinie-sit/ ). Таким образом, Руководство всегда основано на современном уровне знаний и предоставляет читателю достаточную и основанную на фактах информацию для принятия решения по проведению АСИТ и по выбору препаратов для пкАСИТ. Отсутствие сопоставимости между препаратами заставляет рассматривать каждый отдельный препарат для АСИТ в надежных исследованиях эффективности и безопасности [ 1, 31 ]. Это заставляет врачей, выписывающих рецепты, быть осведомленными в отношении доказательной базы данной группы препаратов.
В таблице представлен актуальный статус одобрения отдельных препаратов, обзор исследований, одобренных регуляторными органами (согласно реестру Европейского агентства лекарственных средств (EMA): www.clinicaltrialsregister.eu ), а также количество публикаций, которые соответствуют следующим критериям доказательной медицины (изменено на Всемирную организацию аллергологов - WAO) [ 32 ]:
1. Стандартизованный экстракт аллергена с указанием дозировки
2. Дизайн рандомизированного DBPC исследования
3. Оценивается динамика комбинированного балла, отражающего тяжесть симптомов и интенсивность применения противоаллергических лекарственных препаратов (А) и / или двух отдельных баллов (балл тяжести симптомов (SS) и / или балл, отражающий интенсивность применения противоаллергических лекарственных препаратов (MS)).
4. Данные статистического анализа - статистически значимый результат
5. Эффективность лечения на 20% и более выше в сравнении с плацебо.
Гармонизация исследований АСИТ требуется как на национальном, так и на международном уровне [ 33 ]. Однако эффективность различных препаратов-аллергенов можно сравнивать только в том случае, если разные препараты используются непосредственно в одном исследовании. В настоящее время маловероятно, что подобные исследования будут проводиться в обозримом будущем.
Зарегистрировать препараты для АСИТ можно посредством стандартной процедуры подачи регистрационного досье в регуляторные органы. Препараты для АСИТ, которые уже получили официальное одобрение до вступления TAV в силу, продемонстрировали свою эффективность в исследованиях, которые соответствовали требованиям регистрации на тот момент. Эти препараты не нуждаются в повторной оценке в новых исследованиях в соответствии с предпосылками TAV, вместо этого они сохраняют свою долгосрочную конкурентоспособность. Поскольку исследования, проведенные в прошлом, не соответствуют критериям WAO, предусмотренным для включения в таблицы Руководства, в таблицу включены, в частности, более старые разрешенные препараты, для которых исследования не указаны, несмотря на то, что они проведены.
Все вышеперечисленные утверждения применимы только к АСИТ часто встречающимися аллергенами, в отношении которых действует TAV (виды семейства Poaceae, за исключением Poa mays ; Betula sp., виды, принадлежащие к роду березы; Alnus sp., виды, принадлежащие к роду ольхи; Corylus sp., виды, относящиеся к роду лещины; Dermatophagoides sp., виды, относящиеся к роду клещей домашней пыли; пчелиный яд и яд ос) [ 34]. Для всех других терапевтических аллергенов, которые не попадают в вышеупомянутые группы (например, пыльца сорняков - амброзии, полыни, подорожника и др.; плесень, например, Alternaria, Aspergillus, Cladosporium и др.; амбарные клещи; перхоть животных, например кошачья), актуальная правовая ситуация предусматривает рецепты в виде индивидуальных рецептур (так называемые «препараты по программе получения до регистрации или выхода на рынок конкретными пациентами по запросу врача») даже после вступления в силу TAV.
Регуляторные органы выбрали этот путь по уважительной причине: исследования с большим количеством пациентов, требующиеся для утверждения редких аллергенов, практически невозможны из-за отсутствия необходимого количества пациентов. Однако пациенты с аллергией на редкие аллергены имеют такое же право на проведение АСИТ, как и другие пациенты. Препараты, которые производятся и коммерциализируются как индивидуальные препараты в соответствии с § 21 раздела 2, 1b Закона о лекарственных средствах Германии ( Arzneimittelgesetz , AMG), остаются доступными для пациентов для проведения АСИТ.
Пыльца трав
В DBPC исследовании с участием 30 подростков и взрослых, страдающих аллергией на пыльцу трав (от 15 до 35 лет), изучали 3-летнюю пкАСИТ немодифицированным экстрактом аллергенов пыльцы трав с применением высокой начальной дозы [ 35 ]. Наблюдалось статистически значимое улучшение глазных и назальных симптомов во время второго и третьего сезонов опыления трав по сравнению с группой плацебо. В другое DBPC крупное исследование с использованием того же препарата для пкАСИТ в разных дозах включили более 400 человек, страдающих аллергией на пыльцу трав (United Kingdom Immunotherapy Study Group, UKIS; [ 36 ]). При применении более высокой дозы, доступной в Германии, у пациентов наблюдали значительное облегчение симптомов и существенное улучшение показателя, отражающего количество применения лекарственных средств, в первый сезон опыления трав по сравнению с плацебо. Другое DBPC исследование на популяции взрослых пациентов также продемонстрировало эффективность [ 37]. DBPC исследование того же препарата для пкАСИТ, проведенное на популяции 39 детей (в возрасте от 3 до 16 лет), страдающих аллергической астмой, спровоцированной пыльцой трав, показало, что симптомы астмы и показатель, отражающий количество применяемых противоаллергических препаратов значительно улучшились во втором сезоне опыления трав в группе активного лечения в сравнении с пациентами группы плацебо [ 38 ].
В DBPC исследовании на 154 взрослых лицах с аллергией на пыльцу травы изучали пкАСИТ химически модифицированным экстрактом аллергена (аллергоидом) в чисто предсезонном режиме в течение 2-летнего периода и обнаружили статистически значимую эффективность в течение первого и второго сезонов опыления трав [ 24 ]. В другом исследовании с тем же аллергоидом, в котором в первую очередь изучали иммунологические механизмы пкАСИТ у 15 взрослых пациентов, дополнительно определили уровень клинической эффективности (вторичная конечная точка) [ 39 ].
В контролируемом исследовании в течение 7-летнего периода (3-5 лет пкАСИТ, 1-2 года наблюдения) с применением аллергоида луговых трав выявили значительное (55%) снижение базофильной реакции уже через 1-2 года лечения. Даже после завершения лечения была продемонстрирована долгосрочная клиническая эффективность за счет стойкого подавления аллерген-специфической реакции базофилов [ 40 ].
Еще в одном DBPC исследовании аллергоида на пыльцу трав с участием 121 пациента с аллергией на пыльцу трав показали, что пкАСИТ с использованием протокола кластерного режима эскалации доз в течение 1-недельного периода с последующим лечением в течение 1 года является безопасным и, более того, связано со значимым улучшением симптомов и снижении потребности в противоаллергических препаратах уже в первый сезон опыления трав [ 41 ]. Депигментированные аллергоиды пыльцы трав были исследованы в DBPC исследовании АСИТ на 53 пациентах с аллергией, при этом значительная клиническая эффективность вновь была продемонстрирована в первый год лечения [ 42]. В другом DBPC исследовании этого же препарата, но с резкой эскалацией дозы (максимальная поддерживающая доза была достигнута уже в первый день лечения), с последующим круглогодичным лечением в течение 2-летнего периода, продемонстрировали значительное улучшение SS а также показателя, отражающего количество применяемых противоаллергических лекарственных средств (MS) в первый и второй сезоны опыления трав в группе активного лечения по сравнению с пациентами, получавшими плацебо [ 26]. В отдельном исследовании на популяции подростков, страдающих аллергией на пыльцу трав, была продемонстрирована аналогичная эффективность в сравнении с популяцией только взрослых пациентов. Однако различие по сравнению с плацебо было статистически не значимым, что можно было объяснить меньшим количеством пациентов в этой возрастной группе. Аллергоид пыльцы трав, содержащий адъювант МФЛ, был оценен в другом DBPC исследовании, проведенном в чисто предсезонном режиме лечения (всего четыре инъекции) у 141 пациента с аллергией на пыльцу трав; в сезон опыления трав после проведения АСИТ наблюдали статистически значимую положительную динамику [ 43 ]. Результаты другого DBPC исследования того же препарата на популяции более 1000 взрослых пациентов с аллергией на пыльцу трав, подтвердили аналогичную динамику [ 25 ].
В общей сложности 60 пожилых пациентов (> 65 лет) с сезонным аллергическим ринитом, сенисибилизированных пыльцой трав, получили 3-летнюю пкАСИТ другим аллергоидом пыльцы трав в DBPC исследовании; в группе активного лечения наблюдали статистически значимое различие комбинированного балла SMS в сравнении с группой плацебо в третий сезон опыления трав [ 44 ].
Пыльца раннецветущих деревьев (березы, ольхи, лещины)
Исследований терапевтических экстрактов пыльцы раннецветущих деревьев меньше по сравнению с исследованиями пкАСИТ с использованием экстрактов пыльцы трав.
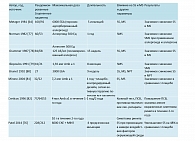
В рамках DBPC исследования с участием 49 взрослых пациентов с аллергией на пыльцу березы [ 45 ], 2-летняя пкАСИТ была проведена с использованием немодифицированного экстракта пыльцы березы ( Betula verrucosa), со значительным облегчением аллергических симптомов по сравнению с группой плацебо и значительным снижением применения противоаллергических препаратов, что наблюдали уже в первый сезон опыления березы. Во втором сезоне эти различия стали еще более выраженными. В другом исследовании с использованием того же препарата изучали безопасность и эффективность кластерного титрования дозы с последующим введением поддерживающей дозы с 8-недельными интервалами в течение 11-месячного периода. В течение сезона опыления трав у пациентов в группе пкАСИТ степень тяжести глазных и назальных симптомов была значимо меньше, равно как и потребность в противоаллергических препаратах, по сравнению с группой плацебо [ 46 ]. В другом DBPC исследовании оценивали клиническую эффективность предсезонной краткосрочной пкАСИТ, предусматривающей введение семи инъекций немодифицированного смешанного экстракта пыльцы деревьев 111 пациентам [47 ]. В сезон опыления березы пкАСИТ привела к значительному улучшению назальных и бронхиальных симптомов в сравнении с пациентами группы плацебо.
В другом DBPC исследовании изучали модифицированный депигментированный аллергоид пыльцы березы на смешанной популяции взрослых, подростков и детей (n=61) с аллергией на пыльцу березы [ 48 ]. Подкожную АСИТ проводили в течение 18 месяцев. После лечения в группе активного лечения наблюдали значимо более низкий комбинированный балл SMS в сравнении с группой плацебо во втором сезоне опыления березы, значимых различий между группами в первом сезоне опыления березы не наблюдалось на фоне проводимой пкАСИТ, сезон опыления в тот год был мягким. Поскольку доля детей и подростков была очень небольшой, анализ по возрастным группам не проводили. Подкожная АСИТ с использованием аллергоида пыльцы деревьев с адъювантом МФЛ была проведена в следующем DBPC исследовании 84 взрослым пациентам, сенсибилизированных к пыльце березы, ольхи и лещины [49 ]. Подкожную АСИТ проводили как предсезонное краткосрочное лечение, состоящее из четырех инъекций с интервалом в 1 неделю. Значительное улучшение комбинированного балла SMS было отмечено в группе активного лечения по сравнению с группой плацебо в течение 4-недельного сезона опыления березы. В DBPC исследовании с привлечением 62 пациентов продемонстрировали, что 18-месячная пкАСИТ аллергоидом пыльцы березы привела к значимому снижению клинического индекса глазных и назальных симптомов в сезон опыления березы [ 50 ].
Клещи домашней пыли
Аллергия на клещей домашней пыли - всемирная проблема. Особенно актуальны клещи, принадлежащие к роду Dermatophagoides [ 51 ]. Как правило, экстракты аллергенов могут быть получены из очищенных тел клещей или экстрактов культур; состав экстрактов варьируется в зависимости от используемого сырья [ 52 , 53 , 54 ]. Имеются большие различия в составе имеющихся в продаже экстрактов. Количественное соотношение между Der p 1 и Der p 2 может значительно варьироваться, а в некоторых экстрактах важные аллергены фактически отсутствуют [ 55 ]. Исследования по определению дозы экстрактов клещей домашней пыли для проведения пкАСИТ отсутствуют.
Еще в 1993 году было показано, что эффективность пкАСИТ с применением экстрактов клещей домашней пыли зависит от количества вводимого аллергена. Хотя это исследование не было плацебо-контролируемым, было проведено сравнение с пациентами контрольной группы, которые не получали инъекций. Сообщалось, что вводимые количества аллергенов составляли 10 000, 100 000 и 30 000 стандартных качественных единиц (СКЕ, SQ-U) [ 56 ]. На основании этих данных препарат все еще находится на рынке в дозировке 100 000 стандартных качественных единиц.
В рамках исследования по подбору доз в пяти группах был протестирован химически модифицированный экстракт клещей домашней пыли (аллергоид) в четырех дозах (6667, 20 000, 50 000, 100 000 БАЕ / мл; (БАЕ – биоэквивалентные аллергические единицы, AUeq) в течение 12 месяцев для анализа влияния эскалации доз на назальный провокационный тест. [ 57 ]. Результаты были статистически значимыми в трех группах наиболее высоких доз аллергенов.
В исследовании с участием 136 пациентов оценивали эффективность экстракта аллергена клеща домашней пыли в форме депо в пяти концентрациях при проведении назального провокационного теста с эскалацией доз после 17 недель лечения [ 58 ]. Концентрация аллергена в экстракте была дана в виде единиц кожного прик-теста. По сравнению с интраназальной провокацией, до лечения во всех группах пациентов требовалась более высокая концентрация аллергена, чтобы вызвать реакцию; значимый эффект был продемонстрирован только при применении четвертой эскалационной дозы.
В DBPC исследовании с клещевыми аллергоидами зафиксировали значительное (64%) улучшение комбинированного балла симптомов (SS) у пациентов в возрасте старше 65 лет по сравнению с исходным уровнем. Через 24 месяца снижение SS составило 52%, что не наблюдалось в группе плацебо [ 59 ]. В открытом проспективном исследовании на популяции детей с аллергией на пылевых клещей продемонстрировали значимое улучшение, выразившееся в снижении степени тяжести астмы, а также в сокращении приема противоастматических лекарственных средств уже через 8 месяцев лечения клещевым аллергоидом. Также наблюдалось улучшение качества жизни [ 60 ]. В многочисленных DBPC исследованиях изучали эффективность по динамике симптомов и динамике применения лекарственных средств. Результаты исследований пкАСИТ с использованием аллергенов клещей домашней пыли представлены в таблице 1. В небольшом исследовании с участием 30 пациентов сравнивали подкожную и сублингвальную иммунотерапию экстрактом клеща домашней пыли [ 61]. Каждая группа состояла из 10 пациентов. Экстракт в форме депо в дозе 500 ТЕ / мл (ТЕ- трансдуцирующие единицы, TU) вводили подкожно, и кумулятивная доза составила 21 885 ТЕ Dp и 21 885 ТЕ Df; экстракт в дозе 1000 МЕ / мл вводили сублингвально 3 раза в неделю. Суммарная доза слАСИТ составила 86 866,5 ТЕ Dp и 86 866,5 ТЕ Df. Основными целевыми количественными конечными точками была динамика SS (балла симптомов) и динамика MS (показателя, отражающего количество применяемых противоаллергических препаратов) через 1 год. Подкожная АСИТ и слАСИТ значительно снизили SS и MS по сравнению с исходным уровнем. Только снижение SS в группе пкАСИТ по сравнению с группой плацебо было значимым.
В DBPC исследовании с участием 55 пациентов, страдающих аллергическим ринитом / риноконъюнктивитом и астмой, лечение депигментированным полимеризованным экстрактом аллергена Dermatophagoides pteronyssinus в течение 1 года показало статистически значимое уменьшение количества симптомов (на 78%) и количества применяемых лекарственных средств (на 68%). Эти данные были дополнительно подтверждены статистически значимым улучшением результатов бронхиального провокационного теста у пациентов группы активного лечения [ 62 ].
В DBPC исследовании с участием 54 пациентов, страдающих аллергическим ринитом / риноконъюнктивитом и астмой, лечение в течение 1 года депигментированным полимеризованным экстрактом аллергена Mite Mix (50% Der. Pter / Der. F ) показало статистически значимое улучшение результатов бронхиального провокационного теста. Этот вывод был дополнительно подтвержден статистически значимым снижением балла симптомов (на 53,86%) и балла, отражающего количество применяемых лекарственных средств (на 58,09%) [ 63 ].
Амбарные клещи
Перекрестная реактивность клещей домашней пыли и амбарных клещей низкая; в недавней литературе сообщается только об одном DBPC исследовании эффективности пкАСИТ экстрактом амбарных клещей.
В исследовании изучали эффективность пкАСИТ с использованием экстракта Lepidoglyphus destructor (максимальная поддерживающая доза - 800 СТЕ (стандартных трансдукционных единиц- STU) у 35 пациентов [ 73 ]. Пациенты получали лечение в течение 12 месяцев. Чувствительность определяли на исходном уровне и после лечения с использованием кожных проб, провокационных тестов, тестов in vitro, а также проводили оценку симптомов и лекарственных препаратов в качестве параметров эффективности. Наблюдалось статистически значимое влияние на кожную чувствительность и провокационные пробы (конъюнктивальная провокация аллергеном и неспецифическая бронхиальная провокация метахолином). Пациенты в группе лечения сообщали об облегчении симптомов и снижении использования лекарственных препаратов, примененных для устранения симптомов, значительно чаще в сравнении с пациентами группы плацебо.
Пыльца амброзии
Аллергия на пыльцу амброзии - огромная проблема в США; Распространенность сенсибилизации к пыльце трав и пыльце амброзии примерно одинакова. Распространенность этих растений также растет в Германии [ 74 ]; кроме того, предполагается, что аллергия на пыльцу амброзии резко возрастет в Европе из-за изменений климата [ 75 ].
Опубликованы исследования по АИТ с использованием экстрактов пыльцы амброзии (Таблица 2); крупные исследования из которых соответствуют критериям качества, установленным для современных исследований.
В исследовании фазы 2B оценивали эффективность абсорбированного тирозином аллергоида пыльцы амброзии в сочетании с адъювантом МФЛ (монофосфорил липид - МФЛ). В ходе исследования было рандомизировано 95 пациентов в группу лечения исследуемым препаратом, 40 – в группу лечения аллергеном без адъюванта и 93 пациента – в группу лечения плацебо. После четырех инъекций, вводимых с недельными интервалами, был получен значимый эффект на провокацию, проводимую в камере воздействия факторов окружающей среды, в сравнении с плацебо, эффект плацебо также превосходил эффект одного аллергена [ 76 ]. Наиболее крупные опубликованные исследования представлены в таблице 2.
Пыльца полыни
Аллергия на пыльцу полыни, безусловно, играет важную роль в Европе, тем более, что она характеризуется перекрестной реактивностью с аллергенами пыльцы амброзии. В ходе недавнего поиска в PubMed не удалось выявить DBPC исследований пкАСИТ экстрактами пыльцы полыни аллергического риноконъюнктивита (ключевые слова: «полынь, артемизия, специфическая иммунотерапия»).
Пыльца ясеня / пыльца оливок
Пыльца оливок является важным ингаляционным аллергеном в Средиземноморском регионе [ 83 , 84 ]. Подкожная АСИТ с использованием экстракта пыльцы оливок иногда рекомендуется в Германии как вариант лечения пациентов с аллергией на пыльцу ясеня. Эффективность пкАСИТ экстрактами пыльцы оливок изучалась в ряде исследований, хотя плацебо-контролируемые исследования не проводили [ 83 , 84 ].
Пыльца париетарии
В отличие от стран Средиземноморья, аллергия на пыльцу Parietaria в настоящее время не имеет значения. Описана перекрестная реактивность с аллергенами пыльцы крапивы.
В DBPC исследовании изучали эффективность адсорбированного гидроксидом алюминия экстракта пыльцы Parietaria [ 85 ]. Всего было рандомизировано 57 пациентов; Через 2 года лечения обследовано 22 пациента. Поддерживающая терапия включала подкожное введение 20 БЕ (биологических единиц) аллергена, соответствующего 1,2 мкг Par j1. Значимое влияние на SS и MS наблюдали через 2 года лечения.
В DBPC исследовании с участием 30 пациентов изучали эффективность пкАСИТ пыльцой Parietaria в течение 34 месяцев. SS, и MS значительно увеличились в контрольной группе (группе сравнения), а в группе активного лечения не наблюдалось значительных изменений этих параметров [ 86 ].
В DBPC исследовании с участием 35 пациентов с аллергией на пыльцу Parietaria получали пкАСИТ в течение 1 года конъюгированным альгинатом экстрактом пыльцы Parietaria, [ 87 ]. При оценке 31 пациента выявили значимое снижение SMS.
В годовом исследовании пкАСИТ с использованием аллергоида пыльцы Parietaria (поддерживающая доза 10 000 БАЕ) продемонстрировали значимое улучшение SS и MS в сравнении с плацебо. Длительность исследования составила 3 года. В последние два года пациенты группы плацебо также получали лечение активным препаратом, положительный терапевтический эффект выразился в отчетливой положительной динамике SS и MS [ 88 ].
Аллергоид пыльцы Parietaria был исследован в популяции 40 пациентов в течение 1 года. Все включенные в это исследование пациенты получили активную пкАСИТ в течение второго года исследования. Предсезонное лечение заключалось в введении кумулятивной дозы 24 500 ТЕ. Исследователи обнаружили значимое уменьшение SS и MS в первый год после начала лечения [ 89 ].
Пыльца кипарисовиков
Пыльца кипарисовиков является важным аэроаллергеном в странах Азии и Средиземноморья. Из-за того, что кипарисы все чаще встречаются в парках и садах, пациенты в Германии становятся все более чувствительными к пыльце кипарисовиков. В рамках DBPC исследования с участием 40 европейских пациентов подкожно вводили экстракт пыльцы кипарисовика (поддерживающая доза 100 IR, максимальная 16,2 мкг Jun a 1) в течение примерно 1,5 лет. Завершили исследование 28 пациентов, а 12 пациентов досрочно прекратили лечение из-за побочных эффектов, недостаточной эффективности или личных причин. В течение второго года было отмечено значимое уменьшение выраженности назальных симптомов. Выраженность глазных симптомов также значимо уменьшилась в течение 2-ух лет исследования. Хотя применение лекарственных препаратов было меньше в группе активного лечения по сравнению с группой плацебо, различие не достигло статистической значимости [ 90 ].
Кошачий аллерген
В Европейском исследовании, в котором изучали частоту положительных прик-тестов диагностической панели из девяти аэроаллергенов, продемонстрировали, что распространенность сенсибилизации к кошачьим аллергенам занимает третье место (8,8%) после сенсибилизации к клещам домашней пыли и пыльце трав. Крупных исследований АСИТ кошачьим аллергеном не опубликовано.
В DBPC исследовании с участием 28 пациентов с умеренно тяжелым течением аллергического риноконъюнктивита и астмой, спровоцированной кошачьим аллергеном, изучали эффективность пкАСИТ с использованием местного нативного препарата кошачьего аллергена в форме депо [ 91 ]. Во время фазы эскалации дозы проводили 11 инъекций дважды в неделю. Целевая поддерживающая доза составляла 100 000 СКЕ (15 мкг Fel d 1).
В рамках исследования эффективности проводили внутрикожные пробы и титровали кошачий аллерген в ходе провокационной конъюнктивальной пробы, после чего реализовывали провокационные тесты (при пребывании в доме с кошками, обеспечивающими определенный уровень кошачьего аэроаллергена). По сравнению с группой плацебо, у пациентов, находящихся дома с кошками, наблюдали значительное уменьшение выраженности симптомов (снижение SS с 61,6 ± 9,1 до 17,1 ± 7,6 баллов в группе активного лечения и с 64,7 ± 13,6 до 62,1 ± 10,0 баллов в группе плацебо). В группе активной терапии, помимо снижения чувствительности к кошачьему аллергену при кожных пробах, выявили одновременное снижение чувствительности к аллергену клеща домашней пыли - феномен, который не поддается объяснению. Опубликованные исследования пкАСИТ кошачьими аллергенами представлены в таблице 3.
Новые подходы к использованию кошачьего аллергена
Fel d 1 является преобладающим основным аллергеном кошек. Внутрикожное введение смеси перекрывающих пептидов Fel d 1 было показано как безопасное и эффективное в исследовании фазы 2: эффект четырех инъекций аллергена (6 нмоль) удерживался в течение года наблюдения [ 94 ]. В исследовании фазы 1 с участием почти 1000 пациентов выявили примерно 60%-ое улучшение в группе плацебо, что было сопоставимо с положительной динамикой в группе активного лечения. Этот результат в настоящее время является предметом обсуждения. Этот необычно высокий эффект плацебо трудно объяснить [ 95 , 96 ]. По крайней мере, в этом отдельном исследовании эффективность кошачьего пептида не была доказана.
Аллергены собак
В недавней литературе нет крупных исследований пкАСИТ аллергенами собак.
Лошадиные аллергены
В современной литературе нет доказательств эффективности пкАСИТ при аллергии на перхоть лошади.
Аллергены плесени
Alternaria и Cladosporium - важные наружные аллергены, распространенные во всем мире. Penicillium и Aspergillus spp. считают комнатными аллергенами; Aspergillus fumigatus колонизирует бронхиальный тракт больных астмой и вызывает аллергический бронхолегочный аспергиллез [ 97 ].
Распространенность сенсибилизации зависит от географических регионов: в Европе положительный результат кожной пробы экстрактом Alternaria и Cladosporium находится в диапазоне 0,2–14,4% и 0–11,9%, соответственно, в популяции людей в возрасте от 20 до 44 лет. Таким образом, споры плесени представляют собой важную группу ингаляционных аллергенов; однако стандартизация экстрактов плесени проблематична. В зависимости от используемой питательной среды культивируемые плесени, в частности, обнаруживают быстрые соматические мутации, которые влияют на их аллергогенность. Спектр аллергенов экстрактов во многом зависит от метода экстракции. Ферменты, содержащиеся в экстрактах, могут, в частности, разрушать диализные мембраны на основе целлюлозы, что может приводить к нарушениям производственного процесса. Если во время выделения основное внимание уделяется белкам, важные богатые углеводами аллергены могут быть потеряны во время производственного процесса [98].
Альтернариоз
Эффективность АСИТ с использованием экстрактов Alternaria оценивали в ряде небольших исследований, которые не соответствовали критериям проведения современных клинических исследований (отсутствие DBPC дизайна, отсутствие базовой статистической модели для оценки необходимого количества случаев, использование нестандартных экстрактов, слишком короткое последующее наблюдение), исключением явилось исследование Kuna et al., как указано ниже [ 99 ]. В обзоре 2014 г. сделан вывод об отсутствии рандомизированных плацебо-контролируемых исследований, демонстрирующих эффективность АСИТ с использованием экстрактов плесени, в частности Alternaria и Cladosporium [ 98 ]. С другой стороны, побочные эффекты, включая системные реакции, не были редкостью в открытых исследованиях пкАСИТ экстрактами плесени [ 100 , 101 , 102]. В недавнем обзоре также пришли к выводу, что надежных исследований АСИТ экстрактами плесени в настоящее время нет. Таким образом, в настоящее время можно рекомендовать лечение аллергического ринита и / или бронхиальной астмы только экстрактами Alternaria alternata, поскольку стандартные экстракты только этой плесени доступны на рынке в настоящее время [ 103 ]. В крупнейшем опубликованном моноцентровом проспективном рандомизированном исследовании с DBPC дизайном изучали эффект непрерывного лечения в течение 3-летнего периода; Были проанализированы 45 из 50 первоначально рандомизированных детей и подростков с риноконъюнктивитом и / или астмой, спровоцированными аллергией на плесень Alternaria [ 99]. Поддерживающая терапия включала введение инъекций в максимальной дозе 5000 МЕ / мл (8 мкг / мл Alt a 1) каждые 4–6 недель. Первичной конечной точкой был комбинированный балл - SMS. Существенных различий между группами плацебо и активного лечения в первый год лечения не наблюдали; во второй год различие в динамике составило 38,7%, а в третий год - 63,5%. Этот результат достиг статистически значимости. Уменьшение выраженности симптомов было связано со значимым улучшением качества жизни. О значительных побочных эффектах не сообщалось. Выявленные при литературном поиске в Medline моноцентровые DBPC исследования АСИТ с использованием экстрактов плесени Alternaria, представлены в таблице 4.
Кладоспорий
Небольшие исследования были проведены и с экстрактами кладоспориума. Результаты DBPC исследований приведены в таблице 5.
Аспергиллы
В литературе нет DBPC исследований эффективности пкАСИТ экстрактами аспергилл.
Подкожная АСИТ ядом насекомых
Многие виды насекомых при укусах способны вызывать местные и системные реакции. В Центральной Европе перепончатокрылые, такие как медоносные пчелы (Apis mellifera) и осы (в частности, Vespula vulgaris и V. germanica), являются наиболее частыми триггерами клинически значимых реакций. Системные анафилактические реакции на укусы насекомых потенциально опасны для жизни.
Подкожное введение на сегодняшний день является единственным научно обоснованным способом проведения АСИТ ядом насекомых [ 109 , 110 , 111 ].
В отличие от первого опыта, полученного рабочей группой около Лихтенштейна при проведении пкАСИТ экстрактами всего насекомого, теперь применяет только яды вышеупомянутых насекомых [ 112 ].
Подкожная АСИТ ядом пчелы или осы следует проводить взрослым пациентам, у которых была анафилаксическая реакция на укус насекомого с респираторными и / или сердечно-сосудистыми симптомами с системными реакциями немедленного типа, независимо от степени тяжести, а также пациентам с индивидуальными факторами риска [ 109 ].
Теперь, когда препараты яда пчелы и осы доступны для диагностических и терапевтических целей, аллергию на яд перепончатокрылых можно лечить очень эффективно. Надлежащая АСИТ защищает практически всех пациентов от повторных системных реакций при укусах насекомых [ 109 , 110 , 111 ]. В недавнем систематическом обзоре литературы и мета-анализе, проведенном Европейской академией аллергологии и клинической иммунологии (EAACI) в 15 международных биомедицинских базах данных, представлены результаты 17 исследований, в которых были соблюдены критерии включения. Результаты этого анализа подтвердили, что пкАСИТ ядами насекомых снижает риск тяжелых реакций при укусах насекомых (ОШ = 0,08; 95% ДИ: 0,03–0,26). В мета-анализе подтвердили улучшение качества жизни (QoL), непосредственно зависящее от заболевания, в 1,41 раза (95% ДИ 1,04–1,79) [ 110].
Водные препараты аллергенов, а также экстракты в форме депо, адсорбированные гидроксидом алюминия, которые можно вводить подкожно, доступны для пкАСИТ ядом насекомых [ 109 , 111 ].
Существует широкий диапазон схем инициирования пкАСИТ и эскалации дозы, при которых поддерживающая доза достигается в различные временные периоды [ 109 , 111 ].
Различают две основные процедуры:
Быстрая гипосенсибилизация, при которой поддерживающая доза достигается в течение периода от нескольких часов до нескольких дней (режим сверхскоростной пкАСИТ) или через 3-5 дней (режим ускоренной пкАСИТ)
Обычная гипосенсибилизация, при которой поддерживающая доза достигается в течение нескольких недель или месяцев.
В частности, у пациентов с риском развития тяжелых реакций фазу нарастания гипосенсибилизации следует проводить в стационарных условиях.
В ходе проведения гипосенсибилизации могут возникать побочные эффекты пкАСИТ в виде системных анафилактических реакций и общих субъективных симптомов, как и в фазе инициации. Однако тяжелые реакции наблюдают редко [ 109 , 111 ]. Преимущество выполнения ультраскоростной пкАСИТ в условиях стационара состоит в том, что поддерживающая доза может быть достигнута всего за несколько дней, после чего пациенты обычно легко переносят укусы насекомых. Стандартная поддерживающая доза яда насекомых обычно составляет приблизительно 100 мкг (200 мкг в отдельных случаях) [ 109 , 111 ], дозирование проводят с 4-недельными интервалами.
Поскольку положительный эффект пкАСИТ, по-видимому, зависит от дозы, пациенты, для которых обычная поддерживающая доза недостаточно эффективна, обычно все же могут достичь полной защиты при эскалации дозы. Таким образом, при необходимости можно рассматривать вопрос о применении увеличенной поддерживающей дозы 200 мкг каждые 4 недели у пациентов с факторами риска, особенно в случае пкАСИТ пчелиным ядом [ 113 ]. В случае сочетанной аллергии на осиный и пчелиный яд, пкАСИТ может проводиться с использованием ядов обоих насекомых одновременно [ 109 , 111 ].
Аспекты безопасности пкАСИТ
В систематическом обзоре и мета-анализе, выполненном EAACI и включавшим 160 исследований АСИТ, проанализировали не только эффективность как первичную конечную точку, но и вторичные конечные точки - экономическую эффективность и безопасность [ 114 ].
Исследователи обнаружили значительную неоднородность классификации побочных эффектов, о которых сообщали в проанализированных рандомизированных контролируемых исследованиях. Относительный риск (ОР) побочных эффектов, рассчитанный при анализе пкАСИТ составил 1,58, и при анализе слАСИТ ОР - 1,68, что указывает на сопоставимый профиль безопасности этих двух терапевтических методов. В объединенном анализе 15 исследований ОР связанных с лечением системных аллергических побочных эффектов пкАСИТ составил 1,15. В объединенном анализе девяти исследований пкАСИТ ОР местных реакций составил 2,21. Руководство EAACI по проведению АСИТ при аллергическом риноконъюнктивите [ 31 ], которое основано на данном систематическом обзоре и мета-анализе, в целом считает пкАСИТ безопасным терапевтическим методом. Однако Руководство также содержит четкие рекомендации по реализации и соблюдению соответствующих мер безопасности.
Эффективность пкАСИТ при определенных показаниях
Доказательств эффективности АСИТ с использованием пыльцевых аллергенов при синдроме оральной аллергии (СОА) недостаточно [ 115 , 116 ]. Прежде чем будет сделана окончательная оценка, необходимо получить результаты дальнейших исследований [ 1 , 116 ].
В рандомизированном контролируемом исследовании на популяции 40 пациентов с аллергией на пыльцу деревьев, 20 из которых получали пкАСИТ и 20 - слАСИТ, продемонстрировали облегчение симптомов СОА у некоторых пациентов [ 117 ]. В недавнем исследовании с участием пациентов, страдающих аллергией на сою, при применении рекомбинантного сворачивающегося варианта Bet v 1 в качестве аллергоида, описали эскалацию дозы запускающего аллергена при пероральном введении после 1 года подкожного лечения [ 118]. К сожалению, из-за плохого набора участников в исследовании не удалось накопить количество случаев, необходимое для достижения достаточной мощности, необходимой для достижения первичной конечной точки. В настоящее время компания-производитель больше не проводит исследования препарата с целью регистрации. В другом недавнем исследовании с участием 60 пациентов со спровоцированной пыльцой березы аллергией на яблоки, показали клиническую эффективность рекомбинантного Mal d 1 (основного аллергена яблока), а не Bet v 1 [ 119 ]. В целом, пкАСИТ СОА в настоящее время показана только в случае соответствующих респираторных симптомов, вызванных аллергенами пыльцы.
Подкожная АСИТ атопического дерматита
В нескольких исследованиях продемонстрировали клинические эффекты пкАСИТ у пациентов с атопическим дерматитом (АтД) и соответствующую сенсибилизацию 1 типа к аэроаллергенам [ 120 ]. В рандомизированном двойном слепом исследовании пкАСИТ у 89 взрослых пациентов с хронической АтД и сенсибилизацией к клещам домашней пыли показали значимое улучшение балла по шкале SCORAD (шкала балльной оценки атопического дерматита) в течение 1-летнего периода лечения [ 121 ]. В другом DBPC исследовании фазы II пкАСИТ на популяции 168 взрослых пациентов показали значимое улучшение балла по SCORAD только у пациентов с тяжелой формой АтД [ 122 ].
В мета-анализе эффективности АСИТ при АтД было изучено восемь рандомизированных контролируемых исследований (два исследования слАСИТ и шесть исследований пкАСИТ). Хотя и был получен положительный эффект [ 123 ], достоверность данного мета-анализа ограничена высокой гетерогенностью дизайнов исследований, в некоторые из которых было включено небольшое количество пациентов. В заключение, на основании имеющихся данных можно сделать вывод, что АтД не противопоказан для пкАСИТ в случае требующих лечения аллергических респираторных симптомов.
Документирование эффективности в повседневной практике
В частности, при рутинном наблюдении за лечением аллергических респираторных заболеваний, данные, полученные в условиях реальной клинической практики, имеют большое значение, так как надежная и сопоставимая информация о тяжести симптомов до, во время и после лечения должна анализироваться и вне клинических исследований [ 124 ].
Для регистрации и оценки этих данных необходимо, чтобы ответы на терапию не выражались произвольно, а были отнесены к статистически измеримой категории. Любая категоризация такого рода должна позволять проводить как внутри-, так и межиндивидуальное сравнение тяжести симптомов. Визуальные аналоговые шкалы (ВАШ) зарекомендовали себя как инструмент оценки эффективности АСИТ, поскольку они рассматриваются пациентами как континуум, в котором одинаковые различия в тяжести симптомов отражаются на шкале ВАШ одинаковыми значениями [ 125 ].
В частности, в сочетании с современными коммуникационными технологиями, например приложениями для смартфонов, они являются ценным инструментом для документирования тяжести симптомов и последующего лечения аллергических респираторных заболеваний; они также хорошо подходят для этой цели благодаря тому, что просты в использовании, экономят время и имеют низкую подверженность ошибкам.
Особенности АСИТ в педиатрии
Помимо вопросов, касающихся эффективной профилактики и иммуномодуляции, которую может обеспечить АСИТ, обсуждается также проведение АСИТ у детей и границы, в рамках которых подкожное введение переносится этой группой пациентов. Также дискутируется вопрос, следует ли отдавать предпочтение сублингвальной иммунотерапии в качестве общего принципа. С педиатрической точки зрения авторы считают, что заслуживают обсуждения следующие вопросы:
1. Лечение, предусматривающее подкожные инъекции, обычно хорошо воспринимается детьми школьного возраста, если они и их родители получают подробные объяснения. При многих клинических ситуациях иногда требуется использование частых подкожных инъекций у детей (диабет, подкожное введение иммуноглобулина, подкожные инъекции метотрексата). Таким образом, ежемесячное введение препаратов подкожной иммунотерапии не представляет собой непреодолимых препятствий. Напротив, многие педиатры считают, что соблюдение режима значительно лучше при подкожном введении, чем при сублингвальном [ 126 ]. Регулярный ежедневный прием таблетки часто представляет собой значительно большую проблему для детей и подростков в их повседневной жизни, чем введение одной инъекции 1 раз в месяц.
2. Другой аспект касается документально подтвержденной эффективности, полученной в клинических исследованиях. Если принять во внимание данные о слАСИТ и пкАСИТ в педиатрии, можно увидеть, что в последние годы здесь наблюдается растущий дисбаланс. Доказательная база, основанная на результатах крупных DBPC исследований все больше смещается в сторону слАСИТ, поскольку документы на регистрацию этих новых препаратов были поданы совсем недавно, и для подтверждения оснований одобрения были проведены современные исследования. Однако с точки зрения практикующего аллерголога нельзя автоматически сделать вывод, что пкАСИТ менее эффективна, чем слАСИТ. Явные преимущества слАСИТ с точки зрения доказательств («эффект был продемонстрирован») не означает «лучший эффект». В мета-анализах, в которых косвенно оценивали эффективность пкАСИТ и слАСИТ, не обнаружили значимых различий между этими способами лечения с точки зрения уровня эффективности. Желательны исследования, в которых сравнили бы эффективность пкАСИТ и слАСИТ при применении сопоставимых препаратов.
Заключение по двум предыдущим пунктам
Решение о том, какой способ применения аллергена лучше всего подходит для детей и подростков, необходимо принимать индивидуально. Помимо данных о клинической эффективности, долгосрочных эффектах и переносимости, необходимо принимать во внимание личную оценку лечащим врачом соблюдение требований и приверженности терапии, а также личные предпочтения пациента. Бесспорно, что должны быть созданы системы отзыва препаратов для АСИТ в соответствии с медицинскими стандартами, чтобы максимально снизить количество случаев досрочного прекращения лечения. Только так можно максимально эффективно использовать потенциал АСИТ в предотвращении прогрессирования сенсибилизации, клинической аллергии, а также появления и хронизации астмы у молодых пациентов.
Информация об авторах и учреждениях
1. L. Klimek и профессор доктор O. Pfaar. Центр ринологии и аллергологии, Висбаден, Германия
2. R. Brehler. Отделение дерматологии, Университетская клиника Мюнстера, Мюнстер, Германия
3. E. Hamelmann. Клиника детской и подростковой медицины, Евангелическая больница (EvKB), Билефельд, Германия
4. M. Kopp. Отделение детской пульмонологии и аллергологии, Детская и подростковая медицина, Университетская больница Шлезвиг-Гольштейн, Любек, Германия
5. J. Ring. Отделение дерматологии и аллергологии на Бидерштайне, Технический университет Мюнхена, Мюнхен, Германия
6. R. Treudler. Отделение и поликлиника дерматологии и аллергологии, Университетская больница Лейпцига, Лейпциг, Германия
7. T. Jakob. Отделение дерматологии и аллергологии, Университетская больница Гиссена и Марбурга (UKGM), Университет Юстуса-Либиха, Гиссен, Германия
8. M.Worm. Отделение дерматологии, венерологии и аллергологии, Шарите - Университетская клиника Берлина, Кампус Митте, Берлин, Германия
Prof. Dr. O. Pfaar. Отделение оториноларингологии, хирургии головы и шеи, Медицинский факультет Мангейма, Гейдельбергский университет, Мангейм, Германия
Отделение оториноларингологии, хирургии головы и шеи, отделение ринологии и аллергии, Университетская клиника Марбурга, Марбург, Германия
Список сокращений
АСИТ — Aллергенспецифическая иммунотерапия
APC — Антигенпрезентирующая клетка
АР — Aллергический ринит
ARIA — Аллергический ринит и его влияние на течение бронхиальной астмы
CpG-ODN — CpG-олигодезоксинуклеотиды
DCs — Дендритные клетки
EAACI — Европейская академия аллергологии и клинической иммунологии
IFN — Интерферон
IL — Интерлейкин
LC — клетки Лангерганса
LPS — Липополисахарид
МФЛ — Монофосфорил липид A (MPL)
MS — Балл, отражающий интенсивность применения противоаллергических препаратов
ОШ — Отношение Шансов (OR)
ПАМП —Патоген-ассоциированный молекулярный паттерн (PAMP)
PEI — Институт им. Пауля Эрлиха
PRR — Паттернраспознающий рецептор
QoL — Качество жизни
RQLQ — Опросник по Качеству жизни пациентов с риноконъюнктивитом
пкАСИТ — Подкожная АСИТ
слАСИТ — Сублингвальная АСИТ
SS — Балл, отражающий тяжесть симптомов
SMS — Комбинированный балл, отражающий тяжесть симптомов и интенсивность применения противоаллергических препаратов
TAV — Постановление о лечении аллергенами
TGF — Трансформирующий фактор роста
TLR — Толл-подобный рецептор
Treg — Регуляторная T-клетка
VlPs —Вирусоподобные частицы
Благодарности
Разработка этой публикации была финансово поддержана компанием Аллергофарма, Рейнбек, Германия, посредством независимого медицинского гранта. Взгляды и мнения, изложенные в этой публикации, не обязательно отражают точку зрения компании, предоставившей грант.
Открытый доступ
Эта статья распространяется в соответствии с условиями Международной лицензии Creative Commons Attribution 4.0 ( http://creativecommons.org/licenses/by/4.0/ ), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии, что вы предоставите надлежащие ссылки на первоначального автора и источник, дадите ссылку на лицензию Creative Commons и укажите, были ли внесены изменения.
*https://link.springer.com/article/10.1007/s40629-019-0092-4
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.