Фармакоэкономика терапии болезни Крона генно-инженерными биологическими препаратами в Российской Федерации
- Аннотация
- Статья
- Ссылки
- English
Ранее авторами была проведена оценка введения в клиническую практику терапии БК препарата устекинумаб на основании проведения анализа затрат, анализа «затраты – эффективность» и влияния на бюджет в сравнении с альтернативными ГИБП.
Установленная Федеральным законом от 6 июня 2019 г. № 134-ФЗ необходимость перерегистрировать в заявительном порядке предельные отпускные цены производителей на импортные лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, при снижении цены в референтных странах привела к уменьшению цен большого количества генно-инженерных биологических препаратов, обращающихся на рынке Российской Федерации. Данное изменение определяет целесообразность обновления проведенных ранее расчетов, целью которых была оценка введения в клиническую практику терапии БК препарата устекинумаб на основании проведения анализа затрат, анализа «затраты – эффективность» в сравнении с альтернативными ГИБП.
В ходе исследования было выявлено, что сумма затрат на применение устекинумаба в режиме применения одна инъекция в 12 недель является наименьшей среди препаратов ведолизумаб, цертолизумаба пэгол, оригинальных инфликсимаба и адалимумаба, а также сопоставима по курсовой стоимости с биосимилярами инфликсимаба и адалимумаба.
Анализ «затраты – эффективность» показал, что лечение БК с использованием устекинумаба характеризуется меньшими затратами за единицу эффективности (доля пациентов, достигших клинического ответа CDAI 100, доля пациентов, достигших клинической ремиссии CDAI < 150, и количество качественных лет жизни – QALY) в режиме применения одна инъекция в 12 недель в сравнении со всеми компараторами и в режиме применения одна инъекция в восемь недель среди всех оригинальных ГИБП и также ниже по курсовой стоимости в сравнении с препаратами ведолизумаб, цертолизумаба пэгол, оригинальными инфликсимабом и адалимумабом.
Ранее авторами была проведена оценка введения в клиническую практику терапии БК препарата устекинумаб на основании проведения анализа затрат, анализа «затраты – эффективность» и влияния на бюджет в сравнении с альтернативными ГИБП.
Установленная Федеральным законом от 6 июня 2019 г. № 134-ФЗ необходимость перерегистрировать в заявительном порядке предельные отпускные цены производителей на импортные лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, при снижении цены в референтных странах привела к уменьшению цен большого количества генно-инженерных биологических препаратов, обращающихся на рынке Российской Федерации. Данное изменение определяет целесообразность обновления проведенных ранее расчетов, целью которых была оценка введения в клиническую практику терапии БК препарата устекинумаб на основании проведения анализа затрат, анализа «затраты – эффективность» в сравнении с альтернативными ГИБП.
В ходе исследования было выявлено, что сумма затрат на применение устекинумаба в режиме применения одна инъекция в 12 недель является наименьшей среди препаратов ведолизумаб, цертолизумаба пэгол, оригинальных инфликсимаба и адалимумаба, а также сопоставима по курсовой стоимости с биосимилярами инфликсимаба и адалимумаба.
Анализ «затраты – эффективность» показал, что лечение БК с использованием устекинумаба характеризуется меньшими затратами за единицу эффективности (доля пациентов, достигших клинического ответа CDAI 100, доля пациентов, достигших клинической ремиссии CDAI < 150, и количество качественных лет жизни – QALY) в режиме применения одна инъекция в 12 недель в сравнении со всеми компараторами и в режиме применения одна инъекция в восемь недель среди всех оригинальных ГИБП и также ниже по курсовой стоимости в сравнении с препаратами ведолизумаб, цертолизумаба пэгол, оригинальными инфликсимабом и адалимумабом.
![Таблица 1. Результат анализа эффективности, основанного на данных метаанализа [19]](/upload/resize_cache/iblock/421/195_350_1/Kulikov2.jpg)


Введение
Воспалительные заболевания кишечника (ВЗК) остаются одной из наиболее серьезных проблем в современной гастроэнтерологии и колопроктологии. Несмотря на то что уровень заболеваемости ВЗК значительно уступает таковому другими заболеваниями органов пищеварения, по тяжести течения и частоте осложнений они лидируют в структуре болезней желудочно-кишечного тракта (ЖКТ) во всем мире [1]. В группу ВЗК относят болезнь Крона (БК) и язвенный колит (ЯК) [2–3]. По данным эпидемиологических исследований последних лет, соотношение ЯК к БК составляет 3:2, доля пациентов, страдающих БК, неуклонно возрастает [2, 4].
Болезнь Крона – хроническое прогрессирующее многофакторное заболевание ЖКТ, характеризующееся трансмуральным, сегментарным гранулематозным воспалением. Большинство пациентов с БК в течение жизни переносят хотя бы одно оперативное вмешательство на ЖКТ [1]. По данным мировой литературы, около 50% пациентов с БК нуждаются в хирургическом лечении в течение первых десяти лет от дебюта заболевания. Распространенность заболевания может достигать 322 случая на 100 000 населения, причем дебют заболевания чаще всего приходится на возраст от 15 до 30 лет [2, 4]. Точная этиология БК не установлена, однако, согласно ряду исследований, заболевание является многофакторным, его проявлению способствует сочетание определенных условий: генетическая предрасположенность, дефект врожденного или приобретенного иммунитета и влияние окружающей среды [1–5]. Пациенты, страдающие ВЗК, испытывают социальную ограниченность, что отрицательно сказывается на качестве их жизни [6]. Своевременно назначенная терапия, в том числе раннее назначение ГИБП, позволяет приостановить прогрессирование БК и снизить частоту возникновения хирургических осложнений. Целью терапии данного заболевания являются не только индукция ремиссии, но и длительное поддержание «глубокой» ремиссии (клинической, лабораторной и эндоскопической), а также улучшение качества жизни пациента [4–6].
Базисная терапия БК включает в себя применение топических и системных глюкокортикостероидов (ГКС) и иммуносупрессоров. ГКС являются препаратами выбора в индукции ремиссии в случае обострения БК, однако, несмотря на свою эффективность, не могут применяться продолжительное время в связи с развитием серьезных побочных эффектов или возникновением стероидной резистентности [1, 4, 7]. Последствием применения иммуносупрессоров служит риск развития злокачественных новообразований и угнетение функции костного мозга [8]. В связи с этим клиническая потребность в лечении оставалась неудовлетворенной, что послужило стимулом создания инновационных видов терапии, в частности генно-инженерных биологических препаратов (ГИБП) [9].
В настоящее время в терапии БК, в соответствии с российскими и международными рекомендациями, применяются следующие классы ГИБП: ингибиторы фактора некроза опухоли альфа (ФНО-α), антагонисты интегриновых рецепторов и ингибиторы интерлейкинов (ИЛ) 12/23 [2, 4, 9]. Возможности применения ингибиторов ФНО-α ограничены: у 30% пациентов ответ на терапию недостаточен либо со временем теряется [5]. Альтернативой ингибиторам ФНО-α являются ингибиторы ИЛ-12/23, к которым относится препарат устекинумаб. Устекинумаб представляет собой моноклональное антитело класса IgG1k к p40 субъединице ИЛ-12 и ИЛ-23. Блокируя взаимодействие субъединицы p40 c цепью IL-12Rβ1 на поверхности T-лимфоцитов и NK-клеток, препарат прерывает каскад гуморальных и клеточных реакций, приводящий к трансмуральному воспалению кишечной стенки. В 2016 г. устекинумаб был одобрен FDA (Food and Drug Administration) для лечения пациентов с болезнью Крона средней/тяжелой степени, у которых стандартная терапия или терапия ингибиторами ФНО-α оказалась неэффективной либо отмечалась ее непереносимость [10, 11]. В 2019 г. показание «болезнь Крона» было зарегистрировано в России [12].
Появление новых биологических препаратов требует проведения не только сравнительного исследования клинической эффективности, но и фармакоэкономической оценки применения ГИБП с учетом его клинической эффективности и стоимости [13–15].
Цель данной работы – уточненная оценка внедрения в реальную клиническую практику лечения среднетяжелой и тяжелой формы болезни Крона препарата устекинумаб с позиций фармакоэкономики с учетом обновления информации о предельных зарегистрированных ценах на арсенал ГИБП.
Материал и методы
В качестве фармакоэкономических методов использованы анализ затрат, анализ «затраты – эффективность» в сравнении с альтернативными ГИБП, представленными на рынке Российской Федерации: инфликсимаб (референтный препарат – Ремикейд®, биосимиляры – Фламмэгис®, Инфликсимаб (производитель ЗАО «Биокад»)), адалимумаб (референтный препарат – Хумира®, биосимиляр – Далибра®), цертолизумаба пэгол (Симзия®) и ведолизумаб (Энтивио®).
При выборе препаратов сравнения для проведения фармакоэкономического исследования были определены следующие критерии включения:
- принадлежность препарата к группе ГИБП;
- наличие препарата в перечне жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП) и в перечне лекарственных препаратов для медицинского применения, в том числе лекарственных препаратов для медицинского применения, назначаемых по решению врачебных комиссий медицинских организаций (программа обеспечения необходимыми лекарственными средствами пациентов, имеющих право на государственную социальную помощь в виде набора социальных услуг за счет бюджетных ассигнований федерального бюджета, ОНЛС);
- наличие у препарата зарегистрированного показания «болезнь Крона»;
- наличие препарата в российских клинических рекомендациях диагностики и лечения БК.
В соответствии с инструкциями по применению ГИБП, целевой популяцией были выбраны пациенты старше 18 лет с подтвержденным диагнозом БК, со среднетяжелой или тяжелой формой БК (индекс активности БК (Crohn disease activity index – CDAI) > 220) с неэффективностью или непереносимостью одного или нескольких препаратов базисной терапии (развитием гормональной зависимости или резистентности, а также при неэффективности иммуносупрессоров) или одного из ингибиторов ФНО-α.
В связи с необходимостью длительной терапии, а также трехлетним планированием бюджетов здравоохранения временной горизонт исследования составил три года.
В качестве критериев эффективности были выбраны точки, рассмотренные в клинических исследованиях в качестве первичных конечных: доля пациентов, достигших клинического ответа (показатель CDAI уменьшился на 100 от исходных значений – CDAI 100); доля пациентов, достигших ремиссии (CDAI < 150), а также годы прожитых лет жизни с поправкой на качество (Quality adjusted life years – QALY) – используемые в фармакоэкономике как единый показатель, позволяющий сравнить эффективность различных подходов терапии различных заболеваний и оценить затрачиваемые на них денежные средства [16]. С учетом трехлетнего периода исследования требовалось проведение дисконтирования эффективности и затрат начиная со второго года терапии с использованием ставки дисконтирования 3% [17].
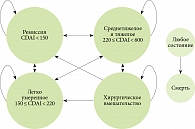
Применение ГИБП в терапии БК начинается с индукционной дозы, а затем при должном уровне ответа происходит переход на длительную поддерживающую терапию в соответствии со схемой, указанной в инструкции по медицинскому применению препарата. Для расчета показателя QALY по данным исследования К. Bodger и соавт. [18] была построена марковская модель с временным горизонтом три года и с циклом, равным 52 неделям. В основу марковской модели (рис. 1) легла поддерживающая фаза терапии ГИБП, которая включала в себя пять состояний здоровья. Пациенты переходили из одного состояния в другое в зависимости от уровня ответа на выбранную биологическую терапию, измеряемую по шкале CDAI:
- среднетяжелое и тяжелое состояние – 220 ≤ CDAI < 600;
- легко умеренное состояние – 150 ≤ CDAI < 220;
- ремиссия – CDAI < 150.
Двумя остальными состояниями пациента являлись хирургическое вмешательство и смерть. Нами было сделано допущение, что пациенты, находящиеся в состоянии хирургического вмешательства, совершали переход только из среднетяжелого и тяжелого состояния БК. Смерть являлась абсорбирующим состоянием, в которое пациенты могли переходить из любого состояния. Таким образом, вероятность перехода между состояниями косвенно зависела от того, какой ГИБП принимал пациент.
Результаты и их обсуждение
Анализ эффективности
Для проведения анализа эффективности был осуществлен информационный поиск в международных базах данных Medline, ClinicalTrials.gov и ScienceDirect с использованием следующих ключевых слов: Crohn’s disease, biological or biosimilar drug, ustekinumab, efficacy, cost-effectiveness, infliximab, adalimumab, certolizumab pegol, vedolizumab. В искомых исследованиях в разделе «результаты» должны были содержаться критерии оценки эффективности препаратов: CDAI 100, CDAI < 150, а также данные о качестве жизни пациентов.
В результате информационного поиска был найден метаанализ A. Varu и соавт. [19], соответствующий критериям отбора и цели исследования, который включал четыре ГИБП сравнения из пяти, включенных в фармакоэкономический анализ. Метаанализ охватывал сравнение критериев эффективности из шести клинических исследований следующих ГИБП: устекинумаба [11, 20], адалимумаба [21], инфликсимаба [22] и ведолизумаба [23]. В качестве критериев эффективности в метаанализе были использованы показатели CDAI 100 и CDAI < 150. Найденные показатели эффективности: CDAI 100 и CDAI < 150 – представлены в табл. 1.
В соответствии с результатами проведенного метаанализа, терапия устекинумабом ассоциирована с самой высокой долей пациентов, достигших клинического ответа и ремиссии на конец первого года терапии по сравнению с плацебо, ведолизумабом, адалимумабом, а также инфликсимабом по показателю достижения клинической ремиссии. Данные о показателе CDAI 100 инфликсимаба в метаанализ не были включены, поэтому доля пациентов, достигших ремиссии, была взята из исследования ACCENT-1 [22], в связи с этим сделано допущение и показатель достижения клинического ответа взят нами из этого же исследования для дальнейшего анализа эффективности.
Следующим этапом проведения анализа эффективности был расчет показателя QALY по следующей формуле:
QALY = ΔUt × LYG,
где ΔUt – изменение показателя полезности; LYG (life years gained) – сохраненные годы жизни.
Значения полезности (Ut) пребывания в разных состояниях здоровья на каждом препарате рассчитаны исходя из результатов опубликованных данных, которые были сопоставлены с опросником ВЗК (Inflammatory Bowel Disease Questionnaire – IBDQ) и переведены в значения EQ – 5D. Полученные данные полезности: для состояния ремиссии – 0,83, легко умеренного – 0,69, среднетяжелого и тяжелого – 0,51; состояние здоровья пациента в момент хирургического вмешательства было приравнено к среднетяжелому и тяжелому и также равнялось 0,51. При помощи марковской модели были рассчитаны значения QALY при терапии каждым ГИБП (см. табл. 1). В основу расчета QALY легла методика, опубликованная в зарубежном фармакоэкономическом исследовании [24], согласно которой показатели CDAI 100 и CDAI < 150, полученные из рандомизированных клинических исследований (см. табл. 1), переводили в показатели QALY с учетом полезностей, соответствующих каждому из пяти состояний здоровья. Вероятности переходов из разных состояний рассчитывали по частоте ремиссии (CDAI < 150), частоте ответа на терапию (CDAI 100) и доле пациентов, которые остаются в среднетяжелом и тяжелом состоянии, по формулам:
- ремиссия: α;
- легкое состояние: β ‑ (α + (β × γ);
- среднетяжелое и тяжелое: β × γ;
- нет ответа на терапию: 1 ‑ β,
где α – доля пациентов, достигших ремиссии (CDAI < 150); β – доля пациентов, достигших клинического ответа (CDAI 100), γ – доля пациентов, оставшихся в среднетяжелом и тяжелом состоянии.
Доля пациентов, которая остается в среднетяжелом и тяжелом состоянии, составила 4,7% в популяции бионаивных пациентов и 6,0% в популяции пациентов, переключенных с ингибиторов ФНО-α [18]. Частота хирургических вмешательств и частота смертности были приняты для всех препаратов одинаковыми и составили 2 и 0,43% в год соответственно [18].
Согласно инструкции по медицинскому применению [12], препарат устекинумаб может иметь два режима применения в поддерживающей фазе: один раз в восемь недель (1/8) и один раз в 12 недель (1/12) в зависимости от уровня ответа пациента на соответствующую терапию. В связи с этим эффективность устекинумаба, выраженная в показателях CDAI 100, CDAI < 150 и QALY, несколько отличается на разных режимах терапии. Необходимо отметить, что терапию устекинумабом следует начинать в режиме применения 1/12 недель и только при отсутствии должного ответа на биотерапию возможно увеличение дозы и переход на режим 1/8 недель [9, 12].
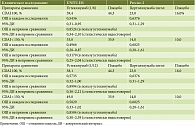
Для сравнения препаратов устекинумаб и цертолизумаба пэгол по выбранным критериям эффективности нами было проведено непрямое сравнение (табл. 2) на основании данных, полученных из клинических исследований для устекинумаба – UNITI-IM [20] и для цертолизумаба пэгол – Precise-2 [25].
Как видно из табл. 2, в результате непрямого сравнения не было доказано достоверной статистической разницы по показателю CDAI 100 при режиме применения устекинумаба 1/8 (отношение шансов (ОШ) 0,85, 95% доверительный интервал (ДИ) 0,34–2,10) и 1/12 (ОШ 0,89, 95% ДИ 0,36–2,21), по показателю CDAI < 150 – 1/8 (ОШ 0,72, 95% ДИ 0,25–2,04) и 1/12 (ОШ 0,85, 95% ДИ 0,30–2,39). Таким образом, для проведения фармакоэкономического анализа было использовано два сценария оценки ГИБП: сравнение по методу «затраты – эффективность» (ввиду наличия статистической достоверности в эффективности устекинумаба в сравнении с препаратами адалимумаб, инфликсимаб, ведолизумаб) и по методу «минимизации затрат» (ввиду отсутствия статистической достоверности в эффективности устекинумаба и цертолизумаба пэгол).
Анализ затрат
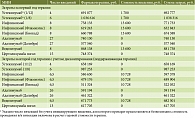
На следующем этапе работы был проведен анализ затрат. Затраты на терапию ГИБП рассчитаны согласно реестру предельных отпускных цен ЖНВЛП (с учетом 10% НДС) и решению Федеральной антимонопольной службы (ФАС) об обязательной перерегистрации предельных отпускных цен на лекарственные препараты, включенные в перечень ЖНВЛП в 2020 г. [26, 30]. Режимы применения каждого ГИБП были определены в соответствии с инструкциями по медицинскому применению [12] (табл. 3). Дозы препаратов инфликсимаб и устекинумаб для внутривенного введения рассчитываются в зависимости от массы пациента и поэтому были определены с учетом среднего веса пациента, заданного в модели, – 75 кг.
На основании полученных результатов о режиме применения и стоимости одной упаковки были рассчитаны затраты на фармакотерапию ГИБП в первый год (год инициации) и последующие годы (годы поддерживающей терапии) (табл. 4). Таблица 3 также демонстрирует, что препараты могут вводиться как в виде подкожной инъекции, так и в виде внутривенной инфузии. В связи с этим в рамках программ льготного лекарственного обеспечения (РЛО и ОНЛС) учитывали также и затраты на введение препаратов. Затраты на внутривенную инфузию составили 1700 руб. (оценивались как стоимость одного койко-дня в стационаре общего профиля и были взяты из опубликованного прейскуранта медицинских услуг, оказываемых в ФГБУ «НМИЦ колопроктологии им. А.Н. Рыжих» Минздрава России) [28]. Затраты на подкожную инъекцию в амбулаторных условиях не рассчитывались с учетом допущения, что пациенты могут вводить препарат самостоятельно.
Исходя из расчетов, представленных в табл. 4, среди всех ГИБП, имеющих показание «болезнь Крона», наименьшей стоимостью терапии среди оригинальных препаратов в первый год обладает препарат устекинумаб в режиме применения одна инъекция в 12 недель. Начиная со второго и в последующие годы стоимость терапии препаратом устекинумаб в режиме одна инъекция в 12 недель ниже стоимости терапии препаратом ведолизумаб и сравнима по стоимости с препаратами адалимумаб, инфликсимаб и цертолизумаба пэгол.
Анализ «затраты – эффективность»
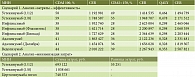
На следующем этапе фармакоэкономического анализа был проведен анализ «затраты – эффективность». Исходя из клинических рекомендаций [4] и первичных точек рандомизированных клинических исследований рассматриваемых препаратов, критериями эффективности были выбраны следующие показатели: доля пациентов, достигающих клинического ответа CDAI 100; доля пациентов, достигающих клинической ремиссии CDAI < 150, а также годы качественной жизни – QALY. Нами было разработано два сценария сравнения ГИБП между собой. В основу сравнения показателей эффективности устекинумаба, адалимумаба, инфликсимаба и ведолизумаба положен метаанализ A. Varu и соавт. [19] (см. табл. 1). В связи с отсутствием в метаанализе препарата цертолизумаба пэгол для возможности сравнения данных препаратов было проведено непрямое сравнение, основанное на данных клинических исследований Precise-2 [25] и UNITI-M [20] (см. табл. 2). Результат непрямого сравнения продемонстрировал отсутствие статистически достоверной разницы в эффективности между препаратами, в связи с чем для этих препаратов проведен анализ «минимизация затрат». Также в работе в связи с отсутствием обратных данных принято допущение о равной эффективности биосимиляров инфликсимаба и адалимумаба. Эффективность устекинумаба оценивали в разных режимах применения: поддерживающая терапия один раз в 12 недель и один раз в восемь недель. Результаты за первый год терапии представлены в табл. 5, за три года терапии – в табл. 6.
Полученные результаты демонстрируют, что терапия препаратом устекинумаб в режиме одна инъекция в 12 недель обладает лучшими показателями «затраты – эффективность» для всех трех анализируемых критериев: доля пациентов, достигших клинического ответа CDAI 100; доля пациентов, достигших клинической ремиссии CDAI < 150, и по показателю QALY. Данные результаты справедливы как для первого года терапии, так и для трех лет терапии.
По итогам анализа «минимизация затрат» было выявлено, что терапия препаратом устекинумаб в режиме применения одна инъекция в 12 недель характеризуется сопоставимым экономическим эффектом по сравнению с препаратом цертолизумаба пэгол в первый год и за три года терапии.
Обсуждение
Данная работа характеризуется разнообразием полученных результатов ввиду глубокой проработки вопросов, касающихся как эффективности трат бюджетных средств, так и анализа изменений необходимых объемов финансирования при введении в клиническую практику препарата устекинумаб.
В связи с отсутствием прямых сравнительных исследований, рассматриваемых в исследовании ГИБП, в основу сравнения эффективности препаратов было положено непрямое сравнение. Для возможности сопоставления эффективности устекинумаба и цертолизумаба пэгол было проведено собственное непрямое сравнение. Результаты продемонстрировали, что применение препарата устекинумаб с учетом его клинической эффективности, оцениваемой как доля пациентов, достигших клинического ответа (CDAI 100), так и доли пациентов, достигших клинической ремиссии (CDAI < 150), а также стоимости, является наиболее целесообразным ввиду наименьшего показателя «затраты – эффективность» в режиме одна инъекция в 12 недель.
Выводы
- Согласно результатам анализа эффективности, устекинумаб в терапии БК обладает наиболее высокими показателями эффективности по трем основным критериям: доля пациентов, достигших клинического ответа CDAI 100; доля пациентов, достигших клинической ремиссии CDAI < 150; количество лет качественной жизни – QALY.
- Анализ затрат продемонстрировал, что устекинумаб в режиме применения одна инъекция в 12 недель характеризуется наименьшими затратами в первый год терапии в сравнении с альтернативными ГИБП и ниже стоимости терапии препаратом ведолизумаб и сравнима по стоимости с препаратами адалимумаб, инфликсимаб и цертолизумаба пэгол в последующие годы. Режим одна инъекция в восемь недель увеличивает бюджетные затраты.
- Анализ «затраты – эффективность» показал, что лечение БК с использованием устекинумаба характеризуется наименьшими затратами за единицу эффективности (доля пациентов, достигших клинического ответа CDAI 100; доля пациентов, достигших клинической ремиссии CDAI < 150, а также по показателю QALY) в режиме применения одна инъекция в 12 недель в сравнении со всеми компараторами. Частный случай – анализ «минимизация затрат» – показал преимущество устекинумаба перед цертолизумаба пэголом в режиме одна инъекция в 12 недель в первый год терапии.
Таким образом, результаты проведенного исследования показали, что применение препарата устекинумаб в клинической практике в режимах применения одна инъекция в 12 недель является целесообразным с точки зрения фармакоэкономики.
A.Yu. Kulikov, PhD, Prof., V.G. Serpik, PhD, A.V. Veselov, D.S. Bordin, PhD, Prof., K.A. Nikolskaya, PhD, O.V. Knyazev, PhD, N.A. Fadeeva, PhD, B.A. Nanaeva, PhD, R.I. Romanov
I.M. Sechenov First Moscow State Medical University
Ryzhikh National Medical Research Centre for Coloproctology
Research Institute of Health Organization and Medical Management
A.S. Loginov Moscow Clinical Scientific Center
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Tver Regional Clinical Oncological Dispensary
Contact person: Аndrey Yu. Kulikov, 7677041@mail.ru
With its high disability and severity, Crohn's disease (CD) is a serious socio-economic burden for both the patient and society as a whole. Therefore, the choice of a therapy strategy for CD should be aimed not only at controlling the disease but also at the rational allocation of resources in health care system. Taking into account the appearance of innovative biologic drugs (biologics) that offer additional options for the treatment of the CD with new data from clinical studies, the decrease of registered maximal selling prices, the development and output of biological analogues (biosimilars) as well as taking into account the limited budget of the health care system, it became obvious that it is necessary to update the pharmacoeconomic evaluation of biologics in CD therapy. The purpose of this study was to evaluate the introduction of ustekinumab drug into clinical practice of CD therapy basing on cost analysis, cost-effectiveness analysis and budget impact analysis in comparison with alternative biologics.
The study found that the sum of costs for the use of ustekinumab in the regimen of 1 injection at 12 weeks was the lowest among vedolizumab, adalimumab and infliximab biosimilars and comparable in costs among adalimumab, infliximab and certolizumab pegol. The cost-effectiveness analysis showed that treatment of CD with ustekinumab is characterized by lower costs per effectiveness unit (share of patients who achieved a CDAI-100 response, share of patients who achieved a CDAI remission of < 150, and QALY) in a 1/12 weeks dosing regimen compared to all other biologics and in the 1/8 weeks dosing regimen among infliximab biosimilars; in the first year of therapy ustekinumab is also a “cost-effectiveness” technology compared to vedolizumab. Switching of 15% of patients to ustekinumab (1/12) is characterized by budget slight increase in costs within the ONLS and RLO financing channels for the 1st year and three years of therapy. Within the OMI system there is a decrease in costs allocated by the OMI Fund for a treatment facility and there is a decrease in the difference between the amount of payment received by a treatment facility for cases with the use of biologics and the cost of purchasing biologics.
As a result of the study, the introduction of ustekinumab in clinical practice is justified from the pharmacoeconomics point of view.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.