количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Обзоры
Физиотенз в лечении артериальной гипертонии
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Кардиология и Ангиология" №4
- Аннотация
- Статья
- Ссылки
Эксперты Всемирной организации здравоохранения (ВОЗ) не случайно охарактеризовали метаболический синдром (МС) как пандемию XXI века. Наличие у пациента МС ставит его в группу высокого риска по развитию в дальнейшем атеросклероза, сердечно-сосудистых осложнений, а также сахарного диабета 2 типа (СД 2 типа) [1–4].
МС ассоциируется с субклиническим поражением жизненно важных органов, что зачастую имеет место даже при отсутствии у пациентов артериальной гипертонии (АГ). Патогенез МС в целом схож у различных категорий пациентов. Однако особую группу больных формируют женщины в постменопаузе, у которых развитие МС инициируется дефицитом эстрогенов [1, 5]. Одним из проявлений МС, развитие которого сопряжено с абдоминальным (висцеральным) ожирением, является АГ.
Эксперты Всемирной организации здравоохранения (ВОЗ) не случайно охарактеризовали метаболический синдром (МС) как пандемию XXI века. Наличие у пациента МС ставит его в группу высокого риска по развитию в дальнейшем атеросклероза, сердечно-сосудистых осложнений, а также сахарного диабета 2 типа (СД 2 типа) [1–4].
МС ассоциируется с субклиническим поражением жизненно важных органов, что зачастую имеет место даже при отсутствии у пациентов артериальной гипертонии (АГ). Патогенез МС в целом схож у различных категорий пациентов. Однако особую группу больных формируют женщины в постменопаузе, у которых развитие МС инициируется дефицитом эстрогенов [1, 5]. Одним из проявлений МС, развитие которого сопряжено с абдоминальным (висцеральным) ожирением, является АГ.
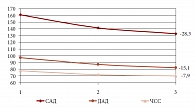
Рис. 1. Динамика АД и ЧСС на фоне терапии Физиотензом
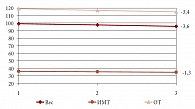
Рис. 2. Динамика веса, ИМТ и ОТ на фоне терапии Физиотензом
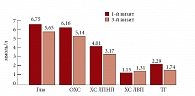
Рис. 3. Динамика лабораторных показателей (ммоль/л) на фоне терапии Физиотензом
Патогенез АГ при МС многогранен. Значительная роль в нем принадлежит инсулинорезистентности (ИР) и компенсаторной гиперинсулинемии (ГИ). Связь ГИ и АГ настолько очевидна, что еще у здоровых лиц с ГИ можно в скором времени прогнозировать развитие АГ. Кроме того, существенный вклад в формирование АГ при МС вносит гиперлептинемия [2].
В российских рекомендациях по диагностике и лечению АГ 2008 г. среди всех классов антигипертензивных препаратов в качестве основных предлагаются пять: мочегонные препараты, β-блокаторы, блокаторы кальциевых каналов (БКК), ингибиторы ангиотензин-превращающего фермента (ИАПФ), антагонисты рецепторов к ангиотензину II (АРА). Выделение этих групп препаратов обусловлено наличием результатов крупных многоцентровых исследований, показавших влияние каждого из этих классов антигипертензивных средств на прогноз [6]. Однако в лечении АГ с успехом применяются препараты и других групп, с которыми не проводилось исследований по изучению их влияния на прогноз. В обновленных Европейских рекомендациях по диагностике и лечению АГ 2009 г. в выборе антигипертензивного препарата предложено исходить из текущей клинической ситуации. Традиционное деление на основные и неосновные препараты имеет сейчас не столь важное научное и практическое значение и его следует избегать.
Одними из препаратов, позитивно влияющих на метаболический профиль пациентов с МС, являются агонисты имидазолиновых рецепторов, а именно моксонидин (Физиотенз). Он является единственным антигипертензивным препаратом с доказанной способностью повышать чувствительность к инсулину и улучшать показатели углеводного и липидного обмена.
Существуют 3 типа имидазолиновых рецепторов: I1-рецепторы отвечают за снижение гиперактивности СНС и контроль АД, I2-рецепторы – за регуляцию высвобождения норадреналина и адреналина, I3-рецепторы регулируют секрецию инсулина бета-клетками поджелудочной железы [7–10]. Механизм положительного влияния моксонидина на углеводный обмен определяется также тем, что он увеличивает экспрессию β-субъединиц рецептора инсулина и белка IRS-1 в тканях экспериментальных моделей, что сопровождается улучшением передачи сигнала инсулина в скелетных мышцах и печени [11]. Моксонидин (Физиотенз) модулирует все три типа имидазолиновых рецепторов, оказывая, таким образом, комплексное действие на уровень АД и метаболический профиль. Более того, в лабораторных условиях показано, что высокие дозы моксонидина способны оказывать не только симпатолитическое действие, но и парасимпатикомиметическое [12].
В работе Ж.Д. Кобалавы и соавт. было показано, что эффекты терапии моксонидином зависят от полиморфизма генов PPARα, PPARγ у конкретного пациента. Наличие G аллеля PPARγ ассоциируется с более выраженным снижением веса на фоне терапии моксонидином, в то время как на фоне терапии метформином наличие G аллеля PPARα ассоциируется с более выраженным снижением веса, а у пациентов с С аллелем PPARα наблюдается максимальное снижение ДАД [13].
Клиническая эффективность моксонидина была доказана в целом ряде работ. В одной из них он сравнивался по эффективности и переносимости с гидрохлортиазидом. Результаты показали, что оба препарата были одинаково эффективны в снижении АД [14]. Моксонидин сравнивался с β-блокатором атенололом. Оба препарата эффективно снижали АД. Синдрома отмены не наблюдалось [15]. Сравнительное исследование моксонидина и каптоприла показало идентичную антигипертензивную активность исследуемых препаратов [16]. В другом рандомизированном двойном слепом исследовании моксонидин сравнивался с еще одним ингибитором АПФ – эналаприлом. Моксонидин и эналаприл были в равной степени эффективны в плане снижения клинического АД, а также среднесуточной величины АД, определяемой на основании 24-часового мониторирования [17]. Проводилось также сравнение моксонидина и антагониста кальция нифедипина в рандомизированном двойном слепом исследовании. Препараты продемонстрировали одинаковую антигипертензивную эффективность, количество больных, ответивших на лечение, было примерно равным. Эффективность моксонидина была подтверждена также в долгосрочных исследованиях. Исследование TOPIC показало высокую клиническую эффективность моксонидина, который вызывал выраженное снижение АД более чем у половины пациентов при назначении как в качестве монотерапии, так и в комбинации с гидрохлортиазидом, эналаприлом и амлодипином [18].
Данные о влиянии моксонидина на метаболический статус были продемонстрированы во многих работах. Результаты наших исследований показали, что терапия моксонидином сопровождалась улучшением параметров углеводного обмена (гликемия натощак, постпрандиальная гликемия, инсулинорезистентность), липидного обмена (общего холестерина (ОХС), холестерина липопротеидов низкой плотности (ХС ЛПНП), снижением уровня лептина, улучшением функции эндотелия, уменьшением массы тела. По данным исследования CAMUS, помимо гипотензивного эффекта моксонидин достоверно снижал вес пациентов (в зависимости от исходного индекса массы тела (ИМТ)) – максимальное снижение массы тела отмечалось в группе больных с ожирением 3 степени и составило в среднем 4 кг [20].
Продемонстрированное во многих работах существенное улучшение показателей углеводного и липидного обмена на фоне добавления к терапии моксонидина, вероятно, обусловлено повышением чувствительности периферических тканей к инсулину. Снижение ИР является важной особенностью действия моксонидина помимо его основного – антигипертензивного – эффекта. Улучшение показателей липидного обмена также может свидетельствовать в пользу повышения чувствительности к инсулину. Последнее обусловлено тем, что данный препарат уменьшает симпатическую активность, что ведет к снижению гидролиза жиров, содержания жирных кислот, сокращению доли инсулинрезистентных (тип II В) волокон в скелетных мышцах, усилению переноса и метаболизма глюкозы [15]. Все это приводит к повышению чувствительности к инсулину и улучшению липидного профиля. Способность моксонидина повышать чувствительность к инсулину была показана как в экспериментальных работах [15], так и в ряде клинических исследований. Повышение чувствительности к инсулину на фоне лечения моксонидином было также продемонстрировано в работе В.А. Алмазова и соавт. В многоцентровом исследовании ALMAZ сравнивали эффективность моксонидина и метформина [19]. Было показано, что антигипертензивный препарат – моксонидин (Физиотенз) – повышал чувствительность к инсулину так же эффективно, как сахароснижающий – метформин, чей эффект непосредственно связан с воздействием на данный механизм. Кроме того, в двойном слепом плацебоконтролируемом исследовании, в котором изучалось влияние моксонидина на чувствительность к инсулину с применением техники контролируемой гликемии, было установлено, что Физиотенз улучшает инсулинопосредованное поступление глюкозы в ткани у больных АГ и ожирением [21].
Одним из наиболее крупных исследований, посвященных изучению долгосрочной безопасности и эффективности моксонидина (Физиотенз), назначаемого с целью снижения артериального давления пациентам с АГ и МС, является многоцентровое международное исследование MERSY (Moxonidine Efficacy on blood pressure Reduction revealed in a metabolic SYndrome population). В исследовании принимали участие мужчины и женщины с признаками абдоминального ожирения и АГ от 1 до 3 степени. Женщины в постменопаузе были выделены в отдельную группу. Причем на момент включения в исследование женщины в постменопаузе достоверно отличались от пациенток с сохранной менструальной функцией более высоким уровнем САД, пульсового артериального давления (ПАД), ЧСС и ОХС. Пациентам, не получавшим лечения до включения в исследование, был назначен Физиотенз. Тем пациентам, у кого целевой уровень АД не был достигнут несмотря на прием антигипертензивных препаратов в виде моно- или комбинированной терапии, в дополнение назначали Физиотенз в дозировке 0,2 мг/сут (33,3%), 0,4 мг/сут (66,3%) и 0,8 мг/сут (0,4%). На монотерапии Физиотензом находились только 19% больных. В результате проводимого лечения уровень САД снизился в среднем на 28,3 ± 14,0 мм рт. ст. (р < 0,0001), ДАД – на 15,1 ± 9,62 мм рт. ст. (р < 0,0001), ПАД – на 13,21 ± 1,8 мм рт. ст. (р < 0,0001), ЧСС – на 7,94 ± 8,6 уд/мин (р < 0,0001) (рис. 1).
Показательно, что на фоне лечения Физиотензом отмечалось также снижение массы тела в среднем на 3,56 ± 7,6 кг (р = 0,01), ИМТ – на 1,26 ± 2,9 (р = 0,009), а ОТ уменьшился в среднем на 3,4 ± 5,6 см (р = 0,004) (рис. 2).
На фоне терапии Физиотензом в общей группе больных улучшились лабораторные показатели: значимо снизился уровень глюкозы крови натощак – на 1,09 ± 1,69 ммоль/л, ОХС – на 1,02 ± 1,15 ммоль/л (р < 0,0001), ХС ЛПНП – на 0,84 ± 1,17 ммоль/л (р = 0,0003), ТГ – на 0,59 ± 1,15 ммоль/л (р < 0,0001), уровень ХС ЛПВП повысился на 0,16 ± 0,42 ммоль/л (р < 0,005) (рис. 3).
У женщин в постменопаузе динамика исследуемых показателей была аналогичной. Таким образом, в общей группе пациентов статистически достоверно улучшились все исследуемые показатели. Примечательно, что при исследовании межгрупповых различий у женщин с менопаузой и без нее абсолютные изменения показателей были отмечены только в отношении уровня ТГ – его снижение ощутимо превалировало в группе больных с сохранной менструальной функцией [22].
Положительное влияние на чувствительность адипоцитов к инсулину было показано в лабораторных условиях в работе Z. Sun и соавт., которые оценивали динамику ответа на введенный инсулин у крыс с искусственно вызванной гипертензией и у крыс с искусственно вызванной гипертензией на фоне ожирения. Был продемонстрирован более выраженный эффект именно во второй группе исследуемых животных при длительном применении моксонидина, в то время как краткосрочное применение моксонидина у крыс со спонтанной гипертензией без ожирения не дало подобного результата [23].
Однако несмотря на множество проведенных исследований, подтверждающих позитивное влияние моксонидина на показатели углеводного обмена, группой польских ученых было выявлено отсутствие данного эффекта; также в данной работе не было выявлено уменьшения уровня маркеров воспаления (YKL-40) и эндотелиальной дисфункции (ЭД) и мочевой кислоты. В то же время были отмечены удовлетворительный антигипертензивный эффект моксонидина и его благотворное влияние на липидный профиль [24]. В противоположность результатам данного исследования целесообразно привести результаты, полученные другой группой исследователей, изучавших влияние на уровень чувствительного маркера воспаления на фоне терапии моксонидином в сравнении с терапией атенололом у женщин в постменопаузе, страдающих избыточным весом и диастолической формой АГ. Уровень TNF-α на фоне терапии моксонидином значимо снижался, в то время как на фоне приема атенолола отмечалось его повышение. Что касается адипонектина, его уровень ощутимо снижался в группе пациенток, принимавших атенолол, в группе моксонидина его концентрация оставалась неизменной. Таким образом, был продемонстрирован противовоспалительный эффект моксонидина без какого-либо влияния на протективные свойства адипонектина [25].
Некоторые расхождения в литературных данных имеются относительно влияния на уровень ренина. В то время как в значительном количестве работ была показана способность моксонидина снижать значения данного показателя, в рандомизированном открытом исследовании с параллельными группами с участием 40 пациентов с АГ и ожирением, проведенном на базе клиники по лечению АГ в Рио-де-Жанейро, после 2-недельной терапии моксонидином уровень активности ренина и альдостерона оставался прежним. Но это исследование наглядно продемонстрировало эффективность моксонидина в отношении подавления активности СНС. Наблюдалось снижение уровней адреналина в артериальной плазме в состоянии покоя, что авторы объясняют высоким сродством моксонидина к I1-имидазолиновым участкам на мембранах хромаффинных клеток мозгового вещества надпочечников. Значительное снижение уровней норадреналина в положении стоя на фоне приема моксонидина подтверждает эффективность препарата в условиях гиперактивности СНС. В пользу этого свидетельствуют также исследования, показавшие, что уровни норадреналина достоверно снижались только у пациентов, отвечающих на терапию моксонидином, в отличие от пациентов с неэффективным контролем АД. Интересным наблюдением в данной работе явилось то, что через 24 недели терапии моксонидином отмечалось снижение уровней лептина в плазме. Следует отметить, что масса тела пациентов на протяжении всего периода лечения оставалась неизменной [26].
Характерным проявлением поражения органов-мишеней при МС является гипертрофия левого желудочка (ГЛЖ). Важную роль в развитии ГЛЖ играют гемодинамические и нейрогуморальные механизмы. Последние включают стимулирующие рост кардиомиоцитов эффекты норадреналина и ангиотензина II, а также усиление процессов фиброзирования миокарда под влиянием компонетов РААС, как циркулирующей, так и тканевой, – ангиотензина II и альдостерона [27].
У пациентов с эссенциальной АГ, как при нормальной, так и при нарушенной толерантности к глюкозе, а также при наличии СД, существуют значимые (независимые от уровней АД) корреляции между уровнями инсулина и инсулиноподобного фактора роста-1 (ILGF-1) с одной стороны, и значениями массы миокарда (ММ) ЛЖ – с другой. В связи с этим представляется вполне объяснимым тот факт, что у пациентов с АГ на фоне МС и СД гипертрофия левого желудочка (ГЛЖ) более выражена, чем у пациентов с АГ на фоне неизмененного углеводного обмена [28–29].
ГЛЖ является дезадаптивным процессом, увеличивающим риск сердечно-сосудистых осложнений (ССО). Для моксонидина в ряде работ описаны эффекты, связанные не только со снижением АД за счет центрального механизма подавления симпатической активности. Описано прямое действие на сердце, выражающееся в индукции предсердного натрийуретического гормона (ПНУГ), обладающего вазодилатирующим и антигипертрофическим действием.
В одном из исследований помимо антигипертензивного эффекта была продемонстрирована регрессия ГЛЖ, выраженность которой напрямую зависела как от продолжительности лечения, так и от дозировки моксонидина. Причем более ощутимое снижение выраженности ГЛЖ отмечалось при нормализации массы тела. На фоне применения моксонидина отмечалось снижение содержания и продукции ДНК в миокарде, транзиторно, но значимо повышалась фрагментация ДНК уже на первой неделе приема моксонидина. Интересно, что через 4 недели приема моксонидина высокие доза препарата снижали активность апоптотического белка Вах, а стимуляция антиапоптотического белка Bcl-2 происходила независимо от дозировки. Таким образом, была продемонстрирована способность моксонидина влиять на ГЛЖ посредством модуляции динамики ДНК миокарда [30].
H. Aceros и соавт. провели исследование механизмов регрессии ГЛЖ. Была продемонстрирована способность моксонидина в субгипотензивной дозировке (100 мкг/сут) снижать ЧСС, улучшать глобальную функцию сердца, редуцировать депозиты коллагена в строме миокарда, вызывать регрессию ГЛЖ, ингибировать фосфорилирование Akt и p38 MAPK, ослаблять активность циркулирующих и тканевых кардиальных цитокинов. Прием моксонидина в среднетерапевтической дозировке (0,4 мг/сут) сопровождался аналогичной динамикой исследованных параметров, однако не более выраженной, чем в первой группе исследованных. Отличие состояло главным образом в выраженности гипотензивного эффекта. In vitro моксонидин подавлял индуцированную норэпинефрином гибель кардиомиоцитов (КМЦ), однако повышал гибель фибробластов посредством влияния на имидазолиновые рецепторы и уровень Akt and p38 MAPK [31].
В развитии АГ одну из ключевых ролей играет эндотелиальная дисфункция (ЭД), наиболее значительным проявлением которой является снижение синтеза эндотелием вазодилатирующих факторов. Наряду с этим нарастает роль вазоконстрикторов – ангиотензина II и эндотелина-1 (ЭТ-1). Данные изменения приводят к ремоделированию артерий в виде пролиферации ГМК и развития фибротических изменений, в результате чего отмечается рост общего периферического сосудистого сопротивления (ОПСС) и развитие собственно АГ [32].
Помимо этого, ЭД создает благоприятные условия для развития атеросклероза за счет увеличения проницаемости сосудистой стенки для атерогенных липидов, а также провоцирует нарушения в системе фибринолиза, что является характерным компонентом МС [32]. Помимо АГ, ЭД является важным звеном патогенеза таких заболеваний (и их осложнений) как СД, ИБС, ХСН, атеросклероз, риск возникновения которых у пациентов с избыточной массой тела крайне высок. Так, в уже упомянутом исследовании MERSY гипертрофия миокарда левого желудочка была выявлена у 75,4% пациентов, СД – у 51,7%, ИБС – у 33,1%, атеросклероз – у 21,0%, острые нарушения мозгового кровообращения (ОНМК) в анамнезе – у 12,1%, хроническая сердечная недостаточность (ХСН) – у 7,7%, диабетическая нефропатия – у 7,3%, перенесенный инфаркт миокарда – у 6,6%, хроническая почечная недостаточность (ХПН) – у 0,7% [22]. Инициирующую роль в формировании ЭД у больных с нарушенным углеводным обменом отводят накоплению конечных продуктов гликозилирования белков в субэндотелиальном пространстве и активации свободнорадикальных процессов с увеличением продукции супероксиданионов, которые оказывают непосредственное действие на тонус ГМК, а также обладают способностью связывать и инактивировать оксид азота [33]. Конечные продукты гликозилирования являются самостоятельными атерогенными факторами, поскольку способствуют повышению проницаемости эндотелия, усилению адгезии клеток крови, активации хемотаксиса моноцитов/макрофагов в артериальную стенку, пролиферации гладкомышечных клеток. В исследовании А.С. Аметова и соавт. было показано, что прием моксонидина благотворно отражается на функции эндотелия: эндотелийзависимая вазодилатация (ЭЗВД) через 16 недель терапии достоверно возросла с 4,86 ± 5,08% до 8,72 ± 3,72% (р < 0,001). ЭЗВД нормализовалась, по данным пробы с реактивной гиперемией, у 30,76%, улучшение отмечено у 34,61% пациентов [33]. Участие моксонидина в развитии гипотензии и дилятации артерий было продемонстрировано в исследовании, проведенном сотрудниками отдела физиологии университета в Сан-Пауло. Предварительное введение ингибитора NO-синтазы предотвращало развитие гипотензии, вызванной введением моксонидина. Введение моксонидина лабораторным моделям редуцировало резистентность мезентериальных, почечных и бедренных артерий у нормотензивных крыс и у животных с искусственно вызванной гипертензией. Причем в тех случаях, когда проводилась предварительная подготовка ингибитором NO-синтазы, вышеописанный эффект моксонидина не наблюдался. Таким образом, было доказано, что моксонидин способен индуцировать вазодилатацию и гипотензию опосредованно через оксид азота [34].
Маркером системной дисфункции эндотелия и независимым предиктором сердечно-сосудистых осложнений является микроальбуминурия. В ряде исследований была продемонстрирована способность моксонидина снижать выраженность альбуминурии [35–36]. Так, в одном исследовании было выявлено снижение уровня микроальбуминурии на фоне терапии моксонидином. 15 больных СД 2 типа с микроальбуминурией были рандомизированы на группы, получающие либо моксонидин (0,4 мг/сут), либо плацебо. Экскреция альбумина снизилась только в группе больных, получавших активное лечение [37].
Способность моксонидина усиливать экскреторную функцию почек через индукцию диуреза и натриуреза посредством активации центральных имидазолиновых рецепторов была продемонстрирована, в частности, в исследовании C.A. de Andrade и соавт. В их работе было также показано, что дилятация почечных артерий в большей степени определяется воздействием на центральные альфа-1-адренорецепторы метилнорадреналина [38].
Таким образом, можно говорить о многоплановых эффектах моксонидина, обусловленных как непосредственным влиянием на ОПСС через активацию центральных имидазолиновых рецепторов, так и его дополнительными эффектами: способностью снижать выраженность таких процессов, как воспаление, ЭД, ремоделирование миокарда левого желудочка, микроальбуминурии. Несомненным является позитивное воздействие данного препарата на показатели липидного и углеводного обмена, главным образом, речь идет о снижении ИР – ключевого компонента МС. Моксонидин (Физиотенз), безусловно, зарекомендовал себя как эффективный антигипертензивный препарат, назначаемый в том числе и в качестве монотерапии. Однако пациентам с МС, которые относятся к группе высокого и очень высокого риска, согласно Рекомендациям по диагностике, профилактике и лечению АГ, разработанным экспертами ВНОК (2008), уже на старте лечения показано назначение комбинированной антигипертензивной терапии. С этой точки зрения применение агониста центральных имидазолиновых рецепторов Физиотенза имеет значительные преимущества, связанные с его способностью нивелировать нежелательные эффекты антигипертензивных препаратов других классов.
В российских рекомендациях по диагностике и лечению АГ 2008 г. среди всех классов антигипертензивных препаратов в качестве основных предлагаются пять: мочегонные препараты, β-блокаторы, блокаторы кальциевых каналов (БКК), ингибиторы ангиотензин-превращающего фермента (ИАПФ), антагонисты рецепторов к ангиотензину II (АРА). Выделение этих групп препаратов обусловлено наличием результатов крупных многоцентровых исследований, показавших влияние каждого из этих классов антигипертензивных средств на прогноз [6]. Однако в лечении АГ с успехом применяются препараты и других групп, с которыми не проводилось исследований по изучению их влияния на прогноз. В обновленных Европейских рекомендациях по диагностике и лечению АГ 2009 г. в выборе антигипертензивного препарата предложено исходить из текущей клинической ситуации. Традиционное деление на основные и неосновные препараты имеет сейчас не столь важное научное и практическое значение и его следует избегать.
Одними из препаратов, позитивно влияющих на метаболический профиль пациентов с МС, являются агонисты имидазолиновых рецепторов, а именно моксонидин (Физиотенз). Он является единственным антигипертензивным препаратом с доказанной способностью повышать чувствительность к инсулину и улучшать показатели углеводного и липидного обмена.
Существуют 3 типа имидазолиновых рецепторов: I1-рецепторы отвечают за снижение гиперактивности СНС и контроль АД, I2-рецепторы – за регуляцию высвобождения норадреналина и адреналина, I3-рецепторы регулируют секрецию инсулина бета-клетками поджелудочной железы [7–10]. Механизм положительного влияния моксонидина на углеводный обмен определяется также тем, что он увеличивает экспрессию β-субъединиц рецептора инсулина и белка IRS-1 в тканях экспериментальных моделей, что сопровождается улучшением передачи сигнала инсулина в скелетных мышцах и печени [11]. Моксонидин (Физиотенз) модулирует все три типа имидазолиновых рецепторов, оказывая, таким образом, комплексное действие на уровень АД и метаболический профиль. Более того, в лабораторных условиях показано, что высокие дозы моксонидина способны оказывать не только симпатолитическое действие, но и парасимпатикомиметическое [12].
В работе Ж.Д. Кобалавы и соавт. было показано, что эффекты терапии моксонидином зависят от полиморфизма генов PPARα, PPARγ у конкретного пациента. Наличие G аллеля PPARγ ассоциируется с более выраженным снижением веса на фоне терапии моксонидином, в то время как на фоне терапии метформином наличие G аллеля PPARα ассоциируется с более выраженным снижением веса, а у пациентов с С аллелем PPARα наблюдается максимальное снижение ДАД [13].
Клиническая эффективность моксонидина была доказана в целом ряде работ. В одной из них он сравнивался по эффективности и переносимости с гидрохлортиазидом. Результаты показали, что оба препарата были одинаково эффективны в снижении АД [14]. Моксонидин сравнивался с β-блокатором атенололом. Оба препарата эффективно снижали АД. Синдрома отмены не наблюдалось [15]. Сравнительное исследование моксонидина и каптоприла показало идентичную антигипертензивную активность исследуемых препаратов [16]. В другом рандомизированном двойном слепом исследовании моксонидин сравнивался с еще одним ингибитором АПФ – эналаприлом. Моксонидин и эналаприл были в равной степени эффективны в плане снижения клинического АД, а также среднесуточной величины АД, определяемой на основании 24-часового мониторирования [17]. Проводилось также сравнение моксонидина и антагониста кальция нифедипина в рандомизированном двойном слепом исследовании. Препараты продемонстрировали одинаковую антигипертензивную эффективность, количество больных, ответивших на лечение, было примерно равным. Эффективность моксонидина была подтверждена также в долгосрочных исследованиях. Исследование TOPIC показало высокую клиническую эффективность моксонидина, который вызывал выраженное снижение АД более чем у половины пациентов при назначении как в качестве монотерапии, так и в комбинации с гидрохлортиазидом, эналаприлом и амлодипином [18].
Данные о влиянии моксонидина на метаболический статус были продемонстрированы во многих работах. Результаты наших исследований показали, что терапия моксонидином сопровождалась улучшением параметров углеводного обмена (гликемия натощак, постпрандиальная гликемия, инсулинорезистентность), липидного обмена (общего холестерина (ОХС), холестерина липопротеидов низкой плотности (ХС ЛПНП), снижением уровня лептина, улучшением функции эндотелия, уменьшением массы тела. По данным исследования CAMUS, помимо гипотензивного эффекта моксонидин достоверно снижал вес пациентов (в зависимости от исходного индекса массы тела (ИМТ)) – максимальное снижение массы тела отмечалось в группе больных с ожирением 3 степени и составило в среднем 4 кг [20].
Продемонстрированное во многих работах существенное улучшение показателей углеводного и липидного обмена на фоне добавления к терапии моксонидина, вероятно, обусловлено повышением чувствительности периферических тканей к инсулину. Снижение ИР является важной особенностью действия моксонидина помимо его основного – антигипертензивного – эффекта. Улучшение показателей липидного обмена также может свидетельствовать в пользу повышения чувствительности к инсулину. Последнее обусловлено тем, что данный препарат уменьшает симпатическую активность, что ведет к снижению гидролиза жиров, содержания жирных кислот, сокращению доли инсулинрезистентных (тип II В) волокон в скелетных мышцах, усилению переноса и метаболизма глюкозы [15]. Все это приводит к повышению чувствительности к инсулину и улучшению липидного профиля. Способность моксонидина повышать чувствительность к инсулину была показана как в экспериментальных работах [15], так и в ряде клинических исследований. Повышение чувствительности к инсулину на фоне лечения моксонидином было также продемонстрировано в работе В.А. Алмазова и соавт. В многоцентровом исследовании ALMAZ сравнивали эффективность моксонидина и метформина [19]. Было показано, что антигипертензивный препарат – моксонидин (Физиотенз) – повышал чувствительность к инсулину так же эффективно, как сахароснижающий – метформин, чей эффект непосредственно связан с воздействием на данный механизм. Кроме того, в двойном слепом плацебоконтролируемом исследовании, в котором изучалось влияние моксонидина на чувствительность к инсулину с применением техники контролируемой гликемии, было установлено, что Физиотенз улучшает инсулинопосредованное поступление глюкозы в ткани у больных АГ и ожирением [21].
Одним из наиболее крупных исследований, посвященных изучению долгосрочной безопасности и эффективности моксонидина (Физиотенз), назначаемого с целью снижения артериального давления пациентам с АГ и МС, является многоцентровое международное исследование MERSY (Moxonidine Efficacy on blood pressure Reduction revealed in a metabolic SYndrome population). В исследовании принимали участие мужчины и женщины с признаками абдоминального ожирения и АГ от 1 до 3 степени. Женщины в постменопаузе были выделены в отдельную группу. Причем на момент включения в исследование женщины в постменопаузе достоверно отличались от пациенток с сохранной менструальной функцией более высоким уровнем САД, пульсового артериального давления (ПАД), ЧСС и ОХС. Пациентам, не получавшим лечения до включения в исследование, был назначен Физиотенз. Тем пациентам, у кого целевой уровень АД не был достигнут несмотря на прием антигипертензивных препаратов в виде моно- или комбинированной терапии, в дополнение назначали Физиотенз в дозировке 0,2 мг/сут (33,3%), 0,4 мг/сут (66,3%) и 0,8 мг/сут (0,4%). На монотерапии Физиотензом находились только 19% больных. В результате проводимого лечения уровень САД снизился в среднем на 28,3 ± 14,0 мм рт. ст. (р < 0,0001), ДАД – на 15,1 ± 9,62 мм рт. ст. (р < 0,0001), ПАД – на 13,21 ± 1,8 мм рт. ст. (р < 0,0001), ЧСС – на 7,94 ± 8,6 уд/мин (р < 0,0001) (рис. 1).
Показательно, что на фоне лечения Физиотензом отмечалось также снижение массы тела в среднем на 3,56 ± 7,6 кг (р = 0,01), ИМТ – на 1,26 ± 2,9 (р = 0,009), а ОТ уменьшился в среднем на 3,4 ± 5,6 см (р = 0,004) (рис. 2).
На фоне терапии Физиотензом в общей группе больных улучшились лабораторные показатели: значимо снизился уровень глюкозы крови натощак – на 1,09 ± 1,69 ммоль/л, ОХС – на 1,02 ± 1,15 ммоль/л (р < 0,0001), ХС ЛПНП – на 0,84 ± 1,17 ммоль/л (р = 0,0003), ТГ – на 0,59 ± 1,15 ммоль/л (р < 0,0001), уровень ХС ЛПВП повысился на 0,16 ± 0,42 ммоль/л (р < 0,005) (рис. 3).
У женщин в постменопаузе динамика исследуемых показателей была аналогичной. Таким образом, в общей группе пациентов статистически достоверно улучшились все исследуемые показатели. Примечательно, что при исследовании межгрупповых различий у женщин с менопаузой и без нее абсолютные изменения показателей были отмечены только в отношении уровня ТГ – его снижение ощутимо превалировало в группе больных с сохранной менструальной функцией [22].
Положительное влияние на чувствительность адипоцитов к инсулину было показано в лабораторных условиях в работе Z. Sun и соавт., которые оценивали динамику ответа на введенный инсулин у крыс с искусственно вызванной гипертензией и у крыс с искусственно вызванной гипертензией на фоне ожирения. Был продемонстрирован более выраженный эффект именно во второй группе исследуемых животных при длительном применении моксонидина, в то время как краткосрочное применение моксонидина у крыс со спонтанной гипертензией без ожирения не дало подобного результата [23].
Однако несмотря на множество проведенных исследований, подтверждающих позитивное влияние моксонидина на показатели углеводного обмена, группой польских ученых было выявлено отсутствие данного эффекта; также в данной работе не было выявлено уменьшения уровня маркеров воспаления (YKL-40) и эндотелиальной дисфункции (ЭД) и мочевой кислоты. В то же время были отмечены удовлетворительный антигипертензивный эффект моксонидина и его благотворное влияние на липидный профиль [24]. В противоположность результатам данного исследования целесообразно привести результаты, полученные другой группой исследователей, изучавших влияние на уровень чувствительного маркера воспаления на фоне терапии моксонидином в сравнении с терапией атенололом у женщин в постменопаузе, страдающих избыточным весом и диастолической формой АГ. Уровень TNF-α на фоне терапии моксонидином значимо снижался, в то время как на фоне приема атенолола отмечалось его повышение. Что касается адипонектина, его уровень ощутимо снижался в группе пациенток, принимавших атенолол, в группе моксонидина его концентрация оставалась неизменной. Таким образом, был продемонстрирован противовоспалительный эффект моксонидина без какого-либо влияния на протективные свойства адипонектина [25].
Некоторые расхождения в литературных данных имеются относительно влияния на уровень ренина. В то время как в значительном количестве работ была показана способность моксонидина снижать значения данного показателя, в рандомизированном открытом исследовании с параллельными группами с участием 40 пациентов с АГ и ожирением, проведенном на базе клиники по лечению АГ в Рио-де-Жанейро, после 2-недельной терапии моксонидином уровень активности ренина и альдостерона оставался прежним. Но это исследование наглядно продемонстрировало эффективность моксонидина в отношении подавления активности СНС. Наблюдалось снижение уровней адреналина в артериальной плазме в состоянии покоя, что авторы объясняют высоким сродством моксонидина к I1-имидазолиновым участкам на мембранах хромаффинных клеток мозгового вещества надпочечников. Значительное снижение уровней норадреналина в положении стоя на фоне приема моксонидина подтверждает эффективность препарата в условиях гиперактивности СНС. В пользу этого свидетельствуют также исследования, показавшие, что уровни норадреналина достоверно снижались только у пациентов, отвечающих на терапию моксонидином, в отличие от пациентов с неэффективным контролем АД. Интересным наблюдением в данной работе явилось то, что через 24 недели терапии моксонидином отмечалось снижение уровней лептина в плазме. Следует отметить, что масса тела пациентов на протяжении всего периода лечения оставалась неизменной [26].
Характерным проявлением поражения органов-мишеней при МС является гипертрофия левого желудочка (ГЛЖ). Важную роль в развитии ГЛЖ играют гемодинамические и нейрогуморальные механизмы. Последние включают стимулирующие рост кардиомиоцитов эффекты норадреналина и ангиотензина II, а также усиление процессов фиброзирования миокарда под влиянием компонетов РААС, как циркулирующей, так и тканевой, – ангиотензина II и альдостерона [27].
У пациентов с эссенциальной АГ, как при нормальной, так и при нарушенной толерантности к глюкозе, а также при наличии СД, существуют значимые (независимые от уровней АД) корреляции между уровнями инсулина и инсулиноподобного фактора роста-1 (ILGF-1) с одной стороны, и значениями массы миокарда (ММ) ЛЖ – с другой. В связи с этим представляется вполне объяснимым тот факт, что у пациентов с АГ на фоне МС и СД гипертрофия левого желудочка (ГЛЖ) более выражена, чем у пациентов с АГ на фоне неизмененного углеводного обмена [28–29].
ГЛЖ является дезадаптивным процессом, увеличивающим риск сердечно-сосудистых осложнений (ССО). Для моксонидина в ряде работ описаны эффекты, связанные не только со снижением АД за счет центрального механизма подавления симпатической активности. Описано прямое действие на сердце, выражающееся в индукции предсердного натрийуретического гормона (ПНУГ), обладающего вазодилатирующим и антигипертрофическим действием.
В одном из исследований помимо антигипертензивного эффекта была продемонстрирована регрессия ГЛЖ, выраженность которой напрямую зависела как от продолжительности лечения, так и от дозировки моксонидина. Причем более ощутимое снижение выраженности ГЛЖ отмечалось при нормализации массы тела. На фоне применения моксонидина отмечалось снижение содержания и продукции ДНК в миокарде, транзиторно, но значимо повышалась фрагментация ДНК уже на первой неделе приема моксонидина. Интересно, что через 4 недели приема моксонидина высокие доза препарата снижали активность апоптотического белка Вах, а стимуляция антиапоптотического белка Bcl-2 происходила независимо от дозировки. Таким образом, была продемонстрирована способность моксонидина влиять на ГЛЖ посредством модуляции динамики ДНК миокарда [30].
H. Aceros и соавт. провели исследование механизмов регрессии ГЛЖ. Была продемонстрирована способность моксонидина в субгипотензивной дозировке (100 мкг/сут) снижать ЧСС, улучшать глобальную функцию сердца, редуцировать депозиты коллагена в строме миокарда, вызывать регрессию ГЛЖ, ингибировать фосфорилирование Akt и p38 MAPK, ослаблять активность циркулирующих и тканевых кардиальных цитокинов. Прием моксонидина в среднетерапевтической дозировке (0,4 мг/сут) сопровождался аналогичной динамикой исследованных параметров, однако не более выраженной, чем в первой группе исследованных. Отличие состояло главным образом в выраженности гипотензивного эффекта. In vitro моксонидин подавлял индуцированную норэпинефрином гибель кардиомиоцитов (КМЦ), однако повышал гибель фибробластов посредством влияния на имидазолиновые рецепторы и уровень Akt and p38 MAPK [31].
В развитии АГ одну из ключевых ролей играет эндотелиальная дисфункция (ЭД), наиболее значительным проявлением которой является снижение синтеза эндотелием вазодилатирующих факторов. Наряду с этим нарастает роль вазоконстрикторов – ангиотензина II и эндотелина-1 (ЭТ-1). Данные изменения приводят к ремоделированию артерий в виде пролиферации ГМК и развития фибротических изменений, в результате чего отмечается рост общего периферического сосудистого сопротивления (ОПСС) и развитие собственно АГ [32].
Помимо этого, ЭД создает благоприятные условия для развития атеросклероза за счет увеличения проницаемости сосудистой стенки для атерогенных липидов, а также провоцирует нарушения в системе фибринолиза, что является характерным компонентом МС [32]. Помимо АГ, ЭД является важным звеном патогенеза таких заболеваний (и их осложнений) как СД, ИБС, ХСН, атеросклероз, риск возникновения которых у пациентов с избыточной массой тела крайне высок. Так, в уже упомянутом исследовании MERSY гипертрофия миокарда левого желудочка была выявлена у 75,4% пациентов, СД – у 51,7%, ИБС – у 33,1%, атеросклероз – у 21,0%, острые нарушения мозгового кровообращения (ОНМК) в анамнезе – у 12,1%, хроническая сердечная недостаточность (ХСН) – у 7,7%, диабетическая нефропатия – у 7,3%, перенесенный инфаркт миокарда – у 6,6%, хроническая почечная недостаточность (ХПН) – у 0,7% [22]. Инициирующую роль в формировании ЭД у больных с нарушенным углеводным обменом отводят накоплению конечных продуктов гликозилирования белков в субэндотелиальном пространстве и активации свободнорадикальных процессов с увеличением продукции супероксиданионов, которые оказывают непосредственное действие на тонус ГМК, а также обладают способностью связывать и инактивировать оксид азота [33]. Конечные продукты гликозилирования являются самостоятельными атерогенными факторами, поскольку способствуют повышению проницаемости эндотелия, усилению адгезии клеток крови, активации хемотаксиса моноцитов/макрофагов в артериальную стенку, пролиферации гладкомышечных клеток. В исследовании А.С. Аметова и соавт. было показано, что прием моксонидина благотворно отражается на функции эндотелия: эндотелийзависимая вазодилатация (ЭЗВД) через 16 недель терапии достоверно возросла с 4,86 ± 5,08% до 8,72 ± 3,72% (р < 0,001). ЭЗВД нормализовалась, по данным пробы с реактивной гиперемией, у 30,76%, улучшение отмечено у 34,61% пациентов [33]. Участие моксонидина в развитии гипотензии и дилятации артерий было продемонстрировано в исследовании, проведенном сотрудниками отдела физиологии университета в Сан-Пауло. Предварительное введение ингибитора NO-синтазы предотвращало развитие гипотензии, вызванной введением моксонидина. Введение моксонидина лабораторным моделям редуцировало резистентность мезентериальных, почечных и бедренных артерий у нормотензивных крыс и у животных с искусственно вызванной гипертензией. Причем в тех случаях, когда проводилась предварительная подготовка ингибитором NO-синтазы, вышеописанный эффект моксонидина не наблюдался. Таким образом, было доказано, что моксонидин способен индуцировать вазодилатацию и гипотензию опосредованно через оксид азота [34].
Маркером системной дисфункции эндотелия и независимым предиктором сердечно-сосудистых осложнений является микроальбуминурия. В ряде исследований была продемонстрирована способность моксонидина снижать выраженность альбуминурии [35–36]. Так, в одном исследовании было выявлено снижение уровня микроальбуминурии на фоне терапии моксонидином. 15 больных СД 2 типа с микроальбуминурией были рандомизированы на группы, получающие либо моксонидин (0,4 мг/сут), либо плацебо. Экскреция альбумина снизилась только в группе больных, получавших активное лечение [37].
Способность моксонидина усиливать экскреторную функцию почек через индукцию диуреза и натриуреза посредством активации центральных имидазолиновых рецепторов была продемонстрирована, в частности, в исследовании C.A. de Andrade и соавт. В их работе было также показано, что дилятация почечных артерий в большей степени определяется воздействием на центральные альфа-1-адренорецепторы метилнорадреналина [38].
Таким образом, можно говорить о многоплановых эффектах моксонидина, обусловленных как непосредственным влиянием на ОПСС через активацию центральных имидазолиновых рецепторов, так и его дополнительными эффектами: способностью снижать выраженность таких процессов, как воспаление, ЭД, ремоделирование миокарда левого желудочка, микроальбуминурии. Несомненным является позитивное воздействие данного препарата на показатели липидного и углеводного обмена, главным образом, речь идет о снижении ИР – ключевого компонента МС. Моксонидин (Физиотенз), безусловно, зарекомендовал себя как эффективный антигипертензивный препарат, назначаемый в том числе и в качестве монотерапии. Однако пациентам с МС, которые относятся к группе высокого и очень высокого риска, согласно Рекомендациям по диагностике, профилактике и лечению АГ, разработанным экспертами ВНОК (2008), уже на старте лечения показано назначение комбинированной антигипертензивной терапии. С этой точки зрения применение агониста центральных имидазолиновых рецепторов Физиотенза имеет значительные преимущества, связанные с его способностью нивелировать нежелательные эффекты антигипертензивных препаратов других классов.
1. Рекомендации экспертов Всероссийского научного общества кардиологов по диагностике и лечению метаболического синдрома. Второй пересмотр. 2009.
2. Чазова И.Е., Мычка В.Б. Метаболический синдром. М., 2004.
3. Mancia G., Bombelli M., Corrao G., Facchetti R., Madotto F., Giannattasio C., Trevano F.Q., Grassi G., Zanchetti A., Sega R. Metabolic syndrome in the Pressioni Arteriose Monitorate E Loro Associazioni (PAMELA) study: daily life bloodpressure, cardiac damage, and prognosis // Hypertension. 2007. Vol. 49. P. 40–47.
4. Lakka H.M., Laaksonen D.E., Lakka T.A., Niskanen L.K., Kumpussalo E., Tuomilehto J., Salonen J.T. The metabolic syndrome and total and cardiovascular disease mortality in middleaged men // JAMA. 2002. Vol. 288. P. 2709–2716.
5. Чазова И.Е., Сметник В.П., Балан В.Е. и соавт. Консенсус российских кардиологов и гинекологов: ведение женщин в пери- и постменопаузе с сердечно-сосудистым риском // Consilium medicum. 2008. Т. 10. № 6. С. 5–18.
6. Рекомендации Всероссийского научного общества кардиологов по диагностике и лечению артериальной гипертонии. 2008.
7. Head G.A., Mayorov D.N. Imidazoline receptors, novel agents and therapeutic potential // Cardiovasc. Hematol. Agents Med. Chem. 2006. Vol. 4. № 1. P. 17–32.
8. Ernsberger P. The I1-imidazoline receptor and its cellular signaling pathways // Ann. N. Y. Acad. Sci. 1999. Vol. 881. P. 35–53.
9. Rösen P., Ohly P., Gleichmann H. Experimental benefit of moxonidine on glucose metabolism and insulin secretion in the fructose-fed rat // J. Hypertens. 1997. Vol. 15. № 1. P. S31–S38.
10. Ernsberger P. Pharmacology of moxonidine. An I1-imidazoline receptor antagonist // J. Cardiovasc. Pharmacol. 2000. Vol. 35. P. S27 – S41.
11. Friedman J.E., Ishizuka T., Liu S., Farrell C.J., Koletsky R.J., Bedol D., Ernsberger P. Anti-hyperglycemic activity of moxonidine: metabolic and molecular effects in obese spontaneously hypertensive rats // Blood Pressure. 1998. Vol. 3. P. 32–39.
12. Turcani M. Biphasic dose-dependent modulation of cardiac parasympathetic activity by moxonidine, an imidazoline I1-receptor agonist // J. Cardiovasc. Pharmacol. 2008. Vol. 52. № 6. P. 524–535
13. Кобалава Ж.Д., Толкачева В.В., Игнатьев И.В., Глезер М.Г., Кузин А.И., Карпов Ю.А., Конради А.О., Железных. Е.А. Клинико-генетические аспекты нарушений углеводного обмена и эффективность их коррекции моксонидином и метформином у больных с артериальной гипертонией // Терапевтический архив. 2005. № 1. С. 46–51.
14. Frei M., Kuster L., Gardosh von Krosigh P-P., Koch H.F. Moxonidine and hydrochlorothiazide in combination: a synergistic antithypertensive effect // J. Cardiovasc. Pharmacol. 1994. Vol. 24. Suppl. 1. P. S25–S28.
15. Prichard B.N.C., Simmons R., Rooks M., Haworth D.A. et al. A double-blind comparison of moxonidine and atenolol in the management of patiens with mild-to-moderate hypertension // J. Cardiovasc. Pharmacol. 1992. Vol. 24. Suppl. 4. P. S45–S49.
16. Kraft K., Vetter H. Twenty-four-hour blood pressure profiles in patients with mild-to-moderate hypertension: moxonidine versus captopril // J. Cardiovasc. Pharmacol. 1994. Vol. 24. Suppl. 1. P. S29–S33.
17. Küppers H.E., Jäger B.A., Luszick J.H., Gräve M.A., Hughes P.R., Kaan E.C. Placebo-controlled comparison of the efficacy and tolerability of once-daily moxonidine and enalapril in mild-to-moderate essential hypertension // J. Hypertens. 1997. Vol. 15. № 1. P. 93–97.
18. Waters J., Ashford J., Jager B. et al. Use of moxonidine as initial therapy and in combination in the treatment of essential hypertension – results of the TOPIC Study // J. Clinical Basic Cardiol. 1999. Vol. 2. P. 219–224.
19. Чазова И.Е., Мычка В.Б. Новые возможности в лечении больных с метаболическим синдромом. Результаты исследования ALMAZ // Системные гипертензии. 2006. Т. 8. № 2.
20. Sharma A.M., Wagner T., Marsalek P. Moxonidine in the treatment of overweight and obese patients with the metabolic syndrome: a postmarketing surveillance study // J. Hum. Hypertens. 2004. Vol. 18. № 9. P. 669–675.
21. Haenni A., Lithel H. Moxonodine improves insulin resistance in obese, insulinresistant patients with moxonidine // J. Hypertens. 1999. Vol. 17. Suppl. P. S24–S35.
22. Мычка В.Б., Тишина Е.В., Жернакова Ю.В. и соавт. Значение агониста имидазолиновых рецепторов моксонидина в лечении больных артериальной гипертонией и метаболическим синдромом. Результаты исследования MERSY в России // Системные гипертензии. 2010. № 1. С. 52–56.
23. Sun Z., Ernsberger P. Marked insulin resistance in obese spontaneously hypertensive rat adipocytes is ameliorated by in vivo but not in vitro treatment with moxonidine // J. Pharmacol. Exp. Ther. 2007. Vol. 320. № 2. P. 845–852.
24. Masajtis-Zagajewska A., Majer J., Nowicki M. Effect of moxonidine and amlodipine on serum YKL-40, plasma lipids and insulin sensitivity in insulin-resistant hypertensive patients – a randomized, crossover trial // Hypertens. Res. 2010. Vol. 33. № 4. P. 348–353.
25. Pöyhönen-Alho M.K., Manhem K., Katzman P., Kibarskis A., Antikainen R.L., Erkkola R.U., Tuomilehto J.O., Ebeling P.E., Kaaja R.J. Central sympatholytic therapy has anti-inflammatory properties in hypertensive postmenopausal women // J. Hypertens. 2008. Vol. 26. № 12. P. 2445–2449.
26. Sanjuliani A.F., de Abreu V.G., Francischetti E.A. Selective imidazoline agonist moxonidine in obese hypertensive patients // Int. J. Clin. Pract. 2006. Vol. 60. № 5. P. 621–629.
27. Agabiti-Rosei E., Muiesan M.L. Hypertensive left ventricularhypertrophy: pathophysiological and clinical issues // Blood Pressure. 2001. Vol. 10. № 5–6. P. 288–298.
28. Hunter J.J., Chien K.R. Signaling pathways for cardiac hypertrophy and failure // New Engl. J. Med. 1999. Vol. 341. № 17. P. 1276–1283.
29. Дядык А.И., Багрий А.Э. Цымба И.Н., Хоменко М.В., Жуков К.В., Самойлова О.В., Приколота О.А., Тюркян К.Р. Регресс гипертрофии левого желудочка сердца больных с эссенциальной гипертензией и сахарным диабетом под влиянием моксонидина // Український кардіологічний журнал. 2003. № 4. С. 41–45.
30. Paquette P.A., Duguay D., El-Ayoubi R., Menaouar A., Danalache B., Gutkowska J., DeBlois D., Mukaddam-Daher S. Control of left ventricular mass by moxonidine involves reduced DNA synthesis and enhanced DNA fragmentation // Br. J. Pharmacol. 2008. Vol. 153. № 3. P. 459–467.
31. Aceros H., Farah G., Cobos-Puc L., Stabile A., Noiseux N., Mukaddam-Daher S. Moxonidine improves cardiac structure and performance in SHR through inhibition of cytokines, p38 MAPK and Akt // Br. J. Pharmacol. 2011. Vol. 164. № 3. P. 946–957.
32. Окороков Н.А. Диагностика болезней внутренних органов. М.: Мед. лит., 2007. Т. 7. C. 82–83.
33. Демидова Т.Ю., Аметов А.С., Смагина Л.В. Моксонидин в коррекции метаболичексих нарушений и эндотелиальной дисфункции у больных сахарным диабетом, ассоциированным с артериальной гипертензией // Артериальная гипертензия. 2004. Т. 10. № 2. С. 104–109.
34. Moreira T.S., Takakura A.C., Sato M.A., Menani J.V., Colombari E. Antihypertensive responses elicited by central moxonidine in rats: possible role of nitric oxide // J. Cardiovasc. Pharmacol. 2006. Vol. 47. № 6. P. 780–787.
35. Krespi P.G., Makris T.K., Hatzizacharias A.N., Triposkiadis P., Tsoukala C., Kyriaki D., Votteas V., Kyriakidis M. Moxonidine effect on microalbuminuria, thrombomodulin, and plasminogen activator inhibitor-1 levels in patients with essential hypertension // Cardiovasc. Drugs Ther. 1998. Vol. 12. № 5. P. 463–467.
36. Strojek K., Grzeszczak W., Górska J., Leschinger M.I., Ritz E. Lowering of microalbuminuria in diabetic patients by a sympathicoplegic agent: novel approach to prevent progression of diabetic nephropathy? // J. Am. Soc. Nephrol. 2001. Vol. 12. № 3. P. 602–605.
37. Давыдова И.В. Центральные симпатолитики в лечении артериальной гипертензии: нереализованные подходы к применению // Артериальная гипертензия. 2011. Т. 18. № 4. С. 201.
38. De Andrade C.A., de Andrade G.M., De Paula P.M., De Luca L.A. Jr., Menani J.V. Involvement of central alpha1-adrenoceptors on renal responses to central moxonidine and alpha-methylnoradrenaline // Eur. J. Pharmacol. 2009. Vol. 607. № 1–3. P. 60–67.
Новости на тему
13.02.2025
14.05.2024
Отправить статью по электронной почте
Ваш адрес электронной почты:
Эксперты Всемирной организации здравоохранения (ВОЗ) не случайно охарактеризовали метаболический синдром (МС) как пандемию XXI века. Наличие у пациента МС ставит его в группу высокого риска по развитию в дальнейшем атеросклероза, сердечно-сосудистых осложнений, а также сахарного диабета 2 типа (СД 2 типа) [1–4].
МС ассоциируется с субклиническим поражением жизненно важных органов, что зачастую имеет место даже при отсутствии
у пациентов артериальной гипертонии (АГ). Патогенез МС в целом схож у различных категорий пациентов. Однако особую группу больных формируют женщины в постменопаузе, у которых развитие МС инициируется дефицитом эстрогенов [1, 5]. Одним из проявлений МС, развитие которого сопряжено с абдоминальным (висцеральным) ожирением, является АГ.
у пациентов артериальной гипертонии (АГ). Патогенез МС в целом схож у различных категорий пациентов. Однако особую группу больных формируют женщины в постменопаузе, у которых развитие МС инициируется дефицитом эстрогенов [1, 5]. Одним из проявлений МС, развитие которого сопряжено с абдоминальным (висцеральным) ожирением, является АГ.
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
