Герцептин в адъювантной терапии рака молочной железы
- Аннотация
- Статья
- Ссылки
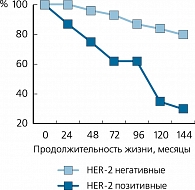


Показано, что гиперэкспрессия HER-2 в опухолевой клетке коррелирует с рядом неблаго-приятных прогностических факторов, а именно, размером опухоли, высокой степенью злокачественности, уменьшением числа рецепторов эстрогена и прогестерона в опухоли [1].
По некоторым данным, гиперэкспрессия HER-2 указывает на повышенный риск рецидива болезни (в 3 раза при HER-2+ N- по сравнению с HER-2- N-) и уменьшение общей и безрецидивной выживаемости (рисунок 1) [2].
При анализе результатов лечения 324 больных РМЖ с N- установлено, что при размере опухоли ≤1 см и HER-2+ рецидив болезни наблюдается значительно чаще, чем при HER-2-. Более того, в случаях HER-2- и N- прогноз даже при большом размере опухоли считается благоприятным.
Установлено, что гиперэкспрессия HER-2 ассоциируется со снижением эффективности химио- и эндокринотерапии.
Герцептин (трастузумаб) – рекомбинантные моноклональные антитела, которые специфически связываются на поверхности клеток с рецепторами HER-2. Помимо прямого антипролиферативного действия, Герцептин способен инициировать выраженную реакцию антитело-зависимой клеточной цитотоксичности, специфически направленную на опухолевые клетки с гиперэкспрессией HER-2 [3]. У Герцептина установлено и наличие антиангиогенной активности [4].
Герцептин является единственным препаратом, который улучшает результаты химио и эндокринотерапии у больных метастатическим РМЖ с гиперэкспрессией HER-2 и, тем самым, увеличивает общую и безрецидивную выживаемость. Он рекомендован для клинического использования в качестве средства терапии 1-2-й линии в комбинации с таксанами (паклитаксел, доцетаксел), винорелбином, а так же препаратами платины.
В результате проведенных клинических исследований, было показано, что Герцептин не обладает значимой токсичностью и не вызывает побочных эффектов, ассоциирующихся с проведением химиотерапии, – алопеции, миелосупрессии, тошноты и рвоты. Острая инфузионная реакция возникает в 40% случаев применения Герцептина и связана с первым введением препарата. В последующем инфузии могут быть продолжены с использованием в качестве премедикации антигистаминных препаратов и глюкокортикоидов.
Кардиотоксичность, как наиболее значимый побочный эффект Герцептина, развивается в 1,4% случаев при использовании этого препарата в монотерапии. Риск развития кардиотоксичности возрастает при комбинации Герцептина с доксорубицином и таксанами, а также при наличии факторов риска развития сердечной недостаточности по критериям NYHA (возраст, инфаркт миокарда в анамнезе и др.). В настоящее время, с учетом высокого риска развития кардиотоксичности, использование Герцептина в комбинации с доксорубицином не рекомендовано.
В связи с доказанной высокой эффективностью Герцептина при метастатическом РМЖ и его низкой токсичностью, в 2001 году была начата серия исследований по изучению эффективности Герцептина в адъювантных режимах лечения (NSAPB B-31, BCIRG 006, PACS 004, HERA) [5].
В настоящее время получены первые результаты исследования HERA (BIG 01-01), которые будут рассмотрены ниже.
HERA представляет собой рандомизированное исследование III фазы по изучению эффективности и безопасности применения Герцептина в адъювантном режиме в течение 1-2 лет в сравнении с одним наблюдением у больных ранними стадиями РМЖ с гиперэкспрессией HER-2.
Основной задачей, которая была поставлена перед исследователями, являлась оценка влияния Герцептина на безрецидивную выживаемости (время после операции и химиотерапии до рецидива заболевания или развития рака второй молочной железы, метахронного рака или смерти от любой причины, не связанной с онкологическим заболеванием).
Вторичные задачи включали изучение безопасности использования Герцептина, общей выживаемости, определение органов-мишеней при развитии первичных метастазов и времени до развития отдаленных метастазов.
В исследовании участвовали женщины с ранними стадиями инвазивного РМЖ. Гиперэкспрессия и/или амплификация HER-2 подтверждалась в центральной лаборатории (ИГХ-методом или FISH-методом в случае HER-2++).
Все женщины до начала исследования полностью завершили стандартное неоадъювантное или адъювантное лечение: операция ± лучевая терапия; как минимум 4 курса химиотерапии (не более 360 мг/м2 доксорубицина или не более 720 мг/м2 эпирубицина и/или таксаны; или ЦМФ – циклофофсфан + метотрексат + 5-фторурацил). При наличии положительного рецепторного статуса назначали эндокринотерапию в течение 5 лет (рисунок 2).
Обязательным условием включения больных в исследовании HERA являлось сохранение фракции выброса левого желудочка ≥ 55% (по данным ЭХО-КГ или MUGA).
Критериями исключения были сердечная недостаточность, инфаркт миокарда, нестабильная стенокардия или неконтролируемая артериальная гипертензия.
Герцептин назначался в нагрузочной дозе 8 мг/кг, затем каждые 3 недели в дозе 6 мг/кг в течение 1 или 2 лет. В случае задержки очередного введения Герцептина более чем на 7 дней требовалось повторное назначение нагрузочной дозы препарата.
Терапия Герцептином должна была быть прекращена при развитии симптоматической сердечной недостаточности и/или снижении фракции выброса левого желудочка ≤ 45%.
Все больным, включая группу наблюдения, был обеспечен тщательный кардиологический контроль (ЭКГ в 12 отведениях, оценка фракции выброса левого желудочка с помощью эхокардиографии или MUGA через 3, 6, 12, 18, 24, 36 и 60 месяцев после рандомизации).
С декабря 2001 г. по март 2005 г. в различных центрах мира в исследование HERA была включена 5081 женщина с ранними стадиями РМЖ и гиперэкспрессией HER-2. Из их числа 1694 женщины были включены в группу терапии Герцептином в течение 1 года, 1694 – в группу двухлетней терапии Герцептном, 1693 – в группу наблюдения. Промежуточный анализ результатов исследования был недавно представлен для группы одногодичной терапии Герцептином и группы наблюдения [6]. Медиана наблюдения составила 1 год.
Средний возраст пациенток составил 49 лет, 2/3 больных имели метастазы в подмышечные лимфатические узлы, у 48% женщин обнаруживались негативные в отношении гормональных рецепторов опухоли.
Из числа участниц исследования 94% больных получали адъювантно антрациклин-содержащие режимы химиотерапии, 26% – таксаны, 76% – лучевую терапию. Основным препаратом эндокринотерапии являлся тамоксифен.
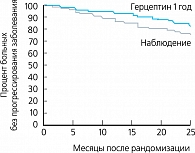
В группе терапии Герцептином было зафиксировано 127 неблагоприятных исходов против 220 – в группе наблюдения (таблица 1).
Использование Герцептина статистически значимо снижало риск развития отдаленных метастазов и, тем самым, увеличивало безрецидивную выживаемость (рисунок 3).
Безопасность применения Герцептина была оценена в 3413 случаях: у 1710 больных в группе наблюдения и у 1677 – в группе одногодичной терапии Герцептином.
При применении Герцептина не было отмечено случаев смерти от кардиологических причин (в контрольной группе – 1 случай).
Развитие симптомов сердечной недостаточности любой степени (включая III-IV степени) отмечено у 29 (1,7%) больных в группе Герцептина и одной (0,06%) пациентки в группе наблюдения (р < 0,001). При этом развитие сердечной недостаточности III-IV степени по критериям NYHA в группе Герцептина наблюдалось у 9 (0,54%) больных.
Бессимптомное снижение фракции выброса левого желудочка менее 50% имело место у 7,1% больных из группы Герцептина и у 2,2% – из группы наблюдения (р < 0,001).
На основании промежуточного анализа результатов исследования HERA сделаны следующие выводы:
- назначение Герцептина в течение 1 года после операции и адъювантной химиотерапии больным ранними стадиями РМЖ с гиперэкспрессией HER-2 значительно (на 46%) повышает безрецидивную выживаемость;
- клиническая эффективность Герцептина не зависит от рецепторного статуса опухоли, количества пораженных лимфатических узлов, режимов используемой адъювантной химиотерапии;
- использование Герцептина в течение 1 года сопровождается низким риском развития симптоматической сердечной недостаточности (в т.ч. III-IV степени): 1,7% в группе Герцептина против 0,06% в группе наблюдения [6].
В настоящее время исследование HERA продолжается. Полученные промежуточные результаты представляются весьма перспективными и обнадеживающими. В 2008 г. ожидается получение ответа на вопрос об оптимальной длительности адъювантной терапии Герцептином (1 или 2 года) у больных ранними стадиями РМЖ с гиперэкспрессией HER-2.
С учетом высокого риска рецидива болезни при гиперэкспрессии HER-2/neu у больных РМЖ после оперативного лечения и современной химиотерапии полученные результаты доказывают целесообразность адъювантного применения Герцептина в течение 1 года.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.