ИБС и ХОБЛ: патофизиологические особенности сочетаний и лечения
- Аннотация
- Статья
- Ссылки


Ишемическая болезнь сердца (ИБС) на протяжении последних десятилетий является главной причиной инвалидизации и ведущей в структуре летальности экономически развитых стран в социально-значимой группе населения. По данным медстатистики Российской Федерации, от 2006 года сердечно-сосудистая патология составила 56,5% в общей летальности, половина в которой приходится на ИБС. С возрастом частота стенокардии резко возрастает и в большинстве Европейских стран составляет 20-40 тыс. на 1 млн населения. В России 10 000 000 трудоспособного населения страдают ИБС.
Одновременно бронхообструктивные заболевания, как показывает статистические данные за 2005 год, также становятся наиболее распространенными в мире патологиями. Хронические бронхо обструктивные легочные заболевания (ХОБЛ) стабильно занимают IV место среди ведущих причин смертности в США и Европе. Через 10 лет заболевший становится инвалидом и потом (в среднем) живет не больше 7 лет. Среди женщин смертность от ХОБЛ за последние 20 лет возросла более чем в 2 раза. В России число больных заболеваниями дыхательных путей приближается к 7 млн человек, в том числе у 10% она характеризуется тяжелым течением. Если в 1990 году, по данным ВОЗ, ХОБЛ находилась на 12 месте, то к 2020 году эксперты рабочей группы предсказывают 5 место этой патологии среди других по социальной значимости ведущих заболеваний (1, 4, 7).
В современном обществе полиморбидность не только является фактом совершенствования диагностических технологий, но и результатом прогрессивно меняющихся социальных и экологических условий.
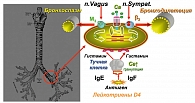
Существует ряд предположений о взаимосвязи ИБС и ХОБЛ, в основе которых лежат механизмы системных провоспалительных реакций при формирования той или иной патологии. Ключевыми звеньями при этих заболеваниях являются перекисные окисления липидов и белков, активация цитокиновых механизмов (увеличение С-протеина, ИЛ6-8, ФНО-α), с вовлечением в патологический процесс иммунной, эндокринной систем с выбросом в кровь гормонов и нейромедиаторов, что сопровождается повышенным расходом энергозависимых пластических биологических субстратов в слизистых бронхов и эндотелии сосудов (1, 2, 5, 6, 7).
При наличии заболеваний бронхолегочной системы, вследствие дыхательной гипоксемии, активируется перекисное окисление липидов (ПОЛ), лежащее в основе развития атеросклероза. В легких, выполняющих множество важных метаболических функций и интенсивно участвующих в обмене белков, жиров, углеводов, на фоне воспалительного процесса еще больше активируются протеолитические ферменты и индуцируются цитокиновые реакции. Итогом этих процессов становится повышенный выброс провоспалительных цитокинов (СРБ, ФНО-α, ИЛ-1,6,8), активация системного воспалительного ответа и дезорганизация основного вещества соединительной ткани, о чем свидетельствуют повышенные уровни гликозаминогликанов, гиалуронидазы, фукозо-содержащих ферментов (2).
На фоне окислительного стресса происходит стимуляция надпочечников с выбросом в кровь адреналина и, как следствие, вазоконстрикция, увеличение ОЦК, ОПСС и повышение АД, в результате активации РААС, суммарно ведущих к развитию ИБС.
На фоне патологии легких в условиях системного воспаления в тканях индуцируются процессы атеросклероза. За счет ПОЛ страдает эндотелиальная выстилка не только сосудов, но и бронхиального дерева. Показано, что клетки, непосредственно включенные в атерогенез, модифицируют липиды под влиянием липооксигеназы и миелопероксидазы. Процессы пероксидации ведут к образованию БАВ – в повышенном количестве высвобождаются гистамин, серотонин, которые индуцируют бронхоспазм, способствуют сгущению мокроты и, как следствие, утяжелению ХОБЛ (рисунок 1). Кроме того, процесс отложения липидов в интиме артерий непременно сопровождается параллельным проникновением лейкоцитов (моноцитов и Т-лимфоцитов) в стенку сосуда и бронхов. Окисленные липопротеиды, в интиме сосуда, выполняют роль хемоаттрактантов, в направлении которых и осуществляется хемотаксис лейкоцитов. При этом моноциты сами начинают продуцировать в большом количестве ИЛ-1,6, ФНО-α и после захвата окисленных липидов НП превращаются в макрофаги. Переполненные модифицированными липопротеинами макрофаги превращаются в пенистые клетки, являющиеся основой липидного ядра атероматозной бляшки (5, 6).
При развитии эндотелиальной дисфункции на фоне повышенного атерогенеза, вызванного провоспалительными реакциями, имеет место спазмирование не только периферических и коронарных сосудов (ИБС), но и сосудов легких, бронхов, органов брюшной полости. При локальном повреждении интимы сосудов нарушается ламинарный ток крови, формируется турбулентный поток крови с активацией тромбоцитов, с оседанием тромбоцитов и лейкоцитов в зоне поражения эндотелия. На фоне дыхательной гипоксемии, окислительного стресса, измененного коагулационного потенциала крови в сторону гиперкоагуляции, пролифелируют гладкомышечные клетки, разрастается соединительная ткань - формируется фиброзная капсула, что и завершает развитие атеросклеротической бляшки. Поскольку данные изменения протекают в рамках системного воспаления с вовлечением всех органов и систем, значительно возрастает риск развития ИБС, сердечно-сосудистых катастроф (таких, как инфаркт миокарда, инсульт, тромбоэмболия легочной артерии), тяжелых нарушений ритма сердечной деятельности. Наджелудочковые тахикардии регистрируются у 70% пациентов с тяжелым течением ХОБЛ, фибрилляция предсердий отмечается у 8% пациентов при этой патологии (4).
Активация РААС сопровождается увеличением ОЦК (увеличение преднагрузки), МОС, ОПСС (увеличение постнагрузки), которые на фоне провоспалительного состояния, вызванного дыхательной гипоксемией (ХОБЛ), способствуют развитию ИБС и ее прогрессированию. Увеличенные преднагрузка и постнагрузка неизбежно ведут к повышенной работы сердца и ПМО2, возникновению дисбаланса между величиной коронарного кровотока и ПМО2, что служит основой развития ИБС. Дыхательная гипоксия сопровождается ростом артерио-венозной разницы по насыщению крови кислородом за счет компенсаторного снижения скорости периферического кровотока (увеличение времени экспозиции крови на уровне капиллярного кровотока для эффективной передачи кислорода клеткам). Суммарная гипоксемия ведет к гипоксии кардиомиоцитов, миоцитов сосудистой стенки и бронхиального дерева, что сопровождается «отставанием» процессов реваскуляризации и развитием ремоделирования (разрастание соединительной ткани). В конечном итоге развивается гипертрофия левого желудочка и дилатация камер сердца, с ретроградным вовлечением в патологический процесс левого предсердия, сосудистого русла малого круга кровообращения и паренхимы легочной ткани.
На фоне длительно текущего патологического процесса (воспаление) в легком постепенно формируется гипертензия малого круга кровообращения с перестройкой бронхиального дерева по типу фиброза, склероза, развития эмфиземы, с гипертрофией миокарда правого желудочка (легочное сердце). Дыхательная гипоксемия, увеличенные пред- и постнагрузки (основа ИБС) также способствуют гипертрофии и формированию соединительно-тканного кардиосклероза левого желудочка с утяжелением течения ХОБЛ и ИБС. При гипертрофии миокарда левого желудочка (АГ, пороки сердца, гипертрофическая кардиомиопатия) и дыхательной гипоксемии значительно раньше развивается нарушение насосной деятельности сердца – снижение сердечного выброса. Снижение МОС – условие для тканевой гипоперфузии с развитием гипоксии смешанного генеза (дыхательной, циркуляторной, гистотоксической). Так замыкается порочный круг реакций, ведущих к активации провоспалительных свойств иммунной системы (1, 4).
Вышеизложенное явилось аргументом для проведения данного исследования с целью выявления частоты сочетаний ИБС и ХОБЛ, их взаимовлияния на тяжесть течения заболеваний и формирование стратегии лечения.
Материалы, методы обследования и лечения
В исследование было включено 70 пациентов: 30 больных с ведущим диагнозом ИБС, средний возраст которых составил 58,5 ± 4,5 лет, из них – 8 женщин (26,6%) в возрасте 61,2 ± 2,1 лет, 22 мужчины (73,4%) в возрасте 57,5 ± 4,5 лет, курящих – 13,3% мужчин; 40 больных с доминирующим диагнозом ХОБЛ, средний возраст по группе составил 57,5 ± 3,4 года, из них было 13 женщин (32,5%) в возрасте 57,1 ± 3,5 лет и 27 мужчин (67,5%) в возрасте 58,2 ± 4,5 лет, курящих среди женщин – 6 пациенток (15%), мужчин – 16 человек (40%).
Для постановки диагноза, оценки тяжести основного заболевания и эффективности проводимого лечения всем больным до и после лечения проводились: оценка функции внешнего дыхания; рентгенография органов грудной клетки; ЭКГ; ЭхоКГ с определением фракции выброса (ФВ%), ударного объема левого желудочка (УО), регистрации КСО, КДО, МОК и ОПСС; ВЭМ; тест 6-минутной ходьбой с целью оценки толерантности к физической нагрузке до и после лечения, степени функциональных классов стенокардии напряжения (СН) и хронической сердечной недостаточности (ХСН).
На автоматическом анализаторе ТЭК 6410 определяли общий анализ крови: уровень гемоглобина, количество эритроцитов, лейкоцитарную формулу, Ht.
Биохимический анализ крови, показатели гемостаза – фибриноген, МНО – оценивали на анализаторе гемостаза АПГ2-02. Другие биохимические показатели крови – мочевина, креатинин, холестерин – определяли на автоматическом биохимическом анализаторе Stat-fax 1904+ и BS-3000P.
Рентгенологические методы являются обязательным исследованием при постановке диагноза ХОБЛ. Рентгенологические исследования проводилось на аппарате «Сирескоп». Рентгенографию грудной клетки проводили во фронтальной и боковых проекциях с целью оценки состояния легочной ткани, бронхиального и сосудистого рисунка, размеров различных отделов сердца. Во фронтальной позиции оценивали амплитуду подвижности, уплощение, низкое расположение диафрагмы, которые являются диагностическим критерием степени гиперинфляции легочной ткани.
Исследование функции внешнего дыхания проводилось на аппаратно-программном комплексе ФВД «Валента» (Санкт-Петербург). Оценка функции внешнего дыхания включала определение: объема форсированного выдоха за первую секунду (ОФВ1), жизненной емкости легкого (ЖЕЛ), форсированной жизненной емкости легких (ФЖЕЛ), индекса Тиффно (ОФВ1/ФЖЕЛ) с пересчетом в % к должной величине.
Всем пациентам в динамике (до и после лечения) с целью оценки сердечного ритма, частоты сердечных сокращений, характера изменений конечной части желудочкового комплекса регистрировали ЭКГ на многоканальном электрокардиографе «Schiller cardiovit At-1».
ЭхоКГ оценка функционального состояния насосной деятельности сердца проводилось на аппарате «Карис плюс» («ОАО Уральский приборостроительный завод») датчиком с частотной характеристикой 3,5 мГц и углом сканирования 45; 60 и 90 градусов в В и М режимах сканирования. Выполнялись количественная и качественная оценка сократительной способности миокарда и выборочных гемодинамических характеристик: ударный объем (УО), фракция выброса (ФВ), минутный объем (МО л/мин), общее периферическое сосудистое сопротивление (ОПСС).
Диагностика ИБС осуществлялась неинвазивными методами путем нагрузочного тестирования ВЭМ, с использованием диагностической системы «Валента» на велоэргометре Тunturi (Санкт-Петербург). Электрокардиографическими критериями положительной пробы на ИБС являлась горизонтальная или косонисходящая депрессия сегмента SТ во время нагрузки на 1 мм ниже от исходного уровня и (или) во время восстановительного периода.
Для определения функционального класса стенокардии проводили тест 6-минутной ходьбой – количество метров, пройденное без патологических ощущений в области грудной клетки. Перед исследованием и по его окончании всем пациентам регистрировали ЧСС и SрО2 (показатель оксигенации крови) с использованием пульсоксиметра. Дистанцию, пройденную в течении 6 минут (6МWD), измеряли в метрах и сравнивали с должным показателем 6МWD (i), которую вычисляли по нижеприведенным формулам, учитывающим возраст в годах, массу тела в килограммах, рост в сантиметрах, индекс массы тела (ИМТ):
- для мужчин: 6МWD (i) = 1140 - 5,61 х ИМТ - 6,94 х возраст;
- для женщин: 6МWD (i) = 1017 - 6,24 х ИМТ - 5,83 х возраст.
Для оценки степени тяжести ХОБЛ и обратимости обструкции бронхиального дерева использовали пробу с ингаляционным бронходилататором – β2-агонистом короткого действия (Беротек-200 мкг) с измерением ОФВ1 через 15 минут после ингалирования препарата. Увеличение ОФВ1 через 15 минут более чем на 15% от исходного уровня свидетельствовало об обратимости обструкции. Степень тяжести ХОБЛ определяли по рекомендациям Европейского респираторного общества (приняты за рабочие и в России): легкая степень – ОФВ1 > 70% от должной величины, средняя – ОФВ1 50-69%, тяжелая – ОФВ1 < 50%.
В подгруппе пациентов ИБС без сопутствующей патологии ХОБЛ, с целью выявления латентной обструкции дыхательных путей проводили однократную ингаляционную пробу с препаратом Спирива (международное непатентованное название тиотропия бромид). Тиотропия бромид относится к фармакотерапевтической группе М3-холиноблокаторов – пролонгированный бронходилататор, преимущественно воздействующий на проксимальные отделы бронхов.
Все пациенты, включенные в исследование, получали стандартную терапию, рекомендованную при лечении ИБС: кардиоселективные β1-адреноблокаторы (Бисогамма от 2,5 до 10 мг/сутки – средняя суточная доза по группе = 5,7 ± 045 мг/сутки), нитраты применялись в лечении у пациентов с проявлением стенокардии напряжения III ф.к. (Изосорбид мононитрат в дозе 40 мг/сутки), антиагреганты (Кардиомагнил 75 мг/сутки), ингибиторы АПФ (Лизигамма в индивидуальных дозах, зависящих от параметров артериального давления и сердечной недостаточности – средняя суточная доза = 17,2 ± 2,1 мг/сутки).
Группа пациентов ХОБЛ получала следующую терапию: Спирива (тиотропия бромид) 1 раз в день. Тиотропия бромид относится к фармакотерапевтической группе М3-холиноблокаторов. Результатом ингибирования М3-холинорецепторов в дыхательных путях является расслабление гладкой мускулатуры бронхов. Лекарственную форму представляют капсулы с порошком для ингаляций: 1 капсула препарата содержит 18 мкг тиотропия бромида. Препарат назначали в виде ингаляций одной капсулы в сутки с помощью ингалятора (Handi Haler ®) в течение 10 дней.
В случаях обострения воспалительного процесса к специфическому лечению добавляли антиаллергическую и антибактериальную фармакотерапию, физиотерапию.
Пациентам из подгрупп с сочетанной патологией ХОБЛ и ИБС, а также ИБС и сопутствующей ХОБЛ, кроме вышеуказанных лекарственных средств, в комплекс лечения вошли препараты магния – Магнерот 3 г/сутки в течение трех недель.
Результаты обследования и лечения
По данным анамнеза, жалоб и функционального обследования, в группе ХОБЛ 19 больных (47,5%) имели сопутствующую патологию ИБС, в группе больных ИБС в 11 случаях (36,8%) имела место ХОБЛ (таблица 1).
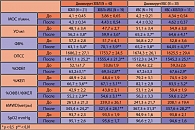
Как видно из таблицы 1, сочетания патологий усугубляют течение основного заболевания: так в подгруппе больных ИБС с ХОБЛ – III ФК стенокардии и средняя степень тяжести ДН регистрируются в 63,% случаев (7 из 11 пациентов); в подгруппе больных ХОБЛ и ИБС средняя степень тяжести ДН и III ФК стенокардии регистрируются соответственно в 68,4% (13 из 19 пациентов). Указанные параметры значительно превышают аналогичные показатели в подгруппах больных с изолированной патологией и косвенно свидетельствуют о взаимовлиянии сопутствующих патологий на клиническое течение заболевания.
При проведении ингаляционной тест-пробы со Спирива у 19 больных ИБС II-III ФК и клиническими признаками СН I-II степени были получены данные, которые представлены в таблице 2, свидетельствующие о наличие скрытой (латентной) формы бронхообструкции, носящей обратимый характер. Как видно из таблицы: при увеличении ОФВ1 в среднем на 21,2%, имело место увеличение ЖЕЛ в среднем по подгруппе на 13,2% и пробы Тефно (ОФВ1/ФЖЕЛ) на 32,7%, что указывает на наличие клинически скрытой бронхообструкции кардиогенного генеза, в результате СН и ретроградного застоя в легком.
В таблице 3 представлены результаты исследования основных показателей насосной функции сердца, внешнего дыхания, толерантности к нагрузке до и после лечения больных ХОБЛ, ИБС и их сочетаний.
Результаты, представленные в таблице 3, указывают на более выраженное, статистически достоверное снижение толерантности к физической нагрузке у пациентов с сочетанной патологией – ХОБЛ+ИБС (на 56,5% к должной величине) и наоборот ИБС+ХОБЛ (на 68,2%), как результат суммарных взаимовлияющих нарушений центральной гемодинамики и функции внешнего дыхания. После проведенного лечения толерантность к физической нагрузке по группам (ХОБЛ, ИБС) возросла соответственно на 32,2% и 52,2% (р < 0,01). Подобная положительная динамика со стороны толерантности к физической нагрузке явилась следствием купирования бронхообструкции при статистически достоверном улучшении бронхиальной проходимости в группе больных ХОБЛ – увеличение %ОФВ1 на 10,3%, а также следствием улучшения насосной деятельности сердца – увеличение ФВ% на 10,3% (р < 0,5).
В результате дополнения к стандартной терапии препарата магния (Магнерот) у пациентов с сочетанной патологией отмечается более выраженная положительная динамика со стороны насосной деятельности сердца (ФВ% по сравнению с исходной величиной увеличилась соответственно – на 35,6% ХОБЛ+ИБС, на 17,7% – ИБС+ХОБЛ) и функции внешнего дыхания. Так, в подгруппах больных ХОБЛ+ИБС и ИБС+ХОБЛ по данным спирометрии показатели бронхиальной проходимости (%ОФВ1, %ЖЕЛ, %ОФВ1/ФЖЕЛ к исходным величинам) соответственно возросли на 28,8% и 14%, на 38,6 и 12,1%, на 24,6% и 18,3% (р < 0,01), что указывает на устранение бронхообструктивного компонента за счет бронходилатационного действия магния. Увеличение толерантности к физической нагрузке соответственно по подгруппам (ХОБЛ+ИБС и ИБС+ХОБЛ) на 43,5% и 68,7%, в сравнении с показателями дистанции до включения в лечение препаратов магния, явилось суммарным проявлением улучшения насосной деятельности сердца и функции внешнего дыхания.
Обсуждение результатов
Анализ данных литературы и наших исследований свидетельствует о высокой частоте сочетаний ИБС и ХОБЛ: от 47,5% среди больных ХОБЛ, до – 36,8% среди больных с ИБС.
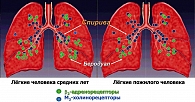
В руководствах по патофизиологии заболеваний дыхательных путей указывается на возрастное и количественное перераспределение ß2-адренорецепторов и М3-холинэргических рецепторов, участвующих в регуляции тонуса мелких (дистальных) и крупных (проксимальных) бронхов, в сторону количественного преобладания последних у лиц старшего и пожилого возраста (рисунок 2). Подобная возрастная динамика в количественном перераспределении рецепторов бронхиального дерева, участвующих в патогенезе обструктивных заболеваний легких, указывает на дифференцированный подход при назначении бронходилататоров с различным фармакологическим действием у больных старшей возрастной группы пациентов с ХОБЛ (3, 7).
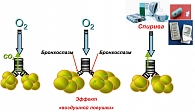
Применение пролонгированных бронходилататоров (Спирива) через ингибирование М3-холинэргических рецепторов способствует профилактике развития эмфиземы легочной ткани посредством устранения механизмов «воздушной ловушки», обусловленной растяжением альвеол при форсированном выдохе на фоне бронхоспазма (3) (рисунок 3).
В наших исследованиях при сочетанной патологии (ИБС + ХОБЛ) использование высоко селективного b-блокатора с отсутствием внутрисимпатической активности в пределах терапевтических доз (Бисогамма 2,5-10 мг/сут) документирован эффективный антиишемический эффект с фармакологической нейтральностью на проходимость бронхиального дерева.
Включение в программу лечения больных ХОБЛ и ИБС препаратов магния (Магнерот) способствует более эффективной коррекции функции внешнего дыхания и насосной деятельности сердца, улучшению качества и прогноза жизни у данной группы пациентов.
Данная работа посвящена проблемам лечения сочетанной патологии со стороны сердечно-сосудистой системы и органов дыхания, в следующих публикациях будет представлен детальный анализ эффективности комбинированной терапии с профилактической направленностью на предупреждение побочных эффектов.
Таким образом, рассмотренные патологические реакции организма при оксидативном стрессе позволяют сделать предположение об общности ключевых звеньев, характерных для воспалительных процессов, в патогенезе развития и прогрессирования ИБС и ХОБЛ. Декомпенсация одного из заболеваний, при наличии в организме человека обоих патологических процессов, по принципу «слабого звена», ведет к усугублению и утяжелению другого заболевания. Как правило, на этом фоне развиваются вторичные иммунопатии с дисбалансом про- и противовоспалительных цитокинов. С учетом вышеизложенного компоненты ИБС и бронхобструктивных заболеваний необходимо рассматривать в рамках системного провоспалительного состояния с вовлечением в патологический процесс всех органов и систем организма.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.