Особенности лечения артериальной гипертонии у больных с метаболическим синдромом
- Аннотация
- Статья
- Ссылки
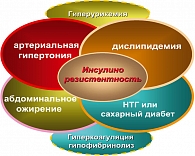
Метаболический синдром (МС) – комплекс патогенетически взаимосвязанных ССЗ и метаболических нарушений, включающих артериальную гипертензию (АГ), инсулинорезистентность (ИР), нарушение толерантности к глюкозе (НТГ), атерогенную дислипидемию (повышение триглицеридов – ТГ, липопротеидов низкой плотности – ЛПНП, снижение липопротеидов высокой плотности – ЛПВП), сочетающихся с абдоминальным ожирением (рисунок 1).
Признаки МС в настоящее время в экономически-развитых странах встречаются у 10-25% населения. Наличие МС в 2-4 раза увеличивает частоту внезапной смерти и развитие сердечно-сосудистых заболеваний (ССЗ), а риск формирования СД 2 типа повышается в 5-9 раз (1, 4, 6, 10, 12, 15).
В клинической практике врачи различных специальностей довольно часто встречаются с МС, который представляет собой кластер гормональных и метаболических нарушений, объединенных общим патофизиологическим механизмом – инсулинорезистентностью (ИР). Определенное время считалось, что МС – это удел лиц преимущественно среднего и пожилого возраста. Однако ряд проведенных исследований указывают, что за прошедшие два десятилетия МС демонстрирует устойчивый рост среди подростков и молодежи: частота встречаемости МС среди подростков за период с 1944 по 2000 гг. возросла с 4,2 до 6,4%, а избыток массы тела среди детского населения в экономически развитых странах был зарегистрирован в 12-14% случаев (4, 9, 10, 11).
Ожирение часто сочетается с такими заболеваниями, как ИБС, АГ, инфаркты, инсульты, дислипидемия, СД 2 типа, подагра, бесплодие, «венозный тромбоэмболизм» и др. Представление о связи избытка жировой ткани с ССЗ было сформировано еще более 50 лет назад. Известный клиницист Е.М. Тареев в 1948 г. писал: «Представление о гипертонике наиболее часто ассоциируется с ожирелым гиперстеником, с возможным нарушением белкового обмена, с засорением крови продуктами неполного метаморфоза — холестерином, мочевой кислотой».
В 1988 г. G. Reaven описал симптомокомплекс, включающий ожирение, АГ, нарушение углеводного обмена (гиперинсулинемию – ГИ, нарушение толерантности к глюкозе – НТГ), изменения липидного состава крови (повышение общего холестерина – ОХС, его фракции ХС ЛПНП и ТГ, низкий уровень ЛПВП), дав ему название «синдром Х». G. Reaven впервые высказал предположение, что в основе всех этих изменений лежит снижение чувствительности тканей к инсулину – ИР. Частота и тяжесть сопряженных с ожирением нарушений и заболеваний зависят не только от степени ожирения (индекс массы тела – ИМТ = Вес [кг]/Поверхность тела[м2]), но и особенностей локализации отложения жировой ткани в организме. Еще в 1947 г. J. Vague описал два типа отложения жира – андроидный (мужской – «яблоковидный») и гиноидный (женский – «грушевидный») – обратив внимание на то, что андроидное ожирение чаще сочетается с СД, ИБС, подагрой. Одновременно с G. Reaven, в 1989 г. J. Kaplan уделил особое внимание абдоминальному (висцеральному) ожирению, сочетающемуся с гипертриглицеридемией, НТГ, АГ и описал этот симптомокомплекс как «смертельный квартет». В 90-х гг. прошлого века появился термин «метаболический синдром», предложенный M. Henefeld и W. Leonhardt. Наконец, некоторые авторы предлагали включать в синдром и такие проявления, как нарушения в свертывающей системе крови, гиперурикемию и ночное апноэ. Прямым следствием гипотезы G. Reaven является вывод о том, что АГ, атеросклероз, ИБС, инсулинонезависимый сахарный диабет (ИНСД) – заболевания, которые ранее рассматривались изолированно друг от друга, и даже в рамках разных медицинских специальностей – являются проявлениями одного заболевания – «метаболического синдрома».
Диагностические критерии МС
Принимая во внимание комплексный характер метаболического синдрома, становится понятным, почему до настоящего времени нет единых диагностических критериев обсуждаемой патологии. Существуют две основные группы диагностических критериев МС, предложенные Всемирной организацией здравоохранения в 1999 г. и Национальной образовательной программой США по холестерину в 2001 г. Эксперты ВОЗ предлагают такой набор проявлений МС, как нарушение толерантности к глюкозе, нарушенная гликемия натощак или сахарный диабет типа 2 плюс 2 любых нижеперечисленных критерия:
-
индекс массы тела > 30 кг/м2;
-
отношение ОТ/ОБ > 0,9; гиперлипидемия;
-
уровень триглицеридов > 1,69 ммоль/л;
-
уровень холестерина ЛПВП < 0,9 ммоль/л;
-
артериальное давление > 140/90 мм рт ст. или антигипертензивная терапия;
-
экскреция альбуминов с мочой > 20 мг/мин. или отношение альбумин/креатинин мочи > 30 мг/кг.
Эксперты Национальной образовательной программы по холестерину (NCEP ATP III) из США выделяют несколько иное сочетание критериев МС, при этом диагноз может быть поставлен при наличии 3 или более перечисленных признаков:
-
уровень глюкозы в плазме крови > 6,1 ммоль/л; гипертриглицеридемия или уровень триглицеридов > 1,7 ммоль/л;
-
снижение холестерина ЛПВП
-
у мужчин < 1,0 ммоль/л, у женщин < 1,0 ммоль/л;
-
артериальное давление > 135/85 мм рт ст. или антигипертензивная терапия;
-
центральное (абдоминальное, висцеральное) ожирение;
-
окружность живота (талии)
-
у мужчин > 102 см,
-
у женщин > 88 см.
В США было проведено исследование по выявлению частоты встречаемости МС согласно двум предложенным группам критериев (NCEP ATP III и ВОЗ). Так, согласно критериям NCEP ATP III метаболический синдром встречался у 23,9% обследуемых, сообразно же критериям ВОЗ он был выявлен у 25,1% лиц, включенных в исследование, что является сопоставимым. Следовательно, существенной разницы в предложенных двух группах диагностических критериев нет.
Международная федерация диабетологов (IDF) предложила в 2005 г. свой комплекс диагностических критериев с целью выработки единого подхода к выявлению частоты встречаемости данной патологии, а также сопоставлению результатов по исследованию МС в любой стране. IDF выделяет следующие 6 компонентов метаболического синдрома:
абдоминальное ожирение, которое тесно ассоциируется с метаболическим синдромом и характеризуется увеличением окружности талии;
атерогенная дислипидемия – повышение уровня триглицеридов и снижение концентрации холестерина липопротеидов высокой плотности, с увеличением уровня аполипопротеина В, появлением мелких частиц липопротеидов низкой плотности;
артериальная гипертония, которая часто развивается при ожирении и инсулинорезистентности, хотя имеет многофакторное происхождение;
инсулинорезистентность, имеющаяся у большинства больных с метаболическим синдромом, тесно ассоциирующаяся с другими метаболическими факторами риска, сама является фактором риска для сердечно-сосудистых заболеваний (стойкая инсулинорезистентность проявляется нарушением толерантности к глюкозе и в конечном итоге приводит к формированию сахарного диабета типа 2);
воспалительное состояние, проявляющееся повышением уровня С-реактивного белка (СРБ); одной из возможных причин увеличения его уровня считают ожирение, которое сопровождается высвобождением воспалительных цитокинов из жировой ткани;
протромботическое состояние, характеризующееся увеличением уровней ингибитора-1 активатора плазминогена (PAI-1) и фибриногена; склонность к тромбозу и воспалительное состояние могут быть метаболически взаимосвязаны.
Весной 2005 г. Международный диабетический фонд (IDF) внес некоторые более жесткие критерии в определение МС, которые были представлены в апреле 2005 г. на I Международном конгрессе по предиабету и метаболическому синдрому в Берлине и на 75 Конгрессе Европейского общества по атеросклерозу в Праге: окружность талии для европеоидов ≥ 94 см – М, ≥ 88 см – Ж; глюкоза плазмы натощак > 5,6 ммоль/л или ранее диагностированный СД, абдоминальное ожирение – основной критерий диагностики МС.
Практически все компоненты, составляющие МС, являются клинически значимыми факторами риска сердечно-сосудистых заболеваний.
Таким образом, обоснование МС как самостоятельного заболевания, обусловленного ИР, могло бы оптимизировать лечение его проявлений и помочь разработать соответствующие стандарты по ведению МС, как нозологической единицы.[1,2,4,14,17].
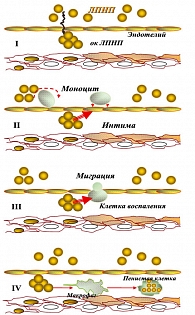
Атерогенная дислипидемия, как компонент МС, чаще встречается при центральном (висцеральном) типе ожирения. Вот почему ожирение в области живота (мужской, абдоминальный, центральный или яблоковидный тип) является ведущим признаком МС. Именно этот тип ожирения обычно связан с высоким уровнем триглицеридов (ТГ). В результате активации липолиза образуется большое количество НЭСЖК в крови, которые в избытке поступают из жировых клеток в портальную циркуляцию и печень. В условиях гипергликемии и гиперинсулинемии печень, использующая в качестве энергосубстрата ЖК, начинает синтезировать из глюкозы большое количество ТГ, что сопровождается повышением концентрации в крови липопротеинов очень низкой и низкой плотности (ЛПОНП, ЛПНП), которые несут холестерин к клеткам, и снижением липопротеинов высокой плотности (ЛПВП) – транспортеры холестерина из клеток к печени. Поступление ЛПНП в клетки в нормальных условиях происходит в результате захвата их специализированными рецепторами, которые синтезируются в клетке аппаратом Гольджи, и находятся в специальных углублениях, получивших название «окаймленная ямка». Избыток внутриклеточного холестерина выводится ЛПВП. Процесс взаимодействия ЛП с рецепторами характеризуется высокой чувствительностью и специфичностью. Развивающаяся дислипопротеинемия имеет атерогенный характер, поскольку дефицит ЛПВП снижает способность организма к удалению избытка холестерина (ХС) из клеток стенок сосудистого русла посредством обратного транспорта ХС в печень (рисунок 2).
Статины – ингибиторы редуктазы 3-гидрокси-3-метилглутарила – кофермента А (ГМГ-КоА) – группа препаратов с гипохолестеринемическими действиями. Ингибирование ГМГ-КоА-редуктазы тормозит синтез ХС в печени и кишечнике. Это приводит к компенсаторной экспрессии гепатоцитами повышенного числа рецепторов липопротеидов низкой плотности, что увеличивает клиренс ХС ЛПНП из плазмы. Убедительно доказанная прогностическая польза длительного приема ингибиторов ГМГ-КоА-редуктазы при атеросклерозе и сахарном диабете уверенно вывела эту группу препаратов на ведущее место в рекомендациях по современной медикаментозной терапии и профилактике сердечно-сосудистых заболеваний. Так, сравнение итогов первичной, вторичной профилактики и лечения ИБС, проводимое с помощью статинов и сопоставимых с ними по степени снижения липидов холестирамина или шунтирования тонкого кишечника, показало, что терапевтическое действие при применении статинов наступает на 2 года раньше и эффект их выше. Лучшие результаты, полученные при лечении статинами, объясняются наличием у них не только антихолестеринемического, но и множеством других полезных эффектов. Полезные свойства статинов, не зависящие от их влияния на липиды плазмы, получили название плейотропных (от греческих «pleio» – «множественный», и «tropos» – «действие»). Плейотропные эффекты статинов проявляются уже в первые 3-4 месяца лечения: обеспечивают положительное влияние на функцию эндотелия, оказывают антиишемический, антитромботический, антиаритмический, антиатерогенный и другие эффекты. Благодаря этому спектр показаний к назначению статинов при лечении ССЗ расширяется.
В настоящее время в клинической практике постулировано, что составляющими компонентами МС являются: абдоминальное ожирение, ИР, НТГ, гиперинсулинемия, дислипидемия, ранний атеросклероз, недостаточное снижения уровня АД в ночное время, АГ, ИБС, микроальбуминурия, нарушения гемостаза, нарушения пуринового обмена, синдром ночного апноэ, стеатоз печени и поликистоз яичников. К сожалению, на практике диагностика сочетаний этих метаболических нарушений часто происходит случайно. Высказываются мнения, что нет необходимости выделять МС в самостоятельную нозологическую форму, поскольку лечение АГ, ИБС и сахарного диабета тип 2 (СД 2) остается традиционным, а определение ИР скорее является инструментом научного поиска, чем рутинным лабораторным анализом и не может использоваться в широкой клинической практике. С другой стороны, знание и лабораторное подтверждение ИР дает более широкие возможности для внедрения эффективных воздействий, повышающих чувствительность тканей к инсулину, в том числе медикаментозное воздействие на метаболические нарушения, связанные с ИР. Это могло бы улучшить прогноз и снизить риск сердечно-сосудистых осложнений уже на ранних этапах, когда еще не сформировалось заболевание как диагноз. Изменения в сосудистой стенке, а именно ее ригидность, эндотелиальная дисфункция, а затем микроангиопатии и ремоделирование сосудистого русла развиваются задолго до формирования АГ, ИБС и СД 2 со всеми их клиническими проявлениями. Так, на приеме больного с высокими цифрами АД врач тут же предпринимает меры по оказанию помощи, а с пограничным уровнем АД рекомендуется наблюдение, хотя изменения в сосудистой стенке идентичны у обоих пациентов.
Накопленные клинические данные свидетельствуют, что ИР играет ведущую, ключевую роль в патогенезе этого сложного патологического процесса. При МС ИР может быть приобретенной и генетически детерминированной. ИР – снижение биологических эффектов (усвоение глюкозы) в тканях и органах в ответ на воздействие инсулина на специфические рецепторы клеток. В настоящее время известно более 40 заболеваний, при которых развивается ИР. Причинами ее развития могут быть стрессы, дефицит магния, гиподинамия, злоупотребление алкоголем, повышение уровня контринсулярных гормонов. ИР четко ассоциирована с характером распределения жировой ткани (адипоцитов – клетки жировой ткани) в организме. Адипоциты висцеральной локализации, в отличие от подкожной жировой ткани, имеют более высокую плотность и чувствительность ß3-адренорецепторов, контролирующих интенсивность липолиза, а также низкое содержание инсулиновых рецепторов. Такие структурно-рецепторные особенности висцеральных адипоцитов определяют метаболическую чувствительность последних к липолитическим воздействиям (ß-адреностимуляция) и толерантность к антилиполитическому эффекту инсулина.
Интенсивность липолиза при висцеральном типе ожирения приводит к интенсификации продукции свободных жирных кислот (СЖК), которые поступают в печень через воротную вену. В свою очередь, избыток СЖК является субстратом для синтеза печенью липопротеидов очень низкой плотности, богатых триглициридами. Повышение концентрации СЖК сопровождается ингибированием окисления глюкозы, уменьшением связывания инсулина рецепторами гепатоцитов и снижением его метаболического клиренса, что в конечном итоге приводит к системной гиперинсулинемии. Длительная гиперинсулинемия, через стимуляцию тонуса симпатической нервной системы, способствует вазоконстрикции и активации РААС, с увеличением ОЦК за счет интенсификации реабсорбции Na и облигатной задержки воды, что суммарно ведет к увеличению АД.
Снижение чувствительности печени к действию инсулина сопровождается уменьшением синтеза гликогена (энергетический резерв клеток), усилением гликогенолиза и гликонеогенеза. Одновременно избыток СЖК оказывает прямое липотоксическое действие на секреторную функцию ß-клеток поджелудочной железы и ингибирует инсулинозависимую утилизацию глюкозы мышечными клетками, развивается периферическая ИР.
Интенсификация свободнорадикального окисления (увеличение скорости генерирования активных форм кислорода), которая имеет место при МС, способствует прогрессированию атеросклероза через перекисное окисление липидов. В условиях ИР и ГИ формируется атерогенная дислипидемия: повышение содержания ТГ, ХС ЛПОНП и ХС ЛПНП, снижение концентрации ХС ЛПВП. Помимо количественного изменения липидного состава плазмы имеют место и качественные сдвиги со стороны активности липидных молекул: при МС фрагменты ХС ЛПНП легко окисляются и мигрируют в субэндотелиальные пространства, способствуя более быстрому формированию бляшек (рисунок 3). Атерогенные окисленные липиды (окси-ЛПНП) – лабильные соединения, быстро подвергаются дальнейшей окислительной деструкции с образованием карбонильных соединений, которые захватываются моноцитами-макрофагами стенки сосудов. Последние трансформируются в пенистые клетки и являются основой атеросклеротической бляшки.
Для больных МС характерна постпрандиальная гиперлипидемия, характеризующаяся интенсивным нарастанием атерогенных липидов в этот период (2, 5, 7). Длительное повышение концентрации в крови ТГ в условиях ИР нарушает в постпрандиальном периоде эндотелийзависимую вазодилатацию, вызывает оксидативный стресс, что способствует развитию раннего атеросклероза и ИБС (8, 9, 15).
Системный оксидативный стресс, лежащий в основе эндотелиальной дисфункции при МС, запускается повышением концентрации ингибитора активатора плазминогена-I (ИАП-I), фактора некроза опухоли-α (ФНО-α), интерлейкина-6 и ангиотензиногена, которые являются провоспалительными цитокинами, секретируемые адипоцитами – клетками жировой ткани (7, 12).
Развитию эндотелиальной дисфункции при МС способствуют периваскулярные отложения жира, нарушения сосудистого тонуса и реактивности. Повышение в плазме крови концентрации ИАП-I (главный ингибитор активатора плазминогена и почечной урокиназы) приводит к угнетению фибринолиза, развитию эндотелиальной дисфункции, повышению риска тромбоза в коронарных артериях и является независимым предиктором инфаркта миокарда. Гиперинсулинемия стимулирует пролиферацию фибробластов, сосудистых гладкомышечных клеток, способствует синтезу коллагена, что суммарно вызывает увеличение ОПСС.
Согласно данным второй части международного исследования ASCOT-LLA (Anglo-Scandinavian Cardiac Outcomes Trial – Lipid Lowering Arm), в котором изучались эффективность антигипертензивной терапии (амлодипин 10 мг/сутки) в сочетании с липидснижающими препаратами, включение аторвастатина в дозе 10 мг/сутки способствовало снижению частоты развития ИМ на 36% и мозговых инсультов – на 27% (3, 16).
Коррекция ИР является важным компонентом в общей схеме лечения МС в сочетании с АГ
Метформин – препарат группы бигуанидов, стимулирующих чувствительность клеточных рецепторов печени и периферических тканей (скелетная мускулатура) к эндогенному инсулину, не оказывая влияния на активность ß-клеток поджелудочной железы.
Первичный, суммарный антигипергликемический эффект метформина, в дозе 1000-2000 мг в сутки, вызван снижением продукции глюкозы печенью (глюконеогенез) и СЖК, через подавление окисления жира, с усилением периферического захвата глюкозы.
Гипогликемическая реакция печени на метформин обусловлена в первую очередь подавлением процессов глюконеогенеза и в меньшей степени – гликогенолиза, что в конечном итоге манифестируется гликемией натощак. Подобный эффект метформина на уровне печени обусловлен ингибированием поступления в гепатоциты предшественников глюкозы (лактат, пируват, аминокислота) и ключевых ферментов глюконеогенеза (глюкоза-6-фосфат, фруктоза -1,6- биофосфатаза, пируваткарбоксилаза).
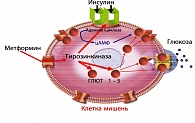
Восстановление чувствительности к инсулину периферической ткани под действием метформина реализуется через ряд клеточных механизмов: увеличивается количество аффинных к инсулину рецепторов, через стимуляцию тирозинкиназы повышается активность инсулиновых рецепторов, активизируются экспрессия и перемещения из внутриклеточного пула на клеточную мембрану транспортеров глюкозы (ГЛЮТ 1-5) (рисунок 4).
Выше перечисленные процессы приводят к увеличению поглощения глюкозы органами – мишенями инсулина: печенью, скелетной мускулатурой, жировой тканью.
Другими механизмами действия метформина являются снижение гастроинтестинальной абсорбции глюкозы с повышением анаэробного гликолиза, что сопровождается снижением уровня глюкозы в крови, оттекающей от кишечника, с одновременным снижением содержания инсулина (тощаковая инсулинемия) в сыворотке крови, что суммарно приводит к снижению постпрандиальной гликемии. С учетом указанных механизмов действия метформина правильнее говорить не о его гипогликемическом, а об антигипергликемическом влиянии (4, 13, 14).
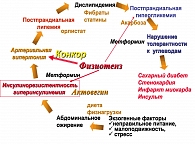
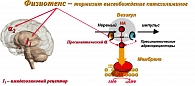
Агонисты I1-имидазолиновых рецепторов (Физиотенз) занимают особое место в терапии МС при коррекции АГ через подавление центральной гиперсимпатикотонии (рисунок 5). Эти препараты, за счет активации имидазолиновых рецепторов 1-го типа в среднем мозге и пресинаптических α-адренорецепторов, уменьшают центральную симпатическую импульсацию, способствуют снижению гидролиза жиров, уменьшению СЖК, усилению метаболизма глюкозы и повышению чувствительности к инсулину, снижению уровня ТГ, повышению ЛПВП и снижению уровня ИАП -1. В исследованиях H. Lithell (1999 г.) получены данные о влиянии Физиотенза (моксонидина) на уменьшение ИР. В пилотном исследовании В.А. Алмазова (2000 г.) также подтверждено влияние Моксонидина на ИР. Данные исследования определили способность Физиотенза (моксонидина) влиять на ИР у пациентов с избыточным весом и с НТГ.
Было проведено сравнительное исследование ALMAZ, в которое было включено 202 пациента (рандомизированные группы по 101 пациенту): лечение – Физиотенз (моксонидин – 0,4 мг в сутки) и Метформин (1000 мг в сутки) в течение 4 месяцев. Критерии включения пациентов в исследование: возраст > 40 лет, ИМТ > 27 кг/м2, глюкоза натощак > 6,1 ммоль/л.
Исследование ALMAZ показало, что Физиотенз (моксонидин) снижал уровень глюкозы натощак, снижал вес пациентов, повышал скорость утилизации глюкозы, снижал ИР. Была также проведена оценка влияния моксонидина и метформина на гликемический контроль у пациентов с избыточным весом, мягкой АГ, ИР и НТГ. На фоне Моксонидина уровень глюкозы натощак снижался менее выраженно, чем на фоне Метформина, но достоверно снижался уровень инсулина, в то время как Метформин на него не влиял, а ИМТ снижался равнозначно на фоне обоих препаратов.
Оба препарата статистически достоверно повышают чувствительность к инсулину после нагрузки глюкозой: Физиотенз оказывает влияние на уровень инсулина в крови, Метформин регулирует уровень глюкозы, что сопровождалось снижением гликозилированного Нв. Оба препарата статистически достоверно снижают массу тела, оставаясь метаболически нейтральными к липидам.
Полученные результаты в комплексном сравнительном исследование ALMAZ позволили сделать практические выводы.
Подтверждена высокая роль активности СНС в формировании ИР при МС.
Физиотенз в дозе 0,4 мг/сутки, первый гипотензивный препарат, оказывает гликолитическую метаболическую активность, не уступающую группе бигуанидов (Метформин).
Физиотенз снижает ИР, не уступая Метформину.
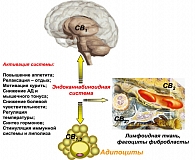
В последние годы привлекает новая группа препаратов, воздействующих на эндоканнабиноидную систему – блокаторов СВ1 эндоканнабиноидных рецепторов. Эндоканнабиноидная система у здорового человека обычно находится в «немом» состоянии, активируясь «по требованию» под воздействием стресса. Основные последствия активации этой системы состоят в невозможности расслабиться (усиление боли и тревоги), нарушения терморегуляции, образование гормонов, регулирование тонуса гладких мышц и АД, ингибирование моторного поведения и успокоения, защиты на клеточном и эмоциональном уровнях; стимулирование аппетита и никотиновой зависимости (индуцирование аппетита и получение удовольствия от приема пищи и курения) (рисунок 6).
Рецепторы к каннабиноидам были открыты во время поисков точек приложения действия основного производного конопли (CANNABIS) – дельтатетрагидроканнабинола. Затем выяснилось, что на эти же рецепторы действуют и некоторые эндогенные биологически активные вещества (энданнабиноиды). К настоящему времени описаны два типа рецепторов СВ1 и СВ2 . Рецепторы СВ1 обнаружены в головном мозге (гипокампе, базальных ганглиях, коре, мозжечке, гипоталамусе, лимбических структурах, стволе головного мозга). Рецепторы СВ2 локализуются на мембранах клеток иммунной системы.
Эндоканнабиноиды образуются из фосфолипидов-предшественников локализованных в мембранах клеток «по требованию». Они действуют локально и немедленно метаболизируются после того, как реализовали свой эффект. Являясь системой «немедленного реагирования», у здоровых людей эндоканнабиноидная система очень быстро активируется и также быстро «засыпает». Но при некоторых состояниях – ожирение, курение – происходит чрезмерное патологическое возбуждение этой системы. Эндоканнабиноидная система, действуя на уровне мозга, индуцирует избыточное потребление пищи и потребность в никотине; действуя на уровне адипоцитов – стимулирует накопление жира.
Блокаторы СВ1 рецепторов устраняют неблагоприятные эффекты гиперактивности эндоканнабиноидной системы. Представитель этого класса препаратов – Римонабант – уже применялся в нескольких многоцентровых рандомизированных плацебо-контролируемых исследованиях у больных ожирением и продемонстрировал обнадеживающие результаты в отношении снижения массы тела, улучшения липидного профиля и контроля гликемии у пациентов с СД. Немаловажным фактором является то, что применение СВ1 – блокаторов способствует отказу от курения. Однако требуются ответы еще на многие вопросы, в том числе касающиеся безопасности, прежде чем этот класс препаратов войдет в широкую клиническую практику. [7].
Таким образом, лечение АД, являющейся компонентом МС, носит комплексный характер: восстановление чувствительности клеток органов-мишеней к инсулину, нормализация липидного и гликемического профилей крови, достижение целевого уровня АД (≤ 125/85 мм рт. ст.). Важным требованием к гипотензивным препаратам при МС является их метаболическая нейтральность. Коррекцию дислипидемии при МС можно проводить как статинами, так и фибратами в зависимости от конкретной ситуации, до достижения оптимального липидного спектра крови.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.