Иммунизация 23-валентной полисахаридной пневмококковой вакциной пациентов с системной красной волчанкой, получавших комбинированную иммуносупрессивную терапию
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В исследование включено 77 пациентов с СКВ в возрасте от 19 до 68 лет. У 10 (13%) наблюдалась высокая активность заболевания, у 18 (23%) – средняя, у 44 (57%) – низкая, у 5 (7%) – ремиссия.
Все участники исследования получали иммуносупрессивную терапию в различных комбинациях. ППВ-23 в количестве 0,5 мл (одна доза) вводили подкожно. Длительность наблюдения составила 12 месяцев и более у 60 пациентов, от 2 до 12 месяцев – у 17. Больные обследовались перед вакцинацией, а также через 1–3 и 12 месяцев после процедуры.
Результаты и обсуждение. У 38 (49,4%) пациентов отмечались стандартные местные вакцинальные реакции легкой и средней степени тяжести, у 1 (1,3%) – общая реакция легкой степени тяжести, у 2 (2,6%) – легкая диарея в течение одних суток, у 1 (1,3%) – гиперергическая реакция по типу феномена Артюса. У 35 (45,4%) больных вакцинальная реакция отсутствовала.
В течение 12 месяцев не было зарегистрировано ни одного случая обострения СКВ, достоверно связанного с вакцинацией, а также развития новых аутоиммунных феноменов.
Через год наблюдения число ответивших на вакцинацию составило 58%.
Длительность и активность заболевания, возраст старше 50 лет, прием глюкокортикоидов свыше 10 мг/сут
значимо не влияли на вакцинальный ответ. Снижение иммунного ответа отмечено у получавших генно-инженерные
биологические препараты (ГИБП) по сравнению с не принимавшими препараты данной группы – 43 и 68% соответственно (р = 0,058). Различий в иммунном ответе на фоне терапии ритуксимабом и белимумабом не установлено. Выявлена тенденция к преобладанию «ответчиков» на вакцинацию в группе получавших ГИБП менее года до иммунизации ППВ-23 и группе пациентов, которым эта терапия была назначена после иммунизации.
В течение года после вакцинации наблюдалась положительная динамика, а именно уменьшилось число инфекций верхних и нижних дыхательных путей.
В последующие три – пять лет пневмонии не регистрировались.
Заключение. ППВ-23 обладает достаточной иммуногенностью, хорошей переносимостью и эффективностью у больных СКВ, получавших комбинированную иммуносупрессивную терапию. Применение ГИБП уменьшает число «ответчиков» на вакцинацию. Однако при соблюдении сроков введения (до инициации терапии ГИБП или истечения первого года их использования) число «ответчиков» возрастает.
Материал и методы. В исследование включено 77 пациентов с СКВ в возрасте от 19 до 68 лет. У 10 (13%) наблюдалась высокая активность заболевания, у 18 (23%) – средняя, у 44 (57%) – низкая, у 5 (7%) – ремиссия.
Все участники исследования получали иммуносупрессивную терапию в различных комбинациях. ППВ-23 в количестве 0,5 мл (одна доза) вводили подкожно. Длительность наблюдения составила 12 месяцев и более у 60 пациентов, от 2 до 12 месяцев – у 17. Больные обследовались перед вакцинацией, а также через 1–3 и 12 месяцев после процедуры.
Результаты и обсуждение. У 38 (49,4%) пациентов отмечались стандартные местные вакцинальные реакции легкой и средней степени тяжести, у 1 (1,3%) – общая реакция легкой степени тяжести, у 2 (2,6%) – легкая диарея в течение одних суток, у 1 (1,3%) – гиперергическая реакция по типу феномена Артюса. У 35 (45,4%) больных вакцинальная реакция отсутствовала.
В течение 12 месяцев не было зарегистрировано ни одного случая обострения СКВ, достоверно связанного с вакцинацией, а также развития новых аутоиммунных феноменов.
Через год наблюдения число ответивших на вакцинацию составило 58%.
Длительность и активность заболевания, возраст старше 50 лет, прием глюкокортикоидов свыше 10 мг/сут
значимо не влияли на вакцинальный ответ. Снижение иммунного ответа отмечено у получавших генно-инженерные
биологические препараты (ГИБП) по сравнению с не принимавшими препараты данной группы – 43 и 68% соответственно (р = 0,058). Различий в иммунном ответе на фоне терапии ритуксимабом и белимумабом не установлено. Выявлена тенденция к преобладанию «ответчиков» на вакцинацию в группе получавших ГИБП менее года до иммунизации ППВ-23 и группе пациентов, которым эта терапия была назначена после иммунизации.
В течение года после вакцинации наблюдалась положительная динамика, а именно уменьшилось число инфекций верхних и нижних дыхательных путей.
В последующие три – пять лет пневмонии не регистрировались.
Заключение. ППВ-23 обладает достаточной иммуногенностью, хорошей переносимостью и эффективностью у больных СКВ, получавших комбинированную иммуносупрессивную терапию. Применение ГИБП уменьшает число «ответчиков» на вакцинацию. Однако при соблюдении сроков введения (до инициации терапии ГИБП или истечения первого года их использования) число «ответчиков» возрастает.
![Таблица 1. Изменение иммунологических показателей и значений SLEDAI-2K у 60 пациентов с СКВ после вакцинации (Ме [25-й; 75-й])](/upload/resize_cache/iblock/4d4/195_350_1/Tarasova2.jpg)

![Таблица 3. Динамика концентрации пневмококковых антител у 60 пациентов с СКВ после вакцинации, мг/л (Ме [25-й; 75-й])](/upload/resize_cache/iblock/b5c/195_350_1/Tarasova4.jpg)
Введение
Streptococcus pneumoniae является самым частым возбудителем внебольничной пневмонии и острого среднего отита – 17–76 и 25% случаев соответственно. Для данного вида бактерий из рода стрептококков характерны высокая частота распространения, бессимптомное носительство, способность вызывать тяжелые инвазивные формы заболевания, такие как пневмония с бактериемией, менингит, эндокардит, сепсис.
Пневмококковая инфекция, как правило, является осложнением других инфекций, например гриппа, кори, или любой другой респираторной вирусной инфекции. Пневмококковый сепсис с развитием тяжелого шокового повреждения органов считается самой тяжелой и жизнеугрожающей формой пневмококковой инфекции, смертность при которой достигает 20–50%. До начала повсеместной вакцинации пневмококковая инфекция ежегодно становилась причиной смерти 1,6 млн человек, в том числе от 0,7 до 1 млн детей [1]. В России вакцинация против пневмококковой инфекции всех достигших возраста 50 лет, а также лиц из группы риска включена в рекомендации по многим клиническим специальностям [1–7].
У пациентов с системной красной волчанкой (СКВ) риск развития пневмококковой инфекции, в первую очередь пневмонии, повышен в силу ряда причин: практически пожизненная иммуносупрессивная терапия, в том числе анти-В-клеточными препаратами, частое развитие лейко- и лимфопении, патология системы комплемента, снижение уровня иммуноглобулина (Ig) G. К факторам, которые могут ухудшать течение и прогноз пневмококковой пневмонии у больных СКВ, относятся высокая активность процесса, поражение легких в рамках основного заболевания (плеврит, люпус-пневмонит, интерстициальные пневмонии, легочные (альвеолярные) геморрагии, легочная гипертензия, легочный васкулит, тромбоэмболии легочных артерий), почечная недостаточность.
Согласно рекомендациям экспертов EULAR (Еuropean League Against Rheumatism), иммунизация пневмококковыми вакцинами является важнейшим фактором профилактики развития тяжелых респираторных инфекций у лиц с иммуновоспалительными ревматическими заболеваниями (ИВРЗ), включая СКВ, и настоятельно показана этим пациентам [8, 9].
Цель исследования
Целью настоящего исследования стала оценка эффективности и безопасности вакцинации 23-валентной полисахаридной пневмококковой вакциной (ППВ-23) пациентов с СКВ, получавших комбинированную иммуносупрессивную терапию.
Материал и методы
В исследование включены 77 пациентов с СКВ, из них 68 женщин и 9 мужчин.
Возраст больных варьировался от 19 до 68 лет. Длительность СКВ – от 6 месяцев до 42 лет.
У всех больных диагноз СКВ соответствовал критериям ACR (American College of Rheumatology) 1997 г. и критериям SLICC (Systemic Lupus International Collaborating Clinics)/ACR 2012 г. [10]. Активность заболевания оценивалась по SLEDAI (Systemic Lupus Erythematosus Disease Activity Index) в модификации 2000 г. (SLEDAI-2K) [11]. Согласно SLEDAI-2K выделяют следующие степени активности СКВ: ремиссия – 0 баллов, низкая активность – 1–5 баллов, средняя активность – 6–10 баллов, высокая активность – 11–19 баллов, очень высокая активность – более 20 баллов.
У 10 (13%) пациентов наблюдалась высокая активность заболевания, у 18 (23%) – средняя, у 44 (57%) – низкая, у 5 (7%) – ремиссия.
Для иммунизации пациентов использовали пневмококковую полисахаридную 23-валентную вакцину. ППВ-23 (Пневмо-23 (Sanofi Pasteur), Пневмовакс 23 (MSD)) вводили подкожно по 0,5 мл препарата в одной прививочной дозе.
Длительность наблюдения у 60 пациентов составила 12 месяцев и более, у 17 – от 2 до 12 месяцев.
Из 60 пациентов 58 получали глюкокортикоиды (ГК) в дозе 5–40 мг/сут в пересчете на преднизолон, 46 – гидроксихлорохин (ГХ), 33 – цитостатики (ЦС), 23 – генно-инженерные биологические препараты (ГИБП), в том числе 12 – ритуксимаб (РТМ), 10 – белимумаб (БЛМ), 1 – комбинированную терапию РТМ и БЛМ.
Больные были обследованы исходно (первый визит), через 1–3 месяца (второй визит), а также через 12 месяцев (третий визит) после вакцинации.
На всех этапах контроля проводили стандартные клинические и лабораторные исследования, а также определяли уровень антител к полисахаридам клеточной стенки Streptococcus pneumoniae в сыворотке крови с помощью коммерческих наборов VaccZymeTM PCP Ig 2 (The Binding Site Ltd, Birmingham, UK). Для каждого больного рассчитывали коэффициент вакцинального ответа – отношение содержания антител на момент второго и третьего визитов к исходному. Иммунный ответ на вакцину расценивали как достаточный, если через год уровень антител как минимум в два раза превышал исходный.
Статистический анализ проводили с помощью пакета программ Stаtistica, версия 12.0 (StatSoft Inc., США). Количественные данные представлены в виде медианы и интерквартильного интервала (Me [25-й; 75-й перцентили]). Для статистической обработки результатов использовали тесты Манна – Уитни и Вилкоксона. Различия считали значимыми при р < 0,05.
Результаты
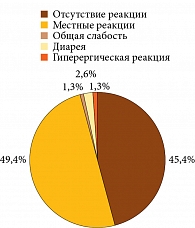
Переносимость вакцинации оценена у 77 пациентов (рисунок). У 35 (45,4%) вакцинальные реакции отсутствовали, у 38 (49,4%) отмечались местные реакции легкой и средней степени тяжести (боль, припухлость, гиперемия кожи в месте инъекции) длительностью от двух до семи дней, у 1 (1,3%) – общая слабость на протяжении месяца, еще у 2 (2,6%) – легкая диарея в течение суток. Вакцинальные реакции были типичными и полностью обратимыми, а также не требовали дополнительных назначений. У 1 (1,3%) пациентки развилась гиперергическая реакция по типу феномена Артюса, симптомы были купированы через неделю на фоне применения антигистаминных препаратов и ГК местно.
Ни у одного из 60 пациентов, срок наблюдения за которыми составил 12 месяцев и более, не выявлено обострения СКВ, непосредственно связанного с вакцинацией, то есть в ближайшие два-три месяца после ее проведения. Динамика показателей иммунологической активности и SLEDAI-2K в течение года после иммунизации представлена в табл. 1.
За 12 месяцев умеренно выраженное обострение заболевания, по срокам не связанное с введением вакцины (через 3,5–12 месяцев после вакцинации), зафиксировано у семи больных: у пяти на фоне снижения дозы ГК, у одного после психологического стресса и еще у одного из-за недостаточной эффективности терапии и высокой иммунологической активности. У всех находившихся под наблюдением обострение протекало с типичной, ранее имевшей место симптоматикой и быстро купировалось умеренным повышением дозы ГК.
У 33 (55%) пациентов вакцинация была проведена на фоне низкой активности СКВ, у 12 (20%) – на фоне средней активности, у 6 (10%) – в период ремиссии. На фоне высокой активности СКВ вакцинированы 9 (15%) больных. В таблице 2 представлены состояния, послужившие основанием для их иммунизации.
Среди пациентов с высокой активностью СКВ не было отмечено выраженных вакцинальных реакций, а также ухудшения течения заболевания. Несмотря на активную иммуносупрессивную терапию, включая циклофосфан (два случая) и ритуксимаб (три случая), все больные этой группы признаны «ответчиками» на вакцину.
Иммуногенность. Через один-два месяца после вакцинации у 78% пациентов отмечено более чем двукратное повышение концентрации пневмококковых антител. Спустя 12 месяцев 35 (58%) больных являлись «ответчиками» на вакцину. У 25 (42%) уровень пневмококковых антител не превышал исходный в два раза, поэтому такие пациенты были расценены как «неответчики». Динамика концентрации пневмококковых антител представлена в табл. 3.
Была также проанализирована выраженность иммунного ответа в зависимости от различных факторов. В частности, среди пациентов моложе 50 лет (n = 46) на «ответчиков» приходилось 52,2%, старше 50 лет (n = 14) – 50%. В зависимости от длительности заболевания частота ответивших на вакцину также значимо не различалась. При длительности болезни до пяти лет доля «ответчиков» составляла 47,6%, от пяти до десяти лет – 66,7%, свыше десяти лет – 55,6%.
У пациентов с СКВ в стадии ремиссии адекватный вакцинальный ответ развился в 50% случаев, при низкой активности заболевания – в 52%, при средней активности – в 50% случаев. Необходимо отметить, что при высокой активности СКВ ответ на вакцинацию был получен в 100% случаев.
Различий между получавшими ГК в дозе > 10 мг/сут (n = 22) и в дозе < 10 мг/сут (n = 36) не установлено. Адекватный иммунный ответ зарегистрирован в 59 и 58% случаев соответственно.
Более половины пациентов (n = 33) получали ГК в сочетании с ЦС (+/- ГХ). В этой подгруппе число «ответчиков» было аналогичным таковому при терапии только ГК (+/- ГХ) – 65 и 67% соответственно. Подобная ситуация наблюдалась при добавлении ЦС к терапии ГИБП и ГК (+/- ГХ) – 44 и 43% «ответчиков» соответственно.
Влияние ГИБП на вакцинальный ответ. ГИБП были представлены анти-В-клеточными препаратами РТМ и БЛМ. Среди получавших эти препараты 43% были «ответчиками» на вакцину. При проведении стандартного лечения доля ответивших возрастала до 68% (р = 0,058).
Установлено значимое влияние сроков вакцинации относительно инициации терапии или очередного введения анти-В-клеточного препарата. Максимальное число «ответчиков» (80%) наблюдалось среди тех, кто получал данный препарат через один – шесть месяцев после вакцинации. В подгруппе больных, которым анти-В-клеточная терапия проводилась в течение определенного периода времени до вакцинации, число «ответчиков» сокращалось до 33% (р = 0,04).
Длительность предшествующей терапии также имела значение для вакцинального ответа. Меньше всего «ответчиков» (12,5%) наблюдалось среди получавших ГИБП более чем 12 месяцев до вакцинации. При приеме ГИБП в течение 12 месяцев и менее до вакцинации доля ответивших возрастала до 50%.
Таким образом, выявлена тенденция к преобладанию «ответчиков» среди получавших ГИБП менее года до вакцинации, а также среди начавших принимать препараты данной группы после вакцинации.
Различие в количестве «ответчиков» на фоне терапии РТМ и БЛМ было незначительным – 50 и 40% соответственно.
Клиническая эффективность вакцинации. В течение года после вакцинации по сравнению с тем же периодом до вакцинации значимо уменьшилось число инфекций нижних дыхательных путей – 13,5 и 46,7% соответственно (р = 0,001). Кроме того, с 18,3 до 6,7% снизилась частота развития внебольничных пневмоний (р = 0,09). При этом в течение года не было зарегистрировано ни одного повторного случая пневмонии, хотя до вакцинации они имели место.
У 4 (6,7%) пациентов в течение года после вакцинации зафиксирована пневмония нетяжелого течения, не потребовавшая госпитализации. У всех этих больных отмечалось наличие факторов, предрасполагающих к развитию пневмонии. Так, у трех пациентов проводилась анти-В-клеточная терапия и отсутствовал адекватный ответ на вакцину, у одного – диагностировано интерстициальное поражение легких. К факторам повышенного риска инфицирования также следует отнести трудовую деятельность пациентов (один – воспитатель детского сада, двое – медработники) и наличие детей дошкольного возраста.
После вакцинации не выявлено ни одного нового аутоиммунного феномена, как лабораторного, так и клинического.
В течение года после вакцинации у 60 пациентов проанализирована динамика иммунологических маркеров СКВ. Данных о значимом повышении иммунологической активности заболевания не получено.
Отдаленные результаты. В течение 12 месяцев до вакцинации пневмония была выявлена у 11 пациентов, за этот же период времени после вакцинации – у четырех, при этом пневмония была легкой степени тяжести. В течение последующих трех – пяти лет на фоне продолжавшейся комбинированной иммуносупрессивной терапии пневмония не зарегистрирована.
Обсуждение
Длительный опыт применения ППВ-23 подтверждает ее безопасность в отношении возникновения серьезных поствакцинальных осложнений. Незначительные местные вакцинальные реакции отмечаются у 30–50% пациентов, повышение температуры тела до субфебрильных значений, а также общая слабость наблюдаются редко. Еще реже фиксируются увеличение лимфатических узлов, диарея, рвота, анафилактические реакции [12].
Известно, что при ИВРЗ, в первую очередь при СКВ, присутствуют факторы риска развития инфекционных осложнений, связанных как с самим заболеванием, так и с активной иммуносупрессивной терапией, в частности с широким применением в последние годы анти-В-клеточных биологических препаратов. В структуре указанных осложнений инфекции дыхательных путей занимают первое место. При этом пневмония является наиболее грозным, часто жизнеугрожающим осложнением. Противопневмококковая вакцинация пациентов с ИВРЗ, направленная в первую очередь на предотвращение развития тяжелой пневмонии, в настоящее время находит все большее распространение [13–15]. Увеличивается доказательная база безопасности пневмококковых вакцин при ИВРЗ. В целом они хорошо переносятся, не вызывают обострения основного заболевания или развития новых аутоиммунных феноменов. Проводимые исследования, в том числе в Научно-исследовательском институте ревматологии им. В.А. Насоновой, свидетельствуют о высокой клинической эффективности и безопасности ППВ-23 у больных ИВРЗ. Согласно результатам собственных исследований, при вакцинации ППВ-23 частота местных вакцинальных реакций у больных ревматоидным артритом достигала 35% [16–19]. В настоящей работе местные реакции наблюдались у 49,4% пациентов, что, возможно, отражает повышенную активность иммунной системы при СКВ. Феномен Артюса, развившийся у одной пациентки после введения вакцины, – редкая поствакцинальная реакция, которая была купирована в течение нескольких дней без серьезных последствий.
В нашем исследовании не было зарегистрировано ни одного случая обострения СКВ или развития нового аутоиммунного феномена, достоверно связанного с вакцинацией. Большинство исследователей также отмечают отсутствие значимого влияния иммунизации ППВ-23 на активность СКВ, определяемую по SLEDAI [20–22].
В общей популяции в течение двух-трех недель после иммунизации ППВ-23 уровень защитных антител как минимум в два раза превышает исходный не менее чем у 80% вакцинированных. В нашем исследовании 68% пациентов получали комбинированную иммуносупрессивную терапию, включавшую не только ГК и ГХ, но и ЦС и ГИБП. При этом значимое повышение концентрации специфических антител через один-два месяца после вакцинации отмечалось у 78%, через год сохранялось у 58%. Аналогичные результаты получены другими авторами, исследовавшими иммуногенность ППВ-23 при ревматоидном артрите и СКВ [23].
Проанализировано влияние проводимой терапии на вакцинальный ответ. Прием ГК в дозах, превышающих 10 мг/сут, не приводил к уменьшению числа ответивших на вакцину по сравнению с применением ГК в дозе 10 мг/сут и менее – 58 и 59% соответственно. Эти данные согласуются с результатами, полученными ранее у больных ревматоидным артритом, у которых терапия ГК не оказывала негативного влияния на вакцинальный ответ [16].
На фоне терапии ГИБП полноценный иммунный ответ регистрировали реже, чем в отсутствие такого лечения, – 43 и 68% соответственно (р = 0,058). Полученные результаты соответствуют результатам наблюдения других авторов о негативном влиянии ГИБП, а именно анти-В-клеточных препаратов, на иммуногенность пневмококковых вакцин [24–26]. При этом в нашем исследовании было выявлено, что если терапия ГИБП инициируется не менее чем через месяц после иммунизации, то доля «ответчиков» значительно возрастает по сравнению с введением вакцины на фоне уже осуществляемой терапии указанными препаратами (80,0 и 33,3% соответственно). Впервые проанализировано влияние длительности предшествующей терапии ГИБП на выраженность вакцинального ответа. Так, число «ответчиков» было значительно больше при проведении терапии менее чем за 12 месяцев до вакцинации. Таких было 50%. При большей длительности лечения данный показатель снижался до 12,5%.
Эксперты EULAR рекомендуют проводить иммунизацию в неактивную фазу заболевания. Однако необходимость вакцинации нередко возникает при средней и высокой активности СКВ, например при повторных пневмониях, перед планируемым усилением иммуносупрессивной терапии, в частности перед назначением ГИБП. Результаты нашего исследования свидетельствуют об отсутствии отрицательной динамики в состоянии пациентов, вакцинированных во время высокой и средней активности СКВ, определяемой как по SLEDAI-2K, так и по основным иммунологическим показателям, на протяжении 12-месячного периода. Переносимость вакцинации у этих пациентов была не хуже, чем у лиц с низкой активностью СКВ. Процент «ответчиков» среди них не уменьшался. Полученные данные позволяют обсуждать возможность проведения и безопасность вакцинации не только в неактивную фазу заболевания, но и в фазы средней и высокой его активности.
Клиническая эффективность вакцинации подтверждена значительным сокращением числа инфекций нижних дыхательных путей, в том числе пневмоний, их более легким течением в первый год после вакцинации, а также полным отсутствием пневмоний в последующие три – пять лет наблюдения. Кроме того, у многих пациентов после вакцинации значительно реже возникает острая респираторная вирусная инфекция.
Выводы
Полученные результаты позволяют сделать следующие выводы.
- Доказана достаточная иммуногенность и клиническая эффективность ППВ-23 у больных СКВ, получавших комбинированную иммуносупрессивную терапию.
- Вакцинация ППВ-23 хорошо переносится лицами с СКВ и безопасна для них. При необходимости возможна вакцинация пациентов с высокой активностью заболевания без риска развития нежелательных явлений.
- Анти-В-клеточные биологические препараты негативно влияют на иммуногенность ППВ-23. Однако при соблюдении сроков введения (инициация ГИБП не менее чем через месяц после вакцинации или проведение вакцинации на фоне терапии ГИБП длительностью менее года) количество пациентов с адекватным вакцинальным ответом возрастает.
- Необходимы дальнейшие исследования для уточнения и подтверждения полученных результатов.
Прозрачность исследования
Исследование не имело спонсорской поддержки.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
G.M. Tarasova, PhD, B.S. Belov, MD, PhD, M.V. Cherkasova, PhD, Ye.A. Aseyeva, PhD, T.M. Reshetnyak, MD, PhD, Prof., T.V. Popkova, MD, PhD, N.M. Kosheleva, PhD
V.A. Nasonova Research Institute of Rheumatology
Contact person: Galina M. Tarasova, verizubgm@gmail.com
The aim of the study was to study the efficacy and safety of vaccination with 23-valent polysaccharide pneumococcal vaccine (PPV-23) in patients with systemic lupus erythematosus (SLE) receiving combined immunosuppressive therapy.
Material and methods. The study included 77 patients with SLE aged 19 to 68 years. 10 (13%) had high disease activity, 18 (23%) – average, 44 (57%) – low, 5 (7%) – remission. All study participants received immunosuppressive therapy in various combinations. PPV-23 in an amount of 0.5 ml (one dose) was administered subcutaneously. The follow-up time was 12 months or more in 60 patients, from 2 to 12 months – in 17. The patients were examined before vaccination, as well as 1–3 and 12 months after it.
Results and discussion. In 38 (49.4%) patients, standard local vaccination reactions of mild and moderate severity were observed, in 1 (1.3%) – a general reaction of mild severity, in 2 (2.6%) – mild diarrhea within one day, in 1 (1.3%) – a hyperergic reaction according to the type of the Arthus phenomenon. There was no vaccine reaction in 35 (45.5%) patients.
During 12 months, there were no cases of SLE exacerbation reliably associated with vaccination, as well as the development of new autoimmune phenomena.
After a year of follow-up, the number of respondents to vaccination was 58%.
The duration and activity of the disease, the age over 50 years, the intake of glucocorticoids over 10 mg/day did not significantly affect the vaccine response. A decrease in the immune response was noted in those who received genetically engineered biological drugs (GIBD) compared to those who did not take drugs of this group – 43 and 68%, respectively (p = 0.058). There were no differences in the immune response during therapy with rituximab and belimumab. The tendency to the predominance of ‘responders’ for vaccination was revealed in the group of patients who received GIBD less than a year before immunization and in the group of patients who were prescribed this therapy after vaccination with PPV-23. During the year after vaccination, there was a positive trend, namely, the number of upper and lower respiratory tract infections decreased. In the next 3–5 years, no pneumonia was registered.
Conclusion. PPV-23 has sufficient immunogenicity, good tolerability and efficacy in patients with SLE receiving combined immunosuppressive therapy. The use of GIBD reduces the number of ‘responders’ for vaccination. However, if the timing of administration is met (before the initiation of GIBD therapy or the expiration of the first year of their use), the number of ‘responders’ increases.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.