Эффекты таргетной иммуномодулирующей терапии на дискордантное изменение взаимоотношений между сторожевой и незрелой субпопуляциями нейтрофильных гранулоцитов при вирусной и бактериальной инфекциях
- Аннотация
- Статья
- Ссылки
- English
Цель – уточнить особенности взаимоотношений между двумя эффекторными субпопуляциями CD64-CD16+CD32+CD11b+ и СD64+CD16+СD32+СD11b+ нейтрофильных гранулоцитов при вирусной и бактериальной инфекциях и оценить эффективность дифференцированной иммуномодулирующей терапии на регресс выявленной дискордантности во взаимоотношениях между этими субпопуляциями.
Материал и методы. Под наблюдением находились иммунокомпрометированные дети с хронической активной герпесвирусной инфекцией (ГВИ) в возрасте от пяти до восьми лет (группа 1 (Г1) – моно-ГВИ (n = 30) и группа 2 (Г2) – микст-ГВИ (n = 50)) и дети с бактериальной инфекцией в возрасте от двух до пяти лет (группа 3 (Г3) – острая деструктивная пневмония (n = 16)).
В исследуемой популяции определяли содержание субпопуляций НГ (%): сторожевой CD64-CD16+CD32+CD11b+, незрелой CD64+CD16+CD32+CD11b+, а также плотность экспрессии рецепторов.
Дифференцированная таргетная иммуномодулирующая терапия: Г1 получала системную и локальную терапию рекомбинантным интерфероном α2b в сочетании с антиоксидантами, инозином пранобексом, Г2 в дополнение к терапии, назначенной в Г1, применяла глюкозаминилмурамилдипептид, Г3 – гексапептид.
Результаты. У детей с хроническими моно- и микст-ГВИ (Г1, Г2) не отмечалось изменения соотношения сторожевой и незрелой субпопуляций НГ, однако была снижена плотность экспрессии CD32, CD16. Диагностически значимым для бактериальной инфекции (Г3) было увеличение в 30 раз содержания CD64+CD16+CD32+CD11b+ НГ.
Иммуномодулирующая терапия при моно- и микст-ГВИ не влияла на соотношение субпопуляций НГ, но улучшала их оснащенность CD32, CD16, тогда как при бактериальной инфекции наблюдалось восстановление баланса между этими двумя субпопуляциями НГ, а также увеличение плотности экспрессии CD16, CD11b.
Заключение. Иммунодиагностика вариантов дискордантности взаимоотношений субпопуляций НГ – CD64-CD16+CD32+CD11b+ и CD64+CD16+CD32+CD11b+ при различных инфекционно-воспалительных заболеваниях позволяет уточнить наличие вирусной или бактериальной инфекции. Дифференцированный подход к таргетной иммуномодулирующей терапии способствует устранению дискордантности во взаимоотношениях между сторожевой и незрелой субпопуляциями НГ у иммунокомпрометированных детей с вирусной и бактериальной инфекциями, восстановлению адекватности реагирования НГ на воспалительные процессы различной этиологии, что сопровождается развитием позитивной клинической динамики.
Цель – уточнить особенности взаимоотношений между двумя эффекторными субпопуляциями CD64-CD16+CD32+CD11b+ и СD64+CD16+СD32+СD11b+ нейтрофильных гранулоцитов при вирусной и бактериальной инфекциях и оценить эффективность дифференцированной иммуномодулирующей терапии на регресс выявленной дискордантности во взаимоотношениях между этими субпопуляциями.
Материал и методы. Под наблюдением находились иммунокомпрометированные дети с хронической активной герпесвирусной инфекцией (ГВИ) в возрасте от пяти до восьми лет (группа 1 (Г1) – моно-ГВИ (n = 30) и группа 2 (Г2) – микст-ГВИ (n = 50)) и дети с бактериальной инфекцией в возрасте от двух до пяти лет (группа 3 (Г3) – острая деструктивная пневмония (n = 16)).
В исследуемой популяции определяли содержание субпопуляций НГ (%): сторожевой CD64-CD16+CD32+CD11b+, незрелой CD64+CD16+CD32+CD11b+, а также плотность экспрессии рецепторов.
Дифференцированная таргетная иммуномодулирующая терапия: Г1 получала системную и локальную терапию рекомбинантным интерфероном α2b в сочетании с антиоксидантами, инозином пранобексом, Г2 в дополнение к терапии, назначенной в Г1, применяла глюкозаминилмурамилдипептид, Г3 – гексапептид.
Результаты. У детей с хроническими моно- и микст-ГВИ (Г1, Г2) не отмечалось изменения соотношения сторожевой и незрелой субпопуляций НГ, однако была снижена плотность экспрессии CD32, CD16. Диагностически значимым для бактериальной инфекции (Г3) было увеличение в 30 раз содержания CD64+CD16+CD32+CD11b+ НГ.
Иммуномодулирующая терапия при моно- и микст-ГВИ не влияла на соотношение субпопуляций НГ, но улучшала их оснащенность CD32, CD16, тогда как при бактериальной инфекции наблюдалось восстановление баланса между этими двумя субпопуляциями НГ, а также увеличение плотности экспрессии CD16, CD11b.
Заключение. Иммунодиагностика вариантов дискордантности взаимоотношений субпопуляций НГ – CD64-CD16+CD32+CD11b+ и CD64+CD16+CD32+CD11b+ при различных инфекционно-воспалительных заболеваниях позволяет уточнить наличие вирусной или бактериальной инфекции. Дифференцированный подход к таргетной иммуномодулирующей терапии способствует устранению дискордантности во взаимоотношениях между сторожевой и незрелой субпопуляциями НГ у иммунокомпрометированных детей с вирусной и бактериальной инфекциями, восстановлению адекватности реагирования НГ на воспалительные процессы различной этиологии, что сопровождается развитием позитивной клинической динамики.

Введение
Дефектное функционирование иммунной системы может нарушать распознавание и клиренс патогенов (бактерий, вирусов, грибов, простейших), что приводит к развитию различных острых и хронических заболеваний и зачастую к их нетипичному течению [1, 2].
Нейтрофильные гранулоциты (НГ) играют основную роль в реализации противоинфекционного иммунного ответа при вторжении бактерий, вирусов и грибов. Пациенты с дисфункцией в системе НГ не обеспечены адекватной противомикробной защитой, что обусловливает развитие острых тяжело протекающих инфекционно-воспалительных заболеваний, нередко полиэтиологичных, характеризующихся частыми рецидивами или хронизацией процесса [3, 4]. Неадекватное реагирование или отсутствие ответа НГ на микроорганизмы является причиной вялого течения хронических инфекционно-воспалительных заболеваний, не поддающихся стандартной терапии [2].
Являясь основной эффекторной частью иммунной системы, НГ способны не только уничтожать патогены, но и регулировать иммунный ответ и воспаление, в том числе при вирусной инфекции [4, 5]. В противовирусном иммунитете НГ принимают активное участие посредством реализации антителозависимой клеточной цитотоксичности, фагоцитоза, синтеза и секреции интерферонов (ИФН) и других цитокинов, образования активных форм кислорода, дефенсинов [6, 7]. Герпесвирусы способны повреждать иммунную систему, что приводит к прогрессированию иммунодефицита, ассоциированного с инфекционным синдромом, и неспособности элиминировать вирусы из организма. Известно также, что вирусы способны негативно влиять на функции НГ [8, 9]. Вирусные респираторные инфекции могут стимулировать существенное увеличение бактериальной нагрузки и, как следствие, приводить к развитию вторичных осложнений [10, 11]. В связи с этим изучение функционально значимых субпопуляций НГ и их фенотипических характеристик, а также разработка таргетных иммунотерапевтических подходов, направленных на восстановление полноценного функционирования НГ при заболеваниях, протекающих на фоне нарушений противовирусного и противобактериального иммунитета, являются важными задачами.
Противомикробная активность НГ ассоциирована с ведущими поверхностными мембранными рецепторами. СD16 (FcγRIII) – рецептор, отвечающий за цитотоксическое действие, дегрануляцию, кислородный взрыв и пролиферацию. Повышение экспрессии CD16 подтверждает функциональную активность НГ. Низкий уровень CD16 на мембранной поверхности НГ характерен для малодифференцированных молодых форм НГ [12, 13]. CD32 (FcγRII) – цитоплазматический иммунорецептор активации тирозина. Его экспрессия приводит в действие NADPH-оксидазный комплекс, опосредует эндоцитоз, стимулирует секреторную активность, цитотоксическое действие и иммуномодулирующую функцию НГ [13, 14]. CD11b (Mac-1, или рецептор к компоненту комплемента CR3а) – сигнальный партнер для других рецепторов. Он регулирует хемотаксис, миграцию НГ в очаг воспаления, адгезию, фагоцитоз, респираторный взрыв и дегрануляцию. Следствием блокировки CD11b являются дефект в активации Fcγ-рецепторов и нарушение фагоцитарной функции НГ [15]. CD64 (FcγRI) – высокоаффинный рецептор семейства Fcγ. Данный рецептор практически не экспрессируется на мембране НГ периферической крови здоровых лиц, а только на активированных НГ. Повышение экспрессии СD64 на мембране НГ происходит при бактериальной инфекции. Рецепторы CD64 и CD11b являются диагностическими маркерами бактериальной инфекции, тяжести ее течения, продолжительности и исхода воспалительного процесса [15–18].
В 60–70% случаев приобретенных иммунодефицитов наблюдаются изолированные или комбинированные дефекты активности рецепторного аппарата НГ, микробицидной и фагоцитарной активности НГ, для которых характерны различные клинические проявления, рецидивирующие вирусные и бактериальные инфекции, в том числе гнойно-воспалительные, аллергические и аутоиммунные заболевания [1]. При нарушении работы рецепторного аппарата разных субпопуляций НГ имеют место недостаточность количественного прироста НГ, находящихся как в циркуляции, так и в очаге воспаления, снижение числа активно фагоцитирующих клеток с нарушением процессов захвата бактериальных антигенов на фоне неадекватного реагирования микробицидных систем НГ, ассоциированные с дефектами активности NADPH-оксидаз, миелопероксидазы при стимуляции антигенов. Такие дисфункции связаны с отсутствием или дефектами сигналов с мембранных функционально значимых рецепторов [6, 7, 19, 20].
Именно недостаточная степень иммунной защиты создает условия для колонизации бактериями, вирусами, грибами, а также атипичными возбудителями слизистых оболочек, кожи, других тканей и органов. Антибактериальная, противовирусная, противогрибковая терапия таких инфекций может лишь частично решить проблему, устранив персистирующий микроорганизм, но не причину заболевания. Сохраняющийся дефект функционирования иммунной системы является базисом последующего рецидива заболевания, колонизации новыми микроорганизмами, часто резистентными к традиционным антимикробным средствам. Эта микрофлора углубляет и расширяет дефект иммунитета, индуцирует выделение из лейкоцитов цитокинов и формирование синдрома хронической воспалительной реакции [21].
Актуальной проблемой современной клинической иммунологии является создание новых технологий восстановления нормального функционирования иммунной системы при инфекционно-воспалительных заболеваниях бактериальной и вирусной этиологии.
В связи с изложенным чрезвычайно важным становится поиск новых таргетных терапевтических стратегий, базирующихся на изучении иммунопатогенетических механизмов возникновения вирусных или бактериальных инфекций, что в дальнейшем может способствовать не только оптимизации выбора иммунотропных лекарственных средств, но и достижению клинико-иммунологической ремиссии нетипично протекающих инфекционных процессов.
Цель исследования
Целью настоящего исследования стали уточнение особенностей взаимоотношений между двумя эффекторными субпопуляциями CD64-CD16+CD32+CD11b+ и СD64+CD16+СD32+СD11b+ нейтрофильных гранулоцитов при вирусной и бактериальной инфекциях, а также оценка эффективности дифференцированной иммуномодулирующей терапии в отношении регресса выявленной дискордантности во взаимоотношениях между этими субпопуляциями при разных вариантах инфекции.
Материал и методы
Для определения диагностической значимости субпопуляций НГ и усовершенствования лечебных подходов при различных заболеваниях вирусной и бактериальной этиологии под нашим наблюдением находилось 96 иммунокомпрометированных детей, разделенных на группы.
Группа 1 (Г1) – 30 иммунокомпрометированных детей (16 мальчиков и 14 девочек) в возрасте от пяти до восьми лет с хронической активной моноинфекцией, вызванной герпесвирусами (моно-ГВИ), в частности вирусом Эпштейна – Барр (ВЭБ), цитомегаловирусом (ЦМВ), вирусом герпеса человека 6 (ВГЧ-6), у которых в 100% случаев были диагностированы рекуррентные острые респираторные вирусные инфекции (ОРВИ) с частотой 16,00 (12,00; 17,25) в год (Г1 до лечения), получавших комбинированную интерфероно- и иммунотерапию (Г1 после лечения).
Группа 2 (Г2) – 50 иммунокомпрометированных детей (23 мальчика и 27 девочек) того же возраста с хронической рецидивирующей или активной микст-инфекцией, ассоциированной с различными сочетаниями герпесвирусов (микст-ГВИ), в частности вирусами простого герпеса 1/2 (ВПГ-1/2), ВЭБ, ЦМВ, ВГЧ-6, в 100% случаев сопровождающейся рекуррентными ОРВИ с частотой эпизодов 21,00 (15,25; 22,75) в год (Г2 до лечения), получавших комбинированную интерфероно- и иммунотерапию (Г2 после лечения).
Группа 3 (Г3) – 16 иммунокомпрометированных детей (семь мальчиков и девять девочек) в возрасте от двух до пяти лет с острой деструктивной пневмонией (ОДП) до и после комплексного послеоперационного лечения с включением иммуномодулирующей терапии (Г3 до лечения, Г3 после лечения).
Группа сравнения (ГС) – 20 условно здоровых детей в возрасте от пяти до восьми лет, сопоставимых по полу и возрасту с детьми Г1 и Г2.
Группа сравнения 1 (ГС1) – 20 условно здоровых детей в возрасте от двух до пяти лет, сопоставимых по полу и возрасту с детьми Г3.
Набор пациентов в группы исследования проводился на базе ГБУЗ «Детская краевая клиническая больница» Министерства здравоохранения Краснодарского края (г. Краснодар): консультативно-диагностическое отделение (Г1, Г2), хирургическое отделение (Г3, ГС, ГС1).
Иммунофенотипирование НГ осуществлялось в образцах периферической крови. Определяли процентное содержание субпопуляций НГ (%НГ), одномоментно несущих рецепторы CD64, CD16, CD32 и CD11b, и плотность экспрессии данных рецепторов по MFI методом проточной цитометрии (Веckman Coulter Cytomics FC 500, США) с применением соответствующих моноклональных антител.
Исследование было одобрено этическим комитетом ФГБОУ ВО «Кубанский государственный медицинский университет» Министерства здравоохранения РФ в соответствии с требованиями Хельсинкской декларации с правками от 2013 г.
На основании проведенного нами ранее исследования и выявления клинических и иммунологических критериев иммунокомпрометированности для пациентов с хроническими герпесвирусными инфекциями (ГВИ) – моно- и микст-ГВИ (Г1, Г2), ОДП (Г3) разработана дифференцированная иммуномодулирующая терапия (таблица).
Группа 1 – иммунокомпрометированные дети с моно-ГВИ – получала:
- для коррекции и модуляции ИФН-статуса базисную системную и локальную терапию рекомбинантным ИФНα2b (рИФНα2b) в сочетании с антиоксидантами в течение двух с половиной месяцев;
- противовирусную терапию для элиминации герпесвирусов – инозин пранобекс.
Группа 2 – иммунокомпрометированные дети с микст-ГВИ – использовала:
- для коррекции и модуляции ИФН-статуса базисную системную и локальную терапию рИФНα2b в сочетании с антиоксидантами в течение двух с половиной месяцев;
- противовирусную терапию для элиминации герпесвирусов – инозин пранобекс;
- дополнительно для направленной коррекции нарушений в системе НГ глюкозаминилмурамилдипептид (ГМДП).
Группа 3 – иммунокомпрометированные дети с ОДП – применяла фармпрепарат, действующей субстанцией которого является гексапептид (фГП).
Для статистической обработки данных использовали программы Microsoft Excel 2016 и StatPlus 2010. При сравнении групп применяли непараметрические критерии: U-критерий Манна – Уитни, критерии Шапиро – Уилка и Вилкоксона. Результаты представляли в виде медианы (Ме) и интерквартильного размаха (Q1; Q3). Различие признавали статистически значимым при p < 0,05.
Результаты
Клинические проявления хронических активных моно- или микст-ГВИ (Г1, Г2) характеризовались полиморфизмом и были вариабельны с преобладающими катаральным и интоксикационным синдромами, лимфаденопатией. В то же время не наблюдалось зависимости между отдельными клиническими симптомами и типом герпесвируса. Важно отметить, что хроническая активная ГВИ у детей сочеталась с часто повторяющимися эпизодами ОРВИ различной этиологии. В Г1 и Г2 до лечения детекция герпесвирусов проводилась между эпизодами рекуррентных ОРВИ. При этом ДНК герпесвирусов обнаруживалась в разных биологических локусах (кровь, соскоб из ротоглотки, слюна, моча).
У детей Г1 и Г2 течение ОРВИ сопровождалось изолированным поражением верхних дыхательных путей и лор-органов в виде острого ринита, фарингита, аденоидита, тонзиллита, катарального отита, ларингита, трахеита или их сочетания. Продолжительность острого периода ОРВИ не превышала десяти дней. Как правило, не отмечалось присоединения вторичной бактериальной инфекции респираторного тракта и лор-органов. Данные клинические признаки рекуррентных ОРВИ предполагают наличие именно вирусной этиологии респираторных заболеваний, в том числе герпесвирусной, учитывая репликативную активность герпесвирусов вне острого периода ОРВИ.
У детей Г1 и Г2 вне острого периода рекуррентных ОРВИ имел место разной степени выраженности интоксикационный синдром, проявляющийся слабостью, вялостью, астенией, бледностью кожных покровов, головной болью, головокружением, миалгией, артралгией, снижением аппетита, тошнотой, иногда рвотой.
Различалась и частота встречаемости различных хронических активных ГВИ. Наиболее часто у детей с моно-ГВИ (Г1) были представлены хроническая активная ВГЧ-6-инфекция (46,7%) и хроническая активная ВЭБ-инфекция (26,7%). У детей с микст-ГВИ (Г2) чаще встречалась в разнообразных сочетаниях хроническая ВЭБ-инфекция (42,0%), реже хроническая активная ЦМВ-инфекция (36,0%) и хроническая активная ВГЧ-6-инфекция (32,0%).
Противовирусная и иммуномодулирующая терапия проводилась лишь в острый период ОРВИ, при этом ранее не выявлялись ГВИ или не оценивалась репликативная активность герпесвирусов. Положительный эффект проводимого лечения заключался в уменьшении тяжести и длительности клинических проявлений рекуррентных ОРВИ. Однако симптомы интоксикации, лимфаденопатия сохранялись вне острого периода ОРВИ. Кроме того, короткие курсы иммуномодулирующей терапии не профилактировали возникновение последующих эпизодов ОРВИ. Исходя из изложенного, можно резюмировать, что традиционное лечение с короткими курсами противовирусной и иммуномодулирующей терапии не способствует достижению стойкого клинического эффекта у детей с хронической рецидивирующей или активной ГВИ, протекающей в сочетании с рекуррентными ОРВИ, имеющих клинические признаки иммунокомпрометированности.
У детей с развившейся ОДП (Г3) на основании анализа данных анамнеза были выявлены критериальные признаки иммунокомпрометированности: частые (до десяти раз в год) ОРВИ длительностью более двух недель, осложняющиеся присоединением острых бактериальных инфекций респираторного тракта и лор-органов, хронические латентные и активные моно- или микст-ГВИ, частые обострения хронических очагов инфекций, прежде всего лор-органов, различной степени тяжести острые, в том числе рецидивирующие, бактериальные инфекции разных органов и систем. Для лечения таких пациентов использовали частые (от шести до восьми раз в год) и продолжительные курсы препаратов антибактериальной направленности, получаемых как перорально, так и парентерально. При этом имела место частая смена антибактериальных препаратов, то есть применение двух-трех препаратов на курс лечения. На момент поступления пациентов с ОДП (Г3) в стационар эмпирическое назначение стартовой антибактериальной терапии не привело к клинико-лабораторному улучшению состояния. Напротив, развилась деструкция легочной ткани, что потребовало хирургического лечения и перехода на антибактериальные препараты из группы резерва (гликопептиды или оксазолидиноны).
Для выявления особенностей субпопуляционного состава НГ проведено иммунофенотипирование при различных заболеваниях вирусной и бактериальной этиологии с определением двух субпопуляций НГ: CD64-CD16+CD32+CD11b+ и СD64+CD16+СD32+СD11b+.
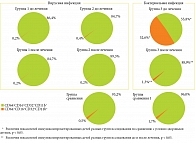
Установлено, что у условно здоровых детей в возрасте от пяти до восьми лет (ГС) субпопуляция CD64-CD16+CD32+CD11b+ НГ была преобладающей и составляла 93,2 (90,0; 94,7)%. В периферической крови в небольшом количестве определялась субпопуляция СD64+CD16+СD32+СD11b+ НГ – 0,5 (0,3; 1,5)%. У условно здоровых детей в возрасте от двух до пяти лет (ГС1) также установлено преобладание субпопуляции CD64-CD16+CD32+CD11b+ НГ – 96,0 (95,5; 97,6)%. Содержание субпопуляции CD64+CD16+CD32+CD11b+ НГ составляло 1,7 (1,4; 1,9)% циркулирующих НГ (рисунок).
С нашей точки зрения, именно преобладающая субпопуляция CD64-CD16+CD32+CD11b+ НГ является функционально значимой субпопуляцией, способной наиболее полноценно выполнять эффекторные функции НГ. Ее можно обозначить как сторожевую. Субпопуляция СD64+CD16+СD32+СD11b+ НГ у условно здоровых детей представлена в минимальных количествах. Экспрессия CD64 на мембране НГ свидетельствует об ускоренном миелопоэзе, что позволяет считать субпопуляцию СD64+CD16+СD32+СD11b+ НГ незрелой. Под воздействием различных стимулов (G-CSF, IFNγ, бактериальные антигены) рецептор CD64 также может транслоцироваться на мембрану НГ [16–18].
Установлено, что в Г1 у детей с хронической активной моно-ГВИ содержание субпопуляции СD64-CD16+СD32+СD11b+ НГ составляло 86,4 (84,9; 92,5)% и не отличалось от такового у условно здоровых детей (р > 0,05) (см. рисунок).
У детей с хронической рецидивирующей и активной микст-ГВИ в Г2 содержание СD64-CD16+СD32+СD11b+ составляло 84,7 (80,0; 90,1)% и было незначительно снижено по сравнению с детьми в ГС (p > 0,05) (см. рисунок).
При хронической активной ГВИ количество субпопуляции СD64+CD16+СD32+СD11b+ НГ было ниже в 2,9 раза в Г1 и в 1,4 раза в Г2 по отношению к показателям ГС (p1–2 > 0,05) (см. рисунок). Особенностью фенотипа субпопуляций, отвечающих за эффекторные функции НГ при вирусных инфекциях, является нарушение плотности экспрессии функционально значимых рецепторов. Так, при моно-ГВИ отмечалось снижение экспрессии рецепторов CD16 и CD32 в обеих субпопуляциях. При микст-ГВИ, напротив, наблюдалось повышение экспрессии рецепторов CD16 и CD11b на фоне снижения экспрессии рецепторов CD32 в сторожевой субпопуляции, снижение экспрессии рецепторов CD16 и CD32 в незрелой субпопуляции.
При оценке субпопуляционного состава НГ в Г3 у детей с ОДП определено снижение содержания сторожевой субпопуляции НГ до 55,8 (35,3; 74,8)% – в 1,7 раза относительно показателей ГС1 (р < 0,05). Содержание минорной субпопуляции НГ CD64+CD16+CD32+CD11b+ в Г3 увеличилось в 30 раз – до 52,6 (41,8; 54,9) против 1,7 (1,4; 1,9)% в ГС1 (р < 0,05), что является диагностически значимым для бактериальной инфекции (см. рисунок).
При вирусных инфекциях либо отсутствуют изменения уровня сторожевой субпопуляции НГ, как у детей с моно-ГВИ, либо эти изменения статистически незначимы, как у детей с микст-ГВИ снижение уровня сторожевой субпопуляции НГ. При бактериальной инфекции особое диагностическое значение приобретает содержание незрелой субпопуляции CD64+CD16+CD32+CD11b+ НГ, многократно увеличенное у детей с ОДП.
Полученные данные в отношении субпопуляционного состава НГ свидетельствуют о дискордантном изменении взаимоотношений между сторожевой и незрелой субпопуляциями при вирусной и бактериальной инфекциях. Важно отметить, что количественные изменения двух субпопуляций НГ у иммунокомпрометированных детей с моно- и микст-ГВИ и ОДП ассоциированы с нарушением эффекторных функций НГ, что было показано ранее [22, 23].
Нами разработана дифференцированная таргетная иммуномодулирующая терапия (см. таблицу) и проведена оценка ее влияния на взаимоотношения между сторожевой и незрелой субпопуляциями НГ у иммунокомпрометированных детей с моно- и микст-ГВИ и бактериальной инфекцией (ОДП).
После проведения интерфероно- и иммунотерапии у детей с хронической активной моно-ГВИ (Г1) содержание сторожевой субпопуляции СD64-CD16+СD32+СD11b+ НГ не изменилось по сравнению с таковым в начале лечения и ГС (р > 0,05) (см. рисунок).
В Г2 при хронической рецидивирующей и активной микст-ГВИ после лечения количество субпопуляции СD64-CD16+СD32+СD11b+ НГ увеличилось до значений ГС (p > 0,05) (см. рисунок).
Содержание незрелой субпопуляции СD64+CD16+СD32+СD11b+ НГ после проведенной таргетной иммуномодулирующей терапии у детей Г1 и Г2 существенно не изменилось относительно показателей до лечения и ГС (p1 > 0,05 и p2 < 0,05). При этом после проведенной терапии наблюдались восстановление плотности экспрессии изучаемых рецепторов CD16 и CD11b, а также тенденция к повышению экспрессии CD32 в обеих группах.
У детей с ОДП (Г3) после проведения комплексного послеоперационного лечения (антибактериальной, дезинтоксикационной, антикоагулянтной, симптоматической терапии) с включением фГП отмечалось увеличение уровня сторожевой субпопуляции CD64-CD16+CD32+CD11b+ НГ до 88,9 (87,2; 90,5) против 55,7 (35,2; 74,8)% до лечения (р < 0,05). При этом в 40 раз снизился уровень незрелой субпопуляции CD64+CD16+CD32+CD11b+ НГ, достигнув уровня у условно здоровых детей (см. рисунок).
Дифференцированный подход к иммуномодулирующей терапии у иммунокомпрометированных детей с хроническими моно- и микст-ГВИ (Г1, Г2) позволил достичь значимых результатов относительно снижения репликативной активности герпесвирусов, частоты рекуррентных ОРВИ, выраженности интоксикационного синдрома, что увеличило длительность клинического благополучия.
При детекции ДНК герпесвирусов (ВЭБ, ЦМВ, ВГЧ-6) после иммуномодулирующей терапии при моно-ГВИ (Г1) количество детей с репликацией герпесвирусов сократилось в 3,4 раза (p < 0,05), а при микст-ГВИ (Г2) – в 2,1 раза (p < 0,05). Таким образом, показано уменьшение репликативной активности герпесвирусов, при этом более значимое у иммунокомпрометированных детей с моно-ГВИ. Наиболее эффективной иммунотерапия оказалась при хронической активной ЦМВ-инфекции. Клиренс ВЭБ и ВГЧ-6 происходил медленнее. Необходимо отметить, что после иммуномодулирующей терапии детекция ДНК герпесвирусов (ВЭБ, ЦМВ, ВГЧ-6) имела место только в одном локусе (слюна или соскоб из носоглотки) в отличие от периода до лечения, когда герпесвирусы выделялись из нескольких локусов (слюна, соскоб из носоглотки, кровь, моча).
Кроме того, через год наблюдения в Г2 значимо сократились количество детей с обострением орофациальной формы хронической рецидивирующей ВПГ-1/2-инфекции (с 36 до 16%) и частота обострений (в 2,7 раза) (p < 0,05). Через восемь – десять месяцев после проведенного лечения эпизоды обострений хронической рецидивирующей ВПГ-1/2-инфекции были единичными.
Длительность клинически благополучного периода увеличилась вследствие уменьшения выраженности интоксикационного синдрома, а также сокращения частоты рекуррентных ОРВИ (в четыре раза в Г1 и в семь раз в Г2) и их продолжительности.
Использование фГП в послеоперационном лечении у иммунокомпрометированных детей с ОДП (Г3) привело к регрессу воспалительного процесса в виде улучшения сатурации с дальнейшим уменьшением уровня дыхательной недостаточности, исчезновения инфильтрации и деструкции легочной ткани, санации респираторного тракта с улучшением эвакуации мокроты, раннему купированию интоксикационного синдрома и отсутствию послеоперационных осложнений. Кроме того, была оптимизирована антибактериальная терапия. Так, сократились количество курсов антибактериальной терапии и потребность в антибактериальных препаратах из группы резерва, что способствовало уменьшению риска их негативного влияния на мукозальный и системный иммунитет, микробиом всех слизистых оболочек, а также сроков послеоперационной реабилитации.
Обсуждение результатов
В Г2 у детей с хронической рецидивирующей активной микст-ГВИ и рекуррентными ОРВИ при большей вирусной нагрузке, чем в Г1 у детей с хронической активной моно-ГВИ и рекуррентными ОРВИ, не отмечено изменения взаимоотношений между сторожевой и незрелой субпопуляциями НГ. Однако в обеих группах исследования происходило значительное изменение интенсивности экспрессии поверхностных мембранных рецепторов. Так, в обеих субпопуляциях НГ наблюдалось преобладающее снижение плотности экспрессии мембранных молекул CD32 и CD16. Данные изменения фенотипической характеристики субпопуляций НГ при вирусных инфекциях свидетельствуют о снижении возможности НГ осуществлять эффекторные функции (фагоцитоз, микробицидная активность), направленные на элиминацию вирусов. Нарушение эффекторных функций сторожевой и незрелой субпопуляций НГ обусловливает длительную персистенцию герпесвирусов и возникновение рекуррентных ОРВИ у детей. Полученные данные подтверждают результаты наших более ранних исследований, продемонстрировавших негативную трансформацию фенотипа субпопуляций НГ, сочетающуюся с дефектами их фагоцитарной и микробицидной активности у иммунокомпрометированных детей с хронической активной ГВИ [22].
Использование в настоящем исследовании дифференцированного подхода к назначению таргетной иммуномодулирующей терапии не повлияло на изменение взаимоотношений между субпопуляциями CD64-CD16+CD32+CD11b+ НГ и CD64+CD16+CD32+CD11b+ НГ при моно- и микст-ГВИ. При этом у детей с хроническими активными моно- и микст-ГВИ после проведения иммуномодулирующей терапии не увеличилось количество субпопуляции CD64+CD16+CD32+CD11b+ НГ, повышение которой имеет диагностическое значение при бактериальных инфекциях. В то же время представляется важным статистически значимое повышение экспрессии мембранных CD32 и CD16 в негативно измененном фенотипе субпопуляции CD64+CD16+CD32+CD11b+ НГ у детей с моно- и микст-ГВИ после проведения таргетной иммуномодулирующей терапии. Восстановление плотности экспрессии CD32 и CD16 также отмечалось в обеих субпопуляциях НГ – CD64-CD16+CD32+CD11b+ и СD64+CD16+СD32+СD11b+. Кроме того, параллельно наблюдалось увеличение плотности экспрессии активационной мембранной молекулы СD11b в сторожевой субпопуляции НГ, что, вероятно, необходимо для ускорения элиминации вирусов [22] и сопоставимо с положительной клинической динамикой.
Проведение таргетной иммуномодулирующей терапии при бактериальной инфекции (ОДП) способствовало не только восстановлению баланса между субпопуляциями НГ CD64+CD16+CD32+CD11b+ и CD64-CD16+CD32+CD11b+, но и увеличению плотности экспрессии активационных молекул CD16 и CD11b в сторожевой субпопуляции, а также экспрессии мембранных молекул CD64 и CD32 в незрелой субпопуляции.
Позитивные количественные и фенотипические изменения в сторожевой и незрелой субпопуляциях НГ при ОДП способствовали восстановлению их адекватного функционирования и более раннему разрешению гнойно-воспалительного процесса в легочной ткани [23].
Заключение
Нарушение эффекторных функций НГ при хронических активных моно- и микст-ГВИ и бактериальной инфекции (ОДП) ассоциировано с дискордантным изменением взаимоотношения между сторожевой и незрелой субпопуляциями. При вирусных инфекциях изменения взаимоотношений между обеими субпопуляциями НГ не происходит, однако изменяется плотность экспрессии функционально значимых рецепторов в зависимости от уровня вирусной нагрузки, что объясняет несостоятельность НГ в реализации противовирусной защиты. При бактериальной инфекции (ОДП) наибольшую информативность приобретает статистически достоверное увеличение количества незрелой субпопуляции СD64+CD16+СD32+СD11b+ НГ на фоне значимого снижения количества сторожевой субпопуляции СD64-CD16+СD32+СD11b+ НГ.
Проведение иммунодиагностики с оценкой фенотипических характеристик и количества функционально значимых субпопуляций НГ СD64-CD16+СD32+СD11b+ и СD64+CD16+СD32+СD11b+ является перспективным, поскольку позволяет проводить при инфекционно-воспалительных заболеваниях неясной этиологии раннюю дифференциальную диагностику между процессами вирусной и бактериальной этиологии, особенно на ранних этапах развития инфекционного процесса, когда в остром периоде тяжелых как вирусных, так и бактериальных инфекций могут иметь место сходные клинические проявления.
Использование разработанных нами дифференцированных подходов к таргетной иммуномодулирующей терапии позволяет улучшить взаимоотношения между сторожевой и незрелой субпопуляциями НГ у иммунокомпрометированных детей с вирусной (хроническая активная моно- или микст-ГВИ, ассоциированная с рекуррентными ОРВИ) и бактериальной (ОДП) инфекциями, достичь регресса дискордантности во взаимоотношениях между обеими субпопуляциями и на этом фоне восстановления полноценного функционирования НГ с развитием адекватного иммунного ответа, что параллельно сопровождается положительной клинической динамикой как при вирусных, так и при бактериальных инфекционно-воспалительных заболеваниях.
Финансирование
Исследование выполнено в рамках гранта Приоритет 2030-КубГМУ № 1240022900096-3.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
I.V. Nesterova, MD, PhD, Prof., S.V. Kovaleva, MD, PhD, G.A. Chudilova, D.Sc., V.N. Chapurina, PhD, L.V. Lomtatidze, PhD, Yu.V. Teterin
Kuban State Medical University
Peoples’ Friendship University of Russia
Contact person: Irina V. Nesterova, inesterova1@yandex.ru
Dysfunctions of neutrophilic granulocytes (NG) do not provide adequate antimicrobial protection, which leads to the development of acute, severe viral and bacterial infections, often polyetiological, characterized by frequent relapses or chronicity, not responding to standard therapy.
Aim – to clarify the features of the relationship between the two effector subpopulations CD64-CD16+CD32+CD11b+ and CD64+CD16+CD32+CD11b+ neutrophil granulocytes during viral and bacterial infections and to evaluate the effectiveness of differentiated immunomodulatory therapy on the regression of identified discordance in the relationships between these subpopulations.
Material and methods. Immunocompromised children with chronic active herpesvirus infection (HVI) aged 5–8 years were under observation: G1 – mono-HVI (n = 30), G2 – mixed-НVI (n = 50), with bacterial infection 2–5 years: G3 – acute destructive pneumonia (n = 16). The content of NG subpopulations (%) was determined: sentinel CD64-CD16+CD32+CD11b+, immature CD64+CD16+CD32+CD11b+, and receptor expression density.
Differentiated targeted immunomodulatory therapy: G1 – systemic and local therapy with recombinant IFNα2b in combination with antioxidants, inosine pranobex, G2, unlike G1, received additional glucoseaminylmuramyl dipeptide, G3 – hexapeptide.
Results. In children with chronic mono- and mixed-HVI (G1, G2), there is no change in the ratio between the sentinel and immature subpopulations of NG, the expression density of CD32, CD16 decreases. Diagnostically significant for bacterial infection (G3) is a 30-fold increase in the content of CD64+CD16+CD32+CD11b+NG. Immunomodulatory therapy for mono- and mixed-HVI does not affect the ratio of NG subpopulations, but improves their availability of CD32, CD16, while with bacterial infection there is a restoration of the balance between 2 subpopulations of NG and an increase in the expression density of CD16, CD11b.
Conclusion. Immunodiagnostics of CD64-CD16+CD32+CD11b+ and CD64+CD16+CD32+CD11b+ subpopulations of NG in various infectious-inflammatory diseases will allow to specify the presence of viral or bacterial infection. Differentiated approaches to the implementation of targeted immunomodulatory therapy contribute to the elimination of discordance in the relationship between the sentinel and immature subpopulations of NG in immunocompromised children with viral and bacterial infections, restoration of the adequacy of NG response to inflammatory processes of different etiology, which was accompanied by the development of positive clinical dynamics.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.