Индивидуализация лекарственного лечения немелкоклеточного рака легкого
- Аннотация
- Статья
- Ссылки


![Таблица 3. Клинически значимые преимущества комбинации пеметрексед+цисплатин при аденокарциноме и крупноклеточном раке [21].](/upload/resize_cache/iblock/cc0/195_350_1/cc09d21c25886285f750ddc1d4110e41.png)

При немелкоклеточном раке легкого (НМРЛ) общая выживаемость заметно варьирует у разных пациентов. Эти различия могут быть обусловлены не только стадией заболевания, но также индивидуальными особенностями пациента и характеристиками опухоли. На протяжении длительного времени выбор схем и режимов лечения больных НМРЛ носил эмпирический характер. Затем с развитием нового направления — так называемой «таргетной» терапии с использованием препаратов молекулярно-биологического действия – при назначении пациентам гефитиниба и эрлотиниба стали учитывать различные клинические параметры, такие как пол, расовая принадлежность, курение.
Постепенно, с накоплением клинического опыта применения, были определены не только показания для назначения ингибиторов EGFR, но и противопоказания к их применению, в частности для антиангиогенного препарата бевацизумаб (Авастин): кровохарканье, инвазия или тесное прилежание опухоли к крупным сосудам. При выборе препаратов важное значение стали придавать морфологическому типу опухоли. Так, при неплоскоклеточном немелкоклеточном раке легкого наилучшие результаты дает пеметрексед, а также ингибиторы EGFR.
Фундаментальные открытия в области молекулярной биологии позволяют более глубоко понять механизмы канцерогенеза. Выделены десятки генов-супрессоров опухолевого роста, определены основные пути передачи сигнала в клетке. Молекулярная гетерогенность опухоли – главная причина того, что НМРЛ с одной и той же стадией заболевания и гистологическим вариантом опухоли могут иметь различные исходы и по разному отвечать на лечение. В настоящее время существуют реальные возможности для целенаправленной разработки режимов лекарственного лечения с учетом индивидуальных особенностей опухоли и клинической характеристики больных, что в конечном итоге должно привести к повышению эффективности противоопухолевой терапии.
Определение и учет факторов прогноза позволит уже на ранних стадиях болезни выявить высокий риск рецидива и рекомендовать больным адъювантную химиотерапию. Определение молекулярных маркеров опухоли у больных с распространенным НМРЛ позволяет предсказать ответ на конкретный вид лекарственного лечения. Наиболее важными, известными на сегодняшний день маркерами прогноза являются ERCC1, RRM1, EGFR, BRCA1, ТС.
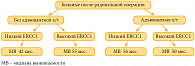
ERCC1 (excision repair cross complementing 1) – фермент репарации ДНК, участвует в удалении нуклеотидов, в том числе поврежденных препаратами платины. Механизмы репарации ДНК чрезвычайно важны для развития резистентности к платиновым производным. Связь между уровнем экспрессии ERCC1 мРНК и резистентностью к цисплатину была подтверждена в клинических исследованиях, в том числе и при НМРЛ [1]. Снижение экспрессии гена ERCC1 при НМРЛ определяет повышенную чувствительность к цисплатину.
Эти данные стали основанием для гипотезы: экспрессия ERCC1 в опухоли может быть индикатором улучшения от цисплатин-содержащей адъювантной химиотерапии НМРЛ. В крупном клиническом исследовании (IALT Bio) по адъювантной терапии НМРЛ у больных со сниженным уровнем белка ERCC1 достигнуто улучшение выживаемости [2]. В контрольной группе, не получавшей химиотерапию, корреляция была обратной: низкий уровень ERCC1 сопровождался снижением выживаемости, возможно, за счет дальнейшего накопления мутаций (рис. 1).
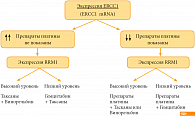
RRM1-регуляторная субъединица рибонуклеотидредуктазы – одна из мишеней гемцитабина. Снижение экспрессии гена RRM1 определяет чувствительность к гемцитабину и ведет к увеличению выживаемости у больных НМРЛ, получающих лечение гемцитабином, особенно в сочетании с цисплатином на фоне сниженной экспрессии гена ERCC1 [3]. Проводятся исследования для проверки клинического значения ERCC1 и RRM1 при НМРЛ и выбора оптимальной комбинации цитостатиков [4].
Алгоритм выбора режима терапии с включением платины и гемцитабина можно представить следующим образом (рис. 2). Одновременно изучаются и другие маркеры – BRCA1, TС. Гиперэкспрессия BRCA1 определяет чувствительность к таксанам, сниженная экспрессия к производным платины. BRCA1 и стадия заболевания могут рассматриваться как независимые предикторы выживаемости – высокий уровень BRCA1 у больных НМРЛ является плохим прогностическим фактором [5].
Эпидермальные факторы роста и их рецепторы (EGFR), активизируя несколько важных нисходящих сигнальных путей в клетке (Ras/Raf/MEK/ERK и пути, включающие фосфатидил-инозитол3-киназу PI3K/Akt и mTOR) регулируют важные механизмы канцерогенеза – пролиферацию, ангиогенез, инвазию, метастазирование – и являются молекулярной мишенью для противоопухолевой терапии. Цетуксимаб – моноклональное антитело к EGFR – в сочетании со стандартной платиносодержащей химиотерапией 1-й линии у больных распространенным НМРЛ улучшает результаты лечения при различных гистологических вариантах опухоли, что подтверждается результатами метаанализа – исследования FLEX, BMS-099, BMS-100, LUCAS [6].
Многоцентровое открытое рандомизированное исследование III фазы FLEX показало достоверное увеличение медианы общей выживаемости – 11,3 мес против 10,1 мес (р = 0.04), непосредственного объективного эффекта с 29% до 36% (р = 0.01), а также повышение показателей однолетней выживаемости с 42% до 47% при добавлении цетуксимаба к стандартной химиотерапии [7]. Однако тщательный анализ зависимости эффективности лечения от морфологического варианта опухоли, а также от мутаций или амплификаций генов EGFR и K-RAS не выявил их значимости в качестве маркеров избирательной чувствительности к цетуксимабу.
Оказалось, что таким клиническим маркером является кожная сыпь, возникающая в 1-й месяц лечения цетуксимабом, а также степень ее тяжести [8]. В ходе исследований было показано, что частота соматических мутаций в киназном домене EGFR при аденокарциноме легкого колеблется от 10 до 30–50% [9]. Мутации чаще встречаются у женщин, некурящих, пациентов монголоидной расы, с чем связана более высокая эффективность ингибиторов тирозинкиназ (ТК) EGFR у этой популяции больных НМРЛ [10–12]. Более 80% мутаций гена EGFR находятся в 19 и 21 экзонах. Мутации EGFR определяют лучший прогноз при НМРЛ и при проведении цитотоксической химиотерапии [13–14]. Гефитиниб и эрлотиниб назначались во 2-й и 3-й линии лечения больных с аденокарциномой легкого. Однако результаты рандомизированного клинического исследования IPASS (Iressa Pan Asia Study) подтвердили целесообразность и преимущество назначения гефитиниба в 1-й линии лечения у больных с мутациями EGFR.
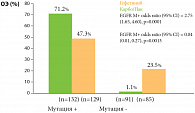
Исследование IPASS проводилось в 87 центрах стран Тихоокеанского бассейна. 1217 не леченных ранее некурящих пациентов с распространенной аденокарциномой легкого было рандомизировано на 2 группы, одна из которых получала гефитиниб (Иресса) 250 мг/сут, вторая – комбинированный режим химиотерапии: паклитаксел 200 мг/м² + карбоплатин AUC5-6 1 раз в 3 недели. Главной целью исследования была оценка выживаемости без прогрессирования, а также частоты объективного ответа, общей выживаемости, качества жизни, безопасности и переносимости терапии. Медиана времени до прогрессирования была одинаковой – 5,7 мес. в группе гефитиниба и 5,8 мес. в группе, получавшей химиотерапию. Объективный эффект был выше при назначении гефитиниба – 43% против 32,2% (р = 0,0001). При сравнении этого же показателя в зависимости от наличия мутации EGFR [15] оказалось, что у больных с мутациями EGFR объективный эффект (ОЭ) в группе гефитиниба был достоверно лучше – 71,2% против 47,3% в группе химиотерапии. Противоположная закономерность наблюдалась при отсутствии мутаций EGFR (рис. 3).
В подгруппе больных (n = 261) с мутациями EGFR выживаемость без прогрессирования была значительно лучше в группе с гефитинибом по сравнению с химиотерапией (HR 0,48; 95% ДИ 0,36–0,64; p < 0,001), и напротив – при отсутствии мутаций EGFR выживаемость без прогрессирования была лучше у больных, получавших химиотерапию (HR 2,85; 95%ДИ, 2,05–3,98; p < 0,001). Однолетняя выживаемость без прогрессирования составила 24,9% у больных, получавших гефитиниб, и только 6,7% у получавших химиотерапию. Следует отметить лучшую переносимость гефитиниба. Таким образом, проведение таргетной терапии ингибиторами тирозинкиназы EGFR в 1-й линии лечения не только показано больным с мутацией EGFR в опухоли, но и имеет значительное преимущество над стандартной химиотерапией. Если статус мутации неизвестен, предпочтение следует отдать химиотерапии.
Эрлотиниб изучался в качестве поддерживающей терапии у больных, ответивших на платиносодержащие режимы в 1-й линии лечения. В исследовании SATURN проводился не только анализ клинических результатов, но и оценка прогностического значения биомаркеров. Оказалось, что поддерживающая терапия эрлотинибом в дозе 150 мг/сут по сравнению с плацебо улучшает выживаемость без прогрессирования с 41% до 45% (HR 0,71; p = 0,000003), общую выживаемость независимо от статуса EGFR (12мес против 11мес), причем разница в выживаемости становится более существенной при длительном приеме эрлотиниба (после 9 мес.) [16]. Наличие мутации KRAS в этом исследовании не имело прогностического значения для терапии эрлотинибом [1]).
Было проведено исследование с целью сравнения эффективности гефитиниба и эрлотиниба во 2-й линии лечения больных с распространенным НМРЛ. Медиана ОВ для обоих препаратов составила 20,4 мес. Достоверных различий во времени до прогрессирования и объективной эффективности отмечено не было [18]. Следует помнить, что максимальное улучшение результатов достигается при длительном лечении ингибиторами TK EGFR. В отделении химиотерапии совместно с лабораторией онкогеномики НИИ канцерогенеза РОНЦ им. Н.Н. Блохина РАМН ведется набор пациентов с распространенным НМРЛ, получающих терапию ингибиторами тирозинкиназы. Оцениваются эффективность и результаты лечения эрлотинибом и гефитинибом в сопоставлении с данными генетического анализа опухолевого материала. Всего в исследование включено 76 пациентов с неоперабельным и рецидивным НМРЛ.
Семьдесят один пациент получал гефитиниб 250 мг (разовая доза) и эрлотиниб 150 мг во 2-й и 3-й линиях лечения после прогрессирования на стандартных режимах химиотерапии. У 5 пациентов ингибиторы тирозинкиназ применялись в 1-й линии лечения в связи ослабленным соматическим статусом и наличием сопутствующей патологии. Лечение проводилось длительно до прогрессирования заболевания или непереносимой токсичности. Объективный эффект отмечен у 13 пациентов (18%), причем у 2-х из них – полный эффект, стабилизация болезни – у 32 пациентов (42%). Контроль роста опухоли составил 60%. Медиана времени до прогрессирования и медиана продолжительности жизни составили 5 мес. и 14,3 мес. соответственно. Нежелательные явления, связанные с проводимой терапией были умеренными. Сыпь и диарея оказались наиболее распространенными побочными эффектами и составили 60% и 20% соответственно.
Для генетического анализа были доступны образцы опухолевой ткани 27 пациентов (35,5%). ДНК выделяли из опухолевых клеток, собранных с помощью микродиссекции из парафиновых срезов биопсий. Методом ПЦР с последующим секвенированием выявляли мутации в экзонах 19 и 21 гена EGFR и в экзоне 2 гена KRAS. Делеции в экзоне 19 EGFR обнаружены у 6 больных аденокарциномой легкого (22%). Мутации KRAS (миссенс-мутации) получены в 4 случаях НМРЛ (15%), а у одного пациента – обе мутации. Ни в одном случае НМРЛ не выявлены точечные мутации в 21-м экзоне EGFR. У 3 пациентов с мутацией EGFR в 19-м экзоне отмечен объективный эффект, а у 2 пациентов возникло прогрессирование заболевания. У 3 пациентов с мутациями KRAS отмечено прогрессирование болезни на фоне приема ингибиторов тирозинкиназ. У пациента с мутациями KRAS и EGFR в опухоли достигнут частичный эффект на фоне приема гефитиниба.
Существуют между тем механизмы устойчивости к ингибиторам EGFR, которая может быть как исходной (первоначальной), так и приобретенной (вторичной). Исходная устойчивость связана с мутацией гена Т790М в 20-м экзоне EGFR, которая наблюдается в 50% случаев устойчивости к ингибиторам EGFR. Предполагается, что мутации KRAS вызывают исходную устойчивость к ингибиторам EGFR. Кроме того, амплификация МЕТ активизирует альтернативный путь передачи сигнала — активация PI3K/Аkt независимо от EGFR. Это наблюдается в 20% случаев устойчивости к ингибиторам EGFR. Существует также прямой путь передачи с тирозинкиназных рецепторов к PI3K/Аkt. Изучаются новые ингибиторы EGFR, которые in vitro ингибируют Т790М (нератиниб, BIBW 2992, ХL647, PF-00299804).
Еще один фермент, имеющий большое прогностическое значение, тимидилатсинтаза (ТС), определяет устойчивость опухоли к фторпиримидинам и антифолатам. Отмечена гетерогенность уровней экспрессии тимидилатсинтазы у пациентов с различными гистологическими вариантами НМРЛ (табл. 2). Как видно из таблицы, минимальная экспрессия ТС определяется в аденокарциноме. ТС является мишенью для целой группы цитостатиков, одним из которых является пеметрексед.
Пеметрексед – мощный ингибитор ТС и других фолат-зависимых ферментов. Помимо ТС мишенью пеметрекседа являются ключевые внутриклеточные фолат-зависимые ферменты: восстановленный переносчик фолатов (RFS), фолилполиглутамат-синтетаза (FPGS), глутамат (GLU), глицинамид-рибонуклеотид-формилтрансфераза (GARFT), дигидрофолат-редуктаза (DHFR), тетрагидрофолат (THF). В перспективе определение этих ферментов также может стать неотъемлемой частью молекулярной диагностики. Наиболее доступным для изучения ферментом в настоящее время является ТС. Пеметрексед в монорежиме рекомендован в качестве 2-й линии химиотерапии при распространенном НМРЛ. Комбинированные режимы, включающие пеметрексед и препараты платины, показали высокие результаты у нелеченых больных НМРЛ.
В рандомизированном сравнительном исследовании изучались два режима химиотерапии – гемцитабин+цисплатин и пеметрексед+цисплатин у нелеченых больных с IIIВ и IV стадиями НМРЛ. Показано достоверное улучшение выживаемости у больных с аденокарциномой и крупноклеточным раком легкого, получавших пеметрексед+цисплатин, что может быть объяснено снижением уровня экспрессии ТС в этих подгруппах [20]. Общая выживаемость была 10,3 мес. в обеих группах, объективный эффект был также сопоставим – 30,6% в группе пеметрексед+цисплатин и 28,2% в группе гемцитабин+ цисплатин, не было достоверных различий и в длительности ответа. Анализ ОВ в зависимости от гистологического варианта опухоли показал преимущество комбинации пеметрексед+цисплатин у больных с аденокарциномомй и крупноклеточным раком легкого.
Результаты исследования служат основанием для предпочтительного выбора режима пеметрексед+цисплатин в качестве 1-й линии химиотерапии у больных с неплоскоклеточным НМРЛ. Пеметрексед исследовали в качестве поддерживающей терапии у больных с неплоскоклеточным НМРЛ [22]. В исследовании JMEN продемонстрировано его значительное преимущество по сравнению с плацебо – время до прогрессирования составило 4,4 мес. по сравнению с 1,8 мес. (р < 0,00001).
Мы изложили основные известные на сегодняшний день факты, позволяющие по-новому взглянуть на проблему лекарственного лечения НМРЛ на разных стадиях опухолевого процесса и, по возможности, сделать лечение индивидуальным, а следовательно, более эффективным и менее токсичным. На основании вышеизложенного предлагается следующий алгоритм выбора 1-й линии лекарственного лечения неплоскоклеточного немелкоклеточного рака легкого. Полученные экспериментальные данные, а также результаты клинических исследований подтверждают необходимость определения молекулярно-генетического профиля опухоли как для выбора оптимальной тактики лечения на разных стадиях болезни, так и для прогноза в целом. Тесное междисциплинарное сотрудничество клиницистов-онкологов, клинических фармакологов, цитогенетиков, онкогенетиков, молекулярных биологов позволит оперативно внедрять новейшие достижения фундаментальной науки в клиническую практику.
