Иринотекан и производные платины в лечении распространенного и рецидивирующего рака шейки матки
- Аннотация
- Статья
- Ссылки




Особую проблему представляет ведение больных с первично-распространенной формой заболевания, а также пациентов с рецидивом и/или отдаленными метастазами после проведенного ранее радикального лечения, включающего хирургическое вмешательство и химиолучевую или лучевую терапию. Комбинированная химиотерапия является основой лечения больных диссеминированным РШМ. В последнее время в практику вошло большое количество новых эффективных цитостатиков (ингибиторы топоизомеразы-1 – иринотекан, топотекан; таксаны – паклитаксел; антиметаболиты – гемцитабин, капецитабин), которые могут применяться для лечения относительно резистентного к химиотерапии РШМ.
По принятой международной классификации ВОЗ, а также по классификации Международной федерации гинекологов и акушеров (FIGO), стадия злокачественного поражения шейки матки определяется по размерам опухоли, степени вовлечения в процесс влагалища и параметральной клетчатки, предполагающей поражение регионарных лимфоузлов. Регионарными для шейки матки являются лимфатические узлы, расположенные около шейки и тела матки, наружные и внутренние подвздошные, общие подвздошные, крестцовые. По данным Национального института рака, локализованная стадия процесса на момент установления диагноза выявляется у 55%, регионарное распространение – у 32% и наличие отдаленных метастазов – у 8% больных [4].
Метастатическое поражение лимфатических узлов при III стадии установлено у 50–58% больных [5]. Частота рецидива РШМ при IB–II стадии колеблется от 10 до 20%, при IIB–IVA – от 50 до 70% [6]. Пациенты с рецидивом заболевания в малом тазу и/или отдаленными метастазами имеют неблагоприятный прогноз – 1-летняя выживаемость составляет 15–20% [7]. На основании ретроспективного анализа особенностей локализации рецидивов у 240 из 915 больных РШМ было показано, что рецидивы в 36,2% случаев локализовались в параметральной клетчатке, у 23% больных – в области первичной опухоли, переход на тело матки отмечался в 11% случаев, отдаленное органное метастазирование – в 21,4% случаев и в регионарные лимфатические узлы – в 8,7% [4]. Частота регионарного метастазирования коррелирует с прорастанием кровеносных и/или лимфатических сосудов, объемом первичной опухоли и степенью ее злокачественности [8].
Иринотекан в лечении распространенного/рецидивирующего РШМ
Иринотекан – полусинтетический дериват алкалоида камптотецина, экстрагированного из стебля и ствола дерева Camptotheca Acuminata. Иринотекан, поступая в организм, не обладает активным цитостатическим эффектом. Под действием фермента карбоксил-эстеразы, который преимущественно находится в печени, но присутствует и в других тканях, иринотекан превращается в активный метаболит SN-38, который является ингибитором ядерного фермента топоизомеразы-1 и участвует в нарушении синтеза ДНК. Наличие фермента топоизомеразы-1 строго необходимо для проявления цитотоксического эффекта камптотецинов.
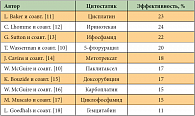
Клинические исследования II фазы выявили определенную эффективность иринотекана в качестве 1–2-й линии терапии метастатического РШМ как в монорежиме, так и в комбинации с другими цитостатиками [10]. Данные представлены в таблице 2. Представленные данные показали относительно низкую эффективность препарата в монотерапии – от 0 до 23,6% положительных ответов опухоли [22]. В связи с этим большое внимание исследователей привлекла комбинация иринотекана с цисплатином, поскольку оба препарата воздействуют на синтез ДНК. В эксперименте был показан синергизм данной комбинации, причем профиль токсичности этих препаратов не совпадает. Данные представлены в таблице 3.
При сравнении различных дозовых режимов иринотекана и цисплатина наиболее эффективной оказалась схема «иринотекан 50 мг/м2 в 1-й день + цисплатин 80 мг/м2 в 1-й день каждые 4 нед.» на фоне использования Г-КСФ в 3–12-й дни каждого цикла. Уровень общего ответа составил 68% (95% ДИ 49–84%). У 19 больных с рецидивом вне зоны облучения и у 3 – в ранее облучаемой зоне уровень ответа составил 74% (95% ДИ 52–89%) и 33% (95% ДИ 10–90%) соответственно. Медиана времени до прогрессирования составила 5,3 мес. (2–23 мес.) [24].
На ASCO 2001 представлены данные рандомизированного многоцентрового исследования II фазы по оценке эффективности комбинации «иринотекан + цисплатин» в сравнении с монотерапией цисплатином у 107 больных распространенным РШМ, 9 из которых не получали предшествующую лучевую терапию (табл. 4).
Было изучено 3 группы больных: первая группа (39 пациенток) получала иринотекан в монорежиме в дозах 250 мг/м2 или 350 мг/м2 1 раз в 3 нед., общий ответ при этом составил 17,1%. Во второй группе больные (27 человек) получали комбинацию иринотекана в дозе 160 мг/м2 или 200 мг/м2 и цисплатина 80 мг/м2 1 раз в 3 нед., что значительно увеличило общую эффективность до 53%. В третьей группе пациенты получали химиотерапию цисплатином по 80 мг/м2 1 раз в 3 нед., уровень общего ответа был несколько выше, чем при использовании иринотекана в монорежиме, и составил 21,1%.
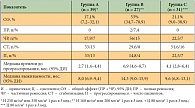
Как видно из данных, представленных в таблице 5, в группе А среднее время до прогрессирования составило 2,7 мес. (от 1,4 до 4,4 мес.), в группе В этот показатель был самым высоким и составил 6,9 мес. (от 4,6 до 8,7 мес.), в группе С – 4,1 мес. (от 2,8 до 6,4 мес.). Результаты проведенного исследования продемонстрировали клинически значимое увеличение эффективности комбинации иринотекана и цисплатина в лечении метастатического РШМ в сравнении с данными препаратами, назначаемыми в монорежиме. Комбинация показала высокую частоту объективных эффектов: 53% против 17,1% и 21% при использовании иринотекана и цисплатина в монорежиме соответственно; увеличение медианы времени до прогрессирования – 6,9 мес. против 2,7 и 4,1 мес., увеличение общей продолжительности жизни – 14,3 мес. против 8,0 и 9,6 мес.
Полученные данные позволяют рассматривать комбинацию иринотекана и цисплатина как потенциально активную схему при лечении диссеминированного РШМ. Использование данной комбинации существенно повышает эффективность терапии, но при этом увеличивается и токсичность. Основными проявлениями токсичности III–IV степени были нейтропения – 46%, диарея – 4%, тошнота и рвота – 5% и 7% случаев соответственно [26].
В исследовании I. Chitapanarux 30 больным местнорецидивирующим и метастатическим РШМ в 1-й линии химиотерапии проводили лечение иринотеканом 60 мг/м2 в 1, 8, 15-й дни в сочетании с цисплатином 60 мг/м2 1 раз в 4 нед. Общая эффективность составила 67%, из них в 7% случаев отмечена полная ремиссия. Медиана времени без прогрессирования составила 13,4 мес., медиана выживаемости – 16,9 мес. Токсичность проявлялась нейтропенией III степени у 30% больных, почечной недостаточностью III степени у 13% и диареей у 17% пациенток [27].
Интересным представляется изучение иринотекана в комбинации с карбоплатином. Представлены данные S. Nori по лечению больных распространенным/рецидивирующим РШМ IVВ степени с использованием схемы «иринотекан 60 мг/м2 в 1, 8, 15-й дни + карбоплатин AUC-5 в 1-й день каждые 4 нед.». Оценены результаты лечения у 33 из 40 пациенток. Средний возраст составил 54 года (35–68). Уровень общего ответа равен 48% (95% ДИ 31–66%), при этом полная регрессия опухоли отмечена у 3 больных (9%) [28]. Уровень эффективности в зависимости от гистологического типа опухоли и локализации рецидива представлен в таблице 5.
Как видно из представленной таблицы, число больных с плоскоклеточным РШМ было больше, чем с аденокарциномой, однако эффективность данного режима оказалась практически одинаковой (48 и 50% соответственно). Схема «иринотекан + карбоплатин» показала свое преимущество при наличии отдаленных метастазов РШМ (эффективность 46%) и отсутствии предшествующей химиотерапии (эффективность 46% и 54% соответственно). Однако токсичность данной комбинации была высокой – нейтропения III–IV степени отмечена у 13 больных (58% случаев), анемия III cтепени – у 13 больных (39%), тромбоцитопения III степени – у 9 пациенток (27% случаев). Негематологическая токсичность представлена диареей III степени у 3 больных (9%).
В другом исследовании E. Nakano и соавт. изучали аналогичный режим химиотерапии распространенного РШМ. Оценено 27 из 39 пролечившихся больных. Общая эффективность составила 31%, при этом у 4 (13%) больных зарегистрирован полный эффект, у 8 (25,8%) – частичный, у 6 (19%) – стабилизация, у 9 (29%) – прогрессирование процесса. Среди гематологической токсичности чаще всего наблюдалась нейтропения III степени – у 33,3% больных, анемия III степени – у 25,6% пациенток. Также были отмечены тошнота и рвота, диарея, слабость. Авторы рекомендуют данный режим в качестве 1-й линии химиотерапии распространенного РШМ, а также считают возможным и удобным его проведение в амбулаторных условиях [29].
В другое исследование P. Fracasso и соавт. было включено 28 больных плоскоклеточным РШМ с измеряемой опухолью, получивших не более 1 курса предшествующей химиотерапии, которая содержала цисплатин или карбоплатин. Оксалиплатин в дозе 130 мг/м2 вводили внутривенно в течение 2 ч в монорежиме. Введения повторялись каждые 21 день до начала прогрессирования опухоли или развития нежелательных явлений, требующих отмены терапии. При этом у 24 больных оценена токсичность и у 22 больных – эффективность. 23 пациентки ранее получали препараты платины. Ответ на терапию был получен только у 2 (8,3%) больных.
У одной больной была достигнута полная ремиссия, продолжавшаяся 2,2 мес., у другой – частичная ремиссия, длившаяся 3,2 мес. У 9 больных (37,5%) выявлена стабилизация опухоли с медианой длительности эффекта 7,6 мес. (от 3,1 до 21,2 мес.). Из проявлений токсичности чаще всего регистрировали анемию, тошноту и рвоту, кумулятивную нейротоксичность. У 3 больных (12,5%) отмечена аллергическая реакция во время инфузии. Авторы пришли к выводу об ограниченной эффективности применявшейся дозировки оксалиплатина при персистирующем или рецидивирующем плоскоклеточном РШМ. В связи с этим перспективным является изучение комбинированных режимов химиотерапии с использованием оксалиплатина в лечении распространенного РШМ [31].
D. Kuo и соавт. изучали эффективность оксалиплатина в комбинации с паклитакселом у больных с рецидивирующим или распространенным РШМ, получавших ранее химиолучевое лечение с использованием цисплатина. Доза оксалиплатина составила 130 мг/м2 в виде в/в инфузии, доза паклитаксела – 175 мг/м2 каждые 21 день. У 16 из 17 исследуемых пациенток оценена эффективность лечения. По гистологическому строению опухоли превалировал плоскоклеточный тип. Средний возраст составил 57 лет (11–51), среднее число лечебных циклов – 3 (от 2 до 8). При оценке эффективности у одной больной зарегистрирован полный эффект, у 4 – частичный эффект, в 4 случаях отмечена стабилизация процесса. Общий ответ составил 29%, время до прогрессирования – 21 неделя (11–51 нед.). Наиболее частыми проявлениями токсичности были лейкопения и нейтропения III степени – у 6 больных – и периферическая нейропатия после 3 циклов химиотерапии – у 3 больных. На основании полученных данных авторами установлена относительно высокая эффективность указанной комбинации, и она была рекомендована для лечения распространенного РШМ [32].
Материалы и методы исследования
В исследование включено 107 больных, получивших 1-ю линию лечения, первичный РШМ диагностирован у 58 (54,2%) пациенток, из них местнораспространенный рак – у 19 (32,8%) и метастатический – у 39 (67,2%) больных. Рецидив РШМ после ранее проведенного первичного лечения был у 49 (45,8%) из 107 пациенток. Из 49 больных локальный рецидив наблюдался у 23 (46,9%), локальный рецидив с отдаленными метастазами – у 26 (53,1%) женщин. Локализация отдаленных метастазов РШМ в изученных группах больных (107) была следующей: забрюшинные лимфоузлы – у 69 (64,5%), паховые лимфоузлы – у 32 (29,9%), надключичные лимфоузлы – у 24 (22,4%), легкие – у 41 (38,3%), печень – у 12 (11,2%), кости – у 5 (4,7%), яичники – у 4 (3,7%), асцит – у 4 (3,7%) пациенток. Метастазы в головной мозг, селезенку и паренхиму почек были у 1, 1 и 1 (0,9%) больной соответственно. Поражение более 3 органов отмечено у 36 (33,6%) из 107 пациенток.
В группе больных (107) с распространенным/рецидивирующим РШМ, получавших 1-ю линию химиотерапии, 49 (45,8%) ранее получили лечение по поводу локализованного рака. При этом среди ранее леченных 49 больных только хирургическое лечение проведено у 9 (18,4%), сочетанная лучевая терапия – у 15 (30,6%), комбинированное лечение – у 15 (30,6%) и комплексное – у 10 (20,4%) больных. Средний возраст больных, включенных в исследование, составил 51 год. Морфологически превалировали плоскоклеточный рак и аденокарцинома – у 100 (93,5%) и 7 (6,5%) пациенток соответственно. Состояние по шкале ECOG 0/1/2 было у 60 (56,1%), 27 (25,2%) и 20 (18,7%) из 107 больных соответственно. Распределение больных по стадиям на момент установления диагноза (107 чел.) было следующим: I стадия – у 17 (15, 9%), II – у 18 (16,8%), III – у 27 (25,2%) и IV – у 45 (42,1%) больных.
У 56 (52,3%) из 107 женщин отмечался хронический болевой синдром, 20 (18,7%) пациенток получали наркотики, и их статус на момент начала лечения соответствовал II степени по шкале ECOG. У 34 (31,8%) из 107 пациенток до включения в исследование отмечался лимфостаз нижних конечностей различной степени выраженности, связанный с метастатическим поражением органов малого таза и/или забрюшинных лимфоузлов. Еще у 23 (21,5%) из 107 женщин была установлена нефростома в связи со сдавлением мочеточников метастазами в парааортальные забрюшинные лимфатические узлы. Кровотечение из опухоли отмечено у 18 (16,8%) из 107 больных до начала лечения.
Режимы химиотерапии
Все больные (107), получавшие 1-ю линию химиотерапии, были разделены на 3 группы. В первой группе 40 пациенток получали лечение по схеме: иринотекан 65 мг/м2 в 1-й, 8-й дни (инфузия внутривенно капельно 30–90 минут) + цисплатин 40 мг/м2 в 1-й, 8-й дни (инфузия внутривенно капельно 30–60 минут + стандартная водная нагрузка 1,5 часа). Циклы повторяли каждые 3 недели. Во второй группе у 35 больных использовался следующий режим: иринотекан 65 мг/м2 в 1-й, 8-й дни + карбоплатин (AUC-2) в 1-й, 8-й день каждые 3 недели. В третьей группе 32 пациентки получали лечение по схеме: иринотекан 120 мг/м2 в 1-й день + оксалиплатин 85 мг/м2 в 1-й день каждые 2 недели.
Результаты исследования
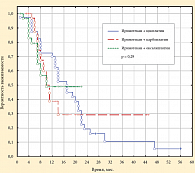
Результаты 1-й линии лечения представлены в таблице 6. Общая эффективность лечения составила 45% и 45,7% соответственно среди больных, получавших комбинации «иринотекан + цисплатин» и «иринотекан + карбоплатин». В третьей группе больных, получавших иринотекан и оксалиплатин, объективный эффект составил 40,6%. При этом наиболее часто (12,5% больных) полный ответ отмечен в группе «иринотекан + цисплатин». Контроль роста опухоли (КРО) в изученных группах пациенток статистически достоверно не отличался и составил 80–82,5%. Графики Каплана – Майера, отражающие общую выживаемость в изученных группах больных распространенным/рецидивирующим РШМ (n = 107), представлены на рисунке 1.
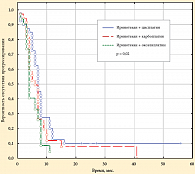
Медиана общей выживаемости в группе «иринотекан + цисплатин» составила 17 мес., а в группах «иринотекан + карбоплатин» и «иринотекан + оксалиплатин» – 10 и 10 мес. соответственно. Различия между группами статистически незначимы. График, отражающий выживаемость без прогрессирования в трех группах по Каплану – Майеру, представлен на рисунке 2 (n = 107). Как видно из представленного графика, медиана выживаемости без прогрессирования в группе «иринотекан + цисплатин» составила 6 мес., а в группах «иринотекан + карбоплатин» и «иринотекан + оксалиплатин» – 7 и 4 мес. соответственно. Достоверные статистические различия получены между группами «иринотекан + цисплатин» и «иринотекан + оксалиплатин» (p = 0,001, Лог-Ранг тест).
На основании полученных данных можно сделать вывод о том, что при лечении распространенного/рецидивирующего РШМ комбинацией «иринотекан + карбоплатин» выявлена эффективность, сравнимая с режимами терапии «иринотекан + цисплатин» и «иринотекан + оксалиплатин», которая составила 45,7%, 45% и 40% соответственно. Медиана общей выживаемости больных в группе «иринотекан + цисплатин» выше таковой в группе «иринотекан + оксалиплатин» – 17 мес. против 10 и 10 мес. соответственно.
Токсичность предложенных режимов химиотерапии оценена у всех 107 пациенток. Наиболее частыми проявлениями гематологической токсичности были лейкопения и нейтропения. Лейкопения отмечена у 89,5% больных, получавших иринотекан и цисплатин, у 99,9% пациенток, получавших иринотекан и карбоплатин, и у всех пациенток, получавших иринотекан и оксалиплатин. Преимущественно регистрировались лейкопения и нейтропения I и II степени. Нейтропения III и IV степени чаще была в первой группе больных, получавших иринотекан и цисплатин, – у 40% пациенток. В двух других группах нейтропения III и IV степени встречалась реже – у 31,6% и 28,2% пациенток. Различия между группами статистически незначимы. Случаев фебрильной нейтропении зарегистрировано не было. Все виды гематологической токсичности были обратимы.
Максимальный процент тяжелой анемии III и IV степени был в первой группе – у 20% больных. Тромбоцитопения IV степени зарегистрирована у 1 (2,9%) больной в группе «иринотекан + карбоплатин», в связи с чем лечение было остановлено. Анализ желудочно-кишечной токсичности ПХТ 1-й линии терапии показал, что процент тошноты I и II степени статистически не отличался в группах пациенток, получавших комбинации «иринотекан + цисплатин», «иринотекан + карбоплатин» и «иринотекан + оксалиплатин» (80%, 91,4% и 71,9% больных соответственно). Рвота I и II степени чаще была во второй группе – у 97,1% женщин, промежуточное положение занимает первая группа – 75% больных, и минимальные проявления были в третьей группе – у 68,7% пациенток.
Тяжелая тошнота III–IV степени в первой группе была у 20% пациенток, рвота – у 15% больных. В двух других группах токсические явления III и IV степени встречались реже – тошнота составила 8,6% и 9,3% соответственно и рвота – 2,9% и 3,1% соответственно. Диарея I и II степени реже встречалась в группах «иринотекан + цисплатин» и «иринотекан + оксалиплатин» – у 30% и 59,3% больных соответственно, максимальный процент диареи I и II степени зарегистрирован в группе «иринотекан + карбоплатин» – у 97,1% женщин. Диарея IV степени была у одной женщины в группе «иринотекан + цисплатин» и еще у одной – в группе «иринотекан + карбоплатин».
Нефротоксичность I и II степени выявлена у 10% больных в первой группе, у 17,1% пациенток во второй группе и у 18,8% женщин в третьей группе. Различия между группами статистически незначимы. Периферическая нейропатия I и II степени зарегистрирована у 50% женщин, получавших комбинацию «иринотекан + оксалиплатин», в группе с карбоплатином этот процент был выше и составил 68,5% женщин, в группе с цисплатином показатель был минимальным – 15% больных. Тяжелой нефротоксичности и полинейропатии III–IV степени не отмечено ни в одной из представленных групп.
Таким образом, токсичность III–IV степени чаще встречалась в группе «иринотекан + цисплатин», а в группах «иринотекан + карбоплатин» и «иринотекан + оксалиплатин» данные нежелательные явления встречались реже, и статистических различий между ними не было.
На основании полученных данных можно сделать вывод о том, что режимы комбинированной химиотерапии на основе иринотекана и производных платины эффективны при распространенном/рецидивирующем РШМ в качестве 1-й линии лечения, что позволяет получить объективный эффект (полная + частичная регрессия) у 40–45,7% больных с медианой времени до прогрессирования от 4 до 7 мес. Изученные режимы (иринотекан + цисплатин, иринотекан + карбоплатин, иринотекан + оксалиплатин) по своей противоопухолевой активности существенно не различались, однако характеризовались разной переносимостью. Максимальная эффективность 1-й линии химиотерапии распространенного/рецидивирующего РШМ достигнута при использовании комбинации «иринотекан + цисплатин». Общий ответ составил 45%, включая 12,5% полных и 32,5% частичных регрессий. Медиана времени до прогрессирования равна 6 мес., медиана общей выживаемости – 17 мес. Режимы химиотерапии «иринотекан + карбоплатин» и «иринотекан + оксалиплатин» обладают равной эффективностью. Общий ответ на лечение составил 45,7% и 40% соответственно, включая 8% и 9,4% полных регрессий соответственно. Медиана времени до прогрессирования равна 7 и 4 мес. соответственно. Медиана общей выживаемости составила 10 и 10 мес. соответственно.
