количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Теория
Инфекции мочевыводящих путей при беременности
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Акушерство и гинекология" № 3 (35)
- Аннотация
- Статья
- Ссылки
- English
В статье приводятся данные об эпидемиологии, этиологии, патогенезе инфекций верхних и нижних мочевыводящих путей у беременных. Рассматриваются вопросы физиологических изменений мочевыводящих путей в период гестации. Описана клиническая картина бессимптомной бактериурии, острого цистита, хронического пиелонефрита, а также подходы к диагностике и лечению указанных заболеваний. Особое внимание уделено характеристике антимикробных лекарственных средств и фитопрепаратов. Кратко охарактеризованы особенности течения беременности и ведения родов у женщин с инфекциями мочевыводящих путей.
![Таблица 1. Структура возбудителей осложненной внебольничной инфекции мочевыводящих путей (ДАРМИС, 2010–2011) [4]](/upload/resize_cache/iblock/c6f/195_350_1/c6fcb1a154c97bc2c676d4c5f250f212.jpg)
Таблица 1. Структура возбудителей осложненной внебольничной инфекции мочевыводящих путей (ДАРМИС, 2010–2011) [4]
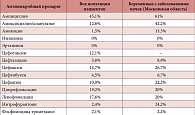
Таблица 2. Резистентность кишечной палочки к антибактериальным лекарственным средствам при осложненной инфекции мочевыводящих путей
![Таблица 3. Фармакокинетические особенности антибактериальных лекарственных средств при инфекции мочевыводящих путей [27]](/upload/resize_cache/iblock/473/195_350_1/473efae5109cf6f85f1b76d09d219d77.jpg)
Таблица 3. Фармакокинетические особенности антибактериальных лекарственных средств при инфекции мочевыводящих путей [27]
![Таблица 4. Схемы антибактериальной терапии бессимптомной бактериурии и острого цистита [14]](/upload/resize_cache/iblock/5bd/195_350_1/5bdc05aa61f753f75bd8ffdbff0d38cc.jpg)
Таблица 4. Схемы антибактериальной терапии бессимптомной бактериурии и острого цистита [14]

Таблица 5. Состав и эффекты препарата Канефрон® Н
![Таблица 6. Схемы антибактериальной терапии гестационного и обострения хронического пиелонефрита [14]](/upload/resize_cache/iblock/64c/195_350_1/64c517a5f5f378ecec46335bef28c18d.jpg)
Таблица 6. Схемы антибактериальной терапии гестационного и обострения хронического пиелонефрита [14]
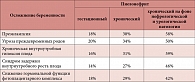
Таблица 7. Частота осложнений беременности в зависимости от формы пиелонефрита
![Таблица 8. Схемы антибактериальной терапии пиелонефрита после родов [14]](/upload/resize_cache/iblock/6ce/195_350_1/6ce9e3afbd1587f9fc1553a2c362afdd.jpg)
Таблица 8. Схемы антибактериальной терапии пиелонефрита после родов [14]
Определение инфекции мочевыводящих путей, факторы риска развития
Инфекция мочевыводящих путей – это группа заболеваний, сопровождающихся микробной колонизацией в моче (свыше 10 000 колоний микроорганизмов в 1 мл мочи) и/или микробной инвазией с развитием инфекционного процесса в какой-либо части мочевой системы – от наружного отверстия уретры до коркового слоя почек [1, 2]. Каждая третья беременная переносит эпизод инфекции мочевыводящих путей. Кратко охарактеризуем несколько факторов риска, предрасполагающих к развитию инфекции мочевыводящих путей во время беременности [3].
Во-первых, анатомо-физиологические особенности женского организма (короткая и широкая уретра, близость уретры к естественным резервуарам инфекции – прямой кишке, влагалищу и «вагинализация» уретры).
Во-вторых, нарушение уродинамики, обусловленное:
- гипотонией и дискинезией/гипокинезией мочевыводящих путей вследствие нарастания концентрации эстрадиола, других эстрагенов и прогестерона, а также повышением концентрации глюкокортикоидов;
- развитием пузырно-мочеточнико-лоханочного рефлюкса;
- механическим сдавлением во второй половине беременности мочеточников увеличенной и ротированной вправо маткой и расширенными яичниковыми венами;
- ослаблением в конце беременности сфинктера уретры.
В-третьих, изменение свойств мочи, проявляющееся щелочной реакцией вследствие бикарбонатурии на фоне свойственного беременности возрастания скорости клубочковой фильтрации.
В-четвертых, различные гинекологические заболевания преимущественно инфекционного генеза и различные заболевания почек и мочевыводящих путей (врожденные аномалии развития, хронический гломерулонефрит, наследственные нефриты, диабетическая нефропатия, интерстициальный нефрит, трансплантированная почка, поражение почек при системных васкулитах и т.д.). Кроме того, ранее перенесенные эпизоды инфекции мочевыводящих путей.
В-пятых, генетическая предрасположенность. Иммунная система человека распознает микробные или вирусные частицы с помощью специальных рецепторов, среди которых важнейшая роль принадлежит так называемым связывающим кишечную палочку Toll-like-рецепторам (TLRs), расположенным в различных отделах нефрона.
Классификация инфекций мочевыводящих путей
По локализации инфекционного процесса различают инфекции нижних (цистит, уретрит) и верхних (пиелонефрит) мочевыводящих путей, по происхождению – внебольничные и внутригоспитальные, по течению – неосложненные и осложненные [1, 4–7]. Разделение инфекций на неосложненные и осложненные в реальной клинической практике часто бывает затруднительным [8, 9]. Только при отсутствии каких-либо нарушений оттока мочи из почек или мочевого пузыря, структурных изменений в почках или мочевыводящих путях, а также серьезных сопутствующих заболеваний можно говорить о неосложненном течении инфекции мочевыводящих путей.
Факторы, осложняющие течение инфекции мочевыводящих путей, многообразны. Признаком осложненной инфекции является нарушение уродинамики, вызванное обструктивными причинами, нейрогенными расстройствами, пузырно-мочеточниковым рефлюксом. Наличие инородных тел (стентов, конкрементов) и операций на мочевыводящих путях в анамнезе, в том числе трансплантация почки, также относит инфекцию в разряд осложненных. Наконец, инфекция признается осложненной при сопутствующих заболеваниях (сахарном диабете, почечной и печеночной недостаточности, иммуносупрессивных состояниях, серповидно-клеточной анемии), инфекциях, передаваемых половым путем, вирусных инфекциях.
Инфекции мочевыводящих путей в период беременности считаются осложненными даже при отсутствии предшествующих урологических и нефрологических заболеваний и сопутствующего заболевания со стороны внутренних органов [10]. Это обусловлено развитием гипотонии и дилатации мочевыводящих путей, а также формированием пузырно-мочеточнико-лоханочного рефлюкса.
Этиология инфекций мочевыводящих путей
Основным возбудителем инфекций мочевыводящих путей является уропатогенная кишечная палочка [2, 11–13].
Сведения о современной структуре возбудителей осложненной внебольничной инфекции мочевыводящих путей, в том числе у беременных (17%), были получены в ходе отечественного многоцентрового исследования ДАРМИС (2010–2011), проведенного в лечебно-профилактических учреждениях 20 городов России, а также Белоруссии и Казахстана [4, 14]. Из всего количества (987) изученных штаммов возбудителей 614 были получены от лиц с осложненной инфекцией мочевыводящих путей (табл. 1).
Результаты исследования ДАРМИС показали, что кишечная палочка по-прежнему является доминирующей в этиологической структуре осложненной внебольничной инфекции мочевыводящих путей, а у беременных она является причиной заболевания в 80% случаев. Кроме того, данное исследование засвидетельствовало у беременных факт отсутствия синегнойной палочки в структуре возбудителей внебольничной инфекции мочевыводящих путей.
Патогенез инфекций мочевыводящих путей
Источником инфекций мочевыводящих путей как у беременных, так и в общей популяции является нормальная микрофлора, колонизирующая периуретральную область. В частности, кишечная палочка представляет собой бактериальный комменсал, то есть непатогенный микроорганизм, живущий за счет макроорганизма, но не приносящий ему вреда.
Инфицирование происходит восходящим путем за счет наличия у уропатогенной кишечной палочки дополнительных факторов вирулентности, которые обеспечивают ей проникновение и нахождение в мочевыводящих путях. К этим факторам относятся:
Инфицирование происходит восходящим путем за счет наличия у уропатогенной кишечной палочки дополнительных факторов вирулентности, которые обеспечивают ей проникновение и нахождение в мочевыводящих путях. К этим факторам относятся:
- фимбрии (пили), которые являются адгезивными органеллами, обеспечивающими связывание бактерий с тканями хозяина;
- жгутик, обеспечивающий потенциальную способность к восходящему распространению по мочевым путям даже в отсутствие обструкции и рефлюкса;
- способность формировать бактериальные сообщества (биопленки) не только на слизистой оболочке мочевых путей, но и внутри эпителиальных клеток мочевого пузыря.
Критерии диагностики инфекций мочевыводящих путей
Диагноз инфекции мочевыводящих путей беременной устанавливается на основании следующих критериев: перенесенная ранее инфекция мочевыводящих путей, клинические симптомы инфекций верхних или нижних мочевых путей (бессимптомное или малосимптомное течение характерно только для хронического пиелонефрита в фазе латентного течения или ремиссии), лейкоцитурия/пиурия и бактериурия. Только выявление лейкоцитурии/пиурии для установления диагноза инфекции мочевыводящих путей недостаточно. Кроме того, источником лейкоцитурии/пиурии могут быть не только мочевые, но и половые органы женщины.
Следует помнить о возможности обнаружения лейкоцитурии/пиурии в отсутствие бактериурии. Такая ситуация может возникнуть при самостоятельно начатом антибактериальном лечении или инфекции мочевыводящих путей, вызванной редкими возбудителями (микобактериями, грибами, хламидиями, уреплазмами, гонококками, вирусом герпеса). В свою очередь лейкоцитурия может иметь место и при неинфекционном почечном заболевании (гломерулопатии, интерстициальном нефрите, врожденных аномалиях развития почек), а также при вагинальной контаминации и гельминтозах [15]. При диагностике инфекций мочевыводящих путей прежде всего следует оценивать не критерий пиурии, а титр бактериурии.
Варианты течения инфекций мочевыводящих путей
Инфекция мочевыводящих путей у беременных может иметь следующие варианты течения [3, 16]:
- бессимптомная бактериурия;
- острый уретрит (негонококковый) – воспаление слизистой оболочки мочеиспускательного канала;
- острый цистит или рецидивирующий цистит – воспаление слизистой оболочки мочевого пузыря;
- пиелонефрит – инфекционно-воспалительное заболевание почек с преимущественным поражением интерстициальной ткани, лоханки и чашечек.
Бессимптомная бактериурия
Бессимптомная бактериурия – это микробиологический диагноз, который основывается на исследовании мочи, собранной с максимальным соблюдением стерильности и доставленной в лабораторию в предельно короткие сроки, чтобы максимально ограничить рост бактерий. Диагноз бессимптомной бактериурии может быть установлен при выявлении 10⁵ КОЕ/мл одного штамма бактерий в двух пробах мочи, взятых с промежутком более 24 часов при отсутствии клинических проявлений инфекций мочевыводящих путей.
Распространенность бессимптомной бактериурии среди беременных колеблется от 1,9 до 9% (в среднем – 6%). В целом все женщины с почечной патологией в период гестации входят в группу риска развития бессимптомной бактериурии.
Бессимптомная бактериурия оказывает негативное влияние на течение беременности, повышая риск развития анемии, преждевременных родов, фетоплацентарной недостаточности, внутриутробного инфицирования плода, перинатальной смертности. У 11–40% женщин с бессимптомной бактериурией развивается гестационный пиелонефрит.
Выработаны следующие рекомендации по диагностике и лечению бессимптомной бактериурии у беременных.
Во-первых, скрининг на бактериурию выполняется как минимум один раз на ранних сроках беременности (12–16 недель) и в случае положительного результата проводится повторный посев мочи на флору. При наличии одного и того же возбудителя в титрах 10⁵ КОЕ/мл и более назначается лечение (степень доказательности А (высокая), уровень рекомендации I (сильный)).
Во-вторых, продолжительность антибактериальной терапии зависит от препарата: или однократный прием, или лечение в течение пяти – семи дней. Антибактериальный препарат выбирается с учетом результатов бактериологического исследования (степень доказательности А (высокая), уровень рекомендации II (средний)). Препаратом первой линии для лечения бессимптомной бактериурии начиная со второго триместра беременности является фосфомицина трометамол.
В-третьих, через семь дней после проведенного лечения необходимо повторить посев мочи на флору и чувствительность к антибактериальным препаратам (степень доказательности А (высокая), уровень рекомендации III (слабый)).
В-четвертых, нет каких-либо данных за или против проведения повторного скрининга на поздних сроках беременности у женщин с отрицательным результатом на бессимптомную бактериурию в ранние сроки гестации.
Как правило, бактериурия выявляется у беременных, страдающих хроническим пиелонефритом [13] и имеющих в анамнезе повторные эпизоды инфекций мочевыводящих путей на фоне врожденных аномалий мочевой системы, диабетической нефропатии, нейрогенного мочевого пузыря (врожденного или приобретенного), мочекаменной болезни, заболеваний, требующих проведения иммуносупрессивной терапии. Кроме того, частота бактериурии у женщин с хроническим гломерулонефритом также высока (45%). Следовательно, пациентки с урологическими или нефрологическими заболеваниями входят в группу риска по присоединению инфекции мочевыводящих путей.
Изолированная бактериурия, определяемая у беременных с хроническим пиелонефритом, не может трактоваться как бессимптомная бактериурия. Ее наличие соответствует латентному течению хронического пиелонефрита.
Острый цистит
Распространенность острого цистита среди беременных составляет 1–2%. Течение острого цистита характеризуется:
- клинической симптоматикой (дизурия, максимально выраженная в конце акта мочеиспускания, частые императивные позывы на мочеиспускание, боль над лобком);
- лейкоцитурией/пиурией (более 10 клеток в 1 мкл нецентрифугированной мочи);
- бактериурией в титре 10² КОЕ/мл (для колиформных микроорганизмов) и 10⁵ КОЕ/мл (для других уропатогенов) в средней порции утренней мочи;
- терминальной гематурией (может отсутствовать).
Клиницисту следует четко определить причину синдрома острой развившейся дизурии, которая может иметь место не только при остром цистите, но и при воспалительных заболеваниях влагалища и мочеиспускательного канала [3]. Наличие бактериурии является определяющим критерием в диагностике острого цистита в отличие от острого уретрита. Острый уретрит имеет сходную клиническую картину, но протекает без бактериурии, его возбудителями могут быть вирусы, гонококки, хламидии, микоплазмы, уреаплазмы.
Антибактериальная терапия инфекций нижних мочевыводящих путей
Антимикробные лекарственные средства являются основным и обязательным компонентом терапии инфекций нижних мочевыводящих путей у беременных. По мнению экспертов Европейской ассоциации урологов, не следует назначать для лечения инфекций мочевыводящих путей антибактериальные препараты, если резистентность уропатогенов к ним превышает 10–20% [10].
Согласно многоцентровому российскому исследованию ДАРМИС (2010–2011) кишечная палочка, выделенная при осложненном течении инфекции мочевыводящих путей, имеет высокую резистентность к ампициллину, ципрофлоксацину, левофлоксацину [4]. Проведенное в Московской области (на базе Московского областного НИИ акушерства и гинекологии) в рамках исследования ДАРМИС определение резистентности кишечной палочки, выделенной у беременных с инфекцией мочевыводящих путей, показало некоторые различия в сравнении с общероссийскими результатами (табл. 2).
Резистентность кишечной палочки оказалась высокой не только к ампициллину, но и амоксициллину/клавуланату, некоторым представителям цефалоспоринов, фторхинолонов, а также нитрофурантоину. Настораживает частота обнаружения штаммов кишечной палочки с продукцией бета-лактомаз расширенного спектра, которая значительно выше в Московской области, чем в целом по России (25 против 9,6%). Это свидетельствует о необходимости пересмотра существующих алгоритмов назначения эмпирической антибактериальной терапии при инфекциях мочевыводящих путей в Московской области. Кроме того, существенная разница между показателями резистентности кишечной палочки к отдельным лекарственным средствам по России и Московской области подчеркивает целесообразность регулярного мониторинга антибиотикорезистентности возбудителей инфекций мочевыводящих путей в каждом отдельно взятом регионе страны.
При проведении антибактериальной терапии инфекций мочевыводящих путей следует учитывать фармакокинетические характеристики препаратов и локализацию инфекции. При инфекциях нижних мочевыводящих путей (бессимптомной бактериурии, цистите) антибактериальные препараты должны создавать высокую концентрацию в моче, при пиелонефрите (остром, активной фазе хронического) – в паренхиме почек, моче и сыворотке крови. Фармакокинетические особенности антибактериальных лекарственных средств в зависимости от варианта течения инфекции мочевыводящих путей представлены в табл. 3.
Безопасность антибактериальных препаратов в отношении плода целесообразно оценивать по классификации, разработанной Управлением США по надзору за качеством пищевых продуктов и лекарственных средств (Food and Drug Administration − FDA) [17, 18].
Для лечения инфекций мочевыводящих путей у беременных следует использовать следующие группы антимикробных препаратов [3, 14, 16, 19]:
- аминопенициллины (с ингибиторами бета-лактамаз);
- цефалоспорины II–IV поколения;
- фосфомицина трометамол;
- азтреонам;
- карбапенемы (в качестве антибиотиков резерва).
При выявлении бессимптомной бактериурии у беременных показано проведение антибактериальной терапии. Адекватная терапия, назначаемая во втором триместре беременности с учетом выделенного возбудителя и его чувствительности к антибактериальным препаратам, уменьшает риск развития пиелонефрита в поздние сроки беременности (почти на 75%), преждевременных родов, внутриутробного инфицирования плода, рождения ребенка с низкой массой тела, а также неонатальной смертности.
Препаратом выбора при лечении бессимптомной бактериурии беременных и острого неосложненного цистита начиная со второго триместра беременности является фосфомицина трометамол. Фосфомицина трометамол представляет собой производное фосфоновой кислоты и является природным антибиотиком с широким спектром антибактериального действия. Он обладает бактерицидным эффектом за счет, во-первых, торможения начальных этапов синтеза пептидогликана клеточной стенки бактерий и, во-вторых, препятствия адгезии уропатогенных штаммов к клеткам эндотелия мочевыводящих путей. Для него характерно отсутствие перекрестной устойчивости с другими антибиотиками.
Назначение беременным с бессимптомной бактериурией фосфомицина трометамола в однократной дозе 3 г (желательно на ночь) высокоэффективно – излеченность составляет 93%.
Преимуществом бета-лактамных антибиотиков, в том числе цефалоспоринов, является их высокая клиническая и микробиологическая эффективность, а также высокая безопасность. Многоцентровое рандомизированное сравнительное исследование семидневного лечения бессимптомной бактериурии (цефиксим 400 мг/сут однократно и амоксициллин/клавуланат 625 мг три раза в сутки) выявило частоту эрадикации уропатогенов в 98,1% случаев для цефиксима и 96,6% – для амоксициллина/клавуланата (различия недостоверны). Однако частота развития нежелательных явлений у пациенток, принимавших цефиксим, была значительно меньше, чем у пациенток, принимавших амоксициллин/клавуланат (1,7 и 17% соответственно, р < 0,05). Кроме того, при назначении амоксиклава беременным повышается риск развития некротических энтероколитов у недоношенных новорожденных.
Безопасность фурадонина (нитрофурантоина) при беременности доказана в больших популяционных исследованиях, однако его следует отменить за две-три недели до родоразрешения вследствие угрозы развития гемолитической анемии у плода.
Схемы антибактериальной терапии бессимптомной бактериурии и острого цистита, указанные в Российских национальных рекомендациях 2014 г., представлены в табл. 4.
Через 7–14 дней после первого курса антимикробной терапии бессимптомной бактериурии проводят микробиологическое исследование мочи. Если возбудитель не выявлен, лечение завершается. При обнаружении возбудителя назначается повторный курс терапии с бактериологическим контролем, который проводится ежемесячно до наступления родов даже при отсутствии возбудителей в моче. При наличии патогенных микроорганизмов после повторного курса терапии назначают супрессивную терапию до срока родоразрешения и в течение двух недель после родов: фосфомицина трометамол 3 г каждые десять дней или нитрофурантоин 50–100 мг один раз в сутки. Супрессивная терапия при рецидивирующем цистите включает либо прием 250 мг амоксициллина/цефалексина в течение одного месяца или посткоитально до родов, либо фосфомицина трометамол 3 г каждые десять дней до родов. В то же время, по мнению некоторых специалистов, у беременных с рецидивирующим циститом чрезмерное употребление антимикробных препаратов нецелесообразно, эффективнее назначать курс лечения антибактериальными препаратами только в период обострения цистита во избежание роста резистентности возбудителей.
Фитопрепараты в лечении инфекций нижних мочевыводящих путей
Важным преимуществом лекарственных средств растительного происхождения является их безопасность. Фитотерапия назначается в фазе активного воспаления в комбинации с антибактериальными препаратами, в фазе ремиссии для пролонгирования терапевтического эффекта, а также с целью профилактики развития инфекций мочевыводящих путей у беременных, имеющих воспалительные урологические заболевания в анамнезе. В фазе активного воспаления могут назначаться отвары толокнянки, шалфея, шиповника, зверобоя, крапивы, ромашки, полевого хвоща, в период ремиссии – одуванчика, березовых почек, ромашки, крапивы, брусники. К травам, противопоказанным в период беременности, относятся барбарис, дымянка, цимицифуга, можжевельник, ламинария, полынь, мята болотная, сангвинария.
Из официнальных фитопрепаратов показано применение препарата Канефрон® Н (фармацевтическая компания «Бионорика СЕ», Германия), который представляет собой комбинированное лекарственное средство растительного происхождения. В состав препарата входит трава золототысячника, корень любистока и листья розмарина. Благодаря содержанию нескольких активных веществ (фенокарбоновых кислот, эфирных масел, фталидов, флавоноидов) Канефрон® Н обладает разнонаправленным лечебным действием – диуретическим, спазмолитическим, антибактериальным, сосудорасширяющим, противовоспалительным, антиоксидантным, нефропротективным и антиадгезивным (подавляет адгезию уропатогенной кишечной палочки к клеткам мочевого пузыря) (табл. 5) [20].
Анализ безопасности и клинической эффективности препарата Канефрон® Н в акушерской практике показал отсутствие тератогенного, эмбриотоксического и фетотоксического эффектов, что позволяет применять его в комплексном лечении инфекций мочевыводящих путей на любых сроках беременности. Результаты многоцентрового исследования по применению препарата Канефрон® Н у 550 беременных не выявили признаков его фетотоксического действия [20]. Суммарные эффекты препарата Канефрон® Н (улучшение почечного кровотока с усилением клубочковой фильтрации, положительное влияние на уродинамику, антибактериальные и противовоспалительные свойства, стимуляция восстановительных процессов в почечном эпителии) в сочетании с высокой степенью безопасности обусловливают его использование у беременных в лечении и профилактике рецидивирования хронических и острых инфекций мочевыделительной системы.
Препарат Канефрон® Н (по два драже три раза в сутки) показан после проведения адекватной антибактериальной терапии по поводу острого цистита, обострения хронического цистита, острого пиелонефрита или активной фазы хронического пиелонефрита на этапе долечивания или в качестве средства для профилактики рецидивов вышеуказанных заболеваний.
Эффективная профилактика препаратом Канефрон® Н достигается при длительном применении – не менее трех-четырех месяцев. Она может проводиться непрерывно вплоть до родоразрешения или прерывистыми курсами с перерывом в две-три недели.
Пиелонефрит
Классификация
Пиелонефрит – неспецифический инфекционно-воспалительный процесс с первоначальным и преимущественным поражением интерстициальной ткани, чашечно-лоханочной системы и канальцев почек с последующим вовлечением клубочков и сосудов – в период беременности может протекать в двух формах:
1) острый необструктивный и обструктивный пиелонефрит беременной (гестационный пиелонефрит, стадия серозного и гнойного воспаления);
2) хронический пиелонефрит (фаза активного течения – обострение – фаза латентного течения).
Большую часть случаев пиелонефрита составляет гестационный пиелонефрит. Следует отметить: гестационный пиелонефрит – это острый воспалительный процесс, впервые проявившийся во время беременности у женщины, исходно не имевшей урологического заболевания. Следовательно, гестационный пиелонефрит не может быть в стадии ремиссии.
Хронический пиелонефрит в подавляющем большинстве случаев развивается на фоне какого-либо урологического заболевания, которое чаще всего сопровождается нарушением уродинамики. В отдельных случаях хронический пиелонефрит развивается до наступления беременности в результате повторно перенесенных острых пиелонефритов (без урологической патологии). Во время беременности возможно обострение воспалительного процесса в почках, что трактуется как активная фаза хронического пиелонефрита. Хронический пиелонефрит во время беременности может манифестировать эпизодом острого пиелонефрита. Дифференциальная диагностика гестационного пиелонефрита и обострения хронического пиелонефрита основывается на анамнестических данных и результатах лабораторно-инструментального обследования.
Эпидемиология
Согласно отечественным публикациям частота пиелонефрита среди беременных пациенток молодого возраста достигает 15–33,8%. В то же время заболеваемость гестационным пиелонефритом в развитых зарубежных странах составляет в среднем 2%. Эта разница обусловлена прежде всего эффективностью зарубежных медицинских программ, в основе которых выполнение представленных выше рекомендаций по диагностике и лечению бессимптомной бактериурии у беременных.
Гестационный пиелонефрит или обострение хронического пиелонефрита могут возникнуть на любом сроке беременности, но наиболее часто во втором или начале третьего триместра (22–28 недель). Повышают риск развития пиелонефрита бессимптомная бактериурия, перенесенные ранее урологические заболевания, латентно протекающие заболевания почек, интеркуррентные воспалительные заболевания, местные факторы, усугубляющие нарушение уродинамики (крупный плод, узкий таз, многоводие, многоплодие), физические факторы (охлаждение, травма). Развитию пиелонефрита при беременности способствует также нарушение почечного кровотока – венозного оттока, вызванного расстройством уродинамики. Повышение внутрилоханочного и внутричашечного давления обусловливает сдавливание тонкостенных вен почечного синуса и разрыв зон чашечек в области свода, что приводит к попаданию инфекции из лоханки в венозное русло почки [2].
Патогенез
Как уже было сказано выше, возбудитель (чаще всего кишечная палочка) восходящим путем попадает в почку, где взаимодействует с Toll-like-рецепторами. Это вызывает развитие направленной на удаление бактерий из организма воспалительной реакции с активацией различных про- и противовоспалительных цитокинов и хемокинов. Если такая реакция становится сверхмощной, то цитокины и хемокины повреждают почечную ткань с последующим развитием фиброза. Последний является причиной возникновения гипоксии почечной ткани, которая в свою очередь усугубляет интерстициальный фиброз.
Реже возбудитель проникает в почку гематогенным путем, вызывая острый гнойный пиелонефрит в первично неизмененных почках. Такой механизм развития пиелонефрита характерен для плазмокоагулирующего стафилококка и чаще наблюдается у больных сахарным диабетом.
Важная роль в развитии пиелонефрита у беременных отводится изменению неспецифической резистентности и иммунологической реактивности организма. Иммунодефицитное состояние регистрируется практически у каждой женщины. Оно проявляется снижением численности Т-лимфоцитов и увеличением В-лимфоцитов, подавлением фагоцитарной активности лейкоцитов, угнетением неспецифических факторов иммунной защиты (комплемента, лизоцима), нарастанием циркулирующих иммунных комплексов [3, 9, 21].
Клиническая картина
Особенности клинической картины гестационного пиелонефрита зависят от вирулентности возбудителя, степени распространения инфекции, срока беременности, наличия и степени выраженности нарушения пассажа мочи, а также наличия или отсутствия гнойно-деструктивных изменений почечной ткани [3, 21, 22].
Обычно развитию гестационного пиелонефрита предшествует острый цистит, в случае неадекватного лечения которого через два – пять дней уже появляются клинические симптомы пиелонефрита. Для классического течения гестационного пиелонефрита характерны признаки острого воспаления (лихорадка, интоксикация, боль в поясничной области). Пациентки жалуются на повышение температуры тела до 38–40°C, озноб с последующим обильным потоотделением. Подъемы температуры и ознобы повторяются от одного (обычно в вечернее время) до нескольких раз в сутки в зависимости от тяжести заболевания. Женщины также жалуются на головную боль, тошноту, иногда рвоту. При осмотре обращает на себя внимание бледность кожных покровов, учащение дыхания и пульса.
Боль, связанная с растяжением почечной капсулы, чаще локализуется в поясничной области на стороне поражения и в зависимости от стадии распространения воспалительного процесса, наличия препятствий оттоку мочи и деструктивных изменений носит тупой или острый характер. Боль может иррадиировать по ходу мочеточников в паховую область, бедро, промежность, а также в верхнюю часть живота. Боль усиливается при кашле, глубоком дыхании, в положении лежа на спине или на боку, противоположном стороне поражения.
Иногда для облегчения боли пациентки принимают вынужденное положение, наклоняясь в сторону больной почки, или укладываются на этот бок с прижатыми к животу ногами. При наличии препятствий оттоку мочи отмечается снижение диуреза. В случае развития гнойно-деструктивного поражения почки в процесс вовлекается паранефральная клетчатка с появлением напряжения мышц передней брюшной стенки.
При тяжелом течении гестационного пиелонефрита помимо описанной выше симптоматики могут развиваться осложнения беременности, вызванные пиелонефритом: боль внизу живота при угрозе преждевременного прерывания беременности, отеки, нарушения зрения, интенсивная головная боль при преэклампсии. При крайне тяжелом состоянии и нарастающей интоксикации могут присоединиться нарушения гемодинамики в виде тенденции к снижению артериального давления и проявления гепаторенального синдрома. Важным критерием тяжелого прогрессирующего течения пиелонефрита является гемодинамическая нестабильность, свидетельствующая об угрозе развития септического шока. О септическом шоке свидетельствуют выраженная бледность, цианотичность или иктеричность кожных и слизистых покровов, озноб, снижение температуры тела до субфебрильных значений, артериальная гипотензия (артериальное давление менее 90–80 мм рт. ст.) на фоне выраженной тахикардии и олигоанурии [3].
Следует отметить: классическое течение активной фазы хронического пиелонефрита у беременных в последние годы изменилось в сторону малого проявления специфических клинических признаков. Пиелонефрит может протекать при субфебрильной или даже нормальной температуре тела и распознаваться преимущественно при тщательном сборе анамнеза и по лабораторным признакам. Проведенные нами исследования показали, что яркая клиническая картина острой стадии заболевания (боль в поясничной области, повышение температуры тела, дизурические явления) была характерна для 70% пациенток с гестационным пиелонефритом, но только для 30% с хроническим пиелонефритом и лишь для 15% с хроническим пиелонефритом на фоне другого сопутствующего нефрологического или урологического заболевания. Напротив, 33–47% пациенток с хроническим пиелонефритом имели стертую клиническую картину воспалительного процесса без повышения температуры тела и признаков интоксикации.
Существенные коррективы в клиническую картину пиелонефрита вносит сахарный диабет. Так, по нашим данным, острый пиелонефрит или обострение хронического пиелонефрита у беременных с диабетической нефропатией в 17% случаев не сопровождались типичными признаками заболевания – ознобом, повышением температуры тела, болями в поясничной области, дизурическими явлениями и симптомами интоксикации. У таких больных доминировали проявления декомпенсации сахарного диабета: неожиданное ухудшение гликемического профиля, развитие кетоацидоза, появление или быстрое нарастание альбумин- или протеинурии, тошнота, многократная рвота, боль в эпигастральной области, симптомы энтерита или энтероколита, а также обезвоживание организма и электролитные нарушения [2].
Острый пиелонефрит у беременных на третьей и выше стадии хронической болезни почек может проявляться внезапным повышением сывороточной концентрации креатинина и дальнейшим снижением скорости клубочковой фильтрации, присоединением или усугублением артериальной гипертензии, необъяснимым ухудшением общего состояния [2].
Диагностика
Диагноз гестационного пиелонефрита устанавливается на основании клинической симптоматики, лабораторных признаков воспаления, мочевого синдрома и результатов визуализирующих методов обследования.
При выраженной клинической картине пиелонефрита во время беременности постановка диагноза заболевания не вызывает затруднений. При стертой клинической картине ведущими в диагностике пиелонефрита являются результаты лабораторного исследования крови и мочи. В общем анализе крови определяются лейкоцитоз, нейтрофильный сдвиг лейкоцитарной формулы влево за счет увеличения палочкоядерных форм, увеличение скорости оседания эритроцитов. При хронических формах пиелонефрита как в стадии ремиссии, так и в стадии активного воспаления, согласно нашим данным, у 35–38% беременных выявляется относительная или абсолютная лимфоцитопения (менее 18%), что свидетельствует в пользу имеющегося у них иммунодефицита. Постепенно может развиваться гипохромная анемия. К лабораторным признакам воспаления относится также обнаружение в крови острофазовых белков – С-реактивного белка, альфа-1- и альфа-2-глобулинов.
Мочевой синдром характеризуется лейкоцитурией/пиурией (≥ 10 лейкоцитов в поле зрения в 1 мл нецентрифугированной мочи или ≥ 100 в 1 мкл нецентрифугированной мочи), бактериурией (≥ 10⁴ КОЕ/мл), умеренной протеинурией (до 1 г/сут) и микрогематурией. Лейкоцитурия/пиурия подтверждается при исследовании мочи по Нечипоренко: количество лейкоцитов превышает 4 × 10⁹/л (или > 4000 в 1 мл). Для беременных с клинической симптоматикой и лейкоцитурией/пиурией минимальным диагностическим критерием инфицирования мочевыводящих путей служит бактериурия в титре 10³ КОЕ/мл, а при симптомах цистита – 10² КОЕ/мл.
Отсутствие лейкоцитурии не исключает наличия острого пиелонефрита и может иметь место при обструкции мочевых путей, а также при гнойно-деструктивном поражении почки (карбункуле, абсцессе) и минимальном вовлечении в процесс мочевых путей. Только одной лейкоцитурии недостаточно для установления диагнозов гестационного пиелонефрита или обострения хронического пиелонефрита. Всегда требуется уточнение источника лейкоцитурии, который может находиться вне мочевого тракта или не являться следствием его воспаления.
Наличие бактериурии даже в диагностическом титре у беременных с хроническим пиелонефритом также не свидетельствует о его обострении. В данном случае правильнее говорить о латентном течении хронического пиелонефрита (и обязательно проводить лечение бактериурии).
При ультразвуковом исследовании у беременных с гестационным пиелонефритом обнаруживаются относительное увеличение размеров почек, ограничение или отсутствие подвижности, утолщение почечной паренхимы, расширение чашечно-лоханочной системы, неоднородность ее содержимого, изменение эхогенности паренхимы, изменение паранефральной клетчатки за счет ее отека, ограничение подвижности купола диафрагмы, появление жидкости в плевральном синусе. Данные изменения зависят от стадии и формы развития пиелонефрита и должны трактоваться с учетом клинической картины во избежание серьезных диагностических ошибок.
У беременных с хроническим пиелонефритом в период активной фазы воспаления помимо выше описанных изменений в крови и моче могут регистрироваться следующие функциональные расстройства:
- нарушение способности почек к осмотическому разведению и концентрированию мочи (проба С.С. Зимницкого);
- повышение концентрации креатинина в сыворотке крови;
- снижение величины скорости клубочковой фильтрации.
При ультразвуковом исследовании почек визуализируются деформация контура, уменьшение линейных размеров и толщины паренхимы почки. Могут также обнаруживаться конкременты.
Дифференциальная диагностика
Диагноз инфекции мочевыводящих путей (острого пиелонефрита) во время гестации следует дифференцировать:
- с нижнедолевой пневмонией;
- холецисто-панкреатитом;
- сальпингоофоритом, осложненным пельвиоперитонитом;
- преэклампсией (в сроках после 20 недель беременности);
- декомпенсацией сахарного диабета (в случае его наличия), которая всегда возникает на фоне острого пиелонефрита; возможна также манифестация впервые выявленного сахарного диабета при остром пиелонефрите;
- угрозой прерывания беременности и преждевременных родов;
- передозировкой иммуносупрессивных препаратов и отторжением почечного трансплантата у пациенток с почечным трансплантатом.
Осложнения
Гестационный пиелонефрит и хронический рецидивирующий пиелонефрит у беременных могут привести к серьезным осложнениям – инфекционно-токсическому шоку, сепсису, острому почечному повреждению, паранефриту и др. [3, 23–25].
При инфекционно-токсическом шоке эффект терапии определяется адекватным восстановлением уродинамики наряду с противошоковыми мероприятиями. Инфекционно-токсический шок также может быть вызван обструкцией мочевых путей и приемом антибиотиков, обладающих бактерицидным действием, которое приводит к массивной гибели микробов и выбросу эндотоксина. В этой связи главным принципом антимикробной терапии при остром обструктивном пиелонефрите является назначение антибиотиков после восстановления уродинамики.
Острое почечное повреждение развивается не только при двустороннем остром гнойном пиелонефрите, но и при одностороннем гнойно-деструктивном поражении почки из-за токсического влияния на контралатеральную почку. Оно констатируется в следующем случае:
- повышение креатинина сыворотки на 26,5 мкмоль/л и более в течение 48 часов;
- повышение креатинина сыворотки в 1,5 раза и выше по сравнению с исходным уровнем (если это известно или предполагается, что повышение произошло в течение предшествующих семи дней);
- снижение объема мочи менее 0,5 мл/кг/ч в течение шести часов.
Паранефрит всегда развивается вторично на фоне гнойного пиелонефрита, особенно при обструкции мочевых путей. Некротический папиллит может быть осложнением как острого, так и активной фазы хронического пиелонефрита, а также следствием специфического поражения почек (туберкулез). Течение пиелонефрита у беременных может осложниться респираторным дистресс-синдромом с печеночными и гематологическими нарушениями, синдромом чрезмерного растяжения и/или гипертензии почечной лоханки (мочеточников) с разрывом мочевых путей, а также акушерской патологией: преэклампсией, фетоплацентарной недостаточностью и внутриутробным инфицированием.
Лечение
Трудности лечения острого (гестационного) и обострения хронического пиелонефрита во время беременности сопряжены с рядом факторов, таких как высокая вирулентность грамотрицательной флоры, вызывающей заболевание, часто регистрирующаяся полирезистентность этой флоры к антибактериальным препаратам, ограниченный выбор антибактериальных лекарственных средств и наличие иммунодефицитного состояния у беременных.
Лечение острого или активной фазы хронического пиелонефрита у беременных проводится только в условиях стационара. Первый этап предполагает восстановление нормального пассажа мочи по мочевыводящим путям [3]. С этой целью рекомендуются следующие манипуляции. Во-первых, позиционная дренирующая терапия: положение на здоровом боку с приведенными к животу ногами и приподнятым ножным концом кровати или коленно-локтевое положение, что способствует отклонению матки и уменьшению давления на мочеточники. Во-вторых, установка стента желательно с покрытием, который может длительно находиться (четыре – шесть месяцев) в мочевых путях. Стентирование мочевых путей требует строгого соблюдения беременными режима частого мочеиспускания для предотвращения возникновения пузырно-мочеточникового рефлюкса, ежемесячного ультразвукового исследования почек и своевременной замены стентов. Беременные со стентированием мочевых путей должны находиться под динамическим наблюдением уролога вплоть до родов.
Родоразрешение проводится на фоне стентирования мочевых путей, удаление стента выполняется через четыре – шесть недель после родов. В-третьих, чрескожная пункционная нефростомия, основным показанием к которой служит четко выявляемое при ультразвуковом исследовании нарушение оттока мочи по верхним мочевым путям и невозможность по техническим или иным причинам выполнить стентирование верхних мочевых путей. Этот тип восстановления уродинамики является предпочтительным у пациенток с хронической болезнью почек и сахарным диабетом. В-четвертых, открытая нефростомия. Показанием к открытой нефростомии, декапсуляции почки, рассечению или иссечению карбункулов, вскрытию и дренированию абсцессов почки и забрюшинного пространства являются выраженные гнойно-деструктивные изменения в почке на фоне обструкции мочевых путей.
Родоразрешение проводится на фоне стентирования мочевых путей, удаление стента выполняется через четыре – шесть недель после родов. В-третьих, чрескожная пункционная нефростомия, основным показанием к которой служит четко выявляемое при ультразвуковом исследовании нарушение оттока мочи по верхним мочевым путям и невозможность по техническим или иным причинам выполнить стентирование верхних мочевых путей. Этот тип восстановления уродинамики является предпочтительным у пациенток с хронической болезнью почек и сахарным диабетом. В-четвертых, открытая нефростомия. Показанием к открытой нефростомии, декапсуляции почки, рассечению или иссечению карбункулов, вскрытию и дренированию абсцессов почки и забрюшинного пространства являются выраженные гнойно-деструктивные изменения в почке на фоне обструкции мочевых путей.
Острый пиелонефрит беременных требует проведения комплексной терапии, но на результаты лечения оказывают влияние два основных момента: своевременное и адекватное дренирование мочевых путей и стартовая эмпирическая антибактериальная терапия. Антибактериальная терапия должна начинаться сразу после восстановления уродинамики и дренирования гнойных очагов и проводиться на фоне инфузионной терапии (профилактики бактериального шока). Выбор антибактериального лекарственного средства для эмпирического лечения проводится с учетом наиболее вероятного возбудителя. Эффективность терапии оценивается через 48–72 часа. При отсутствии эффекта определяется адекватность дренирования мочевых путей и гнойных очагов и тщательно анализируется применяемая на первом этапе схема антибактериальной терапии. Антибактериальная терапия корректируется после получения результатов бактериологического исследования мочи и крови, забор материалов для которых должен выполняться до начала лечения.
Схемы антибактериальной терапии гестационного и обострения хронического пиелонефрита, приведенные в Российских национальных рекомендациях 2014 г., представлены в табл. 6. Предпочтение следует отдавать внутривенному введению антибиотиков, что позволит быстро создать терапевтическую концентрацию лекарственного средства в паренхиме почек, моче, сыворотке крови. После стабилизации состояния больной целесообразен переход на пероральное применение этого же препарата или препарата, относящегося к этой группе.
В целом длительность антибактериального лечения должна составлять не менее трех недель, поскольку при двухнедельной терапии частота рецидива достигает 60%. При тяжелом течении пиелонефрита и угрозе развития уросепсиса возможно применение карбапенемов, в том числе имипенема, относящегося к С классу безопасности лекарственных средств по классификации FDA. Это возможно, если, по мнению клинициста, ожидаемая польза от применения антибиотика превышает потенциальное отрицательное влияние на внутриутробное состояние плода. Дозы антибактериальных лекарственных средств у пациенток со сниженной функцией почек (хроническая болезнь почек третьей стадии и выше) рассчитываются по скорости клубочковой фильтрации.
К ранним – через 48–72 часа – критериям эффективности антибактериальной терапии пиелонефрита относятся исчезновение болей, прекращение ознобов, снижение лихорадки, уменьшение интоксикации, улучшение показателей анализов крови. К поздним – через 14–30 дней – отсутствие рецидивов лихорадки и отрицательные результаты бактериологического исследования мочи (повторно) на третий – седьмой день после окончания антибактериальной терапии.
Симптоматическая терапия включает потребление жидкости с учетом инфузионной терапии (после восстановления пассажа мочи) до 2,5–3 л/сут, обеспечение ежедневного опорожнения кишечника, коррекцию микробиоценоза влагалища и кишечника, повышение неспецифической резистентности и иммунологической реактивности организма, назначение (по показаниям) десенсибилизирующих, спазмолитических и противоанемических препаратов.
С целью коррекции микробиоценоза желудочно-кишечного тракта в комплекс лечения следует вводить эубиотики в виде живых йогуртовых культур, Лактобактерин по пять доз три раза в день после окончания терапии антибиотиками в течение десяти дней. Хорошие результаты получены при применении клюквенных и брусничных соков в сочетании с культурами лактобацилл. С целью восстановления нормальной флоры влагалища эубиотики применяются в виде вагинальных свечей два раза в сутки в течение 14 дней.
Для коррекции иммунологической реактивности и неспецифической резистентности, а также для профилактики и/или лечения фетоплацентарной недостаточности назначают Кокарбоксилазу, Курантил, Эссенциале Н, Актовегин. Их обычно применяют в течение двух недель в средних терапевтических дозах в период реконвалесценции сразу после обострения пиелонефрита или планово при сроке беременности 23–25 и 29–32 недели. У беременных с хроническим пиелонефритом целесообразно применение указанного комплекса препаратов перед родоразрешением. В качестве иммуномодулятора женщинам с хроническим пиелонефритом с 14 недель гестации целесообразно назначать Виферон – генно-инженерный альфа-2-интерферон, ассоциированный с антиоксидантами. Препарат обладает вирусоцидным, иммуномодулирующим и интерферон-корригирующим действием [2]. При первой манифестации гестационного или обострении хронического пиелонефрита с классическим клиническим течением заболевания Виферон назначают в период реконвалесценции по схеме: 500 тыс. МЕ дважды в сутки ректально в течение десяти дней, далее 500 тыс. МЕ дважды в сутки ректально – два раза в неделю. При хроническом пиелонефрите назначают профилактические курсы 150 тыс. МЕ ректально дважды в сутки в течение десяти дней через каждые четыре – шесть недель.
Особенности течения беременности
Женщины, перенесшие гестационный пиелонефрит и страдающие хроническим пиелонефритом, относятся к группе высокого риска возникновения таких осложнений беременности, как фетоплацентарная недостаточность, синдром задержки внутриутробного роста плода, внутриутробное инфицирование плода, невынашивание, анемия, перинатальная заболеваемость и смертность [3, 24–26]. Проведенные нами исследования подтвердили: степень риска возникновения большинства перечисленных осложнений напрямую зависит от формы пиелонефрита, хотя вероятность неосложненного течения беременности и рождения здоровых детей также не отрицается при любых его формах (табл. 7).
Тяжелая преэклампсия чаще всего развивается у пациенток с хроническим пиелонефритом на фоне врожденных аномалий развития почек и мочевыводящих путей (6%), мочекаменной болезни (10,7%), хронической почечной недостаточности (33%).
Беременные с острым пиелонефритом и его хроническими формами имеют различную степень изменения клеточного метаболизма, гемодинамики и неспецифической резистентности организма. Это в свою очередь влияет на формирование фетоплацентарного комплекса и позволяет прогнозировать частоту перинатальных осложнений и заболеваемости новорожденных. Гестационный пиелонефрит, протекающий без выраженных метаболических и гемодинамических нарушений, приводит к умеренному риску развития перинатальных осложнений, заболеваемость новорожденных соответствует 320‰. При хроническом пиелонефрите, манифестирующем во время беременности на фоне исходных метаболических нарушений и умеренных изменений гемодинамики, риск перинатальных осложнений достаточно высок, а заболеваемость новорожденных составляет 520‰. Для хронического пиелонефрита, протекающего на фоне сопутствующего урологического или нефрологического заболевания, характерны исходно выраженные метаболические, гемодинамические и уродинамические расстройства в организме матери, что приводит к максимальному риску развития перинатальных осложнений: заболеваемость новорожденных достигает 730‰ [2].
С целью профилактики и/или лечения фетоплацентарной недостаточности показано проведение комплекса мероприятий с целью повышения резистентности организма матери к инфекции и снижения выраженности гипоксии плода (назначение Актовегина, Эссенциале Н, Курантила, ксантинола никотината). Применение этих препаратов особо актуально спустя 10–14 дней после острой стадии заболевания, когда развивается так называемая следовая реакция, выражающаяся в снижении продукции плацентарных и плодовых гормонов. При обострении пиелонефрита после 16 недель гестации в связи с высоким риском прерывания беременности в момент обострения обоснованно назначение токолитических препаратов (Гинипрала).
Перинатальные осложнения при инфекциях мочевыводящих путей могут быть достаточно серьезными, что послужило основанием для создания в ряде зарубежных стран специальных программ по выявлению и лечению этой патологии среди беременных. В России в настоящее время подобные программы отсутствуют. Между тем очень важны обследование и лечение пациенток, имеющих почечную патологию, до наступления беременности или в ранние сроки гестации, когда еще возможно скорректировать метаболические, гемо- и уродинамические нарушения.
Мнение о целесообразности прерывания беременности при гнойных формах пиелонефрита в настоящее время пересмотрены. Гнойно-воспалительный процесс в почках после прерывания беременности продолжает прогрессировать и требует того же комплекса лечебных мероприятий, что и во время беременности. В этой связи очевидна возможность сохранения беременности на фоне адекватной и рациональной комплексной терапии пиелонефрита.
Особенности ведения родов
Роды у беременных, перенесших гестационый пиелонефрит или страдающих хроническим пиелонефритом, как правило, протекают самопроизвольно. Индукция родов показана в случае развития острого почечного повреждения, тяжелой преэклампсии, мочекаменной болезни при возникновении почечной колики, не поддающейся купированию, и прогрессирующей фетоплацентарной недостаточности.
Способ родоразрешения выбирается индивидуально. Нефрологическими показаниями к плановому кесареву сечению у пациенток с пиелонефритом служат выраженный гидронефроз с риском разрыва почки в родах, нейрогенный мочевой пузырь, тазовая дистопия почки, препятствующая рождению плода через естественные родовые пути. Показанием к экстренному кесареву сечению может стать сочетание врожденных аномалий развития мочевой системы с аномалиями развития половой системы, однако данный вопрос решается строго индивидуально при наблюдении за развитием родовой деятельности и динамики открытия маточного зева в родах. Пиелонефрит почечного трансплантата не препятствует успешному родоразрешению через естественные родовые пути при их готовности к родам. Если имеются акушерские показания к кесареву сечению, то для того чтобы избежать риска повреждения почечного трансплантата и его мочеточника, желательно присутствие на операции хирурга-трансплантолога.
Для обезболивания у пациенток с гестационным и хроническим пиелонефритом предпочтительно применять длительную эпидуральную анастезию. Такой вид обезболивания показан беременным с хроническим пиелонефритом на фоне сопутствующего урологического или нефрологического заболевания, поскольку эти пациентки изначально имеют выраженные изменения гемодинамики и высокий риск их усугубления в родах.
Показания к прерыванию беременности и экстренному родоразрешению обсуждаются после проведения обследования функции почек в стационарных условиях совместно с нефрологом, урологом и акушером-гинекологом на основании приказа Министерства здравоохранения и социального развития РФ от 3 декабря 2007 г. № 736 «Об утверждении перечня медицинских показаний для искусственного прерывания беременности» [26].
У всех пациенток, перенесших в период беременности гестационный пиелонефрит или обострение хронического пиелонефрита, в послеродовом периоде сохраняется высокий риск возникновения рецидива заболевания. Обычно рецидив пиелонефрита развивается на третьи-четвертые или 12–14-е сутки после родов. Таким женщинам до выписки из родильного дома необходимо провести обследование, включающее общий анализ крови, общий анализ и посев мочи, ультразвуковое исследование почек, матки. С целью профилактики рецидива пиелонефрита назначаются спазмолитические лекарственные средства и растительные уроантисептики (Фитолизин, Канефрон® Н).
Рекомендуемые схемы антибактериального лечения послеродового пиелонефрита представлены в табл. 8. С учетом того что все антибиотики в той или иной степени проникают в грудное молоко, на период проведения антибактериальной терапии необходимо прекращать кормление.
Заключение
Современные успехи диагностики и анестезиологической помощи в акушерской практике, позволяющие проведение паллиативных хирургических вмешательств, существенно изменили подходы к ведению беременных с хроническим пиелонефритом на фоне урологических заболеваний, сопровождающихся нарушением уродинамики.
Соблюдение алгоритма обследования, динамическое наблюдение с ранних сроков гестации, своевременное стационарное обследование и комплексное лечение в зависимости от тяжести заболевания, профилактика рецидивов пиелонефрита, а также профилактика и лечение фетоплацентарной недостаточности позволяют оптимистично относиться к прогнозу беременности и исходу родов у пациенток с различными вариантами течения инфекций мочевыводящих путей.
1. Клинические рекомендации. Урология / под ред. Н.А. Лопаткина. М: ГЭОТАР-Медиа, 2007.
2. Тактика ведения беременных с хронической болезнью почек и бактериурией: пособие для врачей / под ред. Л.С. Логутовой. М., 2012.
3. Орджоникидзе Н.В., Емельянова А.И., Панов В.О. и др. Беременность и роды при заболеваниях мочевыводящих органов / под ред. Г.Т. Сухих. М.: Пресс-меню, 2009.
4. Перепанова Т.С., Козлов Р.С., Руднов В.А. и др. Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов. Российские национальные рекомендации. М., 2013.
5. Акушерство: национальное руководство / под ред. Э.К. Айламазяна, В.И. Кулакова, В.Е. Радзинского и др. М: ГЭОТАР-Медиа, 2009. С. 435–452.
6. Руководство по нефрологии / под ред. Р.В. Шрайера. М: ГЭОТАР-Медиа, 2009. С. 185–226.
7. Экстрагенитальная патология и беременность. Практическое руководство / под ред. Л.С. Логутовой. М.: Литтерра, 2012.
8. Беременность и роды при заболеваниях мочевыводящих органов / под ред. Г.Т. Сухих. М., 2009.
9. Мухин Н.А., Тареева И.Е., Шилов Е.М. и др. Диагностика и лечение болезней почек. М: ГЭОТАР-Медиа, 2011. С. 326–356.
10. Guidelines on the management of urinary and male genital tract infections. European Association of Urology, 2008 // www.uroweb.org/fileadmin/user_upload/Guidelines/The%20Management%20of%20Male%20Urinary%20and%20Genital%20Tract%20Infections.pdf.
11. Алгоритм ведения беременных с инфекциями мочевыводящих путей: Медицинская технология. М.: МАКС-Пресс, 2006.
12. Козырев Ю.В., Густоварова Т.А., Рафальский В.В. и др. Особенности течения беременности, родов, послеродового и раннего неонатального периода на фоне бессимптомной бактериурии // Российский вестник акушера-гинеколога. 2012. № 5. С. 39–43.
13. Никольская И.Г., Будыкина Т.С., Бочарова И.И. и др. Бактериурия у беременных с хронической болезнью почек и осложнения в перинатальном периоде // Российский вестник акушера-гинеколога. 2014. № 1. С. 44–50.
14. Перепанова Т.С., Козлов Р.С., Руднов В.А. и др. Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов. Российские национальные рекомендации. М., 2014.
15. Батюшин М.М., Пасечник Д.Г., Дударева Л.А. Лейкоцитурия: вопросы дифференциальной диагностики // Consilium medicum. 2012. № 7. С. 67–72.
16. Никонов А.П., Асцатурова О.Р., Каптильный В.А. и др. Алгоритмы диагностики и антибактериальной терапии инфекций мочевыводящих путей в акушерской практике // Гинекология. 2005. № 2. С. 100–101.
17. Адамян Л.В., Комиссарова Л.М., Ляшко Л.С. и др. Лекарственные средства в акушерстве и гинекологии. 3-е изд., испр. и доп. М.: ГЭОТАР-Медиа, 2010.
18. Рациональная фармакотерапия в акушерстве, гинекологии и неонатологии: руководство. Т. 1. Акушерство, неонатология / под общ. ред. В.Н. Серова, Г.Т. Сухих. 2-е изд., испр. и доп. М.: Литтерра, 2010.
19. Справочник по антимикробной терапии / под ред. Р.С. Козлова, А.В. Дехнича. Смоленск: MAKMAX, 2013.
20. Серов В.Н., Баранов И.И., Протопопова Н.В. и др. Оценка опыта применения комбинированного растительного лекарственного препарата у беременных (многоцентровое ретроспективное наблюдательное исследование) // Акушерство и гинекология. 2013. № 9. С. 105–112.
21. Нефрология: национальное руководство / под ред. Н.А. Мухина. М.: ГЭОТАР-Медиа, 2009.
22. Нефрология: руководство для врачей / под ред. И.Е. Тареевой. М.: Медицина, 2000.
23. Прокопенко Е.И., Никольская И.Г., Ватазин А.В. и др. Хроническая болезнь почек и беременность: учебное пособие. М., 2013.
24. Dovlatian A.A. Bilateral focal purulent pyelonephritis of pregnancy // Urology. 2007. № 1. P. 14–17.
25. Fisher M.J. Chronic kidney disease and pregnancy: maternal and fetal outcomes // Adv. Chronic Kidney Dis. 2007. Vol. 14. № 2. P. 132–145.
26. Никольская И.Г., Новикова С.В., Баринова И.В. и др. Хроническая болезнь почек и беременность: этиология, патогенез, классификация, клиническая картина, перинатальные осложнения // Российский вестник акушера-гинеколога. 2012. № 5. С. 21–30.
27. Рациональная фармакотерапия в нефрологии: руководство для практикующих врачей / под общ. ред. Н.А. Мухина, Л.В. Козловской, Е.М. Шилова. М.: Литтерра, 2006.
Urinary tract infection under pregnancy
I.G. Nikolskaya, O.N. Vetchinnikova, L.A. Sinyakova, T.S. Budykina
Moscow regional research institute of obstetrics and gynecology
Moscow regional research clinical institute named after M.F. Vladimirsky
Russian medical academy of postgraduate education
Contact person: Irina Georgiyevna Nikolskaya, guzmoniiag@gmail.com
Here, the data about epidemiology, etiology and pathogenesis of the upper and lower urinary tract infections in pregnant women are described. Issues of physiological changes in the urinary tract during gestation period are discussed. Clinical picture of asymptomatic bacteriuria, acute cystitis, chronic pyelonephritis, and approaches to diagnostics and treatment are outlined. Special attention was paid to characterization of antimicrobial medicinal products and herbal medicinal products. Features of pregnancy course and labor management in women with urinary tract infections are briefly characterized.
Новости на тему
11.09.2022 14:00:00
18.08.2022 14:00:00
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.