количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Ингибиторы 5-альфа-редуктазы в современной урологической практике
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Урология и Нефрология" №4
- Аннотация
- Статья
- Ссылки
Известно, что ДГПЖ негативно влияет на качество жизни большинства пожилых мужчин, у некоторых пациентов ДГПЖ принимает осложненное течение. Данные популяционных исследований свидетельствуют о том, что ДГПЖ является прогрессирующим заболеванием. Прогрессирование выражается в ухудшении симптомов, острой задержке мочи (ОЗМ), что приводит к необходимости хирургического вмешательства. В повседневной практике лечение ДГПЖ обычно начинают с медикаментозной терапии; в случае ее неэффективности используют разные варианты хирургического лечения.
Препаратами первого выбора при ДГПЖ являются альфа-адреноблокаторы и ингибиторы 5-альфа-редуктазы. В статье представлены данные о механизме действия, метаболических эффектах, аспектах применения ингибиторов 5-альфа-редуктазы.
Симптомы нижних мочевых путей (СНМП) широко распространены у пожилых мужчин. В последние годы становится очевидным, что в возникновении СНМП играют роль различные патофизиологические механизмы, но доминирующей причиной попрежнему остается доброкачественная гиперплазия простаты (ДГПЖ).
Известно, что ДГПЖ негативно влияет на качество жизни большинства пожилых мужчин, у некоторых пациентов ДГПЖ принимает осложненное течение. Данные популяционных исследований свидетельствуют о том, что ДГПЖ является прогрессирующим заболеванием. Прогрессирование выражается в ухудшении симптомов, острой задержке мочи (ОЗМ), что приводит к необходимости хирургического вмешательства. В повседневной практике лечение ДГПЖ обычно начинают с медикаментозной терапии; в случае ее неэффективности используют разные варианты хирургического лечения.
Препаратами первого выбора при ДГПЖ являются альфа-адреноблокаторы и ингибиторы 5-альфа-редуктазы. В статье представлены данные о механизме действия, метаболических эффектах, аспектах применения ингибиторов 5-альфа-редуктазы.
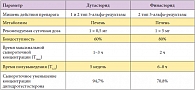
Таблица 1. Фармакокинетические и фармакодинамические отличия дутастерида и финастерида
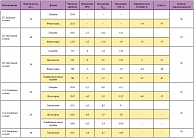
Таблица 2. Данные многоцентровых исследований эффективности медикаментозной терапии в предотвращении прогрессии ДГПЖ
Рост ткани предстательной железы зависит от выработки гормонов и факторов роста. Стероидная 5-альфа-редуктаза – фермент, локализующийся в ядрах стромальных клеток простаты, катализирующий необратимую трансформацию тестостерона в дигидротестостерон. Дигидротестостерон связывается с ядерным андрогенным рецептором в простатических стромальных клетках и приводит к секреции паракринных факторов роста, которые диффундируют из стромы в эпителий простаты, стимулируя рост и дифференцировку клеток. В здоровой предстательной железе поддерживается гомеостаз пролиферативных и апоптотических процессов в эпителиальных и стромальных клетках.
К настоящему времени обнаружено 2 изоэнзима 5-альфа-редуктазы, различающихся по хромосомной локализации генов, паттерну экспрессии в тканях и биохимической активности. 5-альфа-редуктаза 1 типа обладает незначительной активностью в тканях простаты и представлена в основном в коже и печени, 5-альфа-редуктаза 2 типа локализуется чаще всего в предстательной железе. Оба изоэнзима определяются в нормальной простатической ткани, однако при ДГПЖ отмечается их гиперэкспрессия, что приводит к гиперплазии стромальных и эпителиальных клеток в транзиторной зоне и парауретральных железах. При ДГПЖ, в отличие от рака простаты, происходит в основном гиперэкспрессия 5-альфа-редуктазы 2 типа.
Избыточная продукция дигидротестостерона может привести к таким андроген-зависимым состояниям, как доброкачественная гиперплазия простаты (ДГПЖ), рак простаты, акне, алопеция и др. [1]. Таким образом, для лечения этих состояний патогенетически оправданным является назначение ингибиторов 5-альфа-редуктазы. Блокируя 5-альфа-редуктазу, они снижают концентрацию дигидротестостерона, индуцируют апоптоз простатических эпителиальных клеток, при длительном применении уменьшают объем простаты в среднем на 15–25% и увеличивают пиковую скорость мочеиспускания, таким образом устраняя механический компонент обструкции при ДГПЖ. В настоящее время на фармрынке зарегистрированы 2 ингибитора 5-альфа-редуктазы – финастерид и дутастерид. Несмотря на то что оба препарата обладают сходным механизмом действия, существуют некоторые фармакологические и клинические особенности (табл. 1).
Финастерид был синтезирован в 1984 г., разрешен к применению в США для лечения ДГПЖ с 1992 г. Финастерид является конкурентным ингибитором 5-альфа-редуктазы, который обладает гораздо большей аффинностью к 5-альфа-редуктазе 2 типа и образует стабильный комплекс с ферментом. В суточной дозе 5 мг/день финастерид уменьшает уровень дигидротестостерона в простате на 70–90%. Препарат не обладает андрогенными и антиандрогенными эффектами и не влияет на взаимодействие тестостерона и дигидротестостерона с андрогенным рецептором. Сравнительные исследования, оценивавшие интрапростатическую концентрацию дигидротестостерона при применении финастерида и дутастерида, не проводились. По приблизительным данным, интрапростатическая концентрация дигидротестостерона при применении дутастерида уменьшается на 94–95%, а при применении финастерида – на 85–91% [1].
Морфологические и метаболические эффекты ингибиторов 5-альфа-редуктазы Дигидротестостерон, основной фактор экзокринной секреции простатических эпителиальных клеток, является ключевым веществом для образования интрапростатического и сывороточного ПСА. В течение 6–12 месяцев приема ингибиторов 5-альфа-редуктазы уровень сывороточного ПСА снижается на 50%. Это необходимо учитывать при принятии решения о необходимости проведения биопсии простаты. Считается, что критерием для проведения биопсии простаты при приеме ингибиторов 5-альфа-редуктазы является повышение сывороточного уровня ПСА более 0,3 нг/мл от уровня надира. В большом количестве экспериментальных и клинических исследований показано, что ингибиторы 5-альфа-редуктазы уменьшают объем простаты и индуцируют атрофию и апоптоз клеток эпителия при ДГПЖ. Появляется все больше данных о том, что сходные эффекты наблюдаются и при раке простаты. Финастерид дозозависимо уменьшал пролиферацию раковых клеток в клеточных линиях LNCaP. Эти данные индуцировали большое число исследований по применению ингибиторов 5-альфа-редуктазы при РП. Важно, что финастерид снижает экспрессию сосудистого эндотелиального фактора роста (VEGF), ингибируя ангиогенез и значительно уменьшая микрососудистую плотность в простатической субуретральной ткани, что объясняет эффективность финастерида при ДГПЖ, осложненной гематурией, и меньшую кровопотерю при ТУР простаты после терапии препаратом [2].
В последние годы обсуждался вопрос о влиянии финастерида на сперматогенез и безопасность применения препарата мужчинами, чьи сексуальные партнерши беременны. Как упоминалось выше, финастерид разрешен к применению при ДГПЖ с 1992 г., а с 1997 г. финастерид достаточно широко применяется для лечения алопеции в дозе 1 мг в сутки. Это привело к тому, что все большее число мужчин репродуктивного возраста применяют финастерид. В ряде работ показано, что при назначении 1 мг финастерида концентрация сперматозоидов, их подвижность и морфологические характеристики не изменяются [3]. Схожие данные получены при исследовании дозы 5 мг. В США довольно широко обсуждалась возможность накопления ингибиторов 5-альфа-редуктазы в сперме и возможном тератогенном влиянии на плод беременной партнерши. Концентрация финастерида в сперме при ежедневном приеме дозы 5 мг варьировала от неопределяемой до 21 нг/мл. Таким образом, в 5 мл эякулята содержится доза финастерида в 50–100 раз меньшая, чем принимаемая внутрь, и вряд ли оказывает какое бы то ни было влияние на плод. Тем не менее мужчинам, чьи партнерши беременны, рекомендуется принимать финастерид с осторожностью.
Несмотря на то что ингибиторы 5-альфа-редуктазы не обладают антиандрогенным действием, высказывалось опасение о возможных негативных кардиальных и костно-резорбтивных эффектах лечения. В плацебоконтролируемых исследованиях показано, что терапия ингибиторами 5-альфа-редуктазы не оказывает влияния на костную плотность, маркеры костной резорбции, не изменяет липидный и углеводный профили и концентрацию гемоглобина [4]. Ингибиторы 5-альфа-редуктазы в целом хорошо переносятся и вызывают незначительное число побочных эффектов. Большинство побочных реакций наблюдается в первый год терапии, и чаще всего это не приводит к отказу от лечения. Частота развития побочных эффектов на фоне приема дутастерида и финастерида не различается. В 12-месячном исследовании побочных эффектов дутастерида (813 пациентов) и финастерида (817 пациентов) эректильная дисфункция регистрировалась у 7% и 8% больных соответственно, уменьшение либидо – у 5% и 6% соответственно, эякуляторные расстройства – у 1% в каждой группе и гинекомастия – также у 1% в каждой группе [1].
Эффективность монотерапии
Ингибиторами 5-альфа-редуктазы в лечении и предотвращении прогрессии ДГПЖ Финастерид является наиболее изученным ингибитором 5-альфа-редуктазы. P. Boyle с соавт. выполнил метаанализ шести рандомизированных плацебо-контролируемых клинических исследований [5]. Наиболее значимая корреляционная связь была обнаружена между начальным объемом простаты и клиническим улучшением. При начальном объеме простаты менее 20 см3 отмечалось незначительное улучшение: сумма баллов по шкале IPSS уменьшалась на 1,8 балла, скорость мочеиспускания увеличивалась на 0,9 мл/с. Если изначальный объем простаты был более 60 см3, сумма баллов уменьшалась на 2,8 балла, а скорость мочеиспускания увеличивалась на 1,8 мл/с. Разница между группами плацебо и финастерида была очевидна при объеме простаты более 40 см3.
Вслед за результатами этого метаанализа были опубликованы данные 4-летнего использования финастерида в исследовании PLESS (Proscar Long-term Effi cacy and Safety Study) [6]. При приеме финастерида объем простаты сокращался на 18% по сравнению с увеличением на 14% в группе плацебо, уменьшались симптомы при анкетировании IPSS (3,3 балла против 1,3 балла при использовании плацебо), увеличивалась скорость мочеиспускания (3,3 мл/с против 1,3 мл/с).
В последующем стали доступны результаты монотерапии финастеридом в исследовании MTOPS (Medical Therapy of Prostatic Symptoms) – медиана уменьшения объема простаты в группе финастерида составила 19% (против увеличения на 24% в группе плацебо). Также отмечалось значительное улучшение скорости мочеиспускания и уменьшение количества баллов по шкале IPSS [7]. В 12-месячном сравнительном исследовании эффективности финастерида и дутастерида EPICS (Enlarged Prostate International Comparator Study) 1630 пациентов с симптомами ДГПЖ старше 50 лет были рандомизированы в группы финастерида (817 пациентов) и дутастерида (813 пациентов). После года терапии в среднем объем простаты уменьшился на 27,4% в обеих группах. Не было отмечено статистически достоверного отличия в улучшении по шкале IPSS и увеличении Qmax между группами.
Исследование MTOPS стало первым двойным слепым рандомизированным плацебоконтролируемым исследованием, изучившим влияние медикаментозной терапии на прогрессирование ДГПЖ. Клиническая прогрессия заболевания определялась как увеличение суммарного количества баллов по шкале IPSS ≥ 4, развитие ОЗМ, острой почечной недостаточности, связанной с ДГПЖ, рецидивирующих инфекций мочевых путей, недержания мочи. В группе плацебо (737 мужчин) в течение 5 лет наблюдения клиническая прогрессия заболевания регистрировалась у 17% пациентов. Наиболее частым проявлением прогрессии явилось субъективное ухудшение СНМП (увеличение IPSS ≥ 4) – 79,5%, ОЗМ возникла у 2% пациентов из группы плацебо, оперативное вмешательство по поводу ДГПЖ потребовалось 5% больных. За 5 лет наблюдения в группе, не получавшей лечение, объем предстательной железы увеличился на 24%, а уровень ПСА – на 14%.
В исследовании PLESS в группе пациентов, принимавших финастерид, риск ОЗМ уменьшился на 57%, а риск хирургического вмешательства – на 55%. Дутастерид продемонстрировал схожую эффективность в снижении рисков ОЗМ и необходимости хирургического вмешательства. Риск ОЗМ при приеме дутастерида уменьшился на 57%, а хирургического вмешательства – на 48% по сравнению с плацебо [8].
Эффективность комбинированной терапии ингибиторами 5-альфа-редуктазы в лечении и предотвращении прогрессии ДГПЖ Назначение комбинированной терапии ингибитором 5-альфа-редуктазы и альфа-адреноблокатором, которые отличаются по механизму действия и дополняют друг друга, является патогенетически обоснованным. Тем не менее в первых рандомизированных исследованиях при 12-месячном наблюдении не было продемонстрировано преимуществ комбинированной терапии по сравнению с монотерапией альфа-адреноблокатором. В исследованиях PREDICT (доксазозин и финастерид) и Veterans Affairs Cooperative Studies Benign Prostatic Hyperplasia Study (теразозин и финастерид) комбинированная терапия превосходила монотерапию ингибитором 5-альфа-редуктазы, но не показала преимуществ по сравнению с монотерапией альфа-адреноблокатором. Это можно объяснить недолгосрочностью терапии в данном исследовании.
Результаты уже упоминавшегося исследования MTOPS, включавшего 3047 пациентов, подтвердили преимущество длительной (более 4 лет) комбинированной терапии. Несмотря на то что основной целью исследования являлось изучение прогрессирования ДГПЖ на фоне лечения, оказалось, что долгосрочная комбинированная терапия превосходит монотерапию и в уменьшении СНМП, и в улучшении скорости мочеиспускания. За 4 года лечения число баллов по шкале IPSS уменьшилось в среднем на 4,9; 6,6; 5,6; 7,4 в группах плацебо, доксазозина, финастерида и комбинированной терапии соответственно. Скорость мочеиспускания улучшилась на 2,8; 4,0; 3,2 и 5,1 мл/с соответственно. Таким образом, все виды терапии продемонстрировали преимущество над плацебо, терапия альфа-адреноблокатором – над лечением ингибитором 5-альфа-редуктазы, самой эффективной оказалась комбинированная терапия. Это важное исследование также позволило ответить на вопрос о прогрессировании ДГПЖ в разных группах лечения. Риск прогрессирования (усугубление СНМП) в группе комбиниров нной терапии был меньше на 66% по сравнению с 34% и 39% в группах монотерапии финастеридом и доксазозином соответственно. В то же время при оценке риска развития ОЗМ и необходимости хирургического вмешательства оказалось, что именно финастерид, а не доксазозин в качестве моно- или комбинированной терапии значительно уменьшал оба риска.
Частота ОЗМ за время лечения составила 0,2 случая на 100 пациентов в группе финастерида, 0,1 случая на 100 пациентов при комбинированной терапии, 0,4 случая на 100 человек в группе доксазозина и 0,6 случая на 100 пациентов в группе плацебо. Частота хирургических вмешательств по поводу ДГПЖ за время лечения составила 0,5 случая на 100 пациентов в группе финастерида, 0,4 случая на 100 пациентов при комбинированной терапии, 1,3 случая на 100 человек в группе доксазозина и 1,3 случая на 100 пациентов в группе плацебо. Исследователи сделали вывод, что пациенты с СНМП и объемом простаты свыше 30 см3 имеют преимущество при назначении комбинированной терапии по сравнению с любой группой монотерапии.
В 4-летнем исследовании CombAT (Combination Avodart Tamsulosin) [1] изучалось влияние дутастерида, тамсулозина и комбинированной терапии на СНМП и прогрессию ДГПЖ. Также были продемонстрированы преимущества комбинированной терапии по сравнению с монотерапией. В таблице 2 представлены сводные данные по эффективности различных комбинаций препаратов в терапии СНМП и прогрессии ДГПЖ [1].
Возможность перехода на монотерапию ингибитором 5-альфа-редуктазы у пациентов с СНМП
Ингибиторы 5-альфа-редуктазы должны назначаться в течение длительного времени для достижения клинического эффекта, в то время как максимальная эффективность альфа-адреноблокаторов наступает в течение нескольких недель. В исследовании SMART (Symptom Management After Reducing Therapy) изучались эффективность комбинированной терапии дутастеридом и тамсулозином и влияние на СНМП отмены тамсулозина через 6 месяцев лечения. После отмены альфа-блокатора почти три четверти пациентов не жаловались на усиление СНМП. Однако при исходных тяжелых нарушениях мочеиспускания (IPSS > 20) требовался длительный курс комбинированной терапии. В недавно проведенном открытом многоцентровом исследовании оценивали эффективность комбинированного лечения финастеридом и альфа-блокатором в течение 9 месяцев с последующей отменой альфа-блокатора и терапией финастеридом в течение 3 или 9 месяцев. Ни в одной из групп не было зарегистрировано выраженного ухудшения СНМП после прекращения приема альфа-адреноблокатора. Таким образом, у пациентов с легкими и умеренными СНМП через 6–9 месяцев лечения возможен переход на монотерапию ингибитором 5-альфа-редуктазы, в то время как у пациентов с тяжелыми СНМП целесообразно продолжать длительную комбинированную терапию.
Ингибиторы 5-альфа-редуктазы для химиопрофилактики РП Клинические доказательства роли ингибиторов 5-альфа-редуктазы в профилактике рака простаты получены в исследованиях PCPT (Prostate Cancer Prevention Trial) и REDUCE (Reduction by Dutasteride of Prostate Cancer Events). PCPT стартовало в 1993 г. в более 200 центров США. Обязательными критериями отбора для исследования являлись возраст более 55 лет, уровень ПСА ≤ 3,5 нг/мл и отсутствие изменений при пальцевом ректальном исследовании (ПРИ). В начале исследования биопсия простаты не проводилась. Пациенты были рандомизированы на две группы: терапия финастеридом в дозе 5 мг в день и плацебо. Проводились ежегодные исследования ПСА и ПРИ. В случае повышения ПСА более 4 нг/мл или изменений при ПРИ проводилась биопсия простаты. В группе, получавшей финастерид, значение ПСА удваивалось.
В конце исследования через 7 лет всем пациентам была рекомендована биопсия простаты. Всего были рандомизированы 18 882 человека. В группе финастерида было зарегистрировано снижение заболеваемости низкодифференцированным раком простаты на 24,8%. В то же время в группе финастерида был выявлен повышенный риск обнаружения низкодифференцированного рака (280 опухолей с высокими показателями (7–10 баллов) по шкале Глисона в группе финастерида по сравнению с 237 в группе плацебо). Это позволило сделать вывод, что финастерид не должен использоваться для химиопрофилактики РП. Большие надежды связывались с применением двойного ингибитора 5-альфа-редуктазы – дутастерида, влияние которого на развитие рака простаты изучалось в исследовании REDUCE. Однако результаты исследования продемонстрировали аналогичное уменьшение частоты высокодифференцированного рака простаты (22,8%) и сходное увеличение частоты низкодифференцированного РП.
Было проведено несколько дополнительных анализов, чтобы определить истинное влияние ингибиторов 5-альфа-редуктазы на низкодифференцированный рак [9, 10]. К сожалению, данные работы носили ретроспективный анализ, и использование их результатов возможно лишь в качестве предположений, а не четких доказательств. Кроме того, лишь у 27% пациентов с диагностированным раком простаты были доступны морфологические образцы после операции.
В декабре 2010 г. состоялось заседание Управления по контролю за качеством пищевых продуктов и медикаментов США (FDA) по целесообразности применения ингибиторов 5-альфа-редуктазы для профилактики рака простаты [11]. Патоморфологические образцы после исследований PCPT и REDUCE были оценены независимым патологом с учетом модифицированной шкалы Глисона. Однако после повторного анализа биоптатов не было отмечено уменьшения частоты рака простаты с градацией по шкале Глисона от 7 до 10 баллов, в то же время наблюдалось абсолютное увеличение рака простаты с градацией 8–10 баллов по Глисону на 0,5% при применении дутастерида и на 0,7% при применении финастерида. Наблюдалось только уменьшение частоты рака простаты с градацией 6 баллов и ниже по шкале Глисона. В результате ингибиторы 5-альфа-редуктазы не были рекомендованы FDA для рутинного использования в профилактике рака простаты. Бесспорно, проведенные исследования имели ряд эпидемиологических и клинических особенностей, и необходимы дальнейшие исследования, чтобы подтвердить или опровергнуть значение ингибиторов 5-альфа-редуктазы в профилактике рака ростаты.
Заключение
Результаты целого ряда многоцентровых рандомизированных двойных слепых исследований подтвердили эффективность ингибиторов 5-альфа-редуктазы в лечении СНМП и предотвращении прогрессирования ДГПЖ. В настоящее время ведутся клинические исследования других видов комбинированной терапии при ДГПЖ – ингибиторов 5-альфа-редуктазы и М-холиноблокаторов, ингибиторов 5-альфа-редуктазы и ингибиторов фосфодиэстеразы 5 типа. Кроме того, изучается совместное назначение препаратов тестостерона и ингибиторов 5-альфа-редуктазы у пациентов с симптомами гипогонадизма и СНМП на фоне ДГПЖ. В 2009 г. стартовало многоцентровое исследование ARTS (Avodart after Radical Therapy for Prostate cancer Study), в котором изучаются эффективность дутастерида при биохимическом рецидиве после радикальной простатэктомии или лучевой терапии по поводу рака простаты [14], а также возможные преимущества назначения ингибиторов 5-альфа-редуктазы при кастрационнорефрактерном раке простаты. В проблеме химиопрофилактики рака простаты ингибиторами 5-альфа-редуктазы до сих пор остается много вопросов, разрешить которые призваны долгосрочные исследования.
При сравнении двух ингибиторов 5-альфа-редуктазы следует отметить, что данные большинства исследований не продемонстрировали клинического преимущества применения дутастерида у больных ДГПЖ в улучшении СНМП и снижении вероятности прогрессии заболевания. При монотерапии финастерид сокращает объем простаты в среднем на 20%, что приводит к значительному уменьшению механического компонента обструкции при ДГПЖ. Дополнительным преимуществом финастерида является эффективность препарата в лечении ДГПЖ, осложненной гематурией, и возможность его применения в качестве подготовки к ТУР простаты. В исследованиях также подтверждено значительное преимущество использования комбинированной терапии с альфа-адреноблокатором для предотвращения прогрессии ДГПЖ [12], особенно у пациентов с увеличенной предстательной железой (более 30 см3) [13]. Экономическая доступность финастерида по сравнению с дутастеридом позволяет рекомендовать этот препарат для широкого использования в лечении ДГПЖ.
1. Gravas S., Oelke M. Current status of 5α-reductase inhibitors in the management of lower urinary tract symptoms and BPH // World J. Urol. 2010. Vol. 28. P. 9–15.
2. Donohue J.F., Sharma H., Abraham R. et al. Transurethral prostate resection and bleeding: a randomized, placebo controlled trial of the role of finasteride for decreasing operative blood loss // J. Urol. 2002. Vol. 168. P. 2024–2046.
3. Overstreet J., Fuh V., Gould J. et al. Chronic treatment with finasteride daily does not affect spermatogenesis or semen production in young men // J. Urol. 1999. Vol. 162. P. 1295–1300.
4. Amory J.K., Anawalt B.D., Matsumoto A.M. The effect of 5α-reductase inhibition with dutasteride and finasteride on bone mineral density, serum lipoproteins, hemoglobin, prostate specific antigen and sexual function in healthy young men // J. Urol. 2008. Vol. 179 (6). P. 2333–2338.
5. Boyle P., Gould A.L., Roehrborn C.G. Prostate volume predicts outcome of treatment of benign prostatic hyperplasia with Finasteride: meta-analysis of randomized clinical trials // Urology. 1996. Vol. 48. P. 398–405.
6. McConnell J.D., Bruskewitz R., Walsh P. et al. Proscar Long-term Efficacy and Safety Study The effect of Finasteride on the risk of acute urinary retention and the need for surgical treatment among men with benign prostatic hyperplasia. Finasteride Long-Term Effcacy and Safety Study Group // N. Engl. J. Med. 1998. Vol. 338. P. 557–563.
7. McConnell J.D., Roehrborn C.G., Bautista O.M. et al. The long-term effect of doxazosin, Finasteride, and combination therapy on the clinical progression of benign prostatic hyperplasia // N. Engl. J. Med. Vol. 2003. Vol. 349. P. 2387–2398.
8. Roehrborn C.G., Lukkarinen O., Mark S. et al. Long-term sustained improvement in symptoms of benign prostatic hyperplasia with the dual 5alpha-reductase inhibitor dutasteride: results of 4-year studies // BJU Int. 2005. Vol. 96. P. 572–577.
9. Cohen Y.C. et al. Detection bias due to the effect of finasteride on prostate volume: a modeling approach for analysis of the Prostate Cancer Prevention Trial // J. Natl. Cancer Inst. 2007. Vol. 99. P. 1366–1374.
10. Pinsky P., Parnes H., Ford L. Estimating rates of true highgrade disease in the Prostate Cancer Prevention Trial // Cancer Prev. Res. 2008. Vol. 1. P. 182–186.
11. Redman M.W. et al. Finasteride does not increase the risk of high-grade prostate cancer: a bias-adjusted modeling approach // Cancer Prev. Res. 2008. Vol. 1 (3). P. 174–181.
12. Theoret M.R., Ning Y.-M., Zhang J.J. et al. The risks and benefits of 5α-reductase inhibitors for prostate-cancer prevention // N. Engl. J. Med. 2011. Vol. 365 (2). P. 97–99.
13. Theoret M.R., Ning Y.-M., Zhang J.J. et al. The risks and benefits of 5α-reductase inhibitors for prostate-cancer prevention // N. Engl. J. Med. 2011. Vol. 365 (2). P. 97–99.
14. Kaplan S., Lee J., Meehan A. et al. Long-term treatment with Finasteride improves clinical progression of benign prostatic hyperplasia in men with an enlarged versus a smaller prostate: Data from MTOPS Trial // J. Urol. 2011. Vol. 185 (4). P. 1369–1373.
15. Schroder F.H., Bangma C.H., Wolff J.M. et al. Can dutasteride delay or prevent the progression of prostate cancer in patients with biochemical failure after radical therapy? Rationale and design of the Avodart after Radical Therapy for Prostate Cancer Study // BJU International. 2009. Vol. 103 (5). P. 590–596.
16. Bortolato M., Frau R., Orru M. et al. Antipsychotic-like properties of 5-α-reductase inhibitors // Neuropsychopharmacology. 2008. Vol. 33. P. 3146–3156.
Новости на тему
17.02.2023
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.