Ингибиторы протонной помпы в сложных клинических ситуациях. Осенняя сессия Московской школы гастроэнтерологов (11 ноября 2021 г.)
- Аннотация
- Статья
- Ссылки









Ингибиторы протонной помпы: аспекты кардиологической безопасности
С первым сообщением «Ингибиторы протонной помпы. Аспекты кардиологической безопасности» выступил известный американский гастроэнтеролог Майкл Ф. ВАЭЗИ (Michael F. Vaezi), профессор медицины и отоларингологии, заместитель директора департамента гастроэнтерологии, гепатологии и питания Центра клинических исследований и патологии пищевода медицинского центра университета Вандербильта, член Американской ассоциации гастроэнтерологов (Нэшвилл, Теннеси, США).
В начале своего выступления профессор М.Ф. Ваэзи подчеркнул важность темы кардиологической безопасности ИПП – широко применяемых в клинической практике препаратов. В этой связи для прояснения многих вопросов профессор неоднократно обращался к доступной в настоящее время доказательной базе.
М.Ф. Ваэзи представил характеристику ИПП, фокусируясь на постулате о том, что разные ИПП отличаются по фармакокинетическим (ФК) и фармакодинамическим (ФД) параметрам, особенностям метаболизма, силе кислотоподавляющего эффекта, потенциалу межлекарственного взаимодействия. Разнообразие ИПП дает возможность врачу персонифицировать терапию, применяя тот или иной препарат с учетом целей терапии, сопутствующей патологии и фармакотерапии. Первым представителем ИПП является разработанный в конце 80-х гг. омепразол, который показал существенное преимущество в лечении кислотозависимых заболеваний желудка и двенадцатиперстной кишки (ДПК) в сравнении с ингибиторами Н2-рецепторов.
Эффективность длительного применения ИПП оказалась выше даже в сравнении с хирургическим лечением гастроэзофагеальной рефлюксной болезни (эндоскопической фундопликацией), что было подтверждено в пятилетнем сравнительном исследовании. Лучшие результаты были получены у пациентов, получавших эзомепразол, в сравнении с пациентами, перенесшими эндоскопическую фундопликацию. Эффективность ИПП сохранялась на протяжении всего пятилетнего периода исследования без необходимости повышения дозы у большинства пациентов.
Далее профессор М.Ф. Ваэзи остановился на вопросах кардиологической безопасности ИПП, по которым в течение последних десятилетий ведется активная полемика в литературе и на научных площадках. Особенно остро проблемы безопасности применения ИПП стоят в аспекте возможной связи препаратов этой группы с сердечно-сосудистыми (СС) событиями. Все началось с публикации исследования, проведенного на популяции больных с острым коронарным синдромом, которые получали лечение ИПП. Результаты показали, что ИПП ассоциированы с инфарктом миокарда, острым коронарным синдромом и тромбозами стентов, ишемическим инсультом, желудочковой аритмией по типу пируэт и СС-смертью. В отличие от пациентов клиницисты понимают, что ассоциации можно объяснить многими причинами, связанными не с «обвиненным» препаратом, а, например, с другими препаратами сопутствующей терапии, которые пациенты принимают постоянно. К таким средствам относятся противотромбоцитарные препараты (ПТП), например клопидогрел. И действительно, снижение активности клопидогрела на фоне применения ИПП было доказано результатами фармакокинетических исследований и исследований межлекарственных взаимодействий ИПП с ПТП. Клопидогрел, представитель ПТП, не обладает антитромбоцитарным эффектом, этим действием наделен его метаболит, но для такой трансформации клопидогрел должен пройти метаболический путь в печени, взаимодействуя с изоформой цитохрома Р450 – CYP2C19. Большинство ИПП, например омепразол, метаболизируются через этот же путь, что может снижать активность клопидогрела, так как его метаболизм нарушает ИПП, взаимодействующий с той же изоформой цитохрома Р450. Но самое главное состоит в том, что ассоциации не являются эквивалентом причинно-следственной связи.
Эти результаты явились основанием для вынесения FDA предупреждения, суть которого состояла в рекомендации избегать одновременного применения омепразола с клопидогрелом вследствие снижения уровня антитромботической активности метаболита клопидогрела. Информация, касающаяся межлекарственного взаимодействия клопидогрела с другими ИПП, на тот момент времени отсутствовала. В этой связи были проведены дополнительные исследования с целью определения риска серьезных СС-событий на когорте пациентов после чрескожного коронарного вмешательства, применявших клопидогрел совместно с ИПП (пантопразолом и омепразолом) и без ИПП. Результаты показали, что статистически значимых различий в частоте серьезных СС-событий не было в группах пациентов, применявших клопидогрел совместно с ИПП и без ИПП. Помимо этого, был выявлен еще очень важный эффект: у пациентов с СС-заболеваниями, получавших лечение ПТП и ацетилсалициловой кислотой (АСК), на фоне применения ИПП отчетливо снижался риск желудочно-кишечных кровотечений (ЖКК) (отношение шансов (ОШ) 0,50; 0,39–0,65) (рис. 1).
Затем было проведено рандомизированное плацебоконтролируемое исследование COGENT, в которое был включен 3761 пациент с СС-заболеваниями. Все пациенты получали клопидогрел + АСК и рандомизированно омепразол или плацебо. Первичная конечная точка (ПКТ) – частота ЖКК (рис. 2).
Результаты подтвердили отсутствие влияния ИПП на частоту СС-событий (ОШ 0,99; 0,68–1,44). Омепразол продемонстрировал протективный эффект на слизистую оболочку верхних отделов ЖКТ, который выразился в снижении частоты ЖКК.
Далее был проведен метаанализ риска смерти на популяции пациентов, одновременно принимавших ИПП и ПТП. В рандомизированных контролируемых исследованиях (РКИ), включенных в метаанализ, применяли омепразол, эзомепразол, лансопразол и пантопразол. Риски смерти и инфаркта миокарда у пациентов с СС-заболеваниями, получавших антитромбоцитарную терапию, были несущественно ассоциированы с применением ИПП; отношения рисков (ОР) составили 1,5 и 1,3 соответственно, тогда как снижение риска ЖКК было выраженным и статистически значимым.
Совсем недавно было проведено еще одно широкомасштабное РКИ COMPASS на популяции 17 598 пациентов со стабильной стенокардией, рандомизированных в группы пантопразола и плацебо, а также в группы ривароксабана и ривароксобана в сочетании с АСК и группу только АСК.
Результаты этого РКИ показали отсутствие повышения риска СС-событий, а также госпитализаций и смерти от всех причин за трехлетний период наблюдения.
Таким образом, последующие исследования не подтвердили обоснованность потенциальных проблем безопасности применения ИПП у пациентов, получающих терапию ПТП.
При назначении ИПП важно понимать, что препараты этой группы отличаются по своим ФК- и ФД-характеристикам, обладают не только разными кислотоснижающими свойствами, но и разным потенциалом межлекарственных взаимодействий. Рабепразол, например, существенно отличается от других ИПП, что подтверждает доказательная база препарата. В РКИ на группе пациентов, получавших АСК в низкой дозе, рабепразол не повышал риск СС-событий в течение 24–76 недель терапии; в сравнительном исследовании фармакодинамики рабепразола и фамотидина исследуемый ИПП не влиял на эффективность двойной антитромбоцитарной терапии; в метаанализе, включавшем 21 РКИ, на популяции 37 310 пациентов было продемонстрировано, что такие ИПП, как омепразол, лансопразол, пантопразол и эзомепразол, повышали риск больших СС-событий (англ. major adverse cardiac events, МАСЕ), тогда как рабепразол не влиял на риск МАСЕ, что еще раз подтверждает различные ФК- и ФД-свойства разных ИПП. Рабепразол характеризуется наименьшим потенциалом печеночного метаболизма и взаимодействия с CYP2C19, этот ИПП повышает выработку муцина слизистой оболочкой желудка и обладает более низкой способностью к межлекарственным взаимодействиям в сравнении с другими ИПП (рис. 3).
Профессор М.Ф. Ваэзи рекомендует дифференцированно подходить к выбору ИПП. Пациентам, получающим ПТП, нужно назначать ИПП с самым низким потенциалом межлекарственного взаимодействия.
Далее профессор М.Ф. Ваэзи подчеркнул важность понимания различий ассоциации и причинно-следственной связи. Большая часть сообщений об ассоциациях препаратов с теми или иными нежелательными реакциями в наблюдательных исследованиях относятся к ложным сигналам, так как отражают ложные эпидемиологические данные, и на основании многих последующих исследований такие сигналы закрываются. Чтобы полученные данные были достоверными, ОР в когортных исследованиях должно быть более 2–3, а ОШ в исследованиях «случай – контроль» – более 3–4. Значения ОР и ОШ ниже указанных попадают в зону потенциальной систематической ошибки выборки. Таким образом, слабые ассоциации в большинстве случаев отражают погрешность и не доказывают причинно-следственную связь.
Чтобы безоговорочно можно было заявить, что А вызывает В, в эпидемиологических исследованиях должны быть соблюдены все критерии доказательства причинно-следственной связи.
Профессор М.Ф. Ваэзи представил рекомендации по применению ИПП Американской ассоциации гастроэнтерологов (AGA) и Американского общества кардиологов (АСС) в содружестве с Американской ассоциацией больниц (АНА), суть которых состоит в следующем: ИПП рекомендуются больным по зарегистрированным показаниям и пациентам с высоким риском ЖКК, в особенности пациентам с СС-заболеваниями, которые принимают антикоагулянты и у которых есть высокий риск ЖКК.
В заключение профессор М.Ф. Ваэзи подвел общий итог по применению ИПП в клинической практике:
- пациенты должны применять ИПП согласно инструкции;
- ИПП должны применяться в минимальной эффективной дозе;
- выбор ИПП должен основываться на индивидуальном подходе к назначению терапии с учетом свойств ИПП.
Язвенные гастродуоденальные кровотечения: обсуждение национальных клинических рекомендаций
Свое сообщение д.м.н., профессор, заведующий кафедрой госпитальной хирургии Российского национального исследовательского медицинского университета им. Н.И. Пирогова, руководитель хирургической клиники ГКБ им. Ф.И. Иноземцева ДЗМ, заслуженный врач Российской Федерации, лауреат Государственной премии РФ Александр Андреевич Щеголев начал с обзора эпидемиологических данных Великобритании, Дании, США и России. Желудочно-кишечные кровотечения из верхних отделов ЖКТ (за исключением кровотечений из варикозно расширенных вен пищевода) относятся к распространенной патологии во всем мире, оказывающей существенную нагрузку на общественное здравоохранение (количество госпитализаций в год составляет от 20 000 в Дании до 70 000 и 500 000 в Великобритании и США соответственно; летальность от ЖКК варьирует в пределах от 6–8,6% в Великобритании, России и США до 11% в Дании) и является одной из основных причин убыли населения. В России в последние два года отмечена тенденция снижения количества госпитализаций по поводу ЖКК, которая составила 6,5%, обращает на себя внимание высокая послеоперационная летальность (16,5%). Несколько уменьшилось количество больных с язвенными ЖКК в московских стационарах, эта динамика также отмечается в последние два года. Каждого шестого пациента в РФ оперируют по поводу язвенного кровотечения. Хирургическая активность за 20 лет резко снизилась: с 27 до 12%, общая летальность также заметно уменьшилась, составляя в московских стационарах менее 2%, послеоперационная летальность остается приблизительно стабильной. Основными причинами ЖКК профессор А.А. Щеголев назвал острые и хронические язвы желудка и ДПК, эрозивный гастрит, синдром Маллори – Вейсса и рак желудка.
В своем сообщении профессор представил консенсусные соглашения по клиническим рекомендациям по язвенным гастродуоденальным кровотечениям (ГДК), которые были достигнуты на пленуме правления Российского общества хирургов, состоявшемся в 2014 г. в Воронеже. В прошлом году рекомендации были обновлены в связи с появлением новых клинических данных.
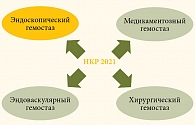
Существует четыре основных метода лечения ГДК – эндоскопический, медикаментозный, эндоваскулярный и хирургический гемостаз (рис. 4).
Как правило, лечение ГДК начинают с проведения экстренной эзофагогастродуоденоскопии (ЭГДС) с диагностической и лечебной целью. Это исследование желательно провести в течение первых двух часов с момента госпитализации. Эндоскопический гемостаз выполняют при FI-A и FI-B ГДК, то есть при продолжающихся струйных либо просачивающихся кровотечениях. А при остановившихся ГДК FII-А и FII-В рекомендуется проводить эндоскопическую профилактику их возобновления. В настоящее время используют комбинированные методы эндоскопического гемостаза, например инъекционный метод в сочетании с эндоскопическим клипированием, диатермокоагуляцией или аргоноплазменной коагуляцией. Залог успеха в остановке кровотечения – комбинированный гемостаз. Наряду с рекомендациями по эндоскопическому гемостазу остаются нерешенные вопросы, например вопросы тайминга и кратности проведения ЭГДС, равно как и вопрос о целесообразности зондирования перед исследованием и повторного эндоскопического гемостаза при рецидиве ГДК. Зарубежные коллеги считают, что ЭГДС надо выполнять в течение ближайших 24 часов, называя этот подход «early endoscopy» – ранняя эндоскопия. У крайне тяжелых больных, находящихся в состоянии геморрагического шока, проведение ЭГДС рекомендуется в течение двух часов.
Какова тактика при рецидиве кровотечения: целесообразен ли эндоскопический гемостаз или в приоритете хирургическое лечение? Или надо проводить эндоваскулярное вмешательство? На сегодняшний день большинство экспертов склоняются к выбору эндоскопического гемостаза, так как, согласно эпидемиологическим данным, при использовании этого метода надежного гемостаза удается добиться примерно у 76% пациентов с рецидивом кровотечения.
Для остановки кровотечения также используются порошки и спреи, пленкообразующие препараты и полисахаридные комплексы. Общей точки зрения относительно эффективности этих препаратов тоже нет, хотя в США TC-325 широко применяют в клинической практике, но вследствие высокой стоимости данного препарата его доступность для применения в реальной клинической практике на сегодняшний день ограничена.
Медикаментозный гемостаз – вторая обязательная составляющая комбинированного гемостаза язвенного кровотечения. Ингибиторы протонной помпы – основа медикаментозной терапии ГДК. ИПП и их классический представитель, выпускаемый в формах для парентерального и перорального введения, отражены на рис. 5.
Все эти препараты, как оригинальные, так и брендированные дженерики, высокоэффективны в снижении кислотности желудочного сока, но отличаются по срокам наступления эффекта, кратности введения, особенностям межлекарственного взаимодействия. Рабочая группа консенсусного соглашения рекомендует применять ИПП сразу при поступлении в стационар, еще до ЭГДС, поскольку эти лекарственные препараты снижают необходимость эндоскопической остановки ЖКК, так как в большинстве случаев остановки кровотечения удается добиться еще до ЭГДС. При введении ИПП стабилизируется рН желудочного содержимого, целевой уровень – не ниже 5,5. Снижение кислотности содержимого в просвете желудка способствует заживлению язвенного дефекта и препятствует рецидиву кровотечения. Сначала ИПП рекомендуется вводить болюсно в дозе 80 мг с последующим переходом на внутривенное капельное введение со скоростью 8 мг/ч посредством инфузомата в течение 78 часов. С момента перевода пациента на пероральный прием жидкостей рекомендуется эрадикация Helicobacter pylori (Hр).
Применение блокаторов Н2-рецепторов при ГДК, в том числе при рецидивах кровотечений, не рекомендуется. А вот синтетические аналоги соматостатина показаны больным с язвенными кровотечениями, особенно пациентам с рецидивами ГДК, связанными с пенетрирующими язвами, когда в процесс вовлекается поджелудочная железа.
В последнее время в литературе обсуждается вопрос, можно ли при язвенных кровотечениях применять ИПП в стандартных, а не в высоких дозах, в том числе в/м и даже ИПП в твердых лекарственных формах, без ущерба для эффективности. Ясности по этим вопросам ни в отечественных, ни в международных рекомендациях пока нет.
Профессор А.А. Щеголев поделился результатами собственного сравнительного исследования рабепразола в трех режимах: 80 мг болюсно с последующим введением в течение 72 часов со скоростью 8 мг/ч посредством инфузомата – стандартная схема (группа I); в обычном режиме в/в введения по 20 мг три раза в сутки в течение 72 часов с последующим приемом внутрь в дозе 20 мг два раза в сутки (группа II) и в режиме введения однократной дозы 20 мг/сут в течение 72 часов с последующим приемом внутрь по 20 мг два раза в сутки (группа III). В первой и второй группах были получены одинаковые результаты: смертельных исходов и рецидивов кровотечения не было, а вот в третьей группе у одного пациента (5%) развилось кровотечение.
Выводы:
- назначение ИПП с целью подавления желудочной кислотопродукции является эффективным методом лечения больных с гастродуоденальными кровотечениями язвенной этиологии;
- применение ИПП в различных дозировках в исследуемых группах позволило существенно снизить риск рецидивов кровотечения и летальных исходов;
- использование ИПП в сниженных дозировках также является эффективным методом лечения больных язвенными гастродуодениальными кровотечениями.
Впервые успешная эмболизация а. gastrica sinistra у пациента с ГДК была описана в 1972 г. На сегодняшний день вопрос об эндоваскулярном гемостазе рассматривается в тех случаях, когда неэффективны медикаментозный гемостаз и повторные попытки эндоскопического гемостаза многократно рецидивирующих ГДК. В таких ситуациях перед клиницистом встает вопрос: оперировать больного или попытаться провести эмболизацию? В обновленном руководстве (2021) транскатетерная эмболизация артерий желудка и ДПК рекомендуется как альтернатива хирургическому лечению при неоднократно рецидивирующих язвенных ГДК, резистентных к эндоскопическому и медикаментозному гемостазу. Эта рекомендация была разработана на основании результатов метаанализа (2019), включившего 1077 пациентов с ГДК, 650 из которых были подвергнуты хирургическому вмешательству, а 427 пациентам была выполнена эндоваскулярная эмболизация. Различий в показателях летальности не было. Частота рецидивов кровотечения и соответственно частота повторных вмешательств были выше в группе пациентов после трансартериальной эмболизации (ТАЭ), зато частота осложнений ТАЭ была меньше в сравнении с хирургическим гемостазом. В настоящее время остается нерешенным вопрос так называемой превентивной эндоваскулярной эмболизации. С целью получения ответа на этот вопрос был проведен метаанализ на популяции из 565 пациентов, поступивших в стационар по поводу ГДК, 310 больным проводили эндоскопический гемостаз (ЭГ) в сочетании с ТАЭ, а 255 пациентам – только ЭГ. В группе комбинированного гемостаза летальность оказалась меньше более чем в два раза (16,2 vs 7,5%). С технической точки зрения ТАЭ была успешна у 90,5% пациентов. Различий в частоте повторных вмешательств и длительности пребывания в стационаре не отмечено. Профессор А.А. Щеголев провел собственное исследование превентивной ТАЭ при язвенном ГДК на группе из 96 пациентов с риском кровотечения F1ab и F2ab. В результате технический успех был достигнут у 93 (98,9%) пациентов, и лишь у одного больного развился рецидив.
Особое внимание профессор А.А. Щеголев уделил вопросам хирургического гемостаза. По его мнению, к вопросу о принятии решения о хирургическом вмешательстве надо возвращаться вовремя, чтобы не допустить ухудшения состояния пациента до критического, при котором он становится плохим кандидатом для выполнения операции. Если у пациента высокий риск рецидива кровотечения, какую тактику выбрать – оперировать, проводить эмболизацию или консервативное лечение? На сегодняшний день допустимы все три варианта, которые изложены в российских национальных рекомендациях. Ряд вопросов, касающихся хирургического гемостаза, остаются нерешенными, например, нет четких критериев угрозы рецидива кровотечения, остается открытым вопрос стратификации больных с язвенным ГДК. Наши зарубежные коллеги, преимущественно американцы, используют три шкалы: Glasgow-Blatchford, Rockall, AIMS65. В России эти классификации не получили распространения в связи с тем, что посредством этих шкал можно ответить только на один вопрос: можно ли лечить пациента амбулаторно, высок ли риск летального исхода или нет. В России повсеместно приняты и используются классификация Forrest и определение степени тяжести кровопотери по Горбашко. Также можно использовать шкалу тяжести кровопотери Американской коллегии хирургов (ACS) (рис. 6).
Открытыми остаются вопросы, касающиеся ранней выписки пациентов и лечения больных язвенным ГДК в амбулаторных условиях.
Зарубежные руководства допускают лечение больных с язвенным ГДК в амбулаторных условиях, если риск кровотечения оценивается 0–1 баллом по шкале Glasgow-Blatchford. В российских рекомендациях пока этот вопрос остается открытым. Предположительно больные с кровотечениями F2c и F3 должны получать консервативную терапию и могут лечиться амбулаторно. Вопрос ранней выписки пациентов также пока находится на этапе обсуждения. Возможно, в ближайшее время накопленные клинические данные позволят сделать определенные выводы по открытым на сегодняшний день вопросам.
Алгоритм ведения больного после кровотечения из верхних отделов ЖКТ гастроэнтерологом
В начале презентации д.м.н., профессор кафедры пропедевтики лечебного факультета Первого Московского государственного медицинского университета им. И.М. Сеченова, председатель комитета по образованию Гастроэнтерологической ассоциации, директор Национальной школы гастроэнтерологов и гепатологов Российской гастроэнтерологической ассоциации, лауреат премии Правительства РФ в области медицины и медицинской техники Елена Константиновна Баранская подчеркнула, что вопросы ведения больного после состоявшегося ЖКК гастроэнтерологом необычайно важны, так как распространенность и смертность от кровотечений из верхних отделов ЖКТ нарастают, эта патология является одной из основных причин смертности населения. Каждые шесть минут в мире развивается ЖКК, и это происходит несмотря на то, что достигнуты большие успехи в применении ИПП, эрадикации Hр-инфекции, снижении частоты обострений язвенной болезни и ее осложнений, внедрены эффективные методы медикаментозного гемостаза парентеральными ИПП, отработаны способы остановки кровотечений. В некоторых странах врач-гастроэнтеролог владеет эндоскопическими методами, в России эндоскопические вмешательства выполняет специально подготовленный врач, а не гастроэнтеролог. Исходя из этого, проблема ведения пациента с состоявшимся кровотечением требует междисциплинарного подхода и помимо гастроэнтеролога, эндоскописта и хирурга для достижения успеха в лечении таких пациентов должны принимать участие и терапевты, и врачи ОИТ. Успех лечения зависит от сплоченности врачей разных специализаций. Помимо классических источников ЖКК, к котором относятся язвы, эрозии, варикозно расширенные вены пищевода, профессор Е.К. Баранская выделила новую причину ЖКК – лекарственную болезнь желудка (ЛБЖ), в корне изменившую свою суть. Теперь ЛБЖ выступает в качестве отдельной нозологической единицы, которая определяется группой неспецифических синдромов, имеющих клиническую картину, сходную с системными аутоиммунными заболеваниями. Эти иммунопатологические реакции возникают вследствие длительного применения ЛП и/или при чрезмерном превышении терапевтических доз или при приеме вне показаний, а также при полипрагмазии в результате межлекарственного взаимодействия. ЛБЖ носит характер хронической болезни, которая может рецидивировать после отмены ЛП, чем частично можно объяснить рецидивирующие ЖКК, которые имеют морфологическую подоснову в виде тотальной лимфоцитарной инфильтрации. В наши дни врачи сталкиваются с другим видом ЛБЖ, а именно с SARS-CoV-2-ассоциированной ЛБЖ, для которой характерен высокий риск ЖКК вследствие прямого цитотоксического действия вируса на слизистую оболочку в сочетании с генерализованным внутрисосудистым свертыванием и усиленным тромбообразованием в сосудах мелкого калибра подслизистого слоя желудка. По этой причине больным назначают антикоагулянты (короткие гепарины), например ривароксабан, а также глюкокортикостероиды, НПВП. И как следствие, патогенез CoV-2 и ее лечение в совокупности приводят к тяжелейшей ЛБЖ. Исследования показали, что на фоне терапии CoV-2 частота осложнений со стороны желудка повышается. Профессор Е.К. Баранская представила интересный клинический случай успешно леченного ЖКК у пациентки 79 лет, поступившей в клинику с ковидной инфекцией в крайне тяжелом состоянии, с высокой лихорадкой и выраженной гиперкоагуляцией. ЖКК у нее развилось на фоне антикоагулянтной терапии и проявилось меленой и быстро развивающейся анемией. Кровотечение удалось успешно купировать парентеральным введением препарата Рабелок, классического представителя ИПП второго поколения. Рецидива ЖКК не было, но в дальнейшем состоявшееся ЖКК послужило пусковым толчком к бурному развитию вирусной инфекции и тотальной пневмонии, что привело к летальному исходу. Применение новых пероральных антикоагулянтов занимает первое место в списке рисков ЖКК.
Профессор Е.К. Баранская разъяснила патогенетическое обоснование применения ИПП в фармакотерапии ЖКК, почему быстрое и мощное угнетение продукции соляной кислоты и поддержание рН не ниже 6 являются условием остановки кровотечения. Согласно результатам исследований in vitro, проведенных еще в 70-е гг. учеными W. Green и M.M. Kaplan, нарушения тромбообразования происходят при повышенной кислотности, соляная кислота ингибирует агрегацию тромбоцитов, вызывает их дезагрегацию, ускоряет тромболизис при участии кислотостимулированного пепсина. С другой стороны, было обнаружено, что ингибирование кислоты облегчает образование тромбов, угнетает фибринолиз. Только такие антисекреторные ЛП, как ИПП, способны удерживать рН желудочной среды не ниже 6, и для достижения постоянства такого уровня рН терапию ИПП при ЖКК начинают с болюса с последующим непрерывным внутривенным капельным введением препарата для поддержания достигнутого результата (рис. 7).
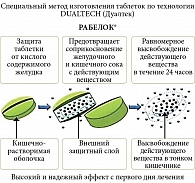
Рабелок – классический представитель рабепразола, который был разработан с помощью особой инновационной технологии DUALTECH. Активное вещество (рабепразол) защищено от воздействия кислой среды желудка, находится в инактивированной форме до момента всасывания и равномерно высвобождается в тонкой кишке в течение 24 часов, а Рабелок в форме лиофилизата для приготовления раствора для в/в введения начинает свое действие мгновенно, как только попадает в системный кровоток, что позволяет быстро достичь редукции симптомов, предупредить рецидивы кровотечений, достичь целевых значений рН. Применение ИПП гарантирует снижение объема кровопотери, времени кровотечения, частоты ранних рецидивов, а также гемотрансфузий, повторных эндоскопических манипуляций, количества хирургических вмешательств и снижение летальности (рис. 8 и 9).
Рабелок в лекарственной форме для парентерального введения применяют не только в терапии и профилактике ЖКК, но и в таких клинических ситуациях, когда невозможен пассаж по ЖКТ или пациент находится без сознания, при осложненной ЛБЖ, гиперсекреторных синдромах, торпидном течении язвенной болезни желудка и ДПК, геморрагическом гастрите, с целью профилактики рефлюкса кислого желудочного содержимого в дыхательные пути, при риске развития аспирационной пневмонии у лежачих пациентов.
Профессор Е.К. Баранская представила еще одно клиническое наблюдение пациента 39 лет с тяжелым ревматологическим заболеванием (анкилозирующим спондилоартритом), по поводу которого больному приходилось применять высокие дозы стероидных препаратов, НПВП и адалимумаб. Лекарственная терапия осложнилась тремя эпизодами рецидивирующего кровотечения. Эндоскопически была диагностирована болезнь Крона (язвенные дефекты выявлены в желудке, ДПК и в куполе слепой кишки). Назначенное лечение включало антицитокиновые препараты, ИПП (Рабелок в/в болюсно в дозе 80 мг с последующим капельным введением по схеме), НПВП были отменены. На фоне уже начатой терапии ИПП у больного развилось ЖКК, которое удалось остановить методом эндоскопического клипирования. Комбинированный гемостаз оказался эффективным, и уже в отделении гастроэнтерологии больной продолжил лечение препаратом Рабелок в таблетках в течение месяца. Была достигнута ремиссия болезни Крона и анкилозирующего спондилоартрита, на что указывало не только заживление язвы желудка, но и нормализация С-реактивного белка (маркера системного воспаления). При повторной контрольной ЭГДС выявлена только постъязвенная деформация нижней трети тела желудка.
Профессор Е.К. Баранская пояснила ступенчатый алгоритм перевода пациента с парентерального применения ИПП на прием внутрь (рис. 10), заострив внимание на особенностях применения ИПП в условиях амбулаторного наблюдения (рис. 11).
При подтверждении хеликобактерной инфекции рекомендуется назначить эрадикационную квадротерапию и в течение как минимум 1–3 месяцев пациент должен продолжать применение назначенного ИПП (Рабелок). Контрольную ЭГДС следует провести через три месяца. Важно не забывать о контроле «красных флажков», к которым профессор Е.К. Баранская отнесла анемию, СС-заболевания и рак желудка.
Для эффективной профилактики ЖКК профессор Е.К. Баранская рекомендует проводить обучение пациентов, в особенности больных с факторами риска. Стандартный объем знаний пациента включает: понимание необходимости эрадикации Hр; исключение НПВП; умение правильно измерять и оценивать артериальное давление, пульс и стул, а также умение использовать экспресс-тесты на кровь в кале; знание признаков, указывающих на необходимость срочного вызова врача скорой помощи (кровавая рвота, мелена, низкое артериальное давление, частый пульс, слабость); соблюдение постельного режима и отказ от приема лекарственных средств до приезда врача в случае появления признаков ЖКК.
Профессор Д.С. Бордин поблагодарил выступивших профессоров за их яркие и содержательные сообщения. Вопросы сердечно-сосудистой безопасности применения ИПП и рекомендации по ведению пациентов с ЖКК с точки зрения хирурга и гастроэнтеролога имеют большое практическое значение. Пациенты с ССЗ должны применять ИПП для снижения риска кровотечения, обусловленного антикоагулянтной терапией. В ведении пациентов с ЖКК участвуют врачи разных специализаций. Междисциплинарный подход на госпитальном и амбулаторном этапе может обеспечить достижение наилучших практических результатов в терапии этой сложной категории больных.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.