Инновационные технологии в терапии атеросклероза – новые возможности для пациентов высокого сердечно-сосудистого риска. Российский национальный конгресс кардиологов. Сателлитный симпозиум компании «Амджен»
- Аннотация
- Статья
- Ссылки










Пациенты высокого сердечно-сосудистого риска: когда статинов недостаточно?
В начале своего выступления ведущий научный сотрудник отдела атеросклероза Института клинической кардиологии им. А.Л. Мясникова Российского кардиологического научно-производственного комплекса (РКНПК) Минздрава России, д.м.н. Андрей Владимирович СУСЕКОВ обозначил ключевые вехи в липидной теории атеросклероза. Он особо отметил значимость трех из них: открытие в 1976 г. мевастатина, в 2003 г. – мутации белка PCSK9 как причину развития семейной гиперхолестеринемии (СГХС) и появление в 2013 г. трех новых классов гиполипидемических препаратов – ингибиторов PCSK9, антисмысловых олигонуклеотидов и ингибиторов MTP.
По словам А.В. Сусекова, статины относятся к основному классу лекарственных средств, применяемых для лечения больных атеросклерозом. Согласно метаанализу исследований, в которых участвовали около 170 000 пациентов, монотерапия статинами четко ассоциировалась со снижением любых сердечно-сосудистых и коронарных событий, а также с любой коронарной реваскуляризацией1. На фоне терапии статинами снижается уровень холестерина (ХС) липопротеинов низкой плотности (ЛПНП) и общего ХС. Между тем у ряда пациентов актуальной остается проблема резидуального сердечно-сосудистого риска, связанного с концентрацией ХС ЛПНП.
Анализ данных 14 исследований, включавших более 38 000 пациентов, показал, что резидуальный риск при терапии статинами достаточно высок. Речь идет о пациентах с ишемической болезнью сердца (ИБС) и пациентах с высоким сердечно-сосудистым риском2.
Рекомендаций по ведению больных очень высокого сердечно-сосудистого риска с обозначенными целевыми уровнями липидов достаточно много. Российские практикующие врачи наиболее приемлемыми считают рекомендации, ориентированные на целевой уровень ХС ЛПНП < 1,8 ммоль/л либо на уровень ХС неЛПВП < 2,6 ммоль/л.
Приходится констатировать, что на фоне применения статинов многие пациенты высокого сердечно-сосудистого риска не достигают целевых значений. В США в 2008 г. только 77% таких больных достигли уровня ХС ЛПНП < 100 мг/дл (2,5 ммоль/л) и 24% – уровня ХС ЛПНП < 70 мг/дл (1,8 ммоль/л)3. В нашей стране эти показатели еще ниже.
Согласно результатам отечественного многоцентрового наблюдательного кросс-секционного исследования 2013 г., из 630 пациентов с ИБС, получавших в течение трех месяцев средние дозы статинов, только 12% достигли целевого уровня ХС ЛПНП < 1,8 ммоль/л.
В целом статины являются безопасным классом препаратов. Вместе с тем в ходе наблюдательных исследований периодически регистрируются статин-ассоциированные мышечные симптомы в виде миопатии – около 9,4% пациентов. В ряде случаев этот показатель достигает 7–29%4. Возможно, именно этим объясняется ограниченное применение статинов в высоких дозах. Например, в западных странах аторвастатин в дозе 80 мг назначают в 3% случаев. В нашей стране этот показатель менее 1%.
Как показывают данные исследования, применение аторвастатина «статин-наивным» пациентам с ХС ЛПНП 2,0 ммоль/л в дозах 40 и 80 мг в равной степени снижает риск сердечно-сосудистых событий на 1,8%5.
Достижение целевых значений ХС ЛПНП – задача нелегкая. И чем выше исходные уровни, тем труднее достичь целевых значений. Между тем для российской клинической практики в большей степени характерно назначение статинов пациентам высокого сердечно-сосудистого риска в умеренных дозах.
Так, в одном из исследований статины в дозах 5 и 10 мг назначали больным очень высокого риска в 42% случаев6. «Терапии высокими дозами статинов в России пока не существует», – констатировал А.В. Сусеков.
Говоря о новых терапевтических подходах, А.В. Сусеков отметил, что одно из перспективных направлений в достижении контроля уровня ХС ЛПНП связано с ингибированием взаимодействия белка PCSK9 с рецептором ЛПНП с помощью моноклонального антитела (мАТ). Когда белок PCSK9 связывается с рецепторами ЛПНП, он ускоряет разрушение рецепторов, что приводит к повышению уровня ХС ЛПНП в плазме крови. Ингибирование взаимодействия белка PCSK9 с рецептором ЛПНП с помощью мАТ потенциально способно снижать уровень ЛПНП в плазме крови. По мнению докладчика, в перспективе ингибиторы PCSK9 могут применяться, например, в лечении пациентов с СГХС и непереносимостью статинов.
Нерешенные вопросы наследственных нарушений липидного обмена: взгляд пациента
По данным председателя Всероссийского общества орфанных заболеваний, профессора кафедры генетики Российской медицинской академии последипломного образования, д.м.н. Екатерины Юрьевны ЗАХАРОВОЙ, СГХС относится к наиболее распространенным наследственным заболеваниям в мире и в то же время остается в значительной мере недиагностируемой.
Почему пациентов с наследственными формами нарушения липидного обмена выявляют поздно или не выявляют совсем? Причин несколько:
-
поздняя обращаемость больных за медицинской помощью (многие пациенты до появления острых нарушений со стороны сердечно-сосудистой системы не обследуются, не измеряют уровень ХС и другие параметры липидного обмена);
-
недостаточное внимание к вопросам наследственности, генетической предрасположенности;
-
невыявление «неклассических» форм гиперхолестеринемии с помощью рутинного биохимического обследования (как правило, при стандартном биохимическом анализе определяют исключительно уровень ХС, что позволяет обнаружить лишь тяжелые гомозиготные формы СГХС, при которых уровень ХС > 7,5 ммоль/л).
СГХС – гетерогенное наследственное заболевание, обусловленное различными мутациями генов. Именно этим объясняется отсутствие простого генетического теста, который позволил бы установить причину заболевания. Сегодня генетическая диагностика СГХС не всегда доступна, поскольку проводится в единичных лабораториях страны, не включена в программу обязательного медицинского страхования и является дорогостоящей.
Отсутствие лечения чревато тяжелыми последствиями. Доказано, что у больных СГХС, не получающих лечение, риск ИБС в 13 раз выше, чем в общей популяции. Правда, и лечение не всегда бывает адекватным. «Как показывает мой собственный опыт, применение статинов не позволяет снизить уровень ХС ЛПНП до рекомендуемых значений. К тому же прием этих препаратов сопровождается осложнениями в виде мышечных болей, что препятствует повышению дозы», – пояснила Е.Ю. Захарова.
Недостаток информации о болезни, методах ее лечения и диагностике, отсутствие утвержденных стандартов по оказанию медицинской помощи пациентам с СГХС негативно сказываются на качестве их жизни.
В заключение Е.Ю. Захарова перечислила меры, принятие которых будет способствовать решению проблемы:
-
информационные акции в СМИ;
-
создание стандартов по оказанию медицинской помощи больным СГХС;
-
формирование липидных центров и регистра больных СГХС;
-
расширение количества лабораторий с ДНК-диагностикой и включение ДНК-диагностики СГХС в перечень обязательного медицинского страхования;
-
проведение диспансерного наблюдения пациентов с гиперхолестеринемией и другими нарушениями липидного обмена;
-
назначение препаратов по торговому наименованию;
-
включение гомозиготной формы СГХС в программу высокозатратных нозологий или в перечень редких заболеваний, утверждаемый Правительством РФ.
Моноклональные антитела к PCSK9, или Как спасти рецептор ЛПНП от разрушения
По словам ведущего научного сотрудника отдела вторичной профилактики хронических неинфекционных заболеваний Государственного научно-исследовательского центра профилактической медицины Минздрава России, к.м.н. Надира Мигдатовича АХМЕДЖАНОВА, рецепторы ЛПНП печени играют ключевую роль в регулировании уровня ХС ЛПНП. Рецепторы ЛПНП, расположенные на гепатоците, удаляют ХС ЛПНП из плазмы крови путем связывания частиц, содержащих ХС ЛПНП. Образовавшийся комплекс направляется в лизосому клетки, где происходит разрушение ЛПНП-частиц. После этого рецепторы ХС ЛПНП возвращаются на поверхность гепатоцита, где захватывают новые частицы ХС ЛПНП (рис. 1)7.
Согласно результатам исследования, белок PCSK9 снижает экспрессию рецепторов ЛПНП на клеточной поверхности за счет их разрушения в лизосомах (рис. 2)8. Генетические варианты PCSK9 свидетельствуют о его роли в регулировании уровня ХС ЛПНП: повышенная активность PCSK9 способствует уменьшению количества рецепторов ЛПНП, пониженная – увеличению их количества. Мутации, приводящие к снижению активности PCSK9, ассоциируются с низким уровнем ХС ЛПНП и низким риском развития ИБС9.
Интересно, что на фоне приема статинов повышается образование как новых рецепторов ЛПНП, так и PCSK9, что неминуемо будет способствовать разрушению части вновь синтезированных рецепторов10. В результате при кратном увеличении дозы статинов отмечается лишь незначительное дополнительное снижение ХС ЛПНП (рис. 3), что обусловливает недостаточный холестеринснижающий эффект статинов у пациентов с высокой гиперлипидемией. Поэтому необходимы новые терапевтические подходы, одним из которых может быть нарушение взаимодействия между рецепторами ЛПНП и PCSK911. Для этого предлагается использовать моноклональные антитела (мАТ), которые за счет блокирования PCSK9 предотвращали бы дальнейшее разрушение рецепторов ЛПНП (рис. 4).
Моноклональные антитела, известные также как иммуноглобулины, вырабатываются из одного клона B-клеток и способны распознавать только один эпитоп на антигене. Именно мАТ обычно используются в терапевтических целях. Биораспределение антител после введения зависит от структуры ткани и эндотелия капилляров.
К другим факторам, влияющим на распределение и фармакокинетику мАТ, относятся заряд, размер, сродство к неонатальному Fc-рецептору и антигену, подкласс IgG, степень и тип гликозилирования, способ и место введения. Особенность механизма их элиминации – это клиренс через ретикулоэндотелиальную систему, что во многом объясняет безопасность данного подхода к лечению.
Терапевтическая ценность мАТ обусловлена высокой специфичностью и высокоаффинным связыванием с антигенами. Кроме того, мАТ отличаются от низкомолекулярных лекарственных средств размером (150 кДа), внеклеточной локализацией мишени, метаболизмом (ретикулоэндотелиальная система, мишень-опосредованное распределение), способом введения (подкожно или внутривенно), отсутствием проникновения через гематоэнцефалический барьер12.
При использовании мАТ, как и других белковых препаратов, могут развиваться реакции гиперчувствительности, инфузионные реакции, реакции в месте инъекции и иммуногенность.
Технология производства мАТ постоянно совершенствуется за счет снижения содержания аминокислотных последовательностей в структуре антитела. Так, в ряду мышиных, химерных, гуманизированных, полностью человеческих мАТ последние обладают самой низкой иммуногенностью.
Создание человеческих мАТ – сложный многоступенчатый процесс. Эффективной системой, позволяющей реализовать производство полностью человеческих мАТ, признана технология компании «Амджен» XenoMouse13, 14. Линии XenoMouse создаются путем введения генов человеческого иммуноглобулина специально выведенным мышам, лишенным функциональных генов мышиного иммуноглобулина. В итоге получаются полностью человеческие антитела без последовательностей мышиного белка.
К наиболее важным свойствам полностью человеческих мАТ относят высокую специфичность к мишеням, низкую иммуногенность, безопасность, альтернативный путь выведения (не через печень и почки).
Завершая выступление, Н.М. Ахмеджанов констатировал:
-
связывание PCSK9 с рецепторами ЛПНП вызывает их разрушение, что приводит к повышению уровня ХС ЛПНП в крови;
-
ингибирование PCSK9 с помощью мАТ предотвращает разрушение рецепторов ЛПНП;
-
терапевтические мАТ успешно применяются в лечении многих тяжелых заболеваний человека;
-
для получения безопасных и эффективных мАТ необходимы обширные научные знания и большой практический опыт в разработке и производстве биотехнологических препаратов.
Ингибирование PCSK9 – эффективная терапия при рефрактерной гиперхолестеринемии
Как показывает анализ литературы, определенная часть пациентов, несмотря на применение современных терапевтических подходов, не достигает целевых показателей ХС ЛПНП. По мнению президента Национального общества по изучению атеросклероза, ведущего научного сотрудника отдела атеросклероза Института клинической кардиологии им. А.Л. Мясникова РКНПК Минздрава России, д.м.н. Марата Владиславовича ЕЖОВА, в эту группу входят больные СГХС, лица с непереносимостью статинов и пациенты с прогрессированием атеросклероза и ИБС на фоне липидснижающей терапии.
Как решить проблему? Специалисты возлагают надежды на новый класс препаратов, ингибирующий белок PCSK9. мАТ, одним из представителей которых является эволокумаб15, ингибируя взаимодействие белка PCSK9 с рецептором ЛПНП, снижают уровень ХС ЛПНП, что может способствовать замедлению прогрессирования атеросклероза всего сердечно-сосудистого бассейна и уменьшать риск сердечно-сосудистых осложнений.
Изучению эффективности и безопасности препарата эволокумаб в различных популяциях пациентов посвящена программа PROFICIO. Это программа, состоящая из 22 клинических исследований с запланированным участием 35 000 пациентов. М.В. Ежов остановился на нескольких ключевых исследованиях программы PROFICIO.
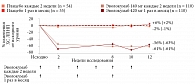
В двойном слепом рандомизированном плацебоконтролируемом многоцентровом исследовании RUTHERFORD оценивали безопасность, переносимость и эффективность эволокумаба в снижении уровня ХС ЛПНП у лиц с гетерозиготной СГХС. В рамках исследования RUTHERFORD-2 сравнивали два режима назначения эволокумаба – в дозе 140 мг один раз в две недели (подкожно) (n = 111) и в дозе 420 мг один раз в месяц (подкожно) (n = 110) с плацебо (подкожно) каждые две недели (n = 55) или ежемесячно (n = 55)16.
Полученные данные продемонстрировали высокую эффективность двух режимов эволокумаба в отношении снижения уровня ХС ЛПНП (рис. 5).
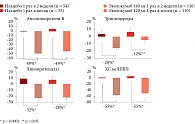
На протяжении 12 недель эволокумаб демонстрировал стабильный эффект в отношении снижения уровня ХС ЛПНП. В группе эволокумаба 140 мг уровень ХС ЛПНП снизился на 61%, в группе эволокумаба 420 мг – на 56%. В группах плацебо эти показатели составили -2 и +6% соответственно. Кроме того, при назначении эволокумаба снижались другие показатели липидного обмена (рис. 6).
Так, уровень апобелка B – переносчика всех атерогенных липопротеинов снизился на 49%, уровень липопротеида (а) – на 28–32%, триглицеридов (как независимого фактора риска атеросклероза) – на 12–20%, любого ХС, не связанного с ЛПВП, – на 55%.
В двойном слепом рандомизированном многоцентровом исследовании GAUSS-2 сравнивали эффективность и безопасность эволокумаба с таковыми эзетимиба у лиц с гиперхолестеринемией и непереносимостью статинов17. Пациентов (n = 307) разделили на группы эволокумаба 140 мг (подкожно) каждые две недели (n = 103) или 420 мг (подкожно) ежемесячно (n = 102) + плацебо ежедневно внутрь и группы плацебо (подкожно) каждые две недели (n = 51) или плацебо (подкожно) ежемесячно + эзетимиб 10 мг ежедневно внутрь (n = 51).
Результаты продемонстрировали лучшую эффективность двух режимов подкожного введения эволокумаба в снижении уровня ХС ЛПНП по сравнению с эзетимибом у лиц с непереносимостью статинов (рис. 7).
К концу 12-й недели лечения в группах эволокумаба отмечалось более значимое снижение ХС ЛПНП (-56 и -53%) по сравнению с группами эзетимиба (-15 и -18% соответственно).
В двойном слепом рандомизированном многоцентровом исследовании LAPLACE-2 оценивали влияние на снижение уровня ХС ЛПНП двух режимов подкожного введения эволокумаба – каждые две недели или ежемесячно – с плацебо при их назначении в комбинации со статинами лицам с первичной гиперхолестеринемией18. Данные исследования показали сопоставимую эффективность двух режимов эволокумаба при их назначении как на фоне интенсивной (аторвастатин 80 мг, розувастатин 40 мг), так и умеренно интенсивной терапии статинами (аторвастатин 10 мг, розувастатин 5 мг, симвастатин 40 мг). Среднее снижение уровня ХС ЛПНП между 10-й и 12-й неделями терапии составило 63–75%.
Как известно, целевых значений ХС ЛПНП на фоне стандартной терапии достигает незначительная часть пациентов высокого и очень высокого сердечно-сосудистого риска. Анализ данных фазы III исследований MENDEL, LAPLACE, RUTHERFORD, GAUSS, входящих в программу PROFICIO, продемонстрировал, что до 94% пациентов достигают целевых значений ХС ЛПНП < 1,8 ммоль/л (рис. 8).
Оценке отдаленной безопасности, переносимости и эффективности эволокумаба у лиц с гиперхолестеринемией и смешанной дислипидемией было посвящено многоцентровое контролируемое открытое исследование OSLER. В нем участвовали около 74% пациентов, завершивших исходные краткосрочные исследования программы PROFICIO19. Пациенты были рандомизированы в соотношении 2:1 в группу эволокумаба и стандартной терапии (n = 2976) и группу только стандартной терапии (n = 1489). Медиана наблюдения составила 11,1 месяца.
Анализ динамики уровня ХС ЛПНП показал, что по сравнению со стандартной терапией на фоне применения эволокумаба к 12-й неделе уровень ХС ЛПНП снизился на 61%. Снижение уровня ХС ЛПНП на терапии эволокумабом оставалось стабильным в динамике.
Более того, заранее запланированный дизайном исследования анализ показал, что эволокумаб снижал относительный риск развития основных сердечно-сосудистых осложнений на 53% (рис. 9).
Исследование OSLER продемонстрировало хорошую переносимость и безопасность эволокумаба. Частота любых нежелательных явлений в группе эволокумаба и стандартной терапии была сопоставима с таковой в группе стандартного лечения (69,2 и 64,8% соответственно), частота серьезных нежелательных явлений не отличалась в обеих группах (7,5 и 7,5%). Это было подтверждено и данными лабораторных исследований: частота случаев повышения уровней аминотрансфераз или креатинкиназы в обеих терапевтических группах была схожей – 1,0 и 0,6% в группе эволокумаба и 1,2 и 1,0% – в группе стандартной терапии.
На основании этих данных можно сделать следующие выводы:
-
эволокумаб по сравнению с плацебо обеспечивает стойкое снижение уровня ХС ЛПНП до 75%, при одновременном использовании эволокумаба и статинов до 94% пациентов достигают целевых значений ХС ЛПНП;
-
эволокумаб обеспечивает значимое дополнительное снижение ХС ЛПНП на фоне любых доз статинов;
-
эволокумаб высокоэффективен в снижении уровня ХС ЛПНП у различных категорий больных, в том числе у лиц с наследственным нарушением липидного обмена и непереносимостью статинов;
-
дозы эволокумаба 140 мг один раз в две недели и 420 мг один раз в месяц клинически эквивалентны, титрации дозы не требуется;
-
эволокумаб положительно влияет на изменение других параметров липидного профиля;
-
эволокумаб хорошо переносится во всех исследуемых популяциях, в том числе у пациентов с СГХC и непереносимостью статинов;
-
эволокумаб может способствовать снижению частоты развития основных сердечно-сосудистых осложнений.
Заключение
Появление ингибитора PCSK9 эволокумаба открывает принципиально новые возможности лечения больных высокого и очень высокого сердечно-сосудистого риска.
Результаты исследований, вошедшие в клиническую программу PROFICIO, продемонстрировали высокую эффективность эволокумаба в отношении снижения уровней атерогенных липидов, а также его безопасность. Кроме того, полученные результаты могут говорить о возможном позитивном влиянии эволокумаба на риск развития сердечно-сосудистых событий.
В перспективе эволокумаб можно будет назначать больным СГХС, c непереносимостью статинов, пациентам очень высокого сердечно-сосудистого риска, а также лицам с недостаточной эффективностью проводимой гиполипидемической терапии.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.