Инсомния как симптом при расстройствах сна
- Аннотация
- Статья
- Ссылки
- English


В Международной классификации расстройств сна третьего пересмотра (2014) инсомния определяется как синдром с характерными повторяющимися нарушениями инициации, продолжительности, консолидации или качества сна, возникающими несмотря на наличие условий и достаточного количества времени для сна и проявляющимися различными нарушениями дневной деятельности [1]. По одному из пунктов диагностических критериев, диагноз инсомнии ставится при отсутствии расстройств сна из других разделов классификации. Однако в некоторых случаях именно инсомния остается ведущей жалобой и заставляет пациента обратиться за помощью к врачу. При этом нарушения сна, несмотря на инсомнический характер, имеют различия и в клинической картине, и в терапии.
Инсомния при расстройствах движений во сне
Расстройства движений, связанные со сном, – состояние, при котором пациент совершает относительно простые, как правило, стереотипные движения, нарушающие сон или засыпание. Синдром беспокойных ног (СБН), или синдром Уиллиса – Экбома, и синдром периодических движений конечностей во сне чаще других расстройств движений во сне ведут к нарушениям сна и значительно влияют на качество жизни [2, 3].
Синдром беспокойных ног. Это сенсомоторное расстройство характеризуется непреодолимым желанием совершать движения, сопровождающимся неприятными ощущениями, как правило, в ногах. Симптомы появляются в состоянии покоя, вечернее и ночное время, вынуждают больного совершать облегчающие их движения и приводят к нарушению сна. По данным популяционных исследований, распространенность СБН среди взрослого населения индустриально развитых стран Европы составляет 5–10%, азиатских стран – 0,1–0,7% [4]. У пожилых людей синдром наблюдается в 10–15% случаев, причем женщины страдают им в два раза чаще.
Различают первичный (идиопатический) и вторичный СБН. Для первичного СБН типично более раннее начало (в первые три десятилетия жизни), он может иметь наследственный характер. Вторичный (симптоматический) СБН обычно возникает при беременности, уремии, железодефицитных состояниях. Риск развития СБН увеличивается при периферических невропатиях, болезни Паркинсона, спиноцеребеллярной атаксии, нарколепсии, рассеянном склерозе, мигрени, боковом амиотрофическом склерозе, болезни Крона, ревматоидном артрите, фибромиалгии, диабете, тревожных расстройствах, депрессии [5]. Симптомы СБН могут появляться или утяжеляться на фоне приема медикаментов: нейролептиков, антидепрессантов (трициклических, селективных ингибиторов обратного захвата серотонина, селективных ингибиторов обратного захвата серотонина и норадреналина), препаратов лития, метоклопрамида, блокаторов кальциевых каналов, антигистаминных препаратов, кофеина.
В настоящее время патофизиология СБН неизвестна. По мнению ряда исследователей, ведущую роль в патогенезе СБН играет дисфункция нисходящих диэнцефально-спинальных дофаминергических путей, источником которых служит группа дофаминергических нейронов, расположенных в каудальном отделе таламуса и перивентрикулярном сером веществе среднего мозга [6]. Еще одна причина развития СБН – дефицит железа как основного кофактора синтеза дофамина в центральной нервной системе. Связь между СБН и низким содержанием железа в головном мозге подтверждена данными аутопсии, магнитно-резонансной томографии и анализами спинномозговой жидкости.
В клинической картине СБН выделяют две основные группы тесно взаимосвязанных симптомов: избыточную двигательную активность (навязчивые побуждения к движению) и субъективные патологические ощущения. Эти симптомы могут локализоваться в любой части ног: бедрах, голенях, стопах, но чаще вовлекаются дистальные отделы. В некоторых тяжелых случаях беспокойство охватывает и руки, реже – другие части тела. Сенсорные симптомы всегда крайне тягостны и неприятны, описываются больными как покалывание, жжение, подергивание, действие разряда электрического тока, шевеление под кожей, ползание мурашек, дрожь и т.д. Треть пациентов характеризует эти ощущения как болевые.
При СБН могут отмечаться ремиссии длительностью от нескольких дней до нескольких лет, во время которых проявления синдрома значительно ослабевают или исчезают полностью.
Возникновение СБН в возрасте до 45 лет характеризуется медленным прогрессированием, незначительной выраженностью симптомов, а в более позднем возрасте – быстрым прогрессированием и более тяжелым течением.
Нарушения сна при СБН имеют ряд особенностей. Для большинства больных наиболее проблематичен момент укладывания в постель, когда одновременно действуют два фактора – состояние покоя и вечернее время. В результате увеличивается время засыпания, больные часто засыпают под утро, когда уменьшается выраженность симптомов. Из-за периодических движений конечностями изменяется архитектура сна.
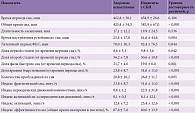
Результаты исследования, проведенного для сравнения показателей полисомнографии больных с идиопатическим СБН и здоровых испытуемых, показывают, что структура сна пациентов с СБН значительно нарушена (табл. 1) [7]. Увеличены время засыпания, количество пробуждений, индексы активаций и число периодических движений конечностями. Наблюдались многочисленные периоды бодрствования внутри сна, уменьшение продолжительности и эффективности сна. Нарушения касались как медленного сна, так и фазы быстрого сна (ФБС). Удлинялся латентный период ФБС и уменьшалась его представленность.
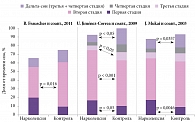
Синдром периодических движений конечностей во сне. Периодические движения конечностями представляют собой непроизвольные повторяющиеся стереотипные движения во сне, обычно ног, включают тыльное сгибание больших пальцев стопы, иногда с веерообразным разведением остальных пальцев или сгибанием всей стопы. В более тяжелых случаях происходит также сгибание ног в коленных и тазобедренных суставах, редко движения могут наблюдаться и в руках. Движения, как правило, сопровождаются активациями на электроэнцефалограмме (ЭЭГ) или могут приводить к пробуждениям пациентов. Периодические движения конечностей отмечаются у 80% больных СБН, но могут существовать и как самостоятельный синдром (у 6% популяции) и быть причиной инсомнии. Больные жалуются на нарушения сна, невосстанавливающий сон или дневную сонливость. На рисунке 1 представлен фрагмент полиграммы пациентки 42 лет с вышеуказанными жалобами, на котором зафиксированы периодические движения конечностей в медленном сне, сопровождающиеся активациями на ЭЭГ. В структуре сна выявлены увеличение количества пробуждений и снижение представленности дельта-сна.
Лечение. Терапевтическая тактика СБН зависит от причин заболевания (идиопатический или вторичный синдром) и выраженности клинических симптомов. Перед началом терапии важно исключить дефицит железа. Наиболее надежный показатель запасов железа в организме – уровень ферритина в сыворотке крови. При концентрации ферритина < 75 мкг/л назначают препараты железа из расчета 50–60 мг элементарного железа в сочетании с витамином С три раза в день [8]. Повторное определение ферритина проводят через три месяца.
В настоящее время в международной практике для фармакотерапии СБН рекомендованы две группы препаратов (табл. 2), эффективность которых доказана многочисленными исследованиями [5]. Первая – агонисты дофаминовых рецепторов прамипексол, ропинирол, ротиготин, вторая – антиконвульсанты (альфа-2-дельта-лиганды) габапентин, габапентин энакарбил, прегабалин. Медикаментозное лечение СБН рекомендуется начинать с монотерапии с учетом коморбидных заболеваний и клинической картины, постепенно увеличивая дозу до достижения терапевтического эффекта. Агонисты дофаминовых рецепторов используются в качестве препаратов первой линии у пациентов с очень тяжелыми симптомами СБН, сопутствующей депрессией, повышенным риском падений или когнитивными нарушениями. При парестезиях болевого характера, выраженных нарушениях сна, высокой тревоге, импульсивно-компульсивных расстройствах в анамнезе предпочтительно применение антиконвульсантов [9].
Инсомния при нарколепсии
Нарколепсия – заболевание из группы гиперсомний, характеризующееся чрезмерной дневной сонливостью, приступами полной или частичной утраты мышечного тонуса (катаплексией) и другими феноменами, связанными с ФБС. Клиническая картина нарколепсии хорошо изучена и проявляется рядом основных симптомов, которые получили название «нарколептическая пентада» [10]:
- дневная сонливость, императивные засыпания;
- приступы катаплексии (внезапная кратковременная полная или частичная потеря мышечного тонуса при сохранении сознания);
- гипнагогические и гипнопомпические галлюцинации;
- катаплексии пробуждения (паралич сна);
- нарушения ночного сна.
Для постановки диагноза нарколепсии необязательно наличие всех перечисленных симптомов.
В настоящее время выделяют две формы заболевания – нарколепсию первого типа (нарколепсия с катаплексией) и нарколепсию второго типа (нарколепсия без катаплексии).
Распространенность нарколепсии в разных популяциях составляет от 0,02 до 0,18%, из них на долю нарколепсии второго типа приходится 15–25%. Дебют заболевания в большинстве случаев происходит в возрасте 10–25 лет. Доказано, что нарколепсия первого типа связана с недостатком гипокретина из-за избирательной потери гипокретиновых нейронов, основная функция которых заключается в поддержании стабильности функциональных состояний человека – бодрствования и сна.
Нарколепсия, возможно, аутоиммунное заболевание. У 90% больных нарколепсией первого типа имеет место особая разновидность группы генов человеческого лейкоцитарного антигена подтипов DR2/DRB1*1501 и DQB1*0602, а в целом у населения эта разновидность встречается от 12 до 38% случаев. Белки, кодируемые генами этой области, участвуют в предъявлении антигенов клеткам иммунной системы. Патогенез нарколепсии второго типа до сих пор неясен. Скорее всего, это гетерогенное заболевание, однако есть сведения, что оно может быть вызвано частичной потерей гипокретиновых нейронов [11].
Нарушение ночного сна при нарколепсии – важный клинический симптом. Более 70% больных не удовлетворены своим сном. Иногда нарушение ночного сна, с которым больные связывают сонливость в течение дня, становится причиной обращения к врачу. Ведущие жалобы пациентов – частые пробуждения, трудности при повторных засыпаниях, плохое качество сна. В отличие от первичной инсомнии при нарколепсии время засыпания редко превышает восемь минут. В 50% случаев отмечается раннее наступление ФБС (≤ 15 минут), при этом пробуждения более частые, но менее длительные. По сравнению со здоровыми лицами у пациентов с нарколепсией увеличены количество пробуждений, время бодрствования внутри сна, представленность первой стадии сна, количество ЭЭГ-активаций, снижена представленность дельта-сна (рис. 2), зафиксирована более высокая двигательная активность [12].
Инсомния при нарколепсии – не коморбидное расстройство, а симптом заболевания, коррелирующий с выраженностью дневной сонливости, снижающий качество жизни больных и требующий терапии. Кроме того, при нарколепсии часто обнаруживаются сопутствующие расстройства сна. Ученые из Инсбрука продемонстрировали, что из 100 пациентов с диагнозом нарколепсии, обследованных при помощи полисомнографии, у 24% был диагностирован синдром обструктивного апноэ сна (СОАС) разной степени тяжести, у 34% – парасомнии (24% ФБС без атонии и 10% – парасомнии, не связанные с ФБС) [13]. Двигательные расстройства отмечались у 55% пациентов, из них у 31% – бруксизм, у 24% – СБН.
Лечение нарколепсии симптоматическое и ведется по трем основным направлениям: уменьшение выраженности дневной сонливости, предупреждение катаплексии и улучшение ночного сна. Наиболее часто используются модафинил, оксибутират натрия и антидепрессанты с активирующим эффектом [14]. Опыт показывает, что стимулирующий эффект модафинила достаточен более чем в 50% случаев (модафинил в Российской Федерации не зарегистрирован). Оксибутират натрия (гамма-оксимасляная кислота) увеличивает длительность и представленность как дельта-сна, так и ФБС, снижает давление сна в течение дня и уменьшает выраженность сонливости. Кроме того, гамма-оксимасляная кислота эффективна в отношении других симптомов нарколепсии: катаплексии, паралича сна, гипнагогических галлюцинаций. Стимулирующие антидепрессанты незначительно воздействуют на сонливость, зато эффективны при сопутствующих симптомах нарколепсии: катаплексии, параличе сна, гипнагогических галлюцинациях. Препаратами выбора на сегодняшний день являются селективные ингибиторы обратного захвата серотонина: венлафаксин от 37,5 до 150 мг утром, реже дулоксетин. Флуоксетин (20–60 мг/сут) с учетом более длительного периода действия препарата оправдан при сопутствующих нарколепсии депрессивных или тревожных симптомах. Кроме того, возможен прием кломипрамина или имипрамина (25–200 мг/сут). Помимо медикаментозной терапии важна индивидуальная адаптация пациента, включающая профессиональную и социальную реабилитацию, направленную на сохранение социального статуса больного, трудоустройство в доступной профессии, психологическую коррекцию, другие меры социальной помощи. В качестве поведенческой терапии используют методику запланированных дневных засыпаний (организация дневного сна один – три раза в день по 20–30 минут).
Инсомния при синдроме обструктивного апноэ сна
СОАС характеризуется повторяющимися эпизодами полной (апноэ) или частичной (гипопноэ) обструкции верхних дыхательных путей во время сна длительностью более 10 секунд. Эпизоды сопровождаются недостаточным насыщением крови кислородом (десатурацией) и, как правило, кратковременными пробуждениями.
Механизм развития обструктивных апноэ во сне связан с физиологическим явлением: снижением мышечного тонуса во время сна, в том числе мышц глотки. При предрасполагающих факторах дальнейшее сужение просвета верхних дыхательных путей под воздействием создаваемого легкими во время вдоха отрицательного давления воздуха может приводить к полному спаданию верхних дыхательных путей и наступлению эпизода обструкции. Развивающаяся в результате гипоксемия вызывает активацию нервной системы и кратковременное пробуждение, что позволяет возобновить дыхание, но ведет к нарушению структуры и качества сна.
Ожирение, увеличение объема мягких тканей глотки, гипертрофия аденоидов и миндалин, особенности строения лицевого черепа, например микрогнатия, миотоническая дистрофия, эндокринные расстройства (акромегалия и гипотиреоз), нарушения регуляции дыхания во время сна – факторы риска развития СОАС. Симптомы СОАС могут усиливаться при употреблении перед сном алкоголя и седативных препаратов, нарушении носового дыхания. Со временем в отсутствие адекватного лечения СОАС медленно прогрессирует и значительно снижает качество жизни, возрастает вероятность развития сердечно-сосудистых осложнений. Клинические и эпидемиологические данные свидетельствуют, что СОАС – ведущий фактор риска развития системной гипертензии, не связанный с ожирением и курением, независимый фактор риска развития ишемической болезни сердца, фибрилляции предсердий и инсульта. СОАС также ассоциируется с диабетом второго типа. Кроме того, у больных с СОАС часто наблюдаются гастроэзофагеальный рефлюкс, никтурия, эмоциональные расстройства, эректильная дисфункция.
Эпидемиологические исследования показывают, что СОАС, сочетающийся с дневной сонливостью, отмечается у 3–7% взрослых мужчин и 2–5% взрослых женщин (риск развития апноэ после менопаузы значительно выше). При этом распространенность СОАС увеличивается с возрастом.
Дифференциальную диагностику СОАС необходимо проводить с ночными паническими атаками, ночным гастроэзофагеальным рефлюксом, астмой, пароксизмальной ночной одышкой на фоне застойной сердечной недостаточности и ночной стенокардией.
Нарушения ночного сна при СОАС имеют выраженный характер и зачастую наряду с дневной сонливостью являются ведущими жалобами больных. При проведении полисомнографии на фоне нарушений дыхания регистрируются ЭЭГ-активации и микропробуждения. Они сопровождаются резким повышением уровня ЭМГ-активности, что указывает на активацию мышц верхних дыхательных путей, непосредственно предшествующую возобновлению нормального дыхания. Во время пробуждений часто отмечаются всплеск симпатической активности и повышение артериального давления. В целом структура сна больных СОАС нарушена за счет повышения количества пробуждений, обусловленных дыхательными расстройствами, увеличением времени бодрствования в период сна, снижения представленности, а иногда и полного отсутствия глубоких стадий медленного сна (дельта-сна), редукции ФБС. Кроме того, у больных значительно увеличена двигательная активность во время сна, часто наблюдаются различные парасомнии и периодические движения в конечностях. В тяжелых случаях пациенты с СОАС вынуждены спать сидя.
Лечение СОАС должно быть комплексным. Вначале необходимо устранить провоцирующие факторы (снизить массу тела, пройти лечение патологии ЛОР-органов и т.д.). Однако часто этого оказывается недостаточно. В настоящее время основным методом лечения является СиПАП-терапия: неинвазивная вспомогательная вентиляция легких путем создания в верхних дыхательных путях постоянного положительного давления воздуха. Широкий арсенал современных приборов позволяет полностью купировать СОАС у различных больных. Однако у больных могут сохраниться жалобы на нарушения сна – инсомнию. По данным одного из исследований, у 50% пациентов с СОАС, получающих адекватную СиПАП-терапию, была диагностирована инсомния [15]. Из них 31% использовали психотропные препараты, 16% регулярно принимали снотворные средства.
Инсомния при других нарушениях сна. Лечение
Несмотря на различия в патогенезе вышеприведенных заболеваний, можно предположить и общие с инсомнией факторы патогенеза, о чем свидетельствует частое сочетание симптомов различных нарушений сна (нарколепсии, СОАС, синдрома периодических движений конечностей во сне, инсомнии) у одного больного. Так, при СБН, СОАС и инсомнии наблюдаются повышенная активность симпатической нервной системы и гиперактивация гипоталамо-гипофизарно-надпочечниковой оси во время сна и бодрствования. Кроме того, при этих нозологиях почти у четверти больных отмечаются депрессивные симптомы, что значительно превышает значения в общей популяции. С этой точки зрения инсомнию у данных пациентов следует рассматривать и как симптом основного заболевания, и как самостоятельное расстройство, требующее терапии.
В настоящее время вне зависимости от формы инсомнии методом выбора в лечении является когнитивно-поведенческая терапия, в том числе рекомендации по гигиене сна, ограничение внешней стимуляции (контроль стимула), ограничение сна и отдыха, когнитивные методики, направленные на изменение представлений о сне. Механизм действия когнитивно-поведенческой терапии согласуется с современными моделями регуляции сна и бодрствования и развития инсомнии.
При выборе фармакотерапии необходимо учитывать патогенез и симптомы основного заболевания. У пациентов с нарколепсией, сопровождающейся выраженной дневной сонливостью, для консолидации ночного сна предпочтение следует отдавать снотворным препаратам с относительно коротким периодом полувыведения и отсутствием эффекта последействия, например золпидему (период полувыведения 2,4 часа) или зопиклону (период полувыведения 3,5–6 часов). При сопутствующих нарколепсии депрессивных или тревожных симптомах оправдан прием флуоксетина (20–60 мг утром), обладающего более длительным по сравнению с другими препаратами временем действия.
Необходимо помнить, что симптомы СБН могут утяжеляться на фоне нейролептиков, антидепрессантов (трициклических, селективных ингибиторов обратного захвата серотонина). Хорошие результаты в терапии нарушений сна и сопутствующих депрессивных симптомов у больных с СБН показал серотонинергический антидепрессант тразодон (50–150 мг на ночь). При необходимости назначают бензодиазепиновые производные клоназепама (0,5–4 мг) или нитразепама (5–10 мг), но их применение существенно ограничивает риск развития толерантности и зависимости при длительном использовании. В случае если требуется длительная терапия снотворными, для исключения риска привыкания можно чередовать ГАМКергические препараты с препаратами, не связанными напрямую с ГАМК-рецепторным комплексом, например блокаторами H1-гистаминовых рецепторов. Гистаминергическая система – одна из наиболее мощных мозговых систем, обеспечивающих поддержание бодрствования. Церебральный гистамин содержится в туберомамиллярном ядре гипоталамуса, проекции от которого широко расходятся в корковые отделы и ядра ствола мозга. Блокада гистаминергической системы приводит к снижению уровня бодрствования и усилению сомногенных влияний [16].
Доксиламин – блокатор H1-гистаминовых рецепторов из группы этаноламинов. Препарат оказывает снотворное, антиаллергическое, седативное и М-холиноблокирующее действие. Наиболее перспективным представляется назначение доксиламина пациентам с инсомнией, ассоциированной с симптомами аллергии или инфекции верхних дыхательных путей. Доксиламин не обладает миорелаксирующим эффектом, поэтому его с осторожностью можно использовать для лечения инсомнии у пациентов с подозрением на апноэ сна. На основании результатов адекватных и хорошо контролируемых исследований доксиламин разрешен к применению на протяжении всего периода беременности (что актуально при развитии нарушений сна у беременных с СБН). Противопоказания к приему препарата обусловлены его М-холиноблокирующим действием и включают закрытоугольную глаукому, гиперплазию предстательной железы, задержку мочи, период грудного вскармливания, детский и подростковый возраст. В России доксиламин представлен препаратом Реслип (фармацевтическая компания «Оболенское»). Показаниями к применению препарата являются преходящие нарушения сна [17].
Заключение
В клинической практике инсомния может быть не только отдельным заболеванием, но и симптомом многих других нарушений сна, требующим самостоятельной терапии. Зачастую нельзя повлиять на патогенетические механизмы основного заболевания (например, нарколепсии), однако можно заметно улучшить качество жизни пациентов, устранив у них инсомнические расстройства.
K.N. Strygin
I.M. Sechenov First Moscow State Medical University (Sechenovskiy University)
Contact person: Kirill Nikolayevich Strygin, strygin67@mail.ru
In the article insomnia is presented as a symptom of other sleep disorders: sleep movement disorders, sleep breathing disorders, narcolepsy. Diagnostic criteria, concepts of pathophysiology, pathogenesis and special aspects of sleep structure in these diseases are given. The use of different pharmacological groups of drugs for the treatment of insomnia is also discussed.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.