Неоадъювантная терапия больных местнораспространенным неоперабельным раком молочной железы
- Аннотация
- Статья
- Ссылки
Местнораспространенный рак молочной железы (РМЖ) – это опухоль больших размеров (> 5 см) с вовлечением в процесс кожи либо грудной стенки и обширными метастазами в региональные лимфоузлы – стадии IIIB, IIIC [1]. К диффузным формам РМЖ относят также инфильтративно-отечный, который составляет около 1% всех вновь диагностируемых форм РМЖ [2, 3].
Специальной статистики частоты местнораспространенного РМЖ в России нет, но учитывая то, что РМЖ III стадии диагностируется у 26% больных [4], предположительная частота IIIB и IIIC стадий составляет около 20%. Практически все больные местнораспространенным РМЖ исходно неоперабельны, и, по современным представлениям, их лечение должно начинаться с системной лекарственной терапии, целью которой, в первую очередь, является перевод опухоли в операбельное состояние для проведения хирургического вмешательства и лучевой терапии, после чего проводится адъювантная системная терапия. Этот подход позволил существенно улучшить результаты лечения местнораспространенного и инфильтративно-отечного РМЖ: пятилетняя безрецидивная выживаемость у больных этой группы превышает 50% [5].
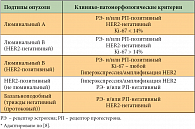
Рак молочной железы – гетерогенная опухоль. Согласно современным представлениям, по биологическим характеристикам четко различаются гормоночувствительный РМЖ, положительный по рецепторам эстрогена и/или прогестерона, опухоли с гиперэкспрессией белка HER2 (рецептора второго типа эпидермального фактора роста) и так называемые трижды негативные опухоли, отрицательные как по содержанию рецепторов стероидных гормонов, так и по экспрессии HER2.
Эти клинические группы в определенной степени соответствуют молекулярным подтипам РМЖ, определяемым по профилю экспрессии генов: люминальный А и В, HER2-позитивный, базальноподобный, выделенный в 2007 г. клаудинодефицитный (с низким содержанием клаудинов) и нормоподобный [6, 7]. Однако нельзя говорить о полном соответствии клинических групп, определяемых с помощью иммуногистохимического исследования, и молекулярно-биологических подтипов РМЖ, определяемых с помощью молекулярно-генетического профилирования. Иммуногистохимическое исследование ткани опухоли является суррогатным методом биологической характеристики РМЖ.
Люминальный А-подтип РМЖ характеризуется высоким содержанием рецепторов эстрогенов и прогестерона, отсутствием признаков гиперэкспрессии/амплификации HER2 и низким индексом пролиферативной активности Ki-67 (< 15%). Это высокодифференцированная опухоль с низкой степенью злокачественности (Grade 1).
Опухоли люминального В-подтипа имеют более низкие показатели рецепторов стероидных гормонов, индекс Ki-67 > 15, более высокую степень злокачественности (Grade 2–3) и способны экспрессировать HER2. Опухоли, не содержащие рецепторов стероидных гормонов и характеризующиеся гиперэкспрессией HER2, относятся к HER2-позитивному (HER2-обогащенному) подтипу.
Базальноподобный РМЖ характеризуется экспрессией базальных цитокератинов (2/6, 17), экспрессией рецепторов эпидермального фактора роста (EGFR), высоким индексом Ki-67. Это низкодифференцированная опухоль с высокой степенью злокачественности (Grade 2–3). Базальноподобный и клаудинодефицитный подтипы составляют около 80% клинической группы трижды негативного рака молочной железы. Приводим таблицу из последней публикации экспертов консенсусной конференции St. Gallen 2011 г. [8], в которой представлены клинико-патоморфологические характеристики основных молекулярных подтипов рака молочной железы (табл. 1).
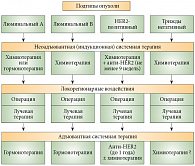
Все перечисленные типы РМЖ характеризуются разной чувствительностью к гормональным и химиотерапевтическим воздействиям и, соответственно, требуют различных терапевтических подходов. Современная стратегия комплексного лечения местнораспространенного РМЖ учитывает биологическую характеристику опухоли (рис. 1). У больных с опухолями люминального А-типа при высоком содержании рецепторов стероидных гормонов, особенно у пациенток в менопаузе, возможно назначение неоадъювантной гормонотерапии. Исследования последних лет [9, 10] показали, что использование ингибиторов ароматазы или антиэстрогенов у больных в менопаузе с эстроген-рецепторопозитивной опухолью большого размера позволяет перевести опухоль в операбельное состояние, при этом эффективность гормонотерапии не уступает эффективности химиотерапии при лучшей переносимости.
В рандомизированных исследованиях доказано преимущество ингибиторов ароматазы перед тамоксифеном при использовании в качестве предоперационной химиотерапии у эстроген-рецепторопозитивных постменопаузальных больных (исследования РО24, IMPACT, PrOACT) [11–14].
Показано также, что у больных в постменопаузе с рецепторопозитивным РМЖ с гиперэкспрессией/амплификацией HER2 преимущество имеет использование трастузумаба (Герцептин) в сочетании с ингибиторами ароматазы перед применением трастузумаба с тамоксифеном. Однако у большинства больных с гормоноположительным РМЖ, особенно у больных с люминальным В-типом, так же как и у пациентов с трижды негативным РМЖ, лечение начинают с неоадъювантной химиотерапии. Неоадъювантная терапия больных с HER2-позитивным РМЖ должна включать анти-HER2 таргетные препараты, в первую очередь трастузумаб, в сочетании с цитотоксическими препаратами.
Активно изучаются новые анти-HER2 препараты и возможности их использования в неоадъювантной химиотерапии HER2-позитивного РМЖ [15]. Предварительные результаты исследования NeoALTTO показали, что неоадъювантная терапия трастузумабом и лапатинибом в сочетании с паклитакселом статистически значимо более эффективна по сравнению с терапией только трастузумабом и паклитакселом у больных HER2-позитивным местнораспространенным РМЖ по показателю полного патоморфологического ответа [16]. Сочетание трастузумаба с пертузумабом в неоадъювантной химиотерапии также оказалось перспективным (исследование NeoSPHERE) [17].
Доказано, что неоадъювантная (индукционная) химиотерапия позволяет перевести в операбельное состояние до 90% больных и обеспечивает выраженный клинический эффект у 60–90% и полный патоморфологический ответ у 12–30% больных.
Единого стандарта неоадъювантной цитотоксической химиотерапии не существует. Как правило, используются комбинации препаратов, обладающих наибольшей активностью при РМЖ, – антрациклинов и таксанов [18–23]. К числу часто используемых режимов относятся комбинации FAC (5-фторурацил + доксорубицин + циклофосфан), FEC (доксорубицин заменяется на менее кардиотоксичный препарат – эпирубицин), а также комбинация TAC (доцетаксел + доксорубицин + циклофосфан). Обычно проводят 4–6 циклов химиотерапии с интервалом 3 недели. Популярна тактика использования 4 курсов АС (доксорубицин + циклофосфан), а затем 4 курсов доцетаксела.
Используют также уплотненные (dose-dense) режимы, при которых интенсификация терапии достигается за счет сокращения интервала между циклами химиотерапии с 3 до 2 недель. Такие терапевтические режимы обычно проводят с использованием КСФ для обеспечения защиты кроветворения. Практически для неоадъювантной химиотерапии HER2-позитивного РМЖ могут быть использованы любые комбинации, применяемые в адъювантном режиме при раннем РМЖ и метастатическом РМЖ. При необходимости избежать применения антрациклинов назначают неантрациклиновые комбинации, такие как CMF (циклофосфан, метотрексат, фторурацил), комбинации с гемцитабином, капецитабином.
В отделении химиотерапии РОНЦ им. Н.Н. Блохина РАМН изучена в качестве неоадъювантной терапии комбинация гемцитабина с паклитакселом в уплотненном режиме, обладающая малым миелосупрессивным действием и не требующая применения КСФ [24]. Проблема исследования чувствительности различных подтипов РМЖ к уже используемым и вновь создаваемым противоопухолевым препаратам не теряет актуальности. Особый интерес вызывает изучение трижды негативного РМЖ – опухоли, которая характеризуется высокой степенью злокачественности, быстрым ростом, часто встречается у молодых женщин и приводит к гибели больных в течение 5 лет с момента установления диагноза [25, 26].
Трижды негативный РМЖ (ТН РМЖ) составляет около 15% всех форм рака молочной железы. По данным ИГХ-исследования, ТН РМЖ не содержит рецепторов стероидных гормонов и не экспрессирует HER2. Чаще всего это медуллярный рак с базальным фенотипом, экспрессией эпидермального фактора роста, обладающий высокой чувствительностью к препаратам, повреждающим ДНК. У 10% больных с трижды негативным РМЖ выявляется мутация BRCA1, при этом 80% больных с мутацией BRCA1 относятся к трижды негативному подтипу. Несмотря на то что до 80% больных с ТН РМЖ относятся к базальноподобному подтипу, нельзя ставить знак равенства между этими понятиями.
Трижды негативный РМЖ чувствителен к цитотоксическим препаратам, особенно повреждающим ДНК. В то же время это опухоль, нечувствительная к антиэстрогенной гормонотерапии. У небольшого количества больных с трижды негативным РМЖ обнаружены рецепторы андрогенов, что послужило основанием для изучения возможности применения антиандрогена бикалутамида (Касодекс) у таких больных. При ретроспективном анализе больших рандомизированных исследований CALGB 9344 и GEICAM показана эффективность таксанов при ТН РМЖ, так же как была показана чувствительность ТН РМЖ к антрациклинам (высокий процент ответа при коротком периоде до прогрессирования). Комбинация таксанов с антрациклинами чаще всего используется при ТН РМЖ. Новый препарат иксабепилон обладает противоопухолевой активностью при ТН РМЖ, но пока не оценен должным образом.
Проводились исследования эффективности ингибиторов рецепторов эпидермального фактора роста (цетуксимаб) и ингибиторов ангиогенеза (бевацизумаб), однако оптимального терапевтического режима для больных ТН РМЖ пока не найдено. Перспективным оказалось изучение ингибиторов поли(АДФ-рибозил)полимеразы (PARP). Семейство PARP состоит из 17 членов, PARP1 и PARP2 участвуют в репарации ДНК. Соответственно ингибиция PARP усиливает антипролиферативную активность агентов, повреждающих ДНК, особенно в случае мутации BRCA.
В рандомизированном исследовании II фазы было показано, что ингибитор PARP инипариб (BSI-201) достоверно повышал эффективность комбинации гемцитабина с карбоплатином при трижды негативном метастатическом РМЖ [29]. Исследование III фазы подтвердило синергизм инипариба и комбинации гемцитабин/карбоплатин, однако ожидаемых статистически значимых результатов пока не получено. Изучение ингибиторов PARP продолжается, в частности, инипариб включен в программу рандомизированных исследований неоадъювантной терапии. Предоперационная химиотерапия позволяет не только перевести опухоль в операбельное состояние, но и оценить используемый терапевтический режим и получить маркеры, позволяющие судить о дальнейших перспективах течения заболевания.
При лечении больных с неоперабельным местнораспространенным и отечно-инфильтративным РМЖ первоочередной задачей является уменьшение размеров опухоли и перевод ее в состояние, когда возможно локорегионарное воздействие – операция и лучевая терапия. Другая, не менее важная задача системной терапии местнораспространенного РМЖ – улучшение безрецидивной и общей выживаемости больных. Показано, что эти показатели зависят от эффективности предоперационной неоадъювантной терапии, в частности от клинического и патоморфологического ответа опухоли на системную терапию.
Клинический эффект определяется по изменениям размеров опухоли в молочной железе и регионарных лимфоузлах, определяемых пальпаторно, с помощью УЗИ и маммографии и оценивается по шкале RECIST. Следует отметить, что ни один из клинических методов обследования, включая МРТ, не позволяет достоверно оценить степень патоморфологических изменений опухоли. Патоморфологическое исследование удаленной опухоли позволяет оценить степень ее повреждения (патоморфоза) в процессе неоадъювантной терапии, при этом обязательна оценка патоморфоза не только в первичной опухоли, но и в метастатически измененных лимфоузлах. Особое значение придается критерию полного патоморфологического регресса опухоли (рathologic Complete Response – рCR), поскольку существуют данные о том, что этот показатель коррелирует с показателями 5-летней безрецидивной выживаемости.
Больные с люминальным типом РМЖ (высокое содержание рецепторов стероидных гормонов, низкий пролиферативный индекс) редко достигают полной патоморфологической регрессии опухоли, в то время как показатели безрецидивной и общей выживаемости у них лучше, чем у больных с трижды негативным РМЖ, у которых полный патоморфологический ответ достигается гораздо чаще. Представляется, что очень важный прогностический критерий полного патоморфологического ответа на химиотерапию может использоваться только при условии стратификации больных по биологическим характеристикам их опухоли. В то же время прогностическое значение ответа на индукционную химиотерапию несомненно. В исследовании C. Liedtke и соавт. [34] показано, что больные с трижды негативным РМЖ в случае полного ответа на индукционную химиотерапию имеют лучшие показатели выживаемости (близкие к показателям выживаемости у больных с люминальным типом РМЖ) по сравнению с остальными больными этой группы.
Патоморфологическое исследование опухоли, выполненное после окончания предоперационной химиотерапии, позволяет оценить маркеры прогноза. Важным показателем является динамика индекса пролиферативной активности Ki-67 – высокие исходящие показатели Ki-67 перед началом терапии указывают на возможную чувствительность опухоли к цитотоксической терапии, повышенный индекс Ki-67 в остаточной опухоли после завершения предоперационной химиотерапии – неблагоприятный прогностический признак, указывающий на высокую вероятность раннего прогрессирования опухолевого процесса [35–37].
Вопрос об адъювантной послеоперационной терапии для больных местнораспространенным РМЖ решается неоднозначно и определяется биологической характеристикой опухоли. Больным с люминальным (гормоночувствительным) РМЖ показана длительная послеоперационная гормонотерапия: тамоксифен, агонисты LH-RH для больных в пременопаузе, ингибиторы ароматазы либо антиэстрогены для менопаузальных больных.
Не вызывает сомнения целесообразность адъювантной терапии трастузумабом, а также другими анти-HER2-препаратами у больных с HER2-позитивным раком молочной железы. Основным предметом дискуссии и исследований является длительность адъювантной терапии у этих больных. В настоящее время принято проводить терапию в течение 1 года.
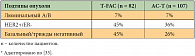
В исследовании E. Тhomas и соавт. 193 больных с местнораспространенным РМЖ получали в неоадъювантном режиме комбинацию CAVP-16 (цисплатин, доксорубицин, этопозид). Выраженный клинический эффект был получен у 83,4% больных, полный патоморфологический ответ – у 12,2% больных. 106 больных, не достигших полного патоморфологического ответа, были рандомизированы на группы послеоперационной адъювантной терапии в том же режиме и терапии комбинацией винбластина, метотрексата с лейковорином и 5-фторурацилом. Отдаленные результаты оказались одинаковы в обеих группах, что указывает на отсутствие преимуществ послеоперационной химиотерапии со сменой режима [40].
Современный комплексный подход к лечению местнораспространенного исходно неоперабельного РМЖ, который включает последовательное использование неоадъювантной индукционной системной терапии (обычно комбинированной химиотерапии), локорегионарные воздействия в виде оперативного лечения и лучевой терапии и послеоперационную системную терапию, позволяет добиться 5-летней безрецидивной выживаемости у 50% больных. При этом оптимальная терапевтическая тактика определяется дифференцированно с учетом молекулярно-биологической характеристики опухоли.
Выводы
-
Целью современной комплексной терапии больных с местнораспространенным и отечно-инфильтративным РМЖ является излечение, которое достигается более чем у 50% пациенток (5-летняя безрецидивная выживаемость при местнораспространенном РМЖ составляет, по различным данным, от 49 до 70%).
-
Терапевтический режим определяется биологическими особенностями опухоли и распространенностью процесса. Соответственно различают режимы для больных с гормонозависимым (люминальный подтип), HER2-позитивным и трижды негативным РМЖ. Все они строятсяна использовании индукционной неоадъювантной системной терапии, локорегионарного воздействия (операции и/или лучевой терапии) и адъювантной системной терапии.
- Неоадъювантная системная терапия является важнейшим этапом, который позволяет перевести опухоль в операбельное состояние. Эффективность используемых лекарственных средств оценивается путем повторного морфологического исследования.
- Перспективным является изучение в неоадъювантном режиме новых противоопухолевых препаратов, в частности ингибиторов PARP, при трижды негативном РМЖ, особенно у больных с мутированным BRCA1.
- Послеоперационная (адъювантная) системная терапия у больных с люминальным РМЖ включает длительную гормонотерапию, у больных с HER2-позитивным РМЖ – использование трастузумаба и других анти-HER2-препаратов.
-
Не существует стандартов послеоперационной терапии для прогностически наиболее неблагоприятной, но высокочувствительной к цитотоксической химиотерапии группы больных с трижды негативным РМЖ.
- При недостаточном эффекте предоперационной химиотерапии подход с использованием в адъювантном режиме препаратов, не обладающих перекрестной резистентностью, не обеспечивает преимуществ в выживаемости.
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />
