Итоги Европейской конференции «3-d EC “ Perspectives in Gynecologic Oncology»
- Аннотация
- Статья
- Ссылки
Рак шейки матки
Бесспорным фактом этиопатогенеза рака шейки матки (РШМ) в настоящее время считается выявление вирусов высокого онкогенного типа паппиломы человека 16,18 типов (HPV–инфекции). В этой связи профессор Стенли Кайе из Глазго еще раз подчеркнул необходимость углубленного клинического изучения современных вакцин, а также необходимость обязательного проведения противовирусной терапии в комплексе со всеми стандартными лечебными мероприятиями преинвазивного и инвазивного РШМ.
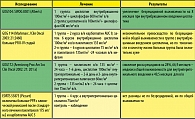
Основная дискуссия развернулась по вопросу приоритетного начала лечения РШМ FIGO IB2 и IIab: «Хирургия или первичная химио-лучевая терапия?». Д-р Раймонд Винтер определил возможности хирургического метода, представив результаты рандомизированного исследования, в котором 104 пациенткам с РШМ (n=34(Ib2) и n =70 (IIab)) на первом этапе была выполнена операция Вертгейма с парааортальной лимфаденэктомией (1 группа). В контрольную группу вошли больные с проведением двух курсов химиотерапии (цисплатин 70-100мг\м2 и блеомицин 40мг\м2 1 раз в 21-28 дней) с последующей лучевой терапией, а также больные (n=13), с противопоказаниями к химиотерапии препаратами платины, получавшие только сочетанную лучевую терапию в СОД 50 ГР (2 группа). Метастазы в подвздошных или парааортальных лимфоузлах были обнаружены у 55,9% пациенток 1 группы. Анализ безрецидивной 5-летней выживаемости достоверно не имел различии в группах: Ib2 - 73,4% и IIab - 72%. Следовательно, начинать лечение в этих случаях целесообразно с выполнения радикальной операции. Совершенно другого мнения придерживался Д-р Кристьян Хайе- Медер, убедительно считающий необходимость обязательного включения в план лечения предварительной неоадъювантной химиолучевой терапии. В результате консенсуса было рекомендовано больным РШМ Ib2 и II ab начинать лечение с химиолучевой терапии, а при наличии противопоказаний для платиновой химиотерапии - проводить сочетанную лучевую терапию в СОД 65-70 гр.
Выступление Д-ра Мартина Горе из Лондона определило роль химиотерапии при лечении рецидивов РШМ. История развития химиотерапии этой проблемы относится к концу 80-х годов с появлением в лечебном арсенале онкологов препаратов платины и применением их в разовой дозе 50-70 мг/м2. Непосредственные результаты лечения рецидивов РШМ пока остаются неутешительными – от 18 до 25%, безрецидивная выживаемость – 3,2-4, 6 месяца, общая выживаемость – 6,2-9,3 месяцев (сводные данные Bonomi 1985, Thigpen 1989, Omura 1997, Vermoken 2001). Современные препараты в качестве монохимиотерапии показали сравнительно невысокие непосредственные результаты: паклитаксел – 19%, навельбин –18%, иринотекан – 17%, топотекан –16%, доцетаксел –13%, гемцитабин – 8%. Комбинированная терапия цисплатин с паклитакселом улучшили результаты лечения: в 31-42% наблюдений (Bioss 2002, Vermorken 2001, Kumar 1998); цисплатин с гемцитабином в 30-50% (Brever 2005, Gonzaiez 2001, Mauionis 2000), а комбинация циплатина с винорельбином в 30-65% клинических случаях были эффективны (Goedhals 2005, Morris 2004). Д-р Мартин Гор, выразил сожаление в том, что пока мы не имеем результатов протокола GOG 204, которые определили бы преимущество применяемых лечебных схем: цисплатин + паклитаксел, цисплатин + гемцитабин, цисплатин + винорельбин, цисплатин + иринотекан, но уже понятно – химиотерапия рецидивов РШМ – это паллиативное лечение, частично улучшающее качество жизни и продлевающее жизнь 50% больных. Стандартов химиотерапии на сегодняшний день нет, режимы лечения должны быть комбинированными и включать препараты циспалатин/карбоплатин в любой из изучаемых комбинаций (GOG 204).
Рак вульвы
Заседание, посвященное лечению рака вульвы (РВ), проводил Д-р Ате ван дер Зи из Нидерландов. Применение химиотерапии сегодня считается приоритетным во всех онкогинекологических клиниках при планировании лечения неоперабельных стадий рака вульвы. Хотя в этом вопросе нет единых стандартов, а перспективные исследования только начинают проводиться, применение схем с препаратами платины и таксаны, совершенствование лучевой терапии при распространенных процессах определено как наиболее перспективное. У больных пожилого и старческого возраста с широким внедрением в клиническую практику сопутствующей поддерживающей терапии стало возможным проведение химиолучевого лечения.
Рак тела матки
Неоспоримым фактом является значительный прогресс, достигнутый в лечении ранних стадий рака тела матки (РТМ). Однако даже самые современные высокоэффективные препараты пока не позволяют существенно изменить продолжительность жизни больных с диссеминированными формами заболевания. В сообщении Д-ра Игнасе Верготте выделены основные факторы прогноза, которыми стоит руководствоваться в назначении больным дополнительного адъювантного лечения. Приведя результаты нескольких крупных исследований, автор подчеркнул, что гистологический тип опухоли, степень ее дифференцировки, плоидность, степень инвазии в миометрий, возраст больной, стадия заболевания, наличие или отсутствие метастазов в лимфатические узлы, молекулярные маркеры (Р53, Bcl 2, HER2/new, эпидермальный и сосудистые факторы роста), факт курения (новый фактор прогноза) являются основными достоверными факторами прогноза течения РТМ. Результаты рандомизированных исследований NCI (2004г.) и ESGO (2005 г.) определили факт наличия или отсутствие метастазов в лимфатических узлах как один из важнейших факторов прогноза, который оправдывает выполнение лимфаденэктомии, и делает ее стандартной для больных РТМ. Исследование NCI, основанное на клинических наблюдениях за 9185 больными РТМ I/IIa стадий с выполнением тазовой и парааортальной лимфаденэктомией, показало, что опухоли с низкой степенью дифференцировки значительно чаще метастазируют в лимфатические узлы (40%) по сравнению с опухолями с умеренной дифференцировкой (27%). По наблюдениям ESGO (Kitchener, 2005г.) за 1408 больными РТМ, разделенными на 2 группы (704 больных в каждой) установлено, что следует рационально выбирать оперативную тактику, основываясь на объективных статистических критериях. В первую группу вошли больные с выполнением тазовой и парааортальной лимфаденэктомией, во вторую – пациентки с простой пангистэрэктомией. Распределение по степени дифференцировки опухоли составило: низкодифференцированные – 19%, умереннодифференцированные – 47%, высокодифференцированные – 34%, соответственно в обеих группах. Общая пятилетняя выживаемость составила 90%, специфическая выживаемость – 94%, безрецидивная – 88%. Причем в группе, где производилась лимфаденэктомия и адъювантная лучевая терапия, результаты лечения были улучшены на 10%.
По основным дискуссионным вопросам о необходимости радикального лечения пациенток с промежуточным риском рецидивирования выступали Д-р Джин–Клауде Хориот из Франции и Д-р Марк Бейкеланд из Норвегии. К пациенткам с промежуточным риском рецидивирования, по их наблюдениям, следует отнести больных Ib, Ic и IIа стадий, при степени дифференцировки G1, G2 включаются Ia,b,c, IIa стадии, а при дифференцировке G3 – только Ia,b стадии. Риск возникновения рецидивов или отдаленных метастазов в группе с “промежуточным” риском составляет 48% (Mariani 2004). В этом случае бесспорным является выполнение тазово-подвздошной лимфаденэктомии, что позволяет не только удалить метастазы, но и определить основной фактор прогноза заболевания – наличие метастазов в лимфатических узлах, провести адекватное стадирование распространенности опухолевого процесса и рационально выбрать адъювантный режим цитостатического воздействия (лучевая терапия, химиотерапия).
Д-р Джин–Клауде Хориот предложил сформировать группу больных с промежуточным риском иначе – стадия Ib- G3, Ic – G1,2. Он считает, что больные с Ia стадией и дифференцировкой G1,2 должны входить в группу с низким риском рецидивирования опухоли и не нуждаются в адъювантном лечении, а больным с IIa и Iс (G3), особенно в возрасте более 60 лет, рекомендовано проведение плановой лучевой терапии. Это разделение основано на данных протокола PORTEC 2.
Однако, изучив все особенности клинических наблюдений авторов, результатом соглашения явилось: к группе с промежуточным риском рецидивирования следует отнести Ia стадию (опухоль с низкой степенью дифференцировки), возможно Ib с G1,2 (старше 60 лет), также в группе промежуточного риска закрепилась стадия IIa–G1,2. Этим группам больных следует в адъювантной терапии планировать дополнительное лечение.
В настоящее время выделена особая гистологическая форма РТМ – серозно-паппилярный эндометриальный рак. Пациентки с такой формой рака относятся к группе высокого риска рецидивирования и нуждаются в адъювантной химиотерапии (Д-р Франциско Одицино из Италии). Ретроспективный мультицентровой анализ показал необходимость альтернативной терапии с системным применением препаратов платины в адъювантном режиме. Для разработки схем лечения потребуются кооперированные клинические исследования.
Рак яичников
Роли молекулярных маркеров, в определении прогноза заболевания при раке яичников (РЯ), была посвящена лекция Д-ра Джакоба Дюпонта из США. Из большинства факторов выделены 5 основных групп: опухолевый фактор (стадия и гистологический тип); хирургический фактор (степень циторедукции опухоли); факторы, определяемые в сыворотке крови (маркеры СА-125 и YKL-40, VEGF – может определяться в сыворотке и асцитической жидкости); молекулярные факторы (VEGF, EGER, p53, MUC 16, MUC 1, Her2/new, NYESO1, Mage3, WT1, FBP); иммунологические факторы (опухоль, инфильтрирующие лимфоциты – TIL).
Основные дискуссии по проблеме лечения больных раком яичников развернулись по двум вопросам: необходима ли лимфаденэктомия в стандартной хирургической тактики РЯ и целесообразно ли проведение внутрибрюшинной химиотерапии при РЯ. По первому вопросу в дебатах выступали Д-р Андре Дю Боис из Германии и Д-р Сиан Кехой из Великобритании. В пользу лимфоденэктомии были выдвинуты следующие аргументы (Д-р Андре Дю Боис): при ранних стадиях РЯ метастазы в парааортальные лимфатические узлы (л/у) обнаруживаются у 11-23% больных, в подвздошные л/у – у 8% больных. Частота поражения парааортальных л/у при рецидивах РЯ (РРЯ) составляет
50 – 65% больных. Протокол AGO-OVAR ОР.3 при распространенных стадиях РЯ показал преимущество в безрецидивной выживаемости для больных, которым выполнялась лимфаденэктомия при визуальном отсутствии остаточной опухоли в брюшной полости. Шотландское кооперированное рандомизированное исследование, включившее наблюдения за 1077 больными РЯ, также показало целесообразность лимфаденэктомии при полной циторедукции опухоли в брюшной полости. Недостатком этих наблюдений может быть их ретроспективность и существенные различия хирургической техники в Англии и других странах (выживаемость пациентов после лимфаденэктомии в Англии оказалась достоверно выше).
Против выполнения лимфоденэктомии использовались не менее весомые факты – больные с распространенным РЯ обычно имеют плохой функциональный статус, операция с лимфаденэктомией обычно сопряжена с высокой травматичностью и обширностью операционного поля. Проспективные научные исследования, убедительно доказавшие преимущество в пятилетней выживаемости, в настоящий момент отсутствуют. Реальный эффект от лимфаденэктомии при I стадии (100 больных) составил: 5-летняя выживаемость – 70%. Для больных РРЯ (n=100) – 5- летняя выживаемость (30%) совершенно не зависела от выполненной лимфаденэктомии. В результате дискуссии было рекомендовано проведение парааортальной и тазовой лимфаденэктомии при начальных стадиях РЯ (I-IIA) для правильного стадирования заболевания и лучшего прогноза у больных с высоким функциональным статусом. При диссеминированном РЯ данный оперативный объем показан для больных, оперированных без остаточной опухоли в брюшной полости, с целью улучшения безрецидивной выживаемости (исследования SCOTROC and AGO-OVAR).
Дебаты о роли внутрибрюшинной химиотерапии развернулись между Д-ром Робертом Озолсом из США и Питером Харпером из Германии. Неоспоримы рациональные составляющие внутрибрюшинной химиотерапии: возможность прямого проникновения лекарственных препаратов непосредственно в опухоль, особенно если имеется большая площадь остаточной опухоли (мелкая диссеминация по брюшине); возможность увеличить дозы препаратов и снизить системные побочные проявления; увеличить безрецидивную выживаемость (Markman JNCCN 2004;2, 54a). Контр-аргументами для внутрибрюшинного введения явились: низкое воздействие на забрюшинную опухоль, печень, плевру, лимфатические узлы, которые поражаются у больных РЯ до 60%; при внутрибрюшинном введении может возникать боль, присоединиться инфекция, часто нарушается функция кишечника, что снижает качество жизни больной; ограниченные проникающие способности препаратов в опухоль – только 2-3 миллиметра (экспериментальные данные). Основные клинические исследования представлены в таблице 1.
Однако внутрибрюшинная химиотерапия не оказывает существенного влияния на отдаленные результаты лечения, а учитывая сложность введения и снижения качества жизни больных, этот метод лечения может быть рекомендован к применению у ограниченного числа больных РРЯ с неблагоприятными факторами прогноза, например, у больных с муцинозным раком яичников внутрибрюшинно лучше вводить цисплатин, карбоплатин и паклитаксел (Ozols: JNCCN 2004: 2:555).
Принципам лечения больных рецидивами РЯ посвящены доклады Д-ра Стенли Кайе и Д-ра Брадлей Монка. Д-р Б. Монк представил предварительные результаты клинических исследований применения таргентных препаратов. Исследования, находящиеся на этапах завершения (II – III фаза), обсуждались более подробно.
Так например, применение GOG 170-D: бевацизумаб при рецидивах РЯ (вторая и третья линия химиотерапии РЯ, N=62) выявило: общий эффект составил 73% (включая стабилизацию заболевания - 55% наблюдений), медиана сохранения эффекта – 10,3 месяца, токсичность 3-й или 4-й степени – гастроинтестинальная – 6%, кардиоваскулярная – 10%, тромбоз вен – 3%, гипертензия – 6%, боли и дискомфорт в животе – 5% больных (Monk B. et.al.).
Исследования ICON 7 и GOG 218, изучающие активность бевацизумаба в 1- линии терапии РРЯ в комбинации карбоплатином и паклитакселом, с октября 2005 года приостановлены, т.к. признан высокий риск (4,8%) лекарственной перфорации кишки у больных РРЯ, применяющих бевацизумаб.
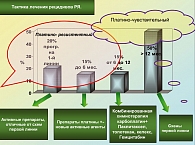
Д-р Стенли Кайе из Лондона представил практические рекомендации для правильного лечения больных рецидивами РЯ. Основным фактором, определяющим тактику лечения для данной категории пациенток, следует считать время возникновения рецидива заболевания и степень чувствительности к первой линии терапии (рисунок 1). Д-р Кайе определил тактические подходы для ведения рефрактерного и резистентного рака яичников. II фаза клинических исследований определила общий лечебный ответ: для платиновых аналогов (ZD473) – 8%, эпотилон В – 24%, антиметаболиты (капецитабин) – 20%, ET 743 – 10%, группа глютатиона (TLK 286) –13%. Для группы пациенток с платино-резистентными формами РЯ комбинация карбоплатина AUC 4 и паклитаксела 90мг/м2 в еженедельном режиме показала эффективность у 39% больных (полных ремиссий – 7%) с медианой сохранения эффекта – 8 месяцев, медиана общей выживаемости – 12 месяцев (van der Burg, ASCO 2004). Больные платино-чувствительным РЯ, возникновение рецидива заболевания у которых наблюдалось свыше 6 месяцев от окончания первой линии терапии, были объеденены в два больших протокола ICON 4 (n=804, рандомизация: группа 1– карбоплатин vs, группа 2 – карбоплатин + паклитаксел) и OVAR 2,5 (n=356, рандомизация: группа 1 карбоплатин vs, группа 2 – карбоплатин + гемцитабин). Результаты ICON 4 показали, что применение карбоплатина, в качестве одного цитостатического агента, существенно не отличается от комбинации его с паклитакселом для планино – чувствительных рецидивов РЯ, особенно при сроках рецидива свыше 12 месяцев: медиана выживаемости 29 vs 24 месяцев, 2-летняя выживаемость – 57% vs 50%. Исследование OVAR 2.5 определило преимущество комбинации карбоплатина с гемцитабином, перед введением одного карбоплатина по общему ответу – 47,2% vs 30,9% и по безрецидивной выживаемости – 5,8 vs 8,6 месяцев (медиана общей выживаемости существенно не отличалась в обеих группах – 18 vs 17,3 месяца). Выявленные преимущества лечебной схемы не зависят от срока возникновения рецидива и сохраняются для больных с РРЯ от 6 до 12 месяцев и свыше 12 месяцев. Нерандомизированное исследование GINECO (липосомальный доксорубицин 30 мг/м2+ карбоплатин AUC 5) включило наблюдения за 104 больными РРЯ от 6 месяцев. По материалам предварительных результатов определена общая эффективность схемы – 63% (полные ремиссии – 38%), медиана безрецидивной выживаемости – 9,4 месяца, медиана общей выживаемости – 32 месяца. Исследование CALIPSO (липосомальный доксорубицин 30 мг/м2 + карбоплатин AUC 5 vs паклитаксел 175 мг/м2 + карбоплатин AUC 5) проводится с участием 800 больных РРЯ от 6 месяцев. Исследование продолжается.
Таким образом, для больных с РРЯ до 6 месяцев рекомендуется применять еженедельные платиновые режимы, сочетая их с другими активными препаратами. Для пациенток РРЯ от 6 месяцев показана комбинированная химиотерапия с включением карбоплатина с гемцитабином, паклитакселом, липосомальный доксорубицином, топотеканом.
Одной из актуальных проблем онкогинекологии считается определение лечебной тактики больных с пограничными опухолями яичников (ПОЯ) (Д-р Джалид Сехойли из Германии). Основная терапия при этой патологии у женщин репродуктивного возраста направлена на сохранение фертильной функции. Химиотерапия при начальных стадиях ПОЯ не целесообразна, при III- IV стадиях ПОЯ применение препарататов цисплатина + циклофосфана существенно не влияют на отдаленные результаты лечения. Исследование применения схем с использованием таксанов для этой категории пациенток находятся в настоящее время в процессе анализа. По предварительным результатам схемы с таксанами более эффективны и позволяют контролировать течение заболевания у больных с неоперабельными формами ПОЯ в 50% наблюдений. Метаанализ 23 исследований показал медиану выживаемости для больных ПОЯ – 89 месяцев, а при III стадии – 46 месяцев. Основными факторами прогноза исхода течения ПОЯ: стадия, возраст, размеры остаточной опухоли после операции. Поражение лимфатических узлов при ПОЯ встречается у 21-27 % больных, поэтому вопрос о необходимости лимфаденэктомии продолжает оставаться дискуссионным. Хирургическое лечение больных ПОЯ обязательно, для пациенток с муцинозной цистаденомой пограничного типа должна выполняться аппендэктомия. С адъювантной целью при IIIa-c стадиях (без остаточной опухоли) предпочтительнее проведение лучевой терапии брюшной полости.
Таким образом, современные научные тенденции в онкогинекологии объединяют в себе основные проблемные направления и определяют многообразие вариантов лечения и использование новых препаратов. Выбор того или иного метода зависит от комплекса субъективных и объективных факторов, в том числе от локализации метастазов, длительности безрецидивного периода после первичного лечения, предшествующей адъювантной терапии, состояния и возраста больной и отношения ее к предлагаемому лечению. Адекватно проведенное определение распространенности опухолевого процесса помогает сделать наиболее рациональный выбор лечебного подхода.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.