Кардиотоксичность макролидов: фокус на азитромицин (критический анализ)
- Аннотация
- Статья
- Ссылки
- English
![Таблица 1. Основные НЛР на фоне применения макролидов и их влияние на различные органы и системы (с изменениями) [6]](/upload/resize_cache/iblock/56e/195_350_1/teva1.jpg)
![Таблица 2. Распространенные ингибиторы цитохрома Р450 и лекарственные препараты, удлиняющие интервал QT [17]](/upload/resize_cache/iblock/fb3/195_350_1/teva2.jpg)
![Таблица 3. Риск смерти в течение первых пяти дней в группе больных, получавших терапию азитромицином (vs группа больных, получавших амоксициллин и не получавших антибактериальную терапию) [9]](/upload/resize_cache/iblock/93d/195_350_1/teva3.jpg)
![Таблица 4. Частота и вероятность развития желудочковых аритмий и смерти от любой причины в течение 30 дней у пациентов, принимавших макролиды и антибиотики других классов [39]](/upload/resize_cache/iblock/1e9/195_350_1/teva5.jpg)
![Рис. 2. Частота и вероятность развития желудочковых аритмий в течение 30 дней у пациентов, принимавших макролиды и антибиотики других классов [39]](/upload/resize_cache/iblock/0d4/195_350_1/teva6.jpg)
![Рис. 3. Частота и вероятность смерти от любой причины в течение 30 дней у пациентов, принимавших макролиды и антибиотики других классов [39]](/upload/resize_cache/iblock/2e7/195_350_1/teva7.jpg)
Введение
Макролиды, появившиеся в клинической практике более 60 лет тому назад, и в настоящее время относятся к широко и повсеместно используемым антибиотикам, прежде всего при внебольничных инфекциях верхних и нижних дыхательных путей [1, 2]. При этом, несмотря на рост устойчивости Streptococcus pneumoniae к макролидам в ряде регионов, этот класс антибиотиков продолжает удерживать позиции одного из наиболее часто назначаемых больным внебольничной пневмонией [3, 4]. Статус макролидов укрепляется и все возрастающим числом доказательств их многочисленных иммуномодулирующих свойств и, как следствие, расширением круга показаний к их практическому применению (муковисцидоз, немуковисцидозные бронхоэктазы, хронический риносинусит, облитерирующий бронхиолит и т.д.) [5].
Многодесятилетний опыт клинического применения макролидов позволил утвердиться во мнении, что данный класс антибиотиков относится к числу наиболее безопасных, а возникающие при их назначении нежелательные лекарственные реакции (НЛР) предсказуемы и относительно редки (табл. 1) [6].
С появлением «новых» макролидов (азитромицин, кларитромицин), характеризующихся среди прочего улучшенной фармакокинетикой, их популярность еще более возросла. Так, только в 2011 г. в США азитромицин был назначен 40,3 млн амбулаторных больных [7].
Тем неожиданнее явилось опубликованное в мае 2012 г. заявление Food and Drug Administration (FDA) [8], предупреждавшее врачей о возможной связи между назначением азитромицина и увеличением риска сердечно-сосудистой смертности и основанное на вышедшей в свет незадолго до этого статье W.A. Ray и соавт. [9]. После детального анализа этой статьи, а также неопубликованных результатов исследований, проведенных фирмой-производителем, в марте 2013 г. FDA выступило с официальным сообщением о связи применения азитромицина с удлинением интервала QT и риском развития потенциально фатальных нарушений сердечного ритма [10]. Эти заявления, а также соответствующие изменения, внесенные в инструкцию по применению препарата, вызвали обоснованное беспокойство среди клиницистов и инициировали широкую дискуссию о возможной связи приема азитромицина с удлинением интервала QT, развитием пируэтной желудочковой тахикардии (tosades de pointes, TdP) и увеличением сердечно-сосудистой смертности.
Удлинение интервала QT и тахикардия TdP
Интервал QT представляет собой временной промежуток от начала волны Q и до окончания волны T на электрокардиограмме, отражающих процессы деполяризации и реполяризации миокарда желудочков сердца [11]. Основываясь на результатах многочисленных популяционных исследований, принято считать, что нормальная продолжительность интервала QT у мужчин и женщин составляет < 430 мс и < 450 мс соответственно1 [12]. В тех случаях, когда интервал QT превышает 500 мс (или удлиняется по сравнению с исходными значениями более чем на 60 мс), возрастает риск развития сердечно-сосудистых событий, включая нарушения сердечного ритма и внезапную смерть [13].
Удлинение интервала QT способно стать причиной так называемых ранних последеполяризаций (early after depolarizations), при достижении которыми порога потенциала действия может развиться полиморфная желудочковая тахикардия TdP и, как следствие, фибрилляция желудочков, остановка сердца и внезапная смерть [14]. Впрочем, предсказание развития тахикардии TdP, основывающееся исключительно на факте удлинения интервала QT, не является надежным.
Помимо ряда генетических полиморфизмов, обусловливающих врожденный синдром удлинения интервала QT, риск развития данного электрофизиологического феномена возрастает у лиц пожилого и старческого возраста (чаще у женщин), при заболеваниях почек и печени с дисфункцией органов, дисэлектролитных расстройствах (гипокалиемия, гипомагниемия, гипокальциемия), брадикардии, приеме салуретиков и ряда других лекарственных средств (табл. 2) [15]. К числу последних относятся антиаритмические препараты (хинидин, прокаинамид, дизопирамид), антипсихотические препараты (зипрасидон, рисперидон, зимелидин, циталопрам), антидепрессанты (амитриптилин, дезипрамин, имипрамин, мапротилин, доксепин, флуоксетин), фторхинолоны (моксифлоксацин, левофлоксацин), макролиды (эритромицин, кларитромицин) и др. [16]. А после публикации метаанализа W.A. Ray и соавт. [9] в этом списке стал упоминаться и азитромицин.
Говоря о ятрогенном происхождении синдрома удлиненного интервала QT, следует упомянуть и возможные лекарственные взаимодействия, приводящие к созданию в плазме крови супратерапевтических концентраций препаратов, обладающих потенциальной кардиотоксичностью. Так, ингибиторы цитохрома Р450 могут вызвать соответствующее замедление клиренса лекарственных субстанций, обладающих способностью удлинять интервал QT (табл. 2) [17].
Лекарственно-обусловленное удлинение интервала QT связывают с ингибированием гена hERG, кодирующего быстрый компонент так называемых замедленных выпрямляющих калиевых каналов (IKR). По IKR осуществляется отток калия из миоцитов в процессе реполяризации желудочков. В случаях ингибирования гена hERG функционирование IKR нарушается, результатом чего становится внутриклеточная аккумуляция калия и задержка реполяризации желудочков, а значит, и удлинение интервала QT [18].
Согласно регуляторным документам FDA, удлинение интервала QT на 10 мс имеет клиническое значение, на 20 мс – потенциальный проаритмогенный эффект, а в случаях превышения 500 мс (или удлинения интервала QT на > 60 мс по сравнению с исходным уровнем) настоятельно рекомендуется прекращение дальнейшего приема лекарственного препарата, «уличенного» в кардиотоксичности [19].
Азитромицин и кардиотоксичность
Вероятно, первое упоминание об удлинении интервала QT на фоне приема азитромицина принадлежит E.V. Granowitz и соавт. [20], описавшим пациента, одновременно с антибиотиком принимавшего дизопирамид. Позднее появились сообщения об удлинении интервала QT и развитии тахикардии TdP при приеме азитромицина больными с врожденным синдромом удлиненного QT-интервала, с хронической сердечной недостаточностью, гипокалиемией и др. [21, 22].
Параллельно с описанием отдельных случаев кардиотоксичности азитромицина появлялись и публикации, содержавшие результаты исследований о возможном влиянии азитромицина на длительность интервала QT у здоровых обследуемых. Так, в ходе наблюдения за 47 добровольцами в возрасте от 19 до 77 лет, принимавшими азитромицин (первый день – 500 мг 2 р/сут, в последующие четыре дня – 500 мг 1 р/сут), было отмечено минимальное удлинение интервала QT до 412,5 мс (на седьмой день после начала приема препарата) и до 419 мс (на 14-й день) по сравнению с исходным уровнем (406 мс) [23]. Однако при этом пропорции обследуемых со значениями интервала QT, превышающими нормальный уровень (> 440 мс), оказались схожими до и после приема азитромицина.
На фоне описаний единичных случаев кардиотоксичности азитромицина, в том числе применявшегося одновременно и с лекарственными средствами с проаритмогенной активностью, как правило, у больных с хронической сердечной недостаточностью, гипокалиемией, врожденным синдромом удлиненного QT-интервала, синдромом слабости синусового узла и т.д. [22, 24–30], как гром среди ясного неба (out of the blue) прозвучали выводы ретроспективного когортного исследования W.A. Ray и соавт. [9]. В исследование были включены пациенты в возрасте 30–74 лет, получавшие в период с 1992 по 2006 г. антибактериальную терапию – амоксициллин, ципрофлоксацин, левофлоксацин и азитромицин (последний в рамках стандартного пятидневного режима дозирования); в качестве отдельной группы контроля наблюдались пациенты, не получавшие за указанный период какой-либо антибактериальной терапии. Критериями невключения в исследование являлись злокачественные новообразования, ВИЧ/СПИД, конечные стадии болезней почек, недавно перенесенное острое нарушение мозгового кровообращения, врожденные сердечно-сосудистые заболевания, муковисцидоз, наркомания, а также пребывание в учреждениях сестринского ухода в течение последнего года или госпитализация за последние 30 дней, предшествовавших включению.
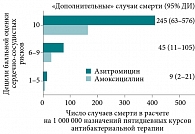
Авторами было показано, что в течение первых пяти дней среди пациентов, получавших азитромицин, смертность от любой причины (преимущественно сердечно-сосудистая) оказалась достоверно выше по сравнению с пациентами, не принимавшими антибиотики (табл. 3) [9]. Схожими оказались и различия в сравнении с больными, получавшими амоксициллин, ципрофлоксацин, но не левофлоксацин. Проведенные авторами цитируемого исследования расчеты позволили сделать вывод о том, что абсолютный риск смерти от любой причины в случаях пятидневной терапии азитромицином составляет 85,2/1 000 000 курсов антибиотикотерапии, тогда как в случаях назначения амоксициллина – 31,5/1 000 000 (табл. 3). Не менее важным представлялось и заключение о «дополнительных» случаях смерти при приеме азитромицина по сравнению с амоксициллином в зависимости от наличия или отсутствия известных сердечно-сосудистых рисков (рис. 1). Так, в группе низкого риска это было 9 случаев на 1 000 000 назначений (или 1 случай на 111 111 назначений), в группе умеренного риска – 45 случаев/1 000 000 (или 1 случай на 21 277 назначений), в группе высокого сердечно-сосудистого риска – 245 случаев/1 000 000 (или 1 случай на 4082 назначения).
Однако обсуждаемое исследование W.A. Ray и соавт. [9] имеет ряд серьезных ограничений. Обсервационный, нерандомизированный характер исследования не может исключить того, что пациенты, получавшие исследуемые препараты в рамках оценки их безопасности, отличаются друг от друга, а также от пациентов контрольной группы по целому ряду важных, но не учитывавшихся характеристик. Так, в частности, высказывается предположение, что в группах пациентов, получавших азитромицин и левофлоксацин, имело место более тяжелое течение инфекционных заболеваний по сравнению с больными, принимавшими амоксициллин, а значит, и фатальный исход в части случаев мог быть неятрогенного происхождения [31]. Свидетельством неоднородности сравниваемых групп больных является и тот факт, что среди пациентов, принимавших азитромицин, было больше женщин (77,5%). А как известно, у женщин вследствие воздействия половых гормонов на сердечную мышцу интервал QT длиннее, чем у мужчин, и выше риск развития желудочковой тахикардии TdP [32, 33]. Эти и другие обстоятельства позволили ряду экспертов высказать предположение, что в исследовании W.A. Ray и соавт. [9] вероятная связь между приемом азитромицина и сердечно-сосудистой смертностью была переоценена (≈ 30%) [34].
При этом также следует учитывать и возможные преимущества макролидов, которые не принимались в расчет в исследовании W.A. Ray и соавт. [9]. Так, например, в недавно опубликованном метаанализе было показано, что в случаях назначения антибактериальной терапии с участием макролидов госпитализированным больным внебольничной пневмонией (ВП) удалось на 25% снизить кумулятивную госпитальную летальность по сравнению со схемами антибактериальной терапии, в состав которых макролиды не входили [35]. К слову, в исследовании W.A. Ray и соавт. [9] число больных ВП было минимальным.
Здесь же уместно сослаться и на недавно опубликованное исследование, в ходе которого анализировался риск сердечно-сосудистой смертности госпитализированных больных ВП пожилого и старческого возраста (≥ 65 лет), получавших соответствующую рекомендациям антибактериальную терапию (в период с 2002 по 2012 г.) [36]. Важнейшим выводом исследования явилось свидетельство статистически более низкой кумулятивной 90-дневной смертности в группе больных, принимавших азитромицин, в сравнении с альтернативными схемами антибактериальной терапии: 17,4 vs 22,3%; отношение шансов (ОШ) 0,73 [95%-ный доверительный интервал (ДИ) 0,70–0,76]. При этом, несмотря на бóльшую частоту инфаркта миокарда (5,1 vs 4,0%; ОШ 1,17 [95% ДИ 1,08–1,25]), при анализе других конечных точек (частота любого сердечно-сосудистого события, нарушений ритма сердца или сердечной недостаточности) достоверных различий в сравниваемых группах пациентов установить не удалось.
Спустя три месяца после публикации статьи W.A. Ray и соавт. [9], вызвавшей широкий резонанс среди экспертов и практикующих врачей, были обнародованы результаты ретроспективного когортного исследования H. SvanstrÖm и соавт. [37], набор амбулаторных пациентов в которое проводился в период c 1997 по 2010 г. и был ограничен молодым и средним возрастом (18–64 года) с целью исключения влияния на конечные точки (смертность от сердечно-сосудистых причин; смертность от причин, не связанных с сердечно-сосудистыми заболеваниями) таких факторов, как преклонный возраст и связанные с ним сопутствующие заболевания. Авторами было показано, что применение азитромицина (n = 1 102 416) по сравнению с приемом пенициллина V (n = 7 364 292) по сходным показаниям не сопровождалось увеличением смертности от сердечно-сосудистых причин непосредственно во время приема антибиотиков (1–5-й дни), непосредственно после окончания лечения (6–10-й дни) и в ходе отдаленного наблюдения за больными (11–36-й дни): ОШ 0,93 [95% ДИ 0,56–1,55], ОШ 0,75 [95% ДИ 0,34–1,62] и ОШ 0,92 [95% ДИ 0,60–1,42] соответственно.
В противоположность этому, в исследовании G.A. Rao и соавт. [38], предполагавшем включение более возрастного контингента амбулаторных пациентов (30–74 года) без серьезных некардиологических заболеваний (1999–2012 гг.), прием азитромицина сопровождался бóльшим и статистически достоверным риском смерти от любой причины или развития серьезных нарушений ритма сердца в период с 1-го по 5-й дни лечения: ОШ 1,48 [95% ДИ 1,05–2,09] и ОШ 1,77 [95% ДИ 1,20–2,62] соответственно.
Противоречивость причинно-следственных связей, устанавливаемых между приемом макролидов (в том числе азитромицина) и риском развития сердечно-сосудистых событий (смерть, нарушения ритма сердца, инфаркт миокарда и т.д.), прежде всего у пациентов групп риска, побуждали к продолжению исследований в этом направлении.
В этом отношении особый интерес вызвала недавняя публикация канадских исследователей, изучавших риск развития серьезных желудочковых аритмий, потребовавших госпитализации, и смерти от любой причины, последовавших в течение первых 30 дней в группах больных, принимавших макролиды (азитромицин, кларитромицин, эритромицин) и другие классы антибиотиков [39]. В исследование были включены пациенты пожилого/старческого возраста (≥ 65 лет), значительное число которых страдало серьезными сопутствующими заболеваниями (хронические заболевания почек, коронарная болезнь сердца, застойная сердечная недостаточность), в том числе принимавшими лекарственные препараты, способные удлинять интервал QT. Авторам не удалось продемонстрировать увеличение риска развития желудочковых аритмий в случаях приема пациентами макролидов; более того, среди последних достоверно меньшим оказалось число смертей от любой причины по сравнению с больными, принимавшими другие антибиотики (табл. 4) [39]. Принципиально при этом, что установленные закономерности касались всех групп больных независимо от наличия и характера сопутствующих заболеваний и/или параллельного приема лекарственных средств, способных удлинять интервал QT (рис. 2 и 3) [39].
Полученные данные позволили авторам сделать заключение о том, что применение макролидов (по сравнению с другими классами антибиотиков) у больных пожилого возраста не сопровождается увеличением риска развития серьезных желудочковых аритмий, а ранее высказанные опасения экспертов FDA на этот счет следует считать преувеличенными.
С представленными M.H. Trac и соавт. [39] данными согласуются и результаты самого масштабного на сегодняшний день метаанализа, объединившего базы данных Дании (AARHUS), Италии (ERD, HSD-CSD-LPD), Германии (GePaRD), Нидерландов (IPCI, PHARMO) и Великобритании (THIN) за период с 1997 по 2010 г. и включившего в общей сложности 14 040 688 пациентов (средний возраст 63 года), принимавших антибактериальную терапию (азитромицин или амоксициллин) [40]. И здесь также не удалось продемонстрировать связь между приемом азитромицина (в сравнении с амоксициллином) и риском развития желудочковых аритмий: ОШ 0,90; 95% ДИ 0,48–1,71.
Результаты последних исследований/метаанализов, подтверждающих минимальный риск развития желудочковых аритмий и других сердечно-сосудистых событий при приеме азитромицина, вполне ожидаемы. Общеизвестно, что в «рейтинге» кардиотоксичности макролидов, связываемой с возможным удлинением интервала QT, азитромицин занимает последнее место: эритромицин > кларитромицин > рокситромицин > азитромицин [41, 42]. А в случаях гипокалиемии в отличие от эритромицина и кларитромицина прием азитромицина не приводит к развитию ранних последеполяризаций (early after depolarizations), являющихся электрофизиологической основой полиморфной желудочковой тахикардии типа TdP [43].
Заключение
Несмотря на высказанные рядом исследователей опасения о кардиотоксичности, азитромицин – один из наиболее часто назначаемых антибиотиков, особенно в амбулаторной практике, – остается относительно безопасным у больных, не страдающих серьезными сердечно-сосудистыми заболеваниями и/или не принимающих лекарственные препараты, способные удлинять интервал QT. В этой связи с целью минимизации развития НЛР со стороны сердечно-сосудистой системы в случаях предполагаемого назначения азитромицина стоит предпринять следующие шаги.
Во-первых, выделить категории пациентов с факторами риска удлинения интервала QT, развития многофокусной пируэтной желудочковой тахикардии типа TdP, других нарушений сердечного ритма. К их числу относятся [10, 44]:
- дисэлектролитные нарушения (например, гипокалиемия и/или гипомагниемия);
- документированная история брадиаритмий, преходящее удлинение интервала QT, ранее перенесенные эпизоды тахикардии типа TdP, декомпенсированная хроническая сердечная недостаточность или врожденный синдром удлинения интервала QT;
- применение антиаритмических препаратов IA (хинидин, прокаинамид, дизопирамид), III классов (амиодарон, ибутилид, соталол, дофетилид, дронедарон) или других лекарственных средств (терфенадин, хлорохин, дроперидол, галоперидол, метадон, хлорпромазин и др.);
- пациенты пожилого/старческого возраста (чаще женщины), более чувствительные к связанному с приемом азитромицина удлинению интервала QT.
Наглядной иллюстрацией действенности такого подхода является исследование R.K. Albert и соавт. [45], ставившего задачей оценку влияния непрерывного 12-месячного приема азитромицина (250 мг/сут) на частоту повторных обострений хронической обструктивной болезни легких. Примечательно, что в исследование не включались пациенты с анамнестическими указаниями на хроническую сердечную недостаточность, эпизоды гипокалиемии, семейную историю синдрома удлиненного интервала QT, а также принимающие лекарственные препараты, способные удлинять интервал QT. Помимо этого перед началом приема антибиотика всем больным выполнялась электрокардиография. Как оказалось, ни у одного из участвовавших в исследовании больных не были выявлены эпизоды клинически значимого удлинения интервала QT или нарушений ритма сердца, включая желудочковую тахикардию типа TdP.
Во-вторых, при назначении азитромицина в амбулаторных условиях следует проинструктировать больного о необходимости сообщения врачу о любых эпизодах головокружения, сердцебиения или обморочных состояниях, возникающих на фоне приема препарата. Оправданным в этой ситуации является и ЭКГ-исследование до начала антибактериальной терапии.
В-третьих, при решении вопроса о назначении азитромицина следует оценивать отношение «польза/риск» [34]. Так, при вирусных инфекциях назначение антибиотика будет сопровождаться повышением риска развития НЛР в отсутствие очевидного терапевтического эффекта («риск > польза»). В противоположность этому, при бактериальной инфекции, принимая во внимание снижение риска смерти [36], назначение азитромицина будет характеризоваться благоприятным соотношением «польза > риск».
Вышеописанные шаги применимы еще в большей степени при назначении других макролидов и фторхинолонов как препаратов, обладающих большим риском кардиотоксичности.
A.I. Sinopalnikov
Russian Medical Academy of Continuing Professional Education
Contact person: Aleksandr Igorevich Sinopalnikov, aisyn@list.ru
As shown by years of experience of macrolides clinical application, these drugs are characterized by the highest level of safety. Their use provokes unwanted drug reactions very rarely. One of the most often prescribed antibiotics, especially in outpatient practice, remains azithromycin. It is relatively safe in patients not suffering from serious cardiovascular diseases and/or not taking drugs that can prolong the QT interval.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.