ХОБЛ и бронхоэктазы
- Аннотация
- Статья
- Ссылки
- English
![Таблица 1. Заболевания/патологические состояния, ассоциируемые с развитием диффузных бронхоэктазов [22, с изменениями]](/upload/resize_cache/iblock/e78/195_350_1/hobl2.jpg)
![Рис. 3. Патофизиологическая гипотеза развития бронхоэктазов у больных ХОБЛ [34]](/upload/resize_cache/iblock/833/195_350_1/hobl4.jpg)
![Таблица 2. Характеристика больных ХОБЛ с бронхоэктазами в сравнении с больными ХОБЛ без бронхоэктазов [36]](/upload/resize_cache/iblock/bd0/195_350_1/hobl5.jpg)
![Рис. 4. Схематичное изображение возможных взаимоотношений между фенотипом «ХОБЛ + бронхоэктазы» и другими фенотипами ХОБЛ [36]](/upload/resize_cache/iblock/871/195_350_1/hobl6.jpg)
Введение
Бронхоэктазы – патологический процесс, нередко прогрессирующего течения, характеризующийся деструкцией и стойкой дилатацией бронхов, приводящих к нарушению мукоцилиарного клиренса, ретенции бронхиального секрета и, как следствие, повторным эпизодам бактериальной инфекции (хронический бронхиальный сепсис) [1–3], – сравнительно недавно относились к числу так называемых орфанных болезней. Поворотным пунктом в истории изучения бронхоэктазов, очевидно, явилось представленное R.T.H. Laёnnec в начале XIX столетия исчерпывающее в своей полноте описание больных с обильным отхождением гнойной мокроты: «Эта болезнь бронхов всегда сопровождается хроническим катаром и подобно некоторым другим заболеваниям проявляется повторными длительными и интенсивными кашлевыми пароксизмами» [4].
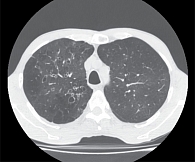
В 1922 г. J.A. Sicard предложил использовать рентген-контрастную бронхографию для получения оптимального изображения деструктивных изменений воздухоносных путей [5]. 50-е годы прошлого столетия знаменательны фундаментальными исследованиями L.M. Reid, связавшего бронхографические и патоморфологические изменения; тогда же было высказано предположение, что уменьшение распространенности бронхоэктазов может быть достигнуто эффективным контролем над туберкулезом и распространением вакцинопрофилактики коклюша и кори [6]. И наконец, особо следует отметить внедрение в современную клиническую практику компьютерной томографии (КТ) высокого разрешения, характеризующейся близкими к абсолютным чувствительностью и специфичностью в визуализации патологических изменений стенки бронхов, вытеснившей бронхографию и ставшей общепринятым стандартом диагностики бронхоэктазов [7–9]. Именно повсеместное использование КТ при обследовании больных с разнообразной патологией органов дыхания, а также унификация КТ-критериев диагностики бронхоэктазов1 (рис. 1) и обусловили наблюдаемый в настоящее время переход заболевания из разряда редко диагностируемых в число широко распространенных болезней.
Эпидемиология
Согласно результатам современных эпидемиологических исследований, распространенность бронхоэктазов, не связанных с муковисцидозом2, колеблется в широком диапазоне – от 486 до 1106 случаев на 100 000 населения; число случаев заболевания увеличивается с возрастом, и в большей степени ему подвержены женщины [14–16]. Эти данные наглядно свидетельствуют о том, что бронхоэктазы значительно превзошли условный эпидемиологический порог так называемых орфанных заболеваний (10–50/100 000) и, в частности, встречаются гораздо чаще, чем такое актуальное для современной пульмонологии заболевание, как идиопатический легочный фиброз (18,2/100 000) [17].
Свидетельством все возрастающего интереса к обсуждаемой проблеме явилась и инициированная экспертами European Respiratory Society программа сотрудничества по изучению распространенности, патофизиологии и определению оптимальных подходов к лечению бронхоэктазов – European Multicentre Bronchiectasis Audit and Research Collaboration (EMBARC), одним из итогов реализации которой стало создание европейского регистра заболевания [18, 19].
Бронхоэктазы традиционно подразделяются на локальные, в основе которых, как правило, лежит обструкция долевого или сегментарного бронха, и диффузные, обычно «аккомпанирующие» другим заболеваниям/патологическим состояниям – синуситу, бронхообструктивным заболеваниям и др. с вовлечением в патологический процесс обоих легких.
К развитию локальных бронхоэктазов могут приводить различные процессы:
- блокада просвета бронха аспирированным инородным телом, бронхиолитом или медленно растущей доброкачественной опухолью;
- компрессия бронха извне (типичным примером является синдром средней доли, когда на фоне переносимых гранулематозных инфекций – туберкулеза, пневмомикозов происходит сдавление среднедолевого бронха «ожерельем» увеличенных лимфатических узлов);
- смещение бронхов после лобэктомии (например, смещение нижней доли легкого в краниальном направлении после удаления верхней доли) [20, 21].
В большинстве случаев диффузные бронхоэктазы ассоциируются с системными заболеваниями/патологическими состояниями, основные из которых представлены в табл. 1 [22].
Последнее время особое внимание уделяется возможному сочетанию ХОБЛ и бронхоэктазов, что отчасти объясняется широкой распространенностью обоих заболеваний. Так, например, в Испании более 10% взрослой популяции страдают ХОБЛ, а бронхоэктазы диагностируются у 1,5% мужчин старше 65 лет [23]. Неудивительно, что у каждого третьего больного ХОБЛ, обращающегося за медицинской помощью к врачу первичного звена, даже в отсутствие выраженных вентиляционных нарушений при КТ органов грудной клетки обнаруживаются диффузные бронхоэктазы [24]. Впрочем, многочисленные эпидемиологические исследования, свидетельствующие о значительной частоте констелляции «ХОБЛ + бронхоэктазы» (29,5–73%) независимо от тяжести и фазы течения бронхообструктивного заболевания [25–31], способны убедить, что речь идет не о случайных совпадениях, а о тесных патофизиологически обусловленных взаимосвязях.
Патофизиология
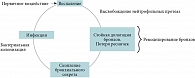
Немногим более 30 лет тому назад P.J. Cole сформулировал гипотезу «порочного круга», объяснявшую взаимоотношения хронической бронхиальной инфекции, вызываемой потенциально патогенными микроорганизмами и обусловливающей хроническое воспаление, приводящее в свою очередь к ремоделированию воздухоносных путей и повреждению локальных защитных механизмов, следствием чего являлось персистирование респираторных патогенов, несмотря на повторно проводимую антибактериальную терапию [32] (рис. 2).
Очевидно, что хроническая бронхиальная инфекция, закономерно часто встречаемая у больных ХОБЛ [33], может оказаться своеобразным патофизиологическим фундаментом, на котором выстраивается новая клиническая констелляция – «ХОБЛ + бронхоэктазы» (рис. 3) [34].
Установление факта частого сочетания ХОБЛ и бронхоэктазов рождает целый ряд вопросов, а именно:
- оказывает ли влияние наличие бронхоэктазов на клиническое течение ХОБЛ;
- каковы прогностические последствия «присоединения» бронхоэктазов к ХОБЛ;
- влияют ли сопутствующие ХОБЛ бронхоэктазы на результативность того или иного терапевтического вмешательства;
- следует ли рассматривать сочетание бронхоэктазов и ХОБЛ как отдельный клинический фенотип?
ХОБЛ и бронхоэктазы: возможные клинические последствия
Ответить на эти вопросы помогают недавно опубликованные метаанализы, итоговые результаты которых представлены в табл. 2 [31, 35, 36].
Накопленный к настоящему времени фактический материал позволяет считать, что к числу клинических характеристик больных ХОБЛ с бронхоэктазами следует отнести более низкий индекс массы тела, более пожилой возраст, бóльшие объемы и гнойность ежедневно экспекторируемой мокроты, большее число сопутствующих заболеваний и более высокие значения индекса BODE3 [27, 37]. Здесь же следует упомянуть и бóльшую частоту и тяжесть повторных обострений заболевания, что впервые было отмечено I.S. Patel и соавт. [38], а затем нашло подтверждение и в работах других исследователей [39–42].
Наличие бронхоэктазов у больных ХОБЛ закономерно часто сопровождается хронической бактериальной инфекцией потенциально патогенными микроорганизмами (отношение шансов (ОШ) 3,76–7,33), прежде всего Pseudomonas aeruginosa (ОШ 3,5–4,75) [35, 36], что «соседствует» с бóльшей бактериальной нагрузкой [39].
Большинство авторов соглашаются с мнением о том, что у больных ХОБЛ с бронхоэктазами имеют место худшие показатели бронхиальной проходимости [24, 25, 37, 40, 43].
Типичным при сочетании ХОБЛ и бронхоэктазов является бóльшая выраженность локального и системного воспаления. Так, в частности, у данной категории больных выявлено повышение концентрации в мокроте провоспалительных интерлейкинов (IL-8, IL-6), связываемое с возрастанием бактериальной нагрузки на дыхательные пути [38], а также СРБ в крови и увеличение СОЭ [40, 41].
Результаты ограниченного числа исследований по оценке прогноза больных ХОБЛ в случаях «присоединения» бронхоэктазов противоречивы. Если ряд авторов в обсуждаемой клинической ситуации указывают на увеличение риска летального исхода независимо от возраста больных, наличия или отсутствия сопутствующих заболеваний, выраженности бронхиальной обструкции [29, 40], то другие, напротив, не находят подобной взаимосвязи [27, 42]. «Промежуточным» ответом на этот вопрос можно, вероятно, считать результаты метаанализа Q. Du и соавт. [31], продемонстрировавших, что подобное сочетание характеризуется возрастанием риска летального исхода больных со стабильным течением ХОБЛ практически в два раза (ОШ 1,96; 95%-ный доверительный интервал (ДИ) 1,04–3,70).
ХОБЛ может протекать без бронхоэктазов, как и бронхоэктазы далеко не всегда сопровождаются хронической бронхиальной обструкцией, однако, когда у больного со стабильным течением ХОБЛ обнаруживаются КТ-признаки бронхоэктазов, трудно согласиться с тем, что это случайная коморбидность. Указанная выше патогенетическая близость ХОБЛ и бронхоэктазов, а также известное клиническое, функциональное, микробиологическое и прогностическое своеобразие подобного сочетания позволяют ряду авторов аргументированно высказаться в поддержку выделения отдельного клинического фенотипа «ХОБЛ + бронхоэктазы» [44–46].
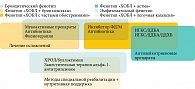
Как уже говорилось, персистирующая бактериальная инфекция в программе бронхоэктазов при их сочетании с ХОБЛ помимо сближающей оба заболевания клинической симптоматики (кашель, продукция мокроты, нередко гнойной) сопровождается более частыми и тяжелыми обострениями и закономерно худшим качеством жизни пациентов. Эти признаки и симптомы очень похожи на те, которые упоминаются при описании так называемого инфекционного фенотипа ХОБЛ [47, 48]. Можно предположить, что сочетание «ХОБЛ + бронхоэктазы» может быть рассмотрено или как субфенотип инфекционного фенотипа ХОБЛ, или как вариант эволюции последнего, характеризующегося хронической бронхиальной инфекцией потенциально патогенными микроорганизмами и частыми бактериальными обострениями [36] (рис. 4). Таким образом, у части пациентов с инфекционным фенотипом ХОБЛ могут со временем сформироваться бронхоэктазы, и, напротив, у других, оказавшихся восприимчивыми к терапевтическим воздействиям, направленным на подавление роста
бактерий и предотвращение их эндобронхиальной персистенции, бронхоэктазы будут отсутствовать. Относительная простота констатации фенотипа «ХОБЛ + бронхоэктазы», очевидно, состоит в его стабильности и унифицированных критериях КТ-визуализации.
Здесь же важно отметить, что фенотип «ХОБЛ + бронхоэктазы» легитимизирован в ряде национальных руководств и учитывается при формировании пациент-ориентированных терапевтических стратегий [49] (рис. 5).
Лечебные подходы
Очевидно, что при сочетании ХОБЛ и бронхоэктазов традиционная бронхолитическая и противовоспалительная терапия должна быть дополнена специфическими для бронхоэктазов лечебными подходами [50, 51]:
- клиренс (очищение) дыхательных путей. Все больные с бронхоэктазами, не связанными с муковисцидозом, должны получить рекомендации по лечебной физкультуре;
- ингаляционные гиперосмолярные растворы и муколитики;
- пероральные антибиотики;
- ингаляционные антибиотики;
- оперативное лечение (в случаях локальных бронхоэктазов).
Особого внимания в этом перечне заслуживают мукоактивная терапия и применение ингаляционных антибиотиков.
Муколитики/мукорегуляторы (N-ацетилцистеин, карбоцистеин) широко применяются при лечении больных с бронхоэктазами, не связанными с муковисцидозом, однако контролируемые исследования по оценке их эффективности и безопасности у данной категории пациентов отсутствуют. Рекомбинантная ДНКаза (Пульмозим®), доказавшая свою эффективность у больных муковисцидозом, в случаях ее применения при бронхоэктазах иной этиологии характеризовалась усугублением нарушений бронхиальной проходимости ($ОФВ1) [52]. Обнадеживающие результаты при ведении больных с бронхоэктазами, не связанными с муковисцидозом, были получены при применении гипертонического 7%-ного раствора NaCl. Так, в частности, в ходе сравнительного перекрестного исследования 0,9%-ного и 7%-ного растворов NaCl было показано, что назначение гипертонического раствора характеризовалось улучшением спирометрических параметров (ОФВ1, ФЖЕЛ), снижением числа обострений заболевания в течение 12 месяцев и, как следствие этого, меньшим числом курсов антибактериальной терапии, а также лучшим качеством жизни пациентов [53].
К сожалению, ингаляции гипертонического раствора NaCl нередко сопровождаются такими нежелательными явлениями, как бронхоспазм и связанный с ним кашель, а также неприятным привкусом, что не может не сказаться на приверженности больного врачебным рекомендациям. Эффективным способом их преодоления явилось создание комбинированного препарата для ингаляций, содержащего 7%-ный раствор NaCl и 0,1%-ный раствор гиалуроновой кислоты (Гианеб®). Применение этого препарата с использованием струйного небулайзера характеризуется не только демонстративным клиническим эффектом (оптимизация реологических свойств бронхиального секрета и облегчение экспекторации мокроты, улучшение функции легких, снижение частоты обострений заболевания) [54, 55], но и лучшей переносимостью (меньшая частота и выраженность раздражения слизистой глотки, кашля, соленого привкуса) [56–58]. И хотя цитируемые исследования включали пациентов с муковисцидозом и бронхоэктазами, не будет ошибкой применение этого направления мукоактивной терапии и в лечении больных с бронхоэктазами иной этиологии, в том числе при их сочетании с ХОБЛ.
Еще одним потенциально эффективным направлением специфического лечения больных с бронхоэктазами, связанными и не связанными с муковисцидозом, является ингаляционная антибактериальная терапия, реализующая концепцию «hit hard, hit fast» («ударь сильнее, ударь быстрее»). Из зарегистрированных в настоящее время антибиотиков для ингаляционного введения, используемых помимо лечения больных с бронхоэктазами при пневмоцистозе, нетуберкулезных микобактериозах, вентилятор-ассоциированной пневмонии (гентамицин, азтреонама лизин, колистин, ципрофлоксацин и др.), наибольшей популярностью пользуется высококонцентрированный раствор тобрамицина [59]. При этом накоплены многочисленные доказательства эффективности ингаляционной антибиотикотерапии больных с бронхоэктазами, в том числе и не связанными с муковисцидозом: снижение микробной нагрузки на дыхательные пути (прежде всего эрадикация Pseudomonas aeruginosa), уменьшение частоты повторно переносимых обострений заболевания, улучшение качества жизни пациентов [60]. Так, авторами недавно опубликованного систематического обзора было показано, что Number Needed to Treat (NNT)4 при оценке эрадикационного потенциала ингаляционной терапии антибиотиками (тобрамицин, гентамицин, цефтазидим + тобрамицин, ципрофлоксацин) больных с бронхоэктазами в отношении Pseudomonas aeruginosa составляет 3:1, что корреспондирует со снижением частоты обострений заболевания на 28% (NNT – 5:1) [61].
Заключение
Современные эпидемиологические исследования свидетельствуют о высокой частоте встречаемости констелляции «ХОБЛ + бронхоэктазы». Ряд этиологических факторов, обусловливающих развитие бронхоэктазов, встречаются и у больных ХОБЛ. И хотя до сих пор не ясно, почему бронхоэктазы диагностируются только у части больных ХОБЛ, логично предположить, что инфекционный фенотип заболевания, характеризующийся хронической бронхиальной инфекцией и повторными эпизодами инфекционных обострений, запускает «порочный круг» инфекции, воспаления и тканевого повреждения. «Обременение» клинического течения ХОБЛ бронхоэктазами сопровождается более частыми и тяжелыми обострениями, худшим качеством жизни и, возможно, увеличением смертности. Для оценки влияния доступных лечебных подходов на микробную нагрузку, частоту обострений и долговременный прогноз больных с сочетанием «ХОБЛ + бронхоэктазы», очевидно, необходимо проведение масштабных продольных исследований [36].
1 К числу КТ-критериев бронхоэктазов относят: 1) отсутствие уменьшения диаметра бронхов к периферии; 2) расширение просвета бронха, когда его внутренний диаметр превышает таковой прилежащей ветви легочной артерии; 3) визуализацию периферических бронхов в пределах 1,0 см от поверхности костальной или медиастинальной плевры [10]. Обнаружение единичных небольшого размера бронхоэктазов в пределах одного сегмента легкого следует игнорировать, поскольку подобные КТ-находки имеют место у немалого числа здоровых обследуемых [11].
2 В 33–42% случаев бронхоэктазы связаны с респираторными инфекциями; в 2–4% случаев – с муковисцидозом, в единичных случаях – с иммунологически опосредованными заболеваниями; в большинстве своем (30–53%) природа бронхоэктазов остается неустановленной [12, 13]. Для обозначения последних в нашей стране продолжает широко использоваться термин «бронхоэктатическая болезнь».
3 Индекс BODE (Body – индекс массы тела; Obstruction – выраженность бронхиальной обструкции, определяемая посредством оценки ОФВ1; Dyspnea – выраженность одышки, определяемой посредством шкалы MRC; Exercise – толерантность к физической нагрузке, определяемая посредством теста с 6-минутной ходьбой) – многомерная скоринг-система, используемая для оценки долговременного прогноза и риска смерти больных ХОБЛ.
4 NNT (число больных, которых необходимо лечить) – эпидемиологический показатель, используемый в оценке эффективности медицинского вмешательства, обычно лечения препаратами. NNT показывает среднее число пациентов, которых необходимо лечить, чтобы достичь определенного благоприятного исхода или предотвратить один неблагоприятный исход, в сравнении с контрольной группой (Laupacis A., Sackett D.L., Roberts R.S. An assessment of clinically useful measures of the consequences of treatment // N. Engl. J. Med. 1988. Vol. 318. P. 1728–1733).
A.I. Sinopalnikov
Russian Medical Academy of Continuing Professional Education
Contact person: Aleksandr Igorevich Sinopalnikov, aisyn@list.ru
The article discusses the epidemiology, pathophysiology of bronchiectasis, as well as possible clinical consequences of chronic obstructive pulmonary disease (COPD) and bronchiectasis combinations. Tactics of treatment of patients with COPD and bronchiectasis is provided.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.