Катехоламин-индуцированная кардиомиопатия с развитием острой левожелудочковой недостаточности при манифестации феохромоцитомы
- Аннотация
- Статья
- Ссылки
- English
Основные положения. Феохромоцитома/параганлиома (ФХ/ПГ) – редко встречающаяся опухоль из хромаффинных клеток мозгового вещества надпочечников, экстраадреналовой хромаффинной ткани симпатических ганглиев и параганглиев различной локализации, продуцирующая катехоламины. Клиническая симптоматика ее разнообразна. Наиболее опасным для жизни проявлением считают катехоламин-индуцированный криз, который может быть спровоцирован различными причинами и протекает достаточно тяжело с развитием катехоламин-индуцированной кардиомиопатии и острой левожелудочковой недостаточности. В представленном наблюдении заболевание манифестировало клинической картиной острого очагового повреждения миокарда, осложненного отеком легких, острого почечного повреждения, повышением уровня кардиоспецифических ферментов, наличием зон гипокинеза и снижением фракции выброса левого желудочка, наличием признаков застоя по малому кругу кровообращения на рентгенограмме легких. В дальнейшем указанные изменения регрессировали, при обследовании диагностирована ФХ правого надпочечника, изменения со стороны сердечно-сосудистой системы расценены как проявления катехоламин-индуцированной кардиомиопатии. Медикаментозная терапия и успешно проведенная адреналэктомия обеспечили благоприятный прогноз жизни и здоровья пациентки. В обсуждении приводятся причины, патогенез, клинические проявления и лечение катехоламин-индуцированной кардиомиопатии при ФХ, описанные в литературе.
Заключение. Необходимо повышать осведомленность врачей в отношении ФХ. Если у пациента наблюдаются необъяснимая полиорганная недостаточность, гипертонический криз, лихорадка, следует проводить комплексное обследование для исключения ФХ.
Основные положения. Феохромоцитома/параганлиома (ФХ/ПГ) – редко встречающаяся опухоль из хромаффинных клеток мозгового вещества надпочечников, экстраадреналовой хромаффинной ткани симпатических ганглиев и параганглиев различной локализации, продуцирующая катехоламины. Клиническая симптоматика ее разнообразна. Наиболее опасным для жизни проявлением считают катехоламин-индуцированный криз, который может быть спровоцирован различными причинами и протекает достаточно тяжело с развитием катехоламин-индуцированной кардиомиопатии и острой левожелудочковой недостаточности. В представленном наблюдении заболевание манифестировало клинической картиной острого очагового повреждения миокарда, осложненного отеком легких, острого почечного повреждения, повышением уровня кардиоспецифических ферментов, наличием зон гипокинеза и снижением фракции выброса левого желудочка, наличием признаков застоя по малому кругу кровообращения на рентгенограмме легких. В дальнейшем указанные изменения регрессировали, при обследовании диагностирована ФХ правого надпочечника, изменения со стороны сердечно-сосудистой системы расценены как проявления катехоламин-индуцированной кардиомиопатии. Медикаментозная терапия и успешно проведенная адреналэктомия обеспечили благоприятный прогноз жизни и здоровья пациентки. В обсуждении приводятся причины, патогенез, клинические проявления и лечение катехоламин-индуцированной кардиомиопатии при ФХ, описанные в литературе.
Заключение. Необходимо повышать осведомленность врачей в отношении ФХ. Если у пациента наблюдаются необъяснимая полиорганная недостаточность, гипертонический криз, лихорадка, следует проводить комплексное обследование для исключения ФХ.
Введение
Феохромоцитома/параганлиома (ФХ/ПГ) – опухоль, продуцирующая катехоламины. В 90% случаев ФХ образуется из хромаффинных клеток мозгового вещества надпочечников, реже из экстраадреналовой хромаффинной ткани симпатических ганглиев и параганглиев различной локализации, секретирует преимущественно норадреналин, редко – адреналин, крайне редко – дофамин. Опухоль чаще локализуется в правом надпочечнике. С одинаковой частотой страдают мужчины и женщины в любом возрасте, чаще от 30 до 50 лет. Частота ФХ составляет 2–8 случаев на 1 млн населения, первичная заболеваемость – 1–2 случая на 100 тыс. взрослых в год [1–3]. Для ФХ характерны артериальная гипертензия (АГ), гиперкинетический тип кровообращения, выраженная вазоконстрикция, развитие гиповолемии [4]. Опасным проявлением ФХ является катехоламиновый криз, который может быть спровоцирован спонтанным кровоизлиянием в опухоль, нарушением ее кровоснабжения при инфаркте, эмоциональным воздействием, испугом, общей анестезией, использованием некоторых медикаментов (симпатомиметиков, инсулинов, сердечных гликозидов), приемом в пищу цитрусовых, сыра, шоколада, горчицы, красных вин, пальпацией живота, резким поворотом (при надпочечниковой локализации опухоли). Самым распространенным провоцирующим фактором криза является хирургическая резекция опухоли [4].
Во время криза при ФХ катехоламины секретируются бесконтрольно и непредсказуемо в большом количестве. Повышение уровня норадреналина в крови провоцирует увеличение потребности миокарда в кислороде, приводит к повреждению миоцитов, нарушению сократимости миокарда, опосредованной реакцией рецепторного аппарата кардиомиоцитов, а также вызывает сосудистые, воспалительные и метаболические нарушения [5, 6]. Развивается дисфункция левого желудочка (ЛЖ), которая может приводить к острым осложнениям: аритмии, отеку легких, сердечной недостаточности, кардиогенному шоку, инфаркту миокарда, инсульту [5] и даже смерти больного, которая наблюдается примерно в 15% случаев [4]. Катехоламиновый криз может сопровождаться стойкой неуправляемой гипотензией. Гипотензия развивается вследствие изменения чувствительности адренорецепторов к медиаторам при их длительной интенсивной стимуляции. Наблюдается неуправляемая гемодинамика – беспорядочное чередование повышения артериального давления (АД) с эпизодами гипотензии. АД практически не реагирует на введение медикаментов или характеризуется парадоксальным ответом [3].
При длительном и чрезмерном воздействии катехоламинов на миокард формируется катехоламин-индуцированная кардиомиопатия (КИКМП). Наблюдается три варианта КИКМП: острая (ишемическая такоцубо) или хроническая (гипертрофическая или дилатационная). Распространенность КИКМП при ФХ составляет 2,6–4,3% [6]. Для КИКМП, как правило, характерны симптомы острого инфаркта миокарда: загрудинная боль, одышка, изменения на электрокардиограмме (ЭКГ): подъемы или снижения сегмента ST, переходящие в диффузную инверсию зубца Т, наблюдается повышение активности кардиоспецифических ферментов. Функция желудочков всегда обратима, однако имеет значение длительность воздействия катехоламинов [5].
КИКМП при ФХ имеет схожие патофизиологические изменения со стрессовой кардиомиопатией такоцубо (первичная КИКМП, синдром «разбитого сердца»), возникающей вследствие эмоционального стресса, избыточного выброса адреналина и характеризующейся транзиторной систолической дисфункцией. Синдром такоцубо назван так на основании сходства ангиограммы ЛЖ (акинезия верхушки и средних сегментов в сочетании с гиперкинезией его базальных отделов) с ловушкой для осьминога. Он был описан японским кардиологом Хикару Сато и его коллегами в 1990 г. Нередко данное состояние приходится дифференцировать с инфарктом миокарда [7].
Клиническое наблюдение
Представляем клиническое наблюдение пациентки с ФХ правого надпочечника, осложненной катехоламин-индуцированным кризом, острой катехоламин-индуцированной кардиомиопатией со снижением фракции выброса (ФВ) ЛЖ до 34%, отеком легких, острым респираторным дистресс-синдромом (ОРДС), синдромом острого почечного повреждения. Она подписала добровольное информированное согласие на обезличенную публикацию клинического случая, одобренную локальным этическим комитетом.
Пациентка Д. 34 лет находилась на лечении в реанимационном, эндокринологическом, кардиологическом, хирургическом отделениях Новосибирской областной клинической больницы с 06.12.2024 г. по 23.01.2025 г. Жалобы при поступлении на периодически возникающее повышение АД до 240/120 мм рт. ст., сопровождающееся сердцебиением, слабостью, потливостью, дрожью в теле.
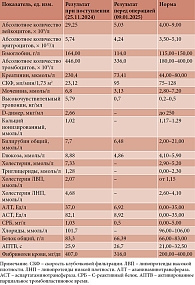
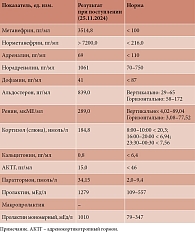
Анамнез заболевания. В течение 2024 г. отмечала приступы повышения АД до 210–240/110–120 мм рт. ст. Постоянную гипотензивную терапию не получала, эпизодически принимала каптоприл. С конца октября 2024 г. гипертонические кризы участились и стали более длительными и интенсивными. Вечером 24.11.2024 г. внезапно повысилось АД до 170/100 мм рт. ст., появились многократная рвота, кашель, давящая боль за грудиной с иррадиацией в челюсть. Прием каптоприла эффекта не дал. В дальнейшем нарастали тахикардия до 146 уд/мин и одышка с частотой дыхательных движений до 30 в минуту, сатурация крови (SpO2) снизилась до 90%, при аускультации в легких выслушивались влажные хрипы. Врач скорой медицинской помощи провел терапию изосорбида динитратом и фуросемидом без выраженного эффекта, пациентка была доставлена в стационар городской клинической больницы скорой медицинской помощи № 2, по экстренным показаниям госпитализирована в отделение реанимации. Состояние расценено как гипертонический криз с начинающимся отеком легких. В анализах крови при поступлении наблюдались лейкоцитоз, тромбоцитоз, уровень гемоглобина (Нв) – 164 г/л, повышение уровней креатинина, глюкозы, аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), тропонина, метанефрина, норметанефрина, норадреналина, кортизола слюны, остальные показатели были в пределах референсных значений или незначительно изменены (табл. 1, 2). В общем анализе мочи изменений не было.
На ЭКГ от 25.11.2024 г.: синусовая тахикардия, частота сердечных сокращений – 160 уд/мин. Слабое нарастание зубца R в V1–V3, умеренные изменения миокарда. На эхокардиограмме (ЭхоКГ) сердца 25.11.2024 г.: ФВ ЛЖ – 34%, левые отделы не расширены, умеренная митральная регургитация, диффузный гипокинез стенок ЛЖ, глобальная сократимость миокарда снижена; правые отделы не расширены; умеренная трикуспидальная регургитация; клапаны не изменены; небольшой выпот в полости перикарда, сепарация листков перикарда в диастолу за задней стенкой ЛЖ – 4 мм.
По данным рентгенографии органов грудной клетки (ОГК) от 25.11.2024 г.: в проекции средней и нижней трети левого легкого имеются склонные к слиянию участки снижения прозрачности слабой и средней интенсивности без четких контуров; легочный рисунок усилен в прикорневых, базальных отделах, сгущен в прикорневой зоне справа; корни не расширены, слева корень инфильтрирован; тень средостения не смещена. Заключение – признаки левосторонней полисегментарной пневмонии.
По данным ультразвукового исследования (УЗИ) вен нижних конечностей от 25.11.2024 г. признаков флеботромбоза вен нижних конечностей не выявлено.
Проводился дифференциальный диагноз с левосторонней полисегментарной пневмонией, тромбоэмболией легочной артерии, миокардитом, острым инфарктом миокарда, ВИЧ-инфекцией, синдромом диссеминированного внутрисосудистого свертывания, онкопроцессом. Выполнен онкопоиск (УЗИ малого таза, фиброгастродуоденоскопия, фиброколоноскопия): злокачественные новообразования исключены.
25.11.2024 г. по данным УЗИ органов брюшной полости (ОБП) и забрюшинного пространства впервые в проекции правого надпочечника обнаружено изоэхогенное образование с неоднородной структурой и жидкостными включениями, размером 4,6 × 6,4 см. Контур его четкий, ровный. УЗИ-признаки диффузных изменений паренхимы печени.
26.11.2024 г. установлен диагноз: ФХ правого надпочечника; катехоламин-индуцированный криз; острое повреждение миокарда, катехоламин-индуцированная кардиомиопатия со снижением ФВ ЛЖ до 34%, повышением уровня тропонина и формированием зон гипокинеза ЛЖ; отек легких; ОРДС, синдром острого почечного повреждения, транзиторная гипергликемия.
В отделении реанимации получала стерофундин, 500 мл, внутривенно капельно; эноксапарин, 0,4 мг, подкожно; доксазозин, 4 мг два раза в сутки, карведилол, 6,25 мг два раза в сутки, омепразол, 20 мг в сутки, инфузионную терапию, симптоматическое лечение.
Состояние пациентки улучшилось. В общем анализе крови от 05.12.2024 г. сохранялся тромбоцитоз – до 492 × 109/л, снизился Нв – до 108 г/л, нормализовалось число лейкоцитов – до 6,3 × 109/л, снизился уровень АСТ с 82,1 ЕД/л – до 29,5 ЕД/л, СКФ повысилась с 23,12 до 95 мл/мин/1,73 м2. На рентгенограмме ОГК от 28.11.2024 г. инфильтративных и очаговых изменений не определялось. Разрешился застой по малому кругу кровообращения. На ЭхоКГ сердца от 29.11.2024 г. ФВ ЛЖ – 64%, положительная динамика, левые отделы не расширены, митральная регургитация 0–1-й степени, нарушения диастолической функции нет.
Пациентка 06.12.2024 г. переведена по линии санитарной авиации в реанимационное отделение ГНОКБ.
Анамнез жизни. В течение жизни редко болела острыми респираторными вирусными заболеваниями, другие заболевания отрицает. Ранее курила десять сигарет в сутки, последние три месяца не курит. Работает руководителем отдела персонала в компании. Аллергологический анамнез не отягощен. Менструации регулярные по 3–5 дней, беременностей не было.
Объективно при поступлении в гНОКБ: состояние тяжелое. Тяжесть обусловлена сердечно-сосудистой недостаточностью на фоне основного заболевания. В сознании, адекватна. Отмечались умеренная влажность кожных покровов, субфебрилитет до 37,1 °С, тахикардия – 109 уд/мин, АГ – 202/134 мм рт. ст., SpO2 – 97%. Дыхание везикулярное. Тоны сердца ясные, ритмичные. Щитовидная железа не увеличена. Индекс массы тела – 23,5 кг/м2. Диагноз прежний. Продолжено обследование и лечение.
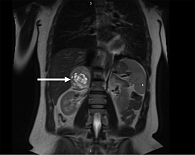
По данным магнитно-резонансной томографии (МРТ) ОБП и забрюшинного пространства от 10.12.2024 г.: правая почка оттеснена книзу неоднородным отграниченным образованием, локализованным вдоль внутренней ножки правого надпочечника, округлой формы, размерами 5,8 × 6,2 × 5,3 см; в центре жидкостный компонент, окруженный по контуру стромой с диффузным типом накопления контрастного препарата; левый надпочечник Y-образной формы, толщина ножек до 5 мм, без дополнительных образований.
Заключение: МР-томографические признаки кистозно-солидного образования правого надпочечника; микрокисты печени; конкремент в желчном пузыре, хронический холецистит; минимальный двусторонний гидроторакс.
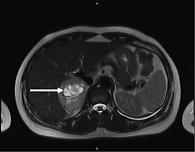
По данным компьютерной томографии (КТ) ОБП и забрюшинного пространства от 11.12.2024 г.: надпочечники – левый Y-образной формы, образований не выявлено; правый содержит образование, неравномерно накапливающее контрастное вещество, 63 × 53 мм. После внутривенного усиления накопление контрастного вещества в нативную, артериальную, венозную, отсроченную фазы составляло 29/56/52/47 HU (единиц по шкале Хаунсфилда) соответственно.
Заключение: КТ-признаки кистозно-солидного образования правого надпочечника, мелких кист печени, желчнокаменной болезни (ЖКБ), хронического холецистита; двусторонний минимальный гидроторакс (рис. 1, 2).
По данным холтеровского мониторирования сердечного ритма от 12.12.2024 г.: синусовый ритм с эпизодами миграции водителя ритма с участками предсердного ритма, средняя частота желудочковых сокращений (ЧЖС) – 90 уд/мин, минимальная – 62 уд/мин, максимальная – 143 уд/мин; за сутки 112 655 сердечных сокращений, максимальная пауза – 1024 мс (норма < 2000 мс), желудочковых экстрасистол – 0, суправентрикулярных – 15, один короткий пароксизм предсердной тахикардии с ЧЖС 133 уд/мин длительностью одна секунда, с последующим эпизодом неполной атриовентрикулярной диссоциации. Смещения сегмента ST не зарегистрировано. Циркадный индекс – 0,96 (норма 1,24–1,44).
По данным суточного мониторирования (СМ) АД от 16.12.2024 г.: среднее суточное АД – 141/82 мм рт. ст. (норма < 130/80 мм рт. ст.); среднее дневное АД – 143/83 мм рт. ст. (норма < 140/90 мм рт. ст.); среднее ночное АД – 131/76 мм рт. ст. (норма < 120/70 мм рт. ст.); индекс времени (ИВ) систолической гипертензии – 64% (норма < 25%), ИВ диастолической гипертензии – 20% (норма < 25%).
Заключение: увеличены систолическое артериальное давление (САД), ночное и суточное диастолическое артериальное давление (ДАД), ИВ систолической гипертензии; критерий систолической гипертензии – нон-диппер.
По данным ЭхоКГ от 07.12.2024 г.: аорта не изменена, клапаны не изменены, регургитации нет, полости не расширены, добавочная хорда в левом желудочке; зон гипокинеза нет; систолическая функция ЛЖ в норме, ФВ ЛЖ – 66%; легочной гипертензии и жидкости в полости перикарда нет.
Консилиум с участием профессора И.А. Бондарь состоялся 13.12.2024 г. На основании кризового течения АГ, осложненной отеком легких, высокого уровня метанефрина и норметанефрина, наличия образования в правом надпочечнике по данным УЗИ ОБП, мультиспиральной (МС) КТ, МРТ подтвержден диагноз: ФХ правого надпочечника, катехоламин-индуцированный криз от 24.11.2024 г., катехоламин-индуцированная кардиомиопатия со снижением ФВ ЛЖ до 34% (по Симпсону), отеком легких, ОРДС от 24.11.2024 г., острым почечным повреждением от 24.11.2024 г., транзиторной гипергликемией; ЖКБ, мелкие кисты печени. Показано оперативное лечение по жизненным показаниям, рекомендовано увеличить дозу метопролола до 25 мг утром и 12,5 мг вечером, увеличить дозу доксазозина до 16 мг в сутки, исследовать уровень натрийуретического пептида, повторить исследование уровня тропонина I, СМАД, провести тест шестиминутной ходьбы.
С 09.12.2024 г. лечение в реанимационном, далее в эндокринологическом и кардиологическом отделениях включало: прием доксазозина, 8 мг в сутки, постепенно доза увеличена до 12 мг, затем до 16 мг в сутки; прием метопролола, 12,5 мг два раза в сутки; введение раствора Рингера, 500,0 мл внутривенно капельно два раза в сутки; прием эноксапарина, 0,4 мл подкожно; прием омепразола, 20 мг два раза в сутки, оксигенотерапию, нутритивную поддержку.
По данным суточного мониторирования АД 09.01.2025 г.: среднее суточное АД – 112/67 мм рт. ст. (норма < 130/80 мм рт. ст.); среднее дневное АД – 113/67 мм рт. ст. (норма < 140/90 мм рт. ст.); среднее ночное АД – 110/68 мм рт. ст. (норма < 120/70 мм рт. ст.); ИВ систолической гипертензии – 0% (норма < 25%); ИВ диастолической гипертензии – 5% (норма < 25%).
Заключение. САД, ДАД, ИВ гипертензии в пределах нормы; критериев АГ нет; нон-диппер – по динамике ночного САД; найт-пикер – по динамике ночного ДАД.
На консилиуме от 10.01.2025 г. констатированы отсутствие катехоламин-индуцированных кризов, стабилизация АД, купирование острой сердечной недостаточности, нормализация функции почек и уровня глюкозы крови. Пациентка переведена в хирургическое отделение для оперативного лечения.
Оперативное вмешательство – адреналэктомия справа лапаротомным доступом – проведено 13.01.2025 г. Во время операции при выделении опухоли отмечался подъем АД до 200/130 мм рт. ст. Применялся урапидил, 50 мг внутривенно капельно в физрастворе. В последующем АД нормализовалось на уровне 120/70 мм рт. ст. В послеоперационном периоде проводилось лечение в отделении реанимации и интенсивной терапии, осложнений не наблюдалось. Макропрепарат для морфологического исследования – правый надпочечник с опухолью 7 × 6 × 5 см тугоэластической консистенции. При гистологическом исследовании: надпочечник с образованием, отграниченным псевдокапсулой. В одном из микропрепаратов – инвазия опухоли в псевдокапсулу. Опухоль состоит из гнезд опухолевых полигональных клеток, образующих альвеолярный рисунок. Клетки мелкие и более крупные, имеют везикулярные ядра с выраженными ядрышками с базофильной цитоплазмой. В строме есть множество полнокровных сосудов и капилляров, очаговые кровоизлияния. Заключение. Морфологическая картина соответствует ФХ.
Пациентка выписана на десятый день после операции со следующими рекомендациями. Наблюдение эндокринолога по месту жительства, обследование в динамике: УЗИ ОБП; исследование уровней метанефрина, норметанефрина в суточной моче через три месяца; генетическое консультирование; МСКТ ОБП и забрюшинного пространства через шесть месяцев, УЗИ щитовидной железы один раз в год, ведение дневника АД.
Обсуждение
Классическая, или первичная, стрессовая кардиомиопатия, возникающая вследствие эмоционального стресса, характеризуется острой, но обратимой левожелудочковой сердечной недостаточностью, по клиническим симптомам и электрокардиографическим признакам напоминающей острый коронарный синдром (ОКС). Впервые она была описана в 1984 г. профессором Ф.З. Меерсоном, который обобщил литературные данные и собственные исследования на животных и назвал это заболевание стрессорной кардиомиопатией [8].
Эмоциональный стресс активирует симпатическую нервную систему на уровне корковых и подкорковых центров мозга, гипоталамо-гипофизарно-надпочечниковой системы, что вызывает избыточную секрецию катехоламинов, нарушение сократимости миокарда. У предрасположенных к такому заболеванию пациентов вследствие микрососудистых нарушений может возникнуть кратковременная ишемия миокарда с последующей быстрой реперфузией. Быстрое восстановление сократимости миокарда подтверждает ведущее значение не ишемии миокарда, а метаболических и воспалительных нарушений [6].
Вторичная КИКМП возникает при обострении соматической патологии, при воздействии физических триггеров, в том числе и в случае адреналинпродуцирующей ФХ, при которой наблюдается катехоламиновый шторм по аналогии со стрессовой ситуацией [9]. В отличие от классической КИКМП, при кардиомиопатии, вызванной ФХ, пациенты достоверно моложе, имеют более высокую частоту тяжелой сердечной недостаточности и кардиогенного шока [7].
Так как электрокардиографические и лабораторные признаки разрушения кардиомиоцитов неспецифичны, КИКМП, вследствие прямого воздействия катехоламинов на миокард, сложно дифференцировать с ишемией миокарда. Однако аритмии, некрозы миокарда, цитолитический синдром, электро- и эхокардиографические изменения в большинстве наблюдений не связаны с изменениями коронарного кровообращения [3].
В нашем случае наличие характерной клинической картины заболевания при первичном обращении позволило заподозрить ОКС, осложненный отеком легких на фоне катехоламин-индуцированного криза. Об этом свидетельствовали давящие боли за грудиной, признаки острой сердечной недостаточности (тахикардия и одышка, снижение SpO2), кашель, влажные хрипы при аускультации в легких, участки снижения прозрачности в левом легком, усиление легочного рисунка в прикорневых зонах по данным КТ – первоначально расценены как признаки левосторонней пневмонии, – повышение уровня тропонина, снижение ФВ ЛЖ, диффузный гипокинез стенок ЛЖ по данным ЭхоКГ. Наблюдались также признаки полиорганной недостаточности (ОРДС, синдром острого почечного повреждения). Внезапное появление неспецифичных симптомов криза может приводить к ошибочной диагностике сепсиса, необъяснимого шока, левожелудочковой или полиорганной недостаточности, лактацидоза.
Уже на второй день госпитализации инфаркт миокарда был исключен, учитывая молодой возраст, неотягощенный анамнез по кардиологическим заболеваниям, отсутствие нарастания уровня кардиоспецифических ферментов, отсутствие характерной динамики на ЭКГ и зон гипокинеза на ЭхоКГ через четыре дня, повышение ФВ ЛЖ до 64%, разрешение застоя по малому кругу кровообращения через три дня наблюдения. Показаний для проведения коронарографии не было. Клинические, лабораторные, электрокардиологические, изменения по данным УЗИ со стороны сердечно-сосудистой системы расценили как проявления катехоламин-индуцированной кардиомиопатии.
Для ФХ характерно чаще кризовое течение АГ, которое сопровождается множеством других клинических симптомов [10]. В ряде исследований оценивали информативность симптомов и их ценность для дифференциальной диагностики ФХ и эссенциальной гипертензии. Констатировано отсутствие специфических симптомов при ФХ [11, 12]. В нашем случае анализ истории болезни подтвердил кризовое течение АГ у пациентки с подъемом АД до 240/120 мм рт. ст. При манифестации криз длился несколько часов, наблюдались следующие симптомы: кризовая АГ, нейроретинопатия, потливость, постоянная тахикардия без связи с физической нагрузкой, беспричинный субфебрилитет, лейкоцитоз, гипергликемия в анализах крови. Субфебрилитет, гипергликемия (с активацией гликогенолиза и снижением продукции инсулина), снижение массы тела являются следствием гиперметаболизма при ФХ [13]. Кризовое течение АГ, молодой возраст могли насторожить специалистов и позволить предположить у пациентки наличие ФХ. Раннее обращение за медицинской помощью, возможно, могло предотвратить развитие острого сердечно-сосудистого события.
Высокая гормональная активность ФХ подтверждается с помощью скринингового теста – исследования уровней норметанефрина (метаболит норадреналина), метанефрина (метаболит адреналина) и метокситирамина (метаболит дофамина) в плазме крови или в моче. Вероятность диагноза ФХ высока при значительном превышении верхней границы референсного интервала показателей. Еще одним маркером ФХ является хромогранин А при чувствительности теста, составляющей 90%. Однако специфичность теста невысока: уровень хромогранина А может повышаться при других нейроэндокринных опухолях [10]. В настоящем исследовании уровень нефринов превышал референсные значения в 33–35 раз. Во время криза ФХ может продуцировать и другие гормоны: кальцитонин, вазоактивный интестинальный пептид, дофамин, нейропептид Y, адренокортикотропный гормон [3]. В нашем случае у пациентки были повышены уровни альдостерона, ренина, кортизола, паратгормона, кальцитонина, пролактина.
Для уточнения локализации патологического процесса первоначально рекомендуется КТ ОБП и таза чувствительностью 88% и точностью 90–95% при размерах ФХ более 1,3 см. При этом отмечают более высокую нативную плотность ФХ (более 10 HU), процент вымывания, составляющий более 60 за 15 минут [14]. Лучшее пространственное разрешение может быть получено с помощью МРТ чувствительностью 100% и сцинтиграфии с метайодбензилгуанидином (МИБГ) – 131I-МИБГ или 123I-МИБГ (чувствительность 100%), последняя показана также при вненадпочечниковых ФХ. Высокая чувствительность у позитронно-эмиссионной томографии (ПЭТ/КТ) с пептидом, конъюгированным с рецептором соматостатина 68Ga-DOTA (68Ga-DOTA-SST), с точностью 93%, 95%-ный доверительный интервал (95% ДИ) 91–95%. Чаще используется ПЭТ/КТ с 18F-фтордезоксиглюкозой (18F-ФДГ) с частотой обнаружения 74% (95% ДИ 46–91%), а также ПЭТ/КТ с 18F-L3,4-дигидроксифенилаланином (18F-ДОФА) при наследственной ФХ кластера 2 с 80%-ным уровнем обнаружения (95% ДИ 69–88%) [15]. Сцинтиграфия и ПЭТ/КТ показаны при множественном поражении, метастазах, атипичной локализации ФХ [16]. В представленном случае по данным визуализирующих методов (УЗИ, КТ, МРТ) установлены размеры и локализация ФХ.
Таким образом, через несколько часов после поступления пересмотрен диагноз в пользу ФХ правого надпочечника, катехоламин-индуцированной кардиомиопатии с катехоламин-индуцированным кризом, учитывая АГ, наличие изоэхогенного образования в правом надпочечнике по данным УЗИ, повышение уровня метанефрина, норметанефрина, норадреналина. В дальнейшем опухоль надпочечника подтверждена результатами МСКТ и МРТ надпочечников и гистологического исследования.
Для предоперационной подготовки рекомендованы блокаторы постсинаптических альфа-1-адренорецепторов, которые снижают общее периферическое сосудистое сопротивление, АД, предупреждают вазоконстрикцию. Чаще используют селективные антагонисты альфа-1-адренорецепторов – доксазозин, от 4 до 16 мг в сутки. Менее селективен феноксибензамин, начиная с 10 мг перорально два раза в день с увеличением дозы до 1 мг/кг/сут. Через 3–4 дня присоединяют бета-блокаторы, предпочтение отдается селективным препаратам для контроля тахикардии. Дополнительно используют блокаторы кальциевых каналов (амлодипин или нифедипин) и сульфат магнезии, снижающие секрецию катехоламинов [10].
Симптоматическая терапия представлена альфаметилпаратирозином, до 4 г в сутки, блокирующим синтез тирозинкиназы, которая регулирует синтез катехоламинов. Имеются сообщения об эффективности милринона и левосимендана, которые действуют не адренергическим путем, а снижают постнагрузку и обеспечивают инотропную поддержку, хотя их применение при стрессовой кардиомиопатии не рекомендуется. Использование экстракорпоральной мембранной оксигенации увеличило выживаемость в больнице при трудноизлечимом кризе до 87% [4]. Ранее сообщалось об уровне смертности в 20% [4].
Рекомендуется увеличить потребление воды и соли за 10–14 дней до операции для предотвращения послеоперационной гипотензии и гиповолемии [16]. В нашем исследовании для коррекции АГ потребовались длительная терапия доксазозином (в течение 49 дней) и максимальная доза препарата – 16 мг в сутки. В связи с тахикардией на втором этапе лечения был присоединен метопролол.
Выбор оперативного вмешательства при ФХ (лапароскопическая или открытая адреналэктомия, с помощью трансабдоминального или ретроперитонеального подхода) зависит от размера опухоли, одно- или двустороннего поражения, наличия или отсутствия локальной инвазии [16]. В настоящем исследовании размеры опухоли были более 5 см, что потребовало выполнения адреналэктомии лапаротомным доступом.
Во время операции необходима осторожность для предупреждения выброса катехоламинов, особенно при наличии кистозных изменений в опухоли. Следует контролировать и надпочечниковую вену, чтобы избежать снижения периферического сосудистого сопротивления после удаления опухоли [16]. В данном случае имелся кистозный компонент в структуре опухоли, а во время операции, несмотря на предоперационную подготовку, отмечен эпизод подъема АД до 200/130 мм рт. ст. во время выделения опухоли, что потребовало введения урапидила, 50 мг внутривенно капельно в физрастворе, после чего АД нормализовалось. Предоперационную биопсию не выполняли.
Заключение
В представленном наблюдении манифестация ФХ сопровождалась клинической картиной катехоламин-индуцированной кардиомиопатии с развитием острого очагового повреждения миокарда и острой левожелудочковой недостаточности, что потребовало дифференцировать данное состояние с инфарктом миокарда. С учетом молодого возраста пациентки, не отягощенного кардиологического анамнеза, быстрого восстановления систолической функции, отсутствия зон гипокинеза по ЭхоКГ, разрешения застоя по малому кругу кровообращения был исключен острый коронарный синдром. Полноценная предоперационная подготовка, успешно выполненная адреналэктомия предопределили благоприятный прогноз жизни и здоровья пациентки.
Необходимо повышать осведомленность врачей в отношении ФХ. Если у пациента наблюдаются необъяснимая полиорганная недостаточность, гипертонический криз, лихорадка, следует проводить комплексное обследование для исключения ФХ.
I.A. Bondar, PhD, Prof., L.I. Chesnochenko, PhD
Novosibirsk State Medical University
Contact person: Irina A. Bondar, bondaria@oblmed.nsk.ru
Aim. To present a successful experience in the treatment of catecholamine-induced cardiomyopathy in a patient with a pheochromocytoma of the right adrenal gland.
Key points. Pheochromocytoma/paraganglioma (PC/PG) is a rare tumor originating from the chromaffin cells of the adrenal medulla, extra-adrenal chromaffin tissue of the sympathetic ganglia, and paraganglia of various locations that produce catecholamines. Its clinical symptoms are diverse. The most life-threatening manifestation is considered to be a catecholamine-induced crisis, which can be triggered by various causes and is quite severe, leading to the development of catecholamine-induced cardiomyopathy and acute left ventricular failure. In this case, the disease manifested itself with a clinical picture of acute focal myocardial damage, complicated by pulmonary edema, acute renal damage, elevated cardiac-specific enzymes, hypokinetic zones, reduced left ventricular ejection fraction, and signs of pulmonary congestion on chest X-ray. Subsequently, these changes regressed, and the patient was diagnosed with right adrenal gland phlebitis. Changes in the cardiovascular system were considered to be manifestations of catecholamine-induced cardiomyopathy. The successful medical treatment and adrenalectomy provided a favorable prognosis for the patient's life and health. The discussion includes the causes, pathogenesis, clinical manifestations, and treatment of catecholamine-induced cardiomyopathy in PC, as described in the literature.
Conclusion. It is necessary to raise awareness among doctors regarding PC. If a patient experiences unexplained multi-organ failure, hypertensive crisis, fever, or lactic acidosis, a comprehensive examination should be conducted to confirm the diagnosis and to prescribe optimal treatment to improve survival rates.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


