Хронический запор: актуальность проблемы и современные возможности терапии
- Аннотация
- Статья
- Ссылки
- English
Согласно эпидемиологическим данным, эта патология поражает до четверти всей популяции экономически развитых стран и существенно влияет на качество жизни больных. Несмотря на высокую распространенность заболевания, пациенты крайне редко обращаются за медицинской помощью. В статье представлены современные данные об эпидемиологии, факторах риска, диагностических критериях и возможностях терапии хронического запора.
Согласно эпидемиологическим данным, эта патология поражает до четверти всей популяции экономически развитых стран и существенно влияет на качество жизни больных. Несмотря на высокую распространенность заболевания, пациенты крайне редко обращаются за медицинской помощью. В статье представлены современные данные об эпидемиологии, факторах риска, диагностических критериях и возможностях терапии хронического запора.


Введение
Под термином «запор» понимают комплекс симптомов, связанных с уменьшением частоты актов дефекации (менее трех раз в неделю), изменением консистенции каловых масс (твердые, фрагментированные), избыточным натуживанием, а также ощущением неполного опорожнения прямой кишки [1, 2]. Принято выделять острый запор, длительность которого не превышает семи суток, и хронический запор (ХЗ), при котором продолжительность симптоматики превышает три месяца [2]. Именно последний тип представляет глобальную медико-социальную проблему и имеет высокую значимость для современной гастроэнтерологии. Во многом это обусловлено широкой распространенностью ХЗ в популяции, а также существенным негативным влиянием на качество жизни больных [3].
В настоящее время в зарубежной литературе ХЗ подразделяют на первичный и вторичный [2, 4]. К первичным относят запоры, обусловленные алиментарными (низкое потребление воды и клетчатки) и поведенческими факторами (низкая физическая активность), а также первичными нарушениями моторики толстой кишки и координации мышечного аппарата, обеспечивающих дефекацию. В свою очередь вторичный ХЗ обусловлен приемом медикаментозных препаратов, обладающих потенциалом в отношении индукции запора (опиоидные анальгетики, антидепрессанты, психотропные и противосудорожные средства, нейролептики и т.д.), или наличием у пациента ряда органических, системных и психиатрических заболеваний (колоректальный рак, дивертикулез толстой кишки, гипотиреоз, болезнь Паркинсона, рассеянный склероз, амилоидоз, расстройство пищевого поведения и др.) [2, 4]. Первичный ХЗ подразделяют на три основные группы:
- хронический идиопатический запор: запор с нормальным транзитом и синдром раздраженного кишечника с преобладанием запора (СРК-З);
- нарушения ректальной эвакуации: диссинергическая дефекация, инвагинация прямой кишки, синдром нисходящей промежности, выпадение прямой кишки и ректоцеле;
- запор с замедленным транзитом: мегаколон, связанный с болезнью Гиршпрунга, болезнью Шагаса, хронический идиопатический мегаколон и мегаколон, ассоциированный с синдромом множественной эндокринной неоплазии 2-го типа.
Большинство клинических случаев первичного ХЗ представлено хроническим идиопатическим запором, запором с нормальным транзитом [2, 3]. При этом типе ХЗ нейромышечная функция толстой кишки интактна, поэтому в литературе его нередко называют функциональным запором, что отражено в последних критериях Римского консенсуса IV пересмотра (2016 г.) [5, 6]. Хронический паттерн течения данного заболевания негативно влияет на качество жизни больных и сопряжен со значительными прямыми и косвенными экономическими затратами. Это обусловливает актуальность проблемы для современной клинической медицины [2, 3].
Эпидемиология и факторы риска
Сегодня тенденция к росту распространенности ХЗ отмечается не только в европейских странах, но и азиатском регионе, где в силу культурных особенностей питания запор еще до недавних пор был относительно редким явлением.
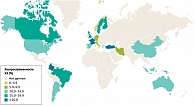
Крупнейший метаанализ 45 кросс-секционных социологических исследований на различных континентах продемонстрировал, что глобальная распространенность хронического идиопатического запора составляет 14% (рис. 1) [7]. В двух связанных между собой азиатских исследованиях, проведенных в Южной Корее, Китае и Индонезии, распространенность запора составила 15–23% среди женщин и приблизительно 11% среди мужчин [8, 9]. В экономически развитых странах ХЗ поражает до четверти всей популяции [7, 10]. В целом данное заболевание чаще выявляется в субпопуляциях с низким социально-экономическим статусом (отношение шансов (ОШ) 1,32; 95%-ный доверительный интервал (ДИ) 1,11–1,57) [7].
В ряде работ показано, что распространенность ХЗ среди женщин в среднем в два-три раза выше, чем среди мужчин [11, 12]. В указанном метаанализе общая распространенность ХЗ среди женщин почти в два раза превысила таковую среди мужчин (17,4% (95% ДИ 13,4–21,8) и 9,2% (95% ДИ 6,5–12,2); ОШ 2,22 (95% ДИ 1,87–2,62) соответственно) [7].
Сохраняется тенденция и в отношении возрастного ценза пациентов: распространенность констипации увеличивается до 50% среди лиц в возрасте старше 65 лет и до 74% к концу жизни [13, 14].
Систематизация трех исследований со сходным дизайном наглядно продемонстрировала этот тренд риска: ОШ 1,20 (95% ДИ 1,09–1,33) в возрасте 30–44 года, ОШ 1,31 (95% ДИ 1,09–1,58) в возрасте 45–59 лет и ОШ 1,41 (95% ДИ 1,17–1,70) в возрасте ≥ 60 лет [8, 9, 15].
При таком росте заболеваемости ХЗ переходит в разряд медико-социальных проблем, поскольку увеличивает не только прямые, но и косвенные затраты [16]. Именно поэтому вопросы рациональной диагностики и лечения ХЗ крайне важны для клиницистов.
Диагностика
Современный диагностический алгоритм ХЗ предполагает несколько этапов. Сначала необходимо идентифицировать признаки заболевания, согласно Римским критериям IV пересмотра (2016 г.) (таблица) [5, 6].
При расспросе пациента для объективизации консистенции и формы кала практикующему врачу целесообразно пользоваться бристольской шкалой (рис. 2) [17, 18]. При запоре процентное содержание воды в кале снижается до < 60%, что обусловливает изменение формы, характерное для 1–2-го типов. В то же время нормальному стулу соответствует 3–4-й тип [17, 18].
Далее следует исключить СРК-З, а также выявить так называемые симптомы «красных флагов», указывающих на наличие органической патологии [16, 19]. Основным критерием дифференциальной диагностики ХЗ с СРК-З является наличие болевого абдоминального синдрома, весьма специфичного для СРК [6, 20]. При ХЗ также могут отмечаться эпизоды абдоминальной боли, но для СРК это облигатный признак [21, 22]. Однако не стоит забывать, что болевой абдоминальный синдром может наблюдаться и при органической патологии, способствующей развитию запора [16, 19, 21]. Для выявления указанных симптомов проводится скрининг на «красные флаги», такие как: гематохезис (наличие неизмененной крови в стуле);
- анемия;
- лихорадка;
- анорексия;
- потеря массы тела;
- появление симптомов в возрасте старше 50 лет;
- усиление запоров в возрасте старше 50 лет;
- патологические изменения объективного статуса, лабораторных показателей, инструментальных исследований;
- положительный тест на скрытую кровь;
- колоректальный рак и рак другой локализации у родственников;
- воспалительные заболевания кишечника у родственников;
- целиакия у родственников.
Отсутствие всех перечисленных симптомов «красных флагов» должно подтолкнуть врача к дальнейшему диагностическому поиску в целях идентификации генеза ХЗ. Так, для исключения вторичного ХЗ целесообразно проведение тщательного лабораторно-инструментального исследования. Речь идет о клиническом и биохимическом анализах крови, мочи, копрологическом исследовании или анализе кала на скрытую кровь, пальцевом исследовании прямой кишки, ректороманоскопии, колоноскопии; полипозиционной ирригоскопии с двойным контрастированием [3, 4, 23]. При выявлении вторичного генеза ХЗ помимо симптоматической терапии проводится лечение, направленное на разрешение основного заболевания. Для выбора адекватной тактики лечения нередко требуются консультации узких специалистов. В отсутствие вторичных причин ХЗ необходимо начинать эмпирическую терапию [2].
Лечение
Лечение ХЗ остается не самой простой задачей для клинициста по ряду причин [24]. В целом лишь 34% больных обращаются за медицинской помощью [25]. Как правило, пациенты обращаются к врачу с такой деликатной проблемой, как запор, уже тогда, когда возможность доступных средств исчерпана (безрецептурные слабительные в произвольном количестве и комбинациях, изменение рациона питания и злоупотребление очистительными процедурами). Длительный анамнез констипации и беспокоящей симптоматики, нарастающая тревога по поводу безуспешности проведенных мероприятий нередко становятся мотивирующим фактором первичного обращения к специалисту [24].
Первоочередным методом в рамках терапии ХЗ является модификация образа жизни [1, 2, 12, 24, 26]. В большинстве случаев пациентам рекомендуют повысить уровень регулярной физической нагрузки, а также потребление жидкости до двух литров в сутки. Тем не менее контролируемых исследований, подтверждающих эффективность подобных рекомендаций у больных ХЗ, не существует [2].
В российских и зарубежных клинических рекомендациях сказано, что все пациенты с ХЗ должны придерживаться диеты, обогащенной клетчаткой [1, 27, 28]. Так, рекомендуется увеличение содержания в пищевом рационе пищевых волокон (ПВ) до 20–25 г в сутки [1, 2]. Эффективность такого подхода в популяциях пациентов с ХЗ и СРК-З показана в ряде систематических обзоров [29–31]. Следует отметить, что пшеничные отруби часто вызывают метеоризм, и до 50% пациентов самостоятельно прекращают их прием, что ограничивает использование ПВ при ХЗ [1]. Рациональным подходом является назначение препаратов или биологически активных добавок к пище на основе ПВ. Начало терапии ХЗ с увеличивающих объем кишечного содержимого слабительных наиболее физиологично, поскольку такой подход не изменяет природного механизма транзита и эвакуации [24]. При этом лечение ПВ требует приема достаточного количества жидкости для увеличения объема стула, стимуляции моторики и облегчения дефекации. Адекватная доза слабительного препарата в каждом конкретном случае строго индивидуальна и достигается постепенно [24, 32]. Действие ПВ реализуется в течение 12–72 часов, а положительный эффект – в течение 4–6 недель. Поэтому для оценки эффективности лечения необходим курс не менее двух месяцев [24, 33]. ПВ играют очень важную роль в изменении кишечной микробиоты, оказывая пребиотические эффекты, такие как стимулирование роста и/или функции полезных кишечных микроорганизмов [3].
Среди препаратов, содержащих натуральные ПВ, в рамках терапии ХЗ целесообразно применять псиллиум или частично гидролизованную гуаровую камедь (ЧГГК), представленную в России продуктом Оптифайбер.
Эффективность ЧГГК у пациентов с ХЗ и СРК-З продемонстрирована в ряде исследований [34–38]. При этом у пациентов с СРК-З помимо разрешения запора отмечался регресс абдоминальной боли, а также вздутия живота на фоне монотерапии ЧГГК [36–38]. В недавнем метаанализе семи исследований показано, что применение ЧГГК достоверно способствует превенции развития ХЗ (стандартизированная разность средних частоты актов дефекации до и после терапии: 0,58 раза в сутки; 95% ДИ 0,43–0,74) [39].
В клинических исследованиях наглядно продемонстрирована эффективность ЧГГК в рамках терапии СРК. G.C. Parisi и соавт. сравнивали положительные эффекты ЧГГК с рационом с высоким содержанием волокон, обычно применяемым при лечении СРК в клинических условиях. 188 пациентов были рандомизированы на две группы для назначения волокон или ЧГГК. Пациенты первой группы получали рацион с высоким содержанием волокон – 30 г/сут пшеничных отрубей, пациенты второй – напиток с ЧГГК в дозе 5 г/сут. ЧГГК добавляли в 60 мл напитка со вкусом яблока, который нужно было принимать утром, незадолго до завтрака. Через четыре недели пациентам, которые не были удовлетворены лечением, разрешали перейти в другую исследуемую группу. Почти половина пациентов группы ПВ перешла в группу ЧГГК (82,1% пациентов использовали возможность поменять группу). В то же время только 10 (10,9%) пациентов из группы ЧГГК перешли в группу ПВ (17,9% пациентов воспользовались возможностью поменять лечение). Авторы установили, что ЧГГК в дозе 5 г/сут нормализовала работу кишечника не только при запоре, но и при всех трех вариантах СРК – с преобладанием диареи (СРК-Д), преобладанием запора (СРК-З) и при изменчивой работе кишечника и уменьшило боль в животе: ЧГГК пациенты переносили лучше, чем рацион с высоким содержанием волокон. В период последующего наблюдения большинство больных решили перейти с лечения волокнами на прием ЧГГК. Частота положительного эффекта оказалась значимо выше в группе ЧГГК по сравнению с группой ПВ (почти 65 и 40% соответственно) [37].
Пребиотический эффект ЧГГК продемонстрирован в двух независимых исследованиях. Показано увеличение количества молочнокислых бактерий и Bifidobacterium spp. в кале после назначения препарата [34, 40]. При этом в исследовании с привлечением здоровых добровольцев были описаны состояния после двух недель приема ЧГГК. Интересно, что наряду с увеличением количества Bifidobacterium и Lactobacillus spp. наблюдалось уменьшение количества Clostridium spp., представителей семейств Enterobacteriaceae и Streptococcaceae [40].
Изучена еще одна интересная область применения ЧГГК – модуляция патологической кишечной микробиоты при синдроме избыточного бактериального роста в тонком кишечнике (СИБР). Так, в исследовании M. Furnari и соавт. 77 пациентов с диагностированным СИБР после дыхательного теста с 50 г глюкозы были рандомизированы на группы для назначения рифакcимина 1200 мг/сут или 1200 мг/сут плюс ЧГГК 5 г/сут в течение десяти дней. Пациенты заполняли опросник оценки симптомов и выполняли дыхательный тест с глюкозой исходно и через месяц после отмены терапии. Установлено, что комбинация ЧГГК с рифаксимином значимо более эффективна, чем только рифаксимин, в отношении эрадикации СИБР. Таким образом, на фоне применения комбинации уровень эрадикации достиг 87,1%, что значимо выше, чем показатель при использовании только рифаксимина (62,1%) [41].
Согласно национальным рекомендациям, при неэффективности модификации образа жизни и препаратов на основе ПВ у пациентов с ХЗ целесообразно использовать осмотические слабительные (полиэтиленгликоль, лактулозу, лактитол), а при рефрактерности – стимулирующие слабительные (бисакодил, пикосульфат натрия) [1]. Использование препаратов на основе сенны (листья кассии) нежелательно по причине не только известного свойства вызывать псевдомеланоз толстой кишки, но и отсутствия данных об эффективности. Как правило, в исследованиях, связанных с ХЗ, сенна изучается в комбинации с ПВ или другими препаратами. При длительном использовании не исключены нарушения электролитного и кислотно-щелочного баланса, повреждения подслизистых нервных сплетений толстой кишки [24, 42].
Заключение
Хронический запор является важнейшей глобальной медико-социальной проблемой. Согласно эпидемиологическим данным, эта патология регистрируется у четверти всей популяции экономически развитых стран и существенно снижает качество жизни больных. Модификация образа жизни и применение препаратов на основе пищевых волокон относятся к приоритетным инициальным направлениям в лечении пациентов с данным заболеванием.
D.S. Bordin, MD, PhD, Prof., Yu.A. Kucheryavy, PhD, D.N. Andreyev, PhD
A.S. Loginov Moscow Clinical Scientific and Practical Center
Tver State Medical University
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Dmitry N. Andreyev, dna-mit8@mail.ru
Chronic constipation is a global medical and social problem. According to epidemiological data, this pathology attacks up to a quarter of the entire population of economically developed countries in the world and significantly affects the patients’ quality of life. Despite of the high prevalence of the disease, patients rarely seek for medical help. The article presents current data on epidemiology, risk factors, diagnostic criteria and possibilities of chronic constipation therapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.