количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Клинические случаи
Клинический случай применения таргетной терапии Нексаваром при метастатическом почечно-клеточном раке
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Урология и Нефрология" №5
- Аннотация
- Статья
- Ссылки
Открытие механизмов развития почечно-клеточного ракаспособствовало разработке новых препаратов для лечения метастатического почечно-клеточного рака, относящихся к группе таргетных препаратов или ингибиторов тирозинкиназ.
Таргетная терапия демонстрирует высокую эффективность, хорошую переносимость и низкую частоту нежелательных явлений при улучшении показателей общей выживаемости и выживаемости без прогрессирования у больных метастатическим почечно-клеточным раком.
В статье представлено клиническое наблюдение больной Л., которой была проведена терапия сорафенибом, описаны профиль токсичности препарата и методы купирования нежелательных побочных явлений.
Установлено, что использование таргетных препаратов является оправданным и обеспечивает контроль над заболеванием при удовлетворительной переносимости.
Открытие механизмов развития почечно-клеточного ракаспособствовало разработке новых препаратов для лечения метастатического почечно-клеточного рака, относящихся к группе таргетных препаратов или ингибиторов тирозинкиназ.
Таргетная терапия демонстрирует высокую эффективность, хорошую переносимость и низкую частоту нежелательных явлений при улучшении показателей общей выживаемости и выживаемости без прогрессирования у больных метастатическим почечно-клеточным раком.
В статье представлено клиническое наблюдение больной Л., которой была проведена терапия сорафенибом, описаны профиль токсичности препарата и методы купирования нежелательных побочных явлений.
Установлено, что использование таргетных препаратов является оправданным и обеспечивает контроль над заболеванием при удовлетворительной переносимости.
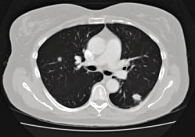
Рис. 1. Метастазы в легкие перед началом таргетной терапии Нексаваром
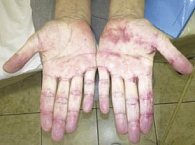
Рис. 2. Побочные эффекты: ладонно-подошвенный синдром
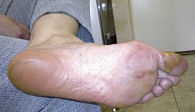
Рис. 3. Побочные эффекты: ладонно-подошвенный синдром
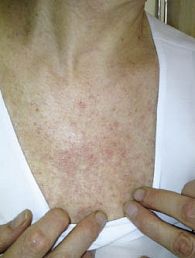
Рис. 4. Побочные эффекты: сыпь
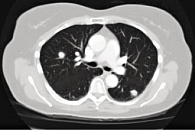
Рис. 5. Метастазы в легкие после 18 месяцев таргетной терапии Нексаваром
Почечно-клеточный рак (ПКР) является одним из наиболее распространенных онкоурологических заболеваний. Ежегодно в мире диагностируют около 210 000 новых случаев ПКР, что составляет 2% в структуре онкологической заболеваемости [1]. В России стандартизованный показатель заболеваемости злокачественными опухолями почки составляет 8,7 на 100 000 населения [2]. По темпам прироста онкологической заболеваемости ПКР устойчиво занимает одну из лидирующих позиций (34,8%). В 2009 г. в нашей стране выявлено 18 328 больных со злокачественными новообразованиями почки, 8586 человек умерли от ПКР.
Первым и основным этапом лечения ПКР начальных стадий остается хирургическое вмешательство, которое излечивает большинство больных. При первичном обращении у 50–60% пациентов диагностируют локализованный ПКР, однако впоследствии у 20–40% из них будут выявлены метастазы. Возможности хирургического лечения метастатического ПКР крайне ограничены. Наиболее эффективным методом лечения метастатического ПКР является таргетная терапия. В настоящее время в арсенале онкологов и урологов уже имеются следующие таргетные препараты: сунитиниб (Сутент), сорафениб (Нексавар), темсиролимус (Торисел), бевацизумаб (Авастин), эверолимус (Афинитор) и пазопаниб (Вотриент). Клинические исследования продолжаются, ожидается появление новых препаратов и схем лечения [3]. Опыт применения таргетных препаратов продемонстрировал уникальные результаты в исследованиях II и III фазы: увеличение выживаемости без прогрессирования и общей выживаемости больных метастатическим ПКР при умеренно выраженной токсичности.
Один из первых исследованных и зарегистрированных таргетных препаратов сорафениб МНИОИ им. П.А. Герцена Минздравсоцразвития России РУДН, кафедра урологии с курсом онкоурологии Д.м.н., проф. Б.Я. АЛЕКСЕЕВ, к.м.н. А.С. КАЛПИНСКИЙ Клинический случай применения таргетной терапии Нексаваром при метастатическом почечно-клеточном раке Онкоурология 29 ЭФ. Урология. 5/2011 (Нексавар) относится к группе мультикиназных ингибиторов, действующих одновременно как на рецепторы тирозинкиназы, так и на серин/треонинкиназы в опухолевых клетках и сосудах.
В регистрационное исследование III фазы TARGET (Treatment Approaches in Renal Cancer Global Evaluation Trial) были включены 903 больных метастатическим ПКР, ранее получавших терапию цитокинами. Результаты показали, что медиана выживаемости без прогрессирования оказалась достоверно более продолжительной в группе больных, принимавших сорафениб, чем в группе плацебо (5,5 мес. против 2,8 мес., p < 0,01). Частичный ответ зарегистрирован у 10% пациентов, получавших сорафениб, по сравнению с 2% в группе плацебо (р < 0,001). Окончательный анализ общей выживаемости с исключением пациентов из группы плацебо, переведенных на терапию сорафенибом, также выявил достоверное преимущество показателей общей выживаемости в группе сорафениба по сравнению с группой плацебо: 17,8 мес. и 14,3 мес. соответственно (р = 0,0287) [4–6].
Эффективность и безопасность применения сорафениба также подтверждены в двух открытых исследованиях с расширенными критериями включения ARCCS (Advanced Renal Cell Carcinoma Sorafenib), выполненных в странах Северной Америки и Европы с участием 2504 и 1155 больных соответственно [7–9]. Так, в нерандомизированном открытом исследовании сорафениба, проводившемся в странах Северной Америки (США и Канада), были изучены эффективность и безопасность применения данного таргетного препарата у 2504 больных распространенным ПКР, которым невозможно было провести таргетную терапию в рамках других исследований. В исследование были включены пациенты с несветлоклеточными опухолями, метастазами в головной мозг, пожилого возраста, а также ранее получавшие терапию другими препаратами, в том числе таргетными. Согласно опубликованным результатам по оценке эффективности терапии сорафенибом, из 1891 случая полный ответ на лечение зарегистрировали у 1 (0,05%) больного, частичный ответ – у 67 (4%), стабилизацию заболевания более 8 недель - у 1511 (80%), прогрессирование заболевания – у 303 (16%); суммарный ответ на лечение (сумма полных, частичных ремиссий и стабилизации) достигнут у 84% пациентов. Медиана выживаемости без прогрессирования составила 36 недель, а медиана общей выживаемости – 50 недель. Различий в эффективности терапии сорафенибом в зависимости от гистологического варианта ПКР, наличия метастазов в головной мозг, возраста и ранее проводившегося лечения отмечено не было. Наиболее часто встречаемая токсичность II степень тяжести, связанная с приемом препарата, проявлялась ладонно-подошвенным синдромом (ЛПС) (18%), сыпью (14%), гипертензией (12%) и слабостью (11%) [7, 9].
Сорафениб входит в перечень основных международных рекомендаций по лечению метастатического ПКР в качестве препарата второй линии терапии [2, 3]. Сорафениб одобрен в странах Европы, США и в 2007 г. зарегистрирован в России для лечения диссеминированного ПКР после неэффективной терапии цитокинами, интерфероном-? или интерлейкином-2.
Клинический случай
Больная Л., 1950 г.р., в июле 2009 г. с жалобами на тянущие боли в спине обратилась в поликлинику по месту жительства, где у нее была диагностирована опухоль левой почки. Для дальнейшего обследования и лечения она была направлена в МНИОИ им. П.А. Герцена Минздравсоцразвития России. При комплексном обследовании по данным компьютерной томографии (КТ) и ультразвукового исследования (УЗИ) органов брюшной полости и забрюшинного пространства у больной выявлено опухолевое образование левой почки размером до 12 см с признаками инвазии в чашечно-лоханочную систему и опухолевым тромбом в левой почечной вене. 29.07.2009 больной выполнено оперативное вмешательство (левосторонняя нефроадреналэктомия, парааортальная лимфаденэктомия). Гистологическое исследование выявило почечно-клеточный светлоклеточный рак левой почки G-2, с обширными очагами некроза и кровоизлияний, выраженной сосудистой инвазией, опухолевыми тромбами в венозных сосудах ворот почки, полностью обтурирующими их просвет. Обнаружены метастазы рака в стенку лоханки. На остальных участках отмечено врастание опухоли в капсулу почки. В паранефральной жировой клетчатке, левом надпочечнике – без опухолевого роста. В крае резекции левого мочеточника – без признаков опухолевого роста. В удаленных парааортальных лимфатических узлах элементов опухоли не обнаружено. Послеоперационный период протекал без осложнений. При выписке больной был поставлен диагноз: рак левой почки III ст. (pT3аN0M0), состояние после хирургического лечения (нефроадреналэктомия слева, парааортальная лимфаденэктомия) от 29.07.2009.
В декабре 2009 г. при очередном контрольном обследовании у пациентки диагностировано прогрессирование заболевания – метастатическое поражение легких. В онкологическом диспансере по месту жительства с января 2010 г. больной назначена иммунотерапия интерфероном-? 9 млн ЕД 3 раза в неделю. На фоне проводимой терапии у больной были зафиксированы следующие побочные эффекты: лихорадка, слабость, утомляемость, гриппоподобный синдром.
В апреле 2010 г. при контрольном обследовании у пациентки диагностировано дальнейшее прогрессирование заболевания на фоне проводимой иммунотерапии интерфероном-α. КТ органов грудной клетки показала новые метастазы в легких и лимфатических узлах средостения.
Для дальнейшего обследования и лечения больная обратилась в МНИОИ им. П.А. Герцена. Пациентке было проведено комплексное обследование. При КТ органов грудной полости в легочной ткани были определены единичные узловые образования: справа в базальных отделах D1 до 1,1 см, слева в S1 и S2 до 0,4 см и в S6 до 1,7 см. По плевре узловые образования выявлены не были. В клетчатке средостения определены единичные парааортальные и паратрахеальные лимфатические узлы размерами до 0,6 см, бифуркационный – до 1,0 см. В левой надключичной области лимфатический узел до 0,9 см. При КТ органов брюшной полости и малого таза признаки опухолевой патологии обнаружены не были. В веществе головного мозга – без очаговой патологии (рис. 1). В анамнезе у пациентки артериальная гипертензия I ст. (с 2002 г.), компенсирована приемом ингибитора АПФ (Энап 10 мг/сут). Выполнена оценка основных факторов прогноза метастатического ПКР согласно модели MSKCC (Memorial Sloan-Kettering Cancer Center) Соматический статус больной по шкале Карновского 90% (> 80%), повышения уровня ЛДГ в > 1,5 раза выше нормы не выявлено (ЛДГ – 160 Ед/л), выявлена высокая концентрация (10,3 мг/дл) скорректированного кальция в сыворотке крови (> 10 мг/дл), уровень гемоглобина в пределах нормы – 122 г/л (норма – 115–122 г/л), также зарегистрирован еще один неблагоприятный фактор – время от выполнения оперативного вмешательства (нефрэктомии) до появления метастазов < 12 месяцев. Таким образом, больная относится к группе пациентов с промежуточным прогнозом по шкале MSKCC. Учитывая промежуточный прогноз по шкале MSKCC и неэффективность иммунотерапии, принято решение о проведении таргетной терапии второй линии препаратом Нексавар. 07.05.2010 больной назначена терапия препаратом Нексавар по схеме по 400 мг (2 таблетки) перорально 2 раза в день.
Через две недели на фоне приема у больной появились побочные эффекты: пациентка жаловалась на болевые ощущения и зуд в коже головы (сенсорная нейропатия) II ст.; сыпь на коже рук, ног и груди II ст.; ЛПС II ст., сопровождающийся болями в подошвах ног при ходьбе (рис. 2, 3, 4). Больной даны рекомендации по лечению возникших нежелательных явлений. Назначен блокатор Н1-гистаминовых рецепторов (лоратадин), рекомендовано исключить ношение тесной обуви, горячие ванные, баню, обязательное ношение гелевых стелек, обработка кожи ног и рук мазью с содержанием мочевины. В связи с выраженными болевыми ощущениями и зудом в коже головы пациентка отказывалась от приема препарата. Учитывая желание больной, решено временно снизить дозировку препарата Нексавар до 400 мг в сутки. На фоне проводимой терапии и полученных рекомендаций побочные эффекты разрешились в течение 10 дней, больная вернулась на прием 800 мг в сутки.
При контрольном обследовании через 3 мес. 23.08.2010 у больной по данным КТ-исследования органов грудной полости в легочной ткани сохраняются единичные узловые образования: справа в базальных отделах D1 до 0,9 см, слева в S1 и S2 до 0,4 см и в S6 до 1,4 см. По плевре узловые образования не визуализируются. В клетчатке средостения визуализируются единичные парааортальные и паратрахеальные лимфатические узлы до 0,6 см, бифуркационный – до 1,0 см. В левой надключичной области лимфатический узел до 0,9 см. При КТ-исследовании органов брюшной полости и малого таза – без признаков опухолевой патологии. В веществе головного мозга – без очаговой патологии. Таким образом, у больной отмечена положительная динамика на фоне лечения, при оценке по шкале RECIST (Response Evaluation Criteria in Solid Tumors) зарегистрирована стабилизация опухолевого процесса в виде уменьшения очагов в легких на 17,8%. При контрольном обследовании через 6 и 9 мес. у больной наблюдалась стабилизация опухолевого процесса в виде уменьшения очагов в легких на 17,8%.
По данным комплексного обследования, проведенного 23.08.2010 через 12 месяцев после начала таргетной терапии Нексаваром, у больной по данным КТисследования органов грудной полости в легочной ткани сохраняются единичные узловые образования, новых очагов не выявлено, в легочной ткани сохраняются единичные узловые образования: справа в базальных отделах D1 очаг до 0,9 см, слева в S1 и S2 до 0,4 см и в S6 до 1,1 см. По плевре узловые образования не визуализируются. В клетчатке средостения визуализируются единичные парааортальные и паратрахеальные лимфатические узлы до 0,6 см, бифуркационный – до 1,0 см. В левой надключичной области лимфатический узел до 0,9 см. Таким образом, у больной отмечена положительная динамика на фоне лечения, при оценке по шкале RECIST зарегистрирована стабилизация опухолевого процесса в виде уменьшения очагов в легких на 28,6%.
В настоящее время больная продолжает прием препарата Нексавар (18-й цикл). По данным обследования, проведенного 16.09.2011, при КТ-исследовании в легочной ткани сохраняются единичные узловые образования: справа в базальных отделах D1 очаг до 0,9 см, слева в S1 и S2 до 0,4 см, в S6 до 1,1 см (рис. 5). По плевре узловые образования не визуализируются. В клетчатке средостения визуализируются единичные парааортальные и паратрахеальные лимфатические узлы до 0,6 см, бифуркационный – до 1,0 см. В левой надключичной области лимфатический узел до 0,9 см. У больной на протяжении 18 мес. сохраняется стабилизация опухолевого процесса. За время приема препарата у больной также регистрировали следующие побочные эффекты: усталость, повышение артериального давления, потребовавшее смены антигипертензивных препаратов, а также эпизоды появления ЛПС, потребовавшие стандартных рекомендаций.
Заключение
Прогресс в молекулярной биологии способствовал разработке новой группы препаратов для лечения метастатического ПКР – таргетных препаратов. По данным последних клинических исследований, антиангиогенные и таргетные препараты продемонстрировали высокую эффективность, хорошую переносимость и низкую частоту нежелательных явлений при улучшении показателей общей выживаемости и выживаемости без прогрессирования у больных метастатическим ПКР. В настоящее время существует целый арсенал зарегистрированных препаратов, применяемых как в первой, так и во второй линиях терапии, эффективных при различных гистологических вариантах и в различных прогностических группах метастатического ПКР.
Результаты приведенного клинического наблюдения позволяют сделать вывод, что к положительным характеристикам большинства таргетных препаратов относятся возможность амбулаторного приема, удовлетворительная толерантность и низкая частота нежелательных явлений, легко контролируемых и купируемых подбором дозы или перерывом в приеме препарата. Несмотря на незначительное уменьшение измеряемых очагов, у большинства больных (60–70%) удается добиться длительного контроля над заболеванием, у пациентов наблюдается стабилизация опухолевого процесса и улучшение показателей выживаемости.
1. Keane T., Gillatt D., Evans C.P., Tubaro A. Current and future trends in treatment of renal cancer // Eur. Urol. Suppl. 2007. Vol. 6. P. 374–384.
2. Злокачественные новообразования в России в 2009 году (заболеваемость и смертность) / под ред. В.И. Чиссова, В.В. Старинского, Г.В. Петровой. М.: ФГУ «МНИОИ им. П.А. Герцена Минздравсоцразвития России», 2011. 260 с.
3. Ljungberg B., Cowan N., Hanbury D.C. et al. Guidelines on renal cell carcinoma. European Association of Urology, 2010. 48 p.
4. Bukowski R.M., Eisen T., Szczylik C. et al. Final results of the randomized phase III trial of sorafenib in advanced renal cell carcinoma: Survival and biomarker analysis // J. Clin. Oncol. 2007. Vol. 25. № 18S. Р. 240.
5. Escudier B., Eisen T., Stadler W. et al. Sorafenib in advanced clear-cell renal-cell carcinoma // N. Engl. J. Med. 2007. Vol. 356. № 2. Р. 125–134.
6. Escudier B., Eisen T., Stadler W.M. et al. Sorafenib for treatment of renal cell carcinoma: Final efficacy and safety results of the phase III treatment approaches in renal cancer global evaluation trial // J. Clin. Oncol. 2009. Vol. 27. № 20. Р. 3312–3318.
7. Beck J., Bajetta E., Escudier B. et al. A large open-label, non-comparative, phase III study of the multi-targeted kinase inhibitor sorafenib in European patients with advanced renal cell carcinoma // Eur. J. Cancer. 2007. Vol. 5. Suppl. 4. Р. 300.
8. Knox J.J., Figlin R.A., Stadler W.M. et al. The advanced renal cell carcinoma sorafenib (ARCSS) expanded access trial in North America: safety and efficacy // J. Clin. Oncol. 2007. Vol. 25. № 18S. Р. 237.
9. Stadler W.M., Figlin R.A., McDermott D.F. et al. Safety and efficacy results of the advanced renal cell carcinoma sorafenib expanded access program in North America // Cancer. 2010. Vol. 116. № 5. Р. 1272–1280.
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
Открытие механизмов развития почечно-клеточного ракаспособствовало разработке новых препаратов для лечения метастатического почечно-клеточного рака, относящихся к группе таргетных препаратов или ингибиторов тирозинкиназ.
Таргетная терапия демонстрирует высокую эффективность, хорошую переносимость и низкую частоту нежелательных явлений при улучшении показателей общей выживаемости и выживаемости без прогрессирования у больных метастатическим почечно-клеточным раком.
В статье представлено клиническое наблюдение больной Л., которой была проведена терапия сорафенибом, описаны профиль токсичности препарата и методы купирования нежелательных побочных явлений. Установлено, что использование таргетных препаратов является оправданным и обеспечивает контроль над заболеванием при удовлетворительной переносимости.
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
