Определяющая роль гистологического анализа и трансмиссионной электронной микроскопии в определении тактики лечения постлучевого поражения сердца
- Аннотация
- Статья
- Ссылки
- English
Основные положения. Одним из наиболее эффективных методов лечения злокачественных новообразований (ЗНО) молочной железы является лучевая терапия (ЛТ). Ионизирующее излучение необратимо повреждает атипичные клетки опухоли, позволяя достичь стойкой ремиссии онкозаболевания. При этом высокая суммарная очаговая доза (СОД) тесно коррелирует с возникновением и прогрессированием фиброза и кальциноза всех структур сердца, восходящей части аорты и легких. Временной промежуток возникновения постлучевого поражения сердца варьирует от 2 до 20 лет после завершения сеансов ЛТ. При этом большинство существующих исследований направлено на пациентов молодого возраста, в то время как подбор оптимальной ЛТ и определение ее рисков, в том числе постлучевого поражения сердца, у пожилых пациентов по-прежнему остается сложной задачей. В статье представлено наблюдение успешного выполнения кардиохирургического лечения в условиях ИК пациентки старческого возраста с развитием ХСН на фоне постлучевого поражения митрального клапана, возникшего спустя три года после восьми курсов ЛТ (СОД > 30 Гр) по поводу ЗНО левой молочной железы, с гистологической характеристикой иссеченных интраоперационно поврежденных структур сердца, повлиявшей на выбор тактики лечения.
Заключение. Необходимо акцентировать внимание специалистов на раннем кардиоонкомониторировании пациентов старческого возраста с использованием биохимических и мультимодальных методов визуализации для своевременного выявления постлучевого поражения сердца. Следует расширить и усовершенствовать рекомендации по ведению данной группы пациентов с оптимальным инициированием лекарственной терапии и определением показаний к кардиохирургическому лечению с учетом предполагаемой пользы и возможного риска осложнений.
Основные положения. Одним из наиболее эффективных методов лечения злокачественных новообразований (ЗНО) молочной железы является лучевая терапия (ЛТ). Ионизирующее излучение необратимо повреждает атипичные клетки опухоли, позволяя достичь стойкой ремиссии онкозаболевания. При этом высокая суммарная очаговая доза (СОД) тесно коррелирует с возникновением и прогрессированием фиброза и кальциноза всех структур сердца, восходящей части аорты и легких. Временной промежуток возникновения постлучевого поражения сердца варьирует от 2 до 20 лет после завершения сеансов ЛТ. При этом большинство существующих исследований направлено на пациентов молодого возраста, в то время как подбор оптимальной ЛТ и определение ее рисков, в том числе постлучевого поражения сердца, у пожилых пациентов по-прежнему остается сложной задачей. В статье представлено наблюдение успешного выполнения кардиохирургического лечения в условиях ИК пациентки старческого возраста с развитием ХСН на фоне постлучевого поражения митрального клапана, возникшего спустя три года после восьми курсов ЛТ (СОД > 30 Гр) по поводу ЗНО левой молочной железы, с гистологической характеристикой иссеченных интраоперационно поврежденных структур сердца, повлиявшей на выбор тактики лечения.
Заключение. Необходимо акцентировать внимание специалистов на раннем кардиоонкомониторировании пациентов старческого возраста с использованием биохимических и мультимодальных методов визуализации для своевременного выявления постлучевого поражения сердца. Следует расширить и усовершенствовать рекомендации по ведению данной группы пациентов с оптимальным инициированием лекарственной терапии и определением показаний к кардиохирургическому лечению с учетом предполагаемой пользы и возможного риска осложнений.
Введение
Рак молочной железы (РМЖ) занимает лидирующие позиции в структуре заболеваемости злокачественными новообразованиями (ЗНО) в России. По опубликованным данным состояния онкологической помощи населению в 2024 г., число случаев РМЖ составляет 563,5 на 100 тыс. населения, при этом: рак кожи (кроме меланомы) – 313,9; предстательной железы – 234,9; тела матки – 207,4; ободочной кишки – 177,7; лимфатической и кроветворной систем – 168,7 на 100 тыс. населения [1]. Хирургическое радикальное лечение с последующей лучевой терапией (ЛТ) является стандартным методом лечения РМЖ на ранних стадиях. В настоящее время перед выполнением курса ЛТ для минимизации повреждения здоровых тканей органов средостения проводят мультиспиральную компьютерную томографию (МСКТ) с объемным 3D-планированием и четким определением контуров полей облучения. Для оптимизации локального контроля выполняют высокотехнологичную 3D-конформную дистанционную ЛТ с задержкой дыхания во время глубокого вдоха в положении лежа [2, 3]. При этом оперированная молочная железа должна получить дозу 46–50 Гр за 23–25 фракций или 40–42,5 Гр за 15–16 фракций [4]. По мнению V.T. Nkomo и соавт., существует линейное увеличение риска развития констриктивного перикардита, ишемической болезни сердца (ИБС), клапанных пороков сердца при общей дозе облучения > 30 Гр [5]. При дозах ЛТ > 30 Гр риск развития постлучевого поражения сердца очевиден, при этом влияние более низких доз в настоящее время недостаточно исследовано, так же как и не ясна пороговая доза ЛТ, при которой риск повреждения здоровых тканей отсутствует. В ряде популяционных исследований отмечается, что постлучевое поражение сердца развивается через 5–30 лет после первого воздействия ионизирующего излучения [6–8]. Старческий возраст служит независимым фактором риска развития периоперационных осложнений, что порой становится причиной того, что пациенты старше 75 лет не получают адекватного хирургического лечения.
Цель данной статьи – представить клинический случай выполнения успешной пластики митрального клапана на открытом сердце у пациентки старческого возраста (79 лет) с постлучевым поражением митрального клапана и хронической сердечной недостаточностью (ХСН), развившейся через три года после восьми курсов ЛТ с суммарной очаговой дозой (СОД) > 30 Гр по поводу ЗНО левой молочной железы.
Клиническое наблюдение
Пациентка А., 79 лет, 2 июля 2024 г. поступила в отделение хирургии пороков сердца РНЦХ им. акад. Б.В. Петровского с жалобами на одышку при умеренной физической нагрузке, отеки нижних конечностей. Из анамнеза – в возрасте 76 лет пациентке была выполнена секторальная резекция левой молочной железы с последующей полихимиотерапией (5 курсов) и ЛТ (8 сеансов, 45 Гр). В 2022 г. отмечены появление одышки при умеренной физической нагрузке, слабость и быстрая утомляемость. В последующем – состояние с отрицательной динамикой в виде присоединения отеков нижних конечностей. В 2023 г. пациентка обратилась за медицинской помощью, в ходе обследования, по данным эхокардиографии (ЭхоКГ), впервые выявлена недостаточность митрального клапана 3-й степени. В анализе крови уровень Nt-proBNP – 1500 пг/мл.
Данные осмотра при поступлении: состояние средней степени тяжести, тоны сердца ясные, ритм правильный, выслушивается систолический шум во всех точках аускультации с максимальной звучностью на верхушке сердца с иррадиацией в левую подмышечную область, артериальное давление – 100/60 мм рт. ст., частота сердечных сокращений – 60 уд/мин, дыхание свободное, аускультативно жесткое, проводится во все отделы легких, хрипов нет; отеки стоп.
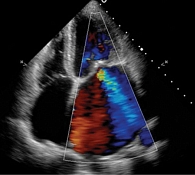
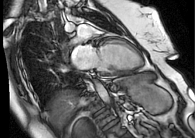
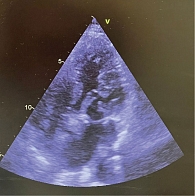
По данным ЭхоКГ: отмечается фиброз створок митрального клапана, отрыв хорд задней створки митрального клапана с формированием регургитации 3-й степени (рис. 1), фиброз створок легочного клапана, пиковое давление в стволе легочной артерии – 50 мм рт. ст., фиброз створок аортального и трикуспидального клапанов без нарушения гемодинамики, отмечается дилатация полости левого предсердия – до 97 мл, объемы левого желудочка (ЛЖ) – в пределах нормы, локальная сократимость и глобальная функция ЛЖ – не нарушены, фракция выброса – 66%, диастолическая дисфункция ЛЖ 2-го типа, объемы правых камер сердца – не увеличены. По результатам селективной коронарной ангиографии, гемодинамически значимого поражения коронарных артерий не выявлено. В качестве дообследования выполнена магнитно-резонансная томография сердца с внутривенным контрастированием, по результатам которой выявлен протяженный фиброз миокарда ЛЖ в базальных, средних и верхушечных отделах – суммарно 6,8% (рис. 2).
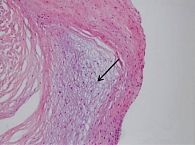
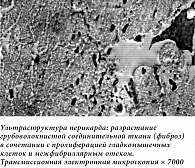
Пациентке в условиях искусственного кровообращения 3 июля 2024 г. выполнена пластика митрального клапана (резекция задней створки митрального клапана, аннулопластика опорным кольцом Мединж-30). Интраоперационно: при ревизии митрального клапана створки фиброзно изменены, утолщены, отмечается отрыв хорд на границе сегментов P1 и Р2. По данным гистохимического исследования, в иссеченных образцах митрального клапана множественные участки мукоидного отека на фоне склероза и гиалиноза (рис. 3). По результатам трансмиссионной электронной микроскопии перикарда, выявлено разрастание грубоволокнистой соединительной ткани в сочетании с пролиферацией гладкомышечных клеток и межфибриллярным отеком (рис. 4).
Послеоперационный период протекал без осложнений. Пациентка выписана на восьмые сутки после операции с рекомендациями по дальнейшей реабилитации и приему лекарственной терапии (спиронолактон – 25 мг/сут; лозартан – 12,5 мг/сут; дапаглифлозин – 10 мг/сут; аторвастатин – 10 мг/сут; варфарин – 1,25 мг/сут). Через год по данным ЭхоКГ, гемодинамические параметры митрального клапана – в пределах нормы, локальная сократимость и глобальная функция ЛЖ сохранены, данных о перикардиальном и плевральном выпотах нет (рис. 5).
Обсуждение
На современном этапе ЛТ служит одним из ведущих методов лечения РМЖ, с помощью которого достигается стойкая ремиссия заболевания. Однако ионизирующее излучение оказывает повреждающее действие не только на клетки опухоли, но и на все структуры сердца, включая проводящую систему, коронарные артерии, перикард, миокард, клапанный аппарат, а также восходящую часть аорты и легкие. Для кардиоонкологических пациентов постлучевое поражение сердца становится ведущей нозологией, которая прогрессирует с годами, приводя к «необратимой» ХСН, резистентной к лекарственной терапии.
В последние десятилетия проблема постлучевого поражения сердца приобрела новое значение в связи с ростом числа пациентов с ЛТ в анамнезе, выполненной более 30 лет назад. По мнению K.M. Menezes и соавт., постлучевое поражение сердца возникает от одного до 10 лет после завершения ЛТ [6], что указывает на непредсказуемость временного возникновения сердечно-сосудистых событий (ССС). Так, частота возникновения ИБС достигает 85% случаев через 20 лет после окончания ЛТ [9]. Перикардит развивается примерно у 70% пациентов в течение двух лет после облучения. Клапанные пороки сердца возникают в 26% случаев через 10 лет и в 60% – через 20 лет. Наиболее распространены недостаточность аортального клапана и аортальный стеноз, реже встречаются пороки митрального клапана [10].
В представленном случае порок митрального клапана верифицирован у пациентки спустя три года после завершения ЛТ. При этом клинически ХСН прогрессировала уже через один год. Ранней манифестации постлучевого поражения сердца способствует наличие рисков, связанных с ухудшением исходов лучевой терапии и увеличением частоты возникновения ССС: молодой возраст на момент выполнения ЛТ (< 50 лет), СОД > 30 Гр, наличие артериальной гипертензии, дислипидемии, сахарного диабета, ожирения, хронической обструктивной болезни легких [11].
Большинство современных исследований направлено на изучение пациентов, в анамнезе которых ЛТ выполнялась в молодом возрасте (< 50 лет). Однако важно учитывать, что РМЖ диагностируют более чем в 50% случаев у пациенток старше 65 лет. Вместе с этим растет доля женщин старческого возраста среди больных РМЖ, причем средняя ожидаемая продолжительность жизни составляет 86,6 года [12, 13]. Мы считаем необходимым акцентировать внимание мультидисциплинарной команды специалистов на осложнениях ЛТ данной возрастной категории, учитывая коморбидные состояния, которые в сочетании с проведенной радиотерапией могут не только значимо ухудшить качество жизни пациентов, но и сократить ожидаемую продолжительность жизни, особенно при ранних стадиях постлучевого поражения сердца.
Становится актуальным вопрос о механизмах патогенеза прогрессирующего фиброза и атеросклероза всех структур сердца. По данным различных литературных источников, основной причиной радиационно-индуцированных заболеваний сердца являются микро- и макрососудистое повреждения. ЛТ с высокой СОД приводит к повреждению эндотелиальных клеток и разрушению их мембран, эндотелий становится пористым, в больших количествах высвобождаются медиаторы воспаления, активизируются гранулоциты, моноциты и макрофаги, что приводит к прогрессирующему фиброзу, утолщению стенок сосудов, запуску каскада свертывания крови, что увеличивает риски тромбозов, к прогрессированию атеросклероза и кальцификации всех структур сердца [14–16].
Полученные нами данные гистохимического исследования и трансмиссионной электронной микроскопии (ТЭМ) интраоперационно иссеченных участков перикарда и резицированного участка митрального клапана сегмента P2 подтверждают вышеописанный патогенез развития постлучевого поражения сердца. При гистохимическом исследовании резецированного сегмента P2 митрального клапана выявлены множественные участки мукоидного отека на фоне склероза и гиалиноза, а также очаговая пролиферация эндотелия на фоне отека клапана. По данным ТЭМ перикарда, обнаружен характерный для постлучевого поражения выраженный межфибриллярный отек, разрастание грубоволокнистой соединительной ткани в сочетании с пролиферацией гладкомышечных клеток. По всей вероятности, это явление связано с высокой активностью тромбоцитарного фактора роста, обеспечивающего не только приток в поврежденную область фибробластов и выработку ими коллагена, но и активную пролиферацию фибробластов и гладкомышечных клеток. Важно отметить, что при поступлении у пациентки предполагался органический порок митрального клапана, однако данные гистохимического исследования и ТЭМ интраоперационно иссеченного материала опровергли данное исходное предположение.
Учитывая деструктивное действие ЛТ, текущие протоколы направлены на минимизацию дозы облучения. В настоящее время у пациентов с левосторонним РМЖ выполняют МСКТ органов средостения с 3D-визуализацией и использованием многослойной коллиматорной защиты с глубокой задержкой дыхания на вдохе лежа на спине [11]. С помощью описанных методов мишень на грудной стенке перемещается дальше от сердца и наиболее точно определяются зоны облучения, тем не менее некоторое облучение окружающих тканей остается неизбежным. В пользу этого предположения свидетельствует описанный нами клинический пример. Пациентке А. проведена ЛТ по современным протоколам, однако через три года после завершения курса у нее диагностирован порок митрального клапана. По нашему мнению, столь ранней манифестации порока митрального клапана с прогрессированием ХСН способствовала высокая СОД (45 Гр) с последующей полихимиотерапией (5 курсов), старческий возраст (76 лет) на момент проведения ЛТ, наличие сердечно-сосудистой патологии (артериальная гипертензия, дислипидемия).
Ранее в статьях мы преимущественно рассматривали пациентов с проведенной ЛТ в среднем и молодом возрасте [17, 18], что было непосредственно одним из факторов риска развития постлучевого поражения сердца. Важной клинической особенностью кардиоонкопациентов старческого возраста является полиморбидность, в связи с чем в настоящее время не существует общепринятых клинических рекомендаций по лечению больных РМЖ старше 65 лет. Активно обсуждается вопрос о возможном отказе от ЛТ при лечении женщин пожилого и старческого возраста при I стадии гормонопозитивного РМЖ [19, 20]. Наличие у большинства пациентов старческого возраста нескольких сопутствующих заболеваний, каждое из которых имеет свои специфические проявления, особенности течения, осложнения и различный прогноз, требует подбора соответствующей индивидуальной терапии и мониторинга.
Фармакологические методы предупреждения последствий ЛТ в настоящее время до конца не сформированы. В литературе рассматривают кардиопротективные свойства препаратов, направленные на ограничение окислительного стресса, воспаления, фиброза и тромбоза. В частности, статины обладают гиполипидемическими свойствами, снижая уровень холестерина и плотность липопротеидов за счет ингибирования 3-гидрокси-3-метилглутарилкоэнзим А редуктазы. Плейотропные эффекты статинов включают в себя улучшение сосудистого тонуса, противовоспалительные, антитромботические, антифибротические и снижающие окислительный стресс свойства [9].
Низкие дозы аспирина могут блокировать агрегацию тромбоцитов, уменьшать воспаление и предотвращать вазоконстрикцию, вызванную тромбоксаном А2. Фактические данные подтверждают полезность низких доз аспирина во вторичной профилактике сердечно-сосудистых заболеваний, однако польза приема препарата при постлучевом поражении сердца до сих пор не изучена [15].
Ингибиторы ангиотензинпревращающего фермента оказывают множественное воздействие на эндотелиальные клетки: снижают выработку эндотелием ангиотензина II и, следовательно, ограничивают сужение сосудов, снижают уровни молекул адгезии и факторов роста, уменьшают окислительный стресс и предотвращают апоптоз. Данная группа препаратов также уменьшает деградацию эндотелиального брадикинина, что приводит к расширению сосудов за счет стимуляции выработки оксида азота. Блокаторы рецепторов ангиотензина II ограничивают сужение сосудов, тем самым оказывая антитромбоцитарное, противовоспалительное и антимитогенное действие. Уровень ангиотензина II локально повышается после облучения и способствует воспалительным реакциям, повреждению сосудов и фиброзу.
Важно учитывать, что фиброз – это патологический процесс, при котором синтез коллагена преобладает над его распадом. По мнению X.С. Zhang и соавт., препаратом, нормализующим содержание коллагена в тканях, является спиронолактон. Антагонисты альдостерона обладают благоприятными клиническими эффектами при рубцевании миокарда, застойной сердечной недостаточности, артериальной гипертензии и атеросклерозе.
Другой препарат, колхицин, обладает противовоспалительными свойствами с механизмом действия, независимым от пути арахидоновой кислоты, и снижает индуцируемую тромбином агрегацию тромбоцитов, это ухудшает подвижность лейкоцитов и ингибирует инфильтрацию нейтрофилов в интиму. Следовательно, у колхицина есть два основных преимущества: снижение риска дестабилизации атеросклеротических бляшек и смягчение фиброзного процесса, поскольку нейтрофилы являются их основными участниками [21].
Эффект вышеописанных препаратов безусловно неоспорим, они включены в клинические рекомендации по лечению ИБС, ХСН, артериальной гипертензии, однако не ясно, могут ли данные группы препаратов оказывать подобное влияние на клиническое и фенотипическое проявления постлучевого поражения сердца. В нашем клиническом наблюдении, в раннем послеоперационном периоде назначена оптимальная кардиальная терапия (спиронолактон – 25 мг/сут; лозартан – 12,5 мг/сут; дапаглифлозин – 10 мг/сут; аторвастатин – 10 мг/сут). Спустя год наблюдения в анализах крови отмечено выраженное снижение уровня NtproBNP – с 1500 до 350 пг/мл, при отсутствии жалоб пациентки.
По данным R. Muratov и соавт., период от завершения ЛТ до кардиохирургического лечения клапанной патологии сердца составляет от четырех до 40 лет [22]. Такой протяженный отрезок времени указывает на непредсказуемость манифестации постлучевого поражения сердца и не позволяет точно определить этапность наблюдения после завершения ЛТ. Считается, что первичный скрининг необходимо проводить через 10 лет после облучения и через пять лет у пациентов с более высоким риском, с повторной ЭхоКГ каждые пять лет [5].
Происходящие по мере старения организма изменения в структуре и метаболизме тканей неизбежно отражаются на функции ряда органов и систем. Известно, что с возрастом происходит относительное увеличение массы жировой ткани и уменьшение мышечной, в тoм числе снижение массы дыхательных мышц (диaфpaгмы), что может быть одним из факторов развития дыхательной недостаточности и снижения с возрастом величины жизненного объема легких. Цереброваскулярные осложнения у пожилых варьируют от спутанности сознания до острого нарушения мозгового кровообращения. Нередко отмечается хроническая почечная недостаточность. Нарушения функции печени являются распространенной проблемой, что увеличивает склонность к геморрагическим осложнениям и требует особого контроля антикоагулянтной терапии. Наблюдаются соответствующие дегенеративные изменения со стороны сосудов, в частности аорты – кальциноз и уплотнение стенок. Отсутствие протоколов по динамическому обследованию кардиоонкопациентов является важной проблемой, так как с течением времени последствия ЛТ приводят к необратимому прогрессированию резистентной к лекарственной терапии ХСН, тотальному кальцинозу всех структур сердца и восходящей аорты, образованию спаечного процесса в переднем средостении, что крайне повышает риски кардиохирургического вмешательства, учитывая наличие исходной полиморбидности.
Пациенты старческого возраста с ЛТ в анамнезе имеют худшие краткосрочные и долгосрочные результаты в сравнении с органическими пороками сердца, а при повторном вмешательстве смертность составляет 17,4% по сравнению с 2,3% у пациентов без предшествующего облучения [23]. В отношении кардиохирургического лечения митрального клапана в группе с радиационным поражением пятилетняя выживаемость составила 55% по сравнению с пациентами без ЛТ в анамнезе (≥ 80%) [24]. Важно отметить, что современные калькуляторы расчета кардиохирургического риска не позволяют оценить истинный риск смертности у кардиоонкопациентов старческого возраста с постлучевым поражением сердца. В ретроспективном исследовании O. Dolmaci и соавт. показано, что согласно Euroscore II, средние показатели смертности пациентов с постлучевым поражением сердца составили 3,4%, при этом 10,2% пришлось на фактическую смертность [25].
В настоящее время все чаще высказывается мнение о том, что старческий возраст не может являться противопоказанием для проведения ЛТ. Основным фактором, негативно влияющим на общую выживаемость, служит наличие многочисленных сопутствующих соматических патологий. По этой причине необходимы тщательный отбор пациентов для проведения ЛТ мультидисциплинарной командой специалистов (с учетом прогностических факторов, правильного выбора метода и режима лучевого воздействия) и разработка последующего индивидуального плана наблюдения с фармакологической стратегией после завершения курсов ЛТ.
Заключение
В нашем клиническом случае представлена ранняя манифестация радиационно-индуцированной недостаточности митрального клапана у пациентки старческого возраста. Спустя три года после завершения ЛТ, по данным полученного гистохимического анализа и ТЭМ интраоперационно иссеченного материала сердца, выявлены изменения, обусловленные воздействием радиотерапии. Мы считаем необходимым акцентировать внимание специалистов на раннем кардиоонкомониторировании пациентов старческого возраста с использованием биохимических и мультимодальных методов визуализации для своевременного выявления постлучевого поражения сердца. Необходимо расширять и совершенствовать рекомендации по ведению пациентов данной группы с оптимальным инициированием лекарственной терапии и определением показаний к кардиохирургическому лечению с учетом предполагаемой пользы и возможного риска осложнений.
Финансирование. Работа выполнена в рамках НИР FURG-2024-0016.
K.A. Vilizhinskaya, Yu.V. Frolova, V.A. Ivanov, M.A. Fomin, Ya.A. Aidamirov, T.G. Nikityuk, Z.V. Gioeva, M.A. Kozlova, L.V. Kaktursky, D.A. Areshidze, E.P. Evseev
Petrovsky National Research Centre of Surgery, Moscow
Contact person: Kristina A. Vilizhinskaya, kvilizhinskaya@yandex.ru
Aim. To present the successful experience of cardiac surgical treatment under conditions of artificial circulation (AC) in an elderly patient with the development of chronic heart failure (CHF) due to post-radiation damage to the mitral valve.
Key points. Radiation therapy is one of the most effective methods of treating breast malignancies. Ionizing radiation “irreversibly” damages atypical tumor cells, allowing for a stable remission of cancer. At the same time, a high total dose of radiation is closely correlated with the occurrence and progression of fibrosis and calcification of all structures of the heart, ascending aorta and lungs. The time interval for the occurrence of postradiation heart damage varies from 2 to 20 years after the completion of radiation therapy sessions. At the same time, most of the existing studies are aimed at young patients, while selecting the optimal RT and determining its risks, including post-radiation heart damage, in elderly patients remains a difficult task. The article presents an observation of the successful implementation of cardiac surgical treatment in conditions of AC in an elderly patient with the development of CHF against the background of postradiation damage to the mitral valve, which occurred 3 years after 8 courses of radiation therapy at a concentration of > 30 Gy for left breast cancer with histological characteristics of excised intraoperatively damaged structures of the heart, which determined the treatment strategy.
Conclusion. It is essential to draw specialists' attention to early cardio-oncological monitoring of elderly patients using biochemical and multimodal imaging methods for the timely detection of post-radiation heart damage. Recommendations for managing this patient group should be expanded and improved, with optimal initiation of drug therapy and determination of indications for cardiac surgical treatment, taking into account the anticipated benefits and potential risks of complications.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.