Редкий вариант ранней преэклампсии
- Аннотация
- Статья
- Ссылки
- English

Введение
Преэклампсия (ПЭ) является распространенным и потенциально летальным многосистемным осложнением беременности [1]. По данным Всемирной организации здравоохранения, ПЭ осложняет течение не менее 2% беременностей, и тенденция роста ее частоты независимо от экономического развития страны сохраняется [2]. Возникшую до 34-й недели гестации ПЭ выделяют в особую, раннюю форму, поскольку ее отличает более тяжелое течение с частым развитием органного поражения у матери и худшими исходами для ребенка [3].
Кроме того, в последнее десятилетие все чаще регистрируются «атипичные» формы ПЭ, проявления которой не соответствуют регламентированным критериям [4], и так называемая наслоившаяся ПЭ (сверх-преэклампсия/superimposed pre-eclampsia) [5], диагностируемая у женщин, имеющих сходные с ПЭ клинические признаки еще до наступления беременности – хроническую артериальную гипертонию (ХАГ) и/или хроническую болезнь почек.
Классическими симптомами умеренной ПЭ считаются впервые возникшая после 20-й недели гестации артериальная гипертензия (АГ) с уровнем артериального давления (АД) более 140/90 мм рт. ст. и протеинурия (ПУ) свыше 0,3 г/сут. Тяжелую ПЭ диагностируют при АД более 160/110 мм рт. ст. и ПУ более 5 г/сут, или более 3 г/л в двух порциях мочи. Следует помнить, что массивная ПУ (более 3,5 г/сут) приводит к развитию нефротического синдрома (НС), проявляющегося снижением содержания белков крови. На это редко обращают внимание в акушерской практике, хотя установлено, что быстрое формирование НС после 20-й недели гестации наиболее характерно для ранней ПЭ и свидетельствует о ее тяжелом течении [6]. Для НС, обусловленного первичной патологией почек, характерен генерализованный отечный синдром разной степени выраженности, а не изолированные отеки. Поэтому развитие у женщины изолированного отека вульвы во второй половине беременности должно настораживать врачей в отношении возможной ПЭ.
Рассмотрим случай ранней ПЭ, манифестировавшей изолированным отеком вульвы.
Клинический случай
Пациентка Д., 30 лет, страдает сахарным диабетом 1-го типа с 14 лет. Течение заболевания было стабильным. Пациентка получала инсулинотерапию, в том числе в течение последних трех лет помповую, НbA1c – 5,2%. Ежегодно проводимое исследование альбуминурии отклонений от нормы не выявляло, данные о наличии диабетической нефропатии отсутствовали. На протяжении последних трех лет отмечалось повышение АД до 130/80 мм рт. ст. при редких измерениях, антигипертензивная терапия не проводилась.
Настоящая беременность первая. При постановке на учет в женской консультации индекс массы тела 22,5 кг/м2. В первом триместре диагностирован субклинический гипотиреоз (назначен L-тироксин 100 мкг), других отклонений в анализах не отмечалось. По данным первого скрининга, риски хромосомных аномалий, развития ПЭ и задержки роста плода низкие. Второй скрининг также не показал патологии ни у матери, ни у плода.
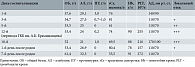
На сроке гестации 22 недели и 6 дней беременная отметила ухудшение самочувствия. При самостоятельном измерении АД 150/90 мм рт. ст. Бригадой скорой медицинской помощи госпитализирована в родильное отделение при многопрофильном стационаре Москвы. При поступлении АД не превышало 140/90 мм рт. ст., однако впервые была выявлена ПУ 3 г/л, что позволило установить диагноз умеренной ПЭ и начать регламентированную терапию: MgSO4 25% 96,0 внутривенно через инфузомат со скоростью 4 мл/ч и метилдопа 250 мг/сут. Данное лечение привело к быстрой стабилизации АД на уровне 110–120/70–80 мм рт. ст. Для оценки диуреза установлен катетер Фолея. Через 10–12 часов после этого пациентка почувствовала дискомфорт в области промежности. При осмотре выявлен быстро нарастающий отек половых губ (рисунок), что расценили как аллергическую реакцию на катетеризацию уретры. Катетер Фолея удалили, однократно внутривенно ввели преднизолон 30 мг и хлорпирамин 20 мг с незначительным положительным эффектом. Однако через несколько часов отек вульвы увеличился, в связи с чем для тщательного наблюдения беременную перевели в отделение интенсивной терапии. Других проявлений аллергической реакции не зафиксировано. С учетом необычной клинической симптоматики пациентку дистанционно проконсультировал главный внештатный аллерголог-иммунолог Департамента здравоохранения Москвы (ДЗМ). Установлен предварительный диагноз локального ангионевротического отека, по клиническим критериям соответствовавшего брадикининовому механизму. Рекомендовано исследовать уровни С1- и С4-компонентов комплемента.
Назначена терапия: эноксапарин натрия 4000 анти-ХА МЕ/0,4 мл/сут в связи с высокими показателями D-димера (2302–3092 нг/мл), преднизолон 90 мг внутривенно струйно + 240 мг через инфузомат со скоростью 10 мг/ч и ингибитор С1-эстеразы человека (Беринерк 1000 МЕ).
На фоне проводимой терапии положительная динамика отсутствовала, нарастание отека вульвы продолжилось.
По данным дополнительного обследования, уровень ингибитора С1-эстеразы не превышал референсных значений (0,82 Ед/мл при норме 0,7–1,3), С4-компонент комплемента – 0,17 г/л (норма 0,15–0,57 г/л). Дополнительно исследованы маркеры ПЭ, которые оказались в пределах референсных значений для данного срока гестации: sFlt-1 – 4506, PLGF – 1190, sFlt-1/PLGF – 3,8. Повышение уровня АД при поступлении расценивалось как проявление ХАГ с учетом указания на повышение уровня АД до 130/90 мм рт. ст. до беременности. В связи с тенденцией к снижению содержания белков крови рекомендовано дообследование для исключения первичной патологии почек (антифосфолипидные антитела, антинейтрофильные цитоплазматические антитела и С3-компонент комплемента). В силу стойкой нормализации АД, колебаний ПУ от 0 до 2 г/л в разовых анализах (табл. 1), стабильного состояния плода и нормальных показателей ангиогенного коэффициента диагноз ранней ПЭ вызывал сомнения. С направительным диагнозом нефротического синдрома беременную перевели в специализированный профильный стационар по оказанию помощи беременным с патологией почек (Городская клиническая больница (ГКБ) им. А.К. Ерамишанцева, Москва).
При поступлении в ГКБ им. А.К. Ерамишанцева сохранялся выраженный симметричный неплотный отек половых губ без гиперемии и зуда с обычной температурой кожи в области вульвы. Лабораторно отмечалась умеренная диспротеинемия (общий белок – 53–50 г/л, альбумин – 25,5–24 г/л) при минимальной протеинурии – 0,3 г/л, креатинин крови стабильно нормальный – 74,8 мкмоль/л, гемоглобин – 90 г/л, тромбоциты – 255 тыс/мкл.
Общебольничным консилиумом констатировано отсутствие эффекта от лечения, направленного на купирование отека брадикининового генеза (ангиоотека) всеми группами препаратов. Минимальная ПУ и нормальные значения фибриногена (3,25 г/л) в сочетании с изолированным отеком необычной локализации давали основание усомниться в наличии НС, несмотря на наличие гипопротеинемии и гиперхолестеринемии (6,83 ммоль/л), которая в данном случае не соответствовала степени диспротеинемии. Таким образом, результаты обследования не позволяли с уверенностью диагностировать как первичную гломерулярную патологию, так и ПЭ, что существенно затрудняло выбор тактики ведения пациентки. В ходе обследования для исключения патологического процесса в малом тазу выполнена магнитно-резонансная томография, показавшая симметричный отек ягодичных мышц, мышц дна малого таза и синовит тазобедренных суставов, что свидетельствовало о постепенной генерализации отечного синдрома. Это подтвердили и результаты ультразвукового исследования, выявившего минимальный двусторонний гидроторакс (200 мл слева и 300 мл справа). Хотя при ультразвуковой допплерографии сосудов нижних конечностей патологии не обнаружено, для исключения тромбоза сосудов малого таза и брюшной полости провели компьютерную томографию с контрастированием: изменений не выявлено. Динамика состояния пациентки, срок появления необычных клинических симптомов, отсутствие данных о первичной патологии почек позволили сформулировать основную диагностическую концепцию: ранняя ПЭ атипичного течения (стабильно нормальный уровень АД на фоне минимальной терапии, значения ПУ, не соответствовавшие критериям ПЭ, тем не менее приведшие к формированию нефротического синдрома, основным клиническим проявлением которого изначально стал изолированный отек вульвы). Показатели состояния плода и фетоплацентарного кровотока при этом оставались стабильными, значения исследованных в динамике маркеров ПЭ – без выраженной отрицательной динамики: sFlt-1 – 3123, PLGF – 358, sFlt-1/PLGF – 8,72 (референсные значения для срока беременности 20–23 недели: PLGF – 106,2–1138,6 пг/мл, sFlt-1 – 468,8–2781,8 пг/мл, sFlt-1/PLGF – 1,8–14,3). Единственной жалобой пациентки оставался выраженный отек вульвы, который вызывал дискомфорт и ограничивал пациентку в движениях. На повторном общегородском междисциплинарном консилиуме с участием главных внештатных специалистов ДЗМ сочли целесообразной выжидательную тактику. Поскольку при суточном мониторировании дважды отмечалось повышение уровня АД до 140/90 мм рт. ст., к лечению добавили нифедипин 20 мг два раза в день. В течение последующих шести дней состояние пациентки оставалось стабильным: АД стойко нормальное, отек вульвы не увеличивался, диспротеинемия не нарастала.
На 18-й день с момента первой госпитализации, на сроке беременности 25 недель и 2 дня состояние пациентки резко ухудшилось, появились озноб, затруднение дыхания, резкая головная боль и повышение температуры тела до 38,5 °C. При осмотре сатурация О2 – 90%, частота дыхательных движений – 24 в минуту, АД – до 170/90 мм рт. ст. Установлен диагноз: тяжелая ПЭ. Проведено экстренное родоразрешение путем операции кесарева сечения. В плодово-плацентарном комплексе извлечена живая недоношенная девочка массой 750 г, длиной 33 см, оценка по шкале Апгар – 5/6 баллов. Характер околоплодных вод – мекониальные с запахом. Плацентарная площадка по передней стенке матки. Плацента (15 × 15 × 1,5 см) отправлена на гистологическое исследование. С целью утеротонической терапии введен пабал 1,0. Матка сократилась хорошо, плотная. Придатки с обеих сторон без особенностей. Общая кровопотеря – 700 мл. После родов выполнена рентгенография грудной клетки, диагностирована двусторонняя полисегментарная пневмония. Назначена антибактериальная терапия цефоперазоном и сульбактамом 1 г + 1 г внутривенно два раза в день пять дней.
В течение первых суток после родов наблюдалась отчетливая положительная динамика в виде уменьшения выраженности отека вульвы и стабилизации АД. В течение последующих трех суток отек полностью регрессировал, а через семь суток после родов нормализовались белковые показатели крови, исчезла ПУ. АД стабильно нормальное без применения антигипертензивных препаратов. На протяжении всего периода наблюдения за беременной течение сахарного диабета оставалось стабильным.
Состояние ребенка при поступлении в отделение реанимации новорожденных расценивалось как очень тяжелое, девочка с рождения находилась на искусственной вентиляции легких. С лечебной целью вводился сурфактантоподобный препарат порактант альфа (Куросурф). Кроме того, проводились антибактериальная, инфузионная терапия, парентеральное питание с дотацией витаминов, антигеморрагическая терапия. В возрасте 14 суток жизни ребенок в стабильно тяжелом состоянии для дальнейшего обследования и лечения переведен на второй этап выхаживания в отделение реанимации и интенсивной терапии новорожденных ДГКБ № 13 им. Н.Ф. Филатова, откуда после длительного лечения и реабилитации с рекомендациями выписан домой в удовлетворительном состоянии с необходимостью диспансерного наблюдения в катамнезе.
Обсуждение
Клинические проявления ПЭ разнообразны. Для своевременной диагностики ПЭ у женщин с ранее существовавшей АГ помимо появления ПУ имеют значение ухудшение контроля над исходным уровнем АД и возникновение дополнительных симптомов органной дисфункции у матери (нарушение функции почек, печени, неврологические нарушения, тромбоцитопения), статус ангиогенеза/антиангиогенеза (PlGF < 36 пг/мл или соотношение sFlt-1/PlGF > 85 до 34-й недели гестации), а также маточно-плацентарная дисфункция (асимметричная задержка внутриутробного развития плода, нарушение маточно-плацентарного и фетоплацентарного кровотоков). Классификация ПЭ как в национальных, так и зарубежных рекомендациях не предусматривает выделение ранней ПЭ, однако большинство исследователей и практикующих врачей отмечают необходимость особого отношения к ПЭ, развившейся до 34-й недели, поскольку ее течение с большой долей вероятности окажется тяжелым.
В некоторых странах предлагается тактика лечения ПЭ в зависимости от срока ее развития [7]. По данным ряда авторов [8, 9], ранняя ПЭ представляет собой не просто клинико-лабораторный синдром, а болезнь плаценты, развивающуюся с момента ее закладки. Заболевание может иметь не только проявления со стороны пораженного органа (плацентарная недостаточность, классическая ПЭ), но и системные проявления (тромбоцитопения, HELLP-синдром, острое повреждение почек), обусловленные прежде всего эндотелиальной дисфункцией [10]. Следует отметить, что далеко не всегда одновременно появляется классическая триада ПЭ (АГ, протеинурия и отек). Беременные находятся под постоянным медицинским наблюдением, им назначаются лекарственные препараты, и симптомы ПЭ могут быть замаскированы или стерты. Так, в настоящее время многие авторы выделяют атипичные варианты течения ПЭ, включающие гестационную АГ без протеинурии, гестационную протеинурию без АГ и выраженные отеки, особенно быстро нарастающие [11, 12]. Представленное клиническое наблюдение позволяет считать изолированный отек вульвы редким проявлением атипичного течения ПЭ. К наиболее распространенным причинам развития отека наружных половых органов во время беременности и после родов относят травматизацию, аллергические реакции [13], наследственный ангионевротический отек и инфекции [14–16]. В литературе встречаются единичные описания и других факторов, приводящих к развитию данного редкого осложнения беременности, – синдрома гиперстимуляции яичников [17] и токолитической терапии [18]. В этих случаях, как правило, после установления причины отека и проведения соответствующей терапии отек регрессирует и беременность можно пролонгировать. Однако быстрое развитие изолированного отека наружных половых органов, особенно при одновременном повышении уровня АД, по мнению всех авторов, следует рассматривать как фактор тяжести ПЭ [19, 20].
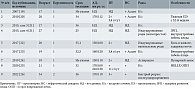
При анализе базы данных PubMed нами обнаружено всего девять работ, посвященных развитию изолированного отека наружных половых органов, ассоциированного с ПЭ (табл. 2) [19–26]. Поиск в этой базе осуществлялся по ключевым словам: vulvar edema pregnancy, isolated edema pre-eclampsia, edema pre-eclampsia pregnancy. Работы до 2000 г. не использовались из-за отсутствия полнотекстовых статей.
В четырех из девяти описанных случаев ПЭ развилась до 34-й недели, в четырех случаях уровень АД соответствовал тяжелой ПЭ (уровень систолического АД > 160 мм рт. ст.). В пяти случаях зафиксировано развитие нефротического синдрома, в трех из них – с полостными отеками. Необходимо отметить, что ПУ превышала 5 г/сут лишь в одном случае. У одной пациентки выявлены признаки полиорганной недостаточности (HELLP-синдром и острое повреждение почек). В двух случаях плод погиб внутриутробно. Несмотря на разные подходы к ведению изолированного отека вульвы, во всех случаях, как и в представленном клиническом наблюдении, отмечался быстрый регресс данного осложнения после родоразрешения, что подтверждает его несомненную связь с ПЭ. В рассмотренном случае только быстрый регресс отека и гипопротеинемии после родов окончательно утвердил нас в диагнозе ПЭ. Нефротический синдром и в настоящее время нечасто сопровождает ПЭ, а у нашей пациентки он еще и атипично манифестировал изолированным отеком необычной локализации при небольшой ПУ и даже ее полном отсутствии в некоторые дни, что не соответствовало не только критериям умеренной ПЭ, но и самого НС. Именно такое необычное течение затрудняло своевременную диагностику ПЭ. Кроме того, уровень АД практически был в норме на фоне антигипертензивной терапии в небольшом объеме в течение 18 дней наблюдения вплоть до развития критической ситуации, в референсном диапазоне находился ангиогенный коэффициент, исследованный в динамике.
Предполагается, что изолированный отек вульвы при беременности развивается из-за повышенной проницаемости сосудов и низкого уровня альбумина плазмы [20, 23]. Действительно, умеренная гипоальбуминемия (до 27–30 г/л) свойственна беременности per se и может обусловливать физиологические отеки беременных. Однако при развитии ПЭ возникают дополнительные факторы в виде активации ренин-ангиотензиновой системы, спазма мелких сосудов, дисбаланса ангиогенных и антиангиогенных факторов и повреждения эндотелиальных клеток, что может приводить к появлению патологических отеков [27]. Непосредственным триггером развития изолированного отека вульвы у пациенток с гипоальбуминемией, вероятно, служит механическое воздействие при гинекологическом осмотре или проведении других медицинских процедур. В представленном наблюдении таковым могла стать установка уретрального катетера. Ранее высказывалось предположение, что развитие патологических отеков во время беременности – важный клинический маркер ПЭ. Полное исключение этого симптома из диагностических критериев ПЭ преждевременно [28].
Заключение
С нашей точки зрения, представленный случай демонстрирует, что быстрое развитие отечного синдрома любой локализации после 20-й недели беременности, особенно в сочетании с незначительной гипоальбуминемией и гипопротеинемией, с большой долей вероятности свидетельствует о развитии преэклампсии, несмотря на отсутствие значимой АГ. Подобная клиническая ситуация требует тщательного наблюдения междисциплинарной командой врачей в динамике с возможностью применения всех доступных современных диагностических методов для быстрого принятия решения в случае ухудшения состояния беременной и/или плода.
S.V. Apresyan, PhD, Prof., K.A. Demyanova, PhD, N.L. Kozlovskaya, PhD, Prof., G.V. Usatenko, T.V. Bondarenko, M.V. Alekseeva, A.G. Chegodaeva, Yu.V. Korotchaeva, A.R. Gabrielyan
Peoples Friendship University of Russia
A.K. Yeramishantsev City Clinical Hospital, Moscow
I.M. Sechenov First Moscow State Medical University
Contact person: Ksenia A. Demyanova, ksedem@gmail.com
This article provides a clinical example of the development of early severe preeclampsia (PE) in a woman with type 1 diabetes mellitus, at the onset of which nephrotic syndrome with severe isolated vulvar edema developed. Unusual clinical manifestations raised doubts about the diagnosis of PE, which served as the basis for an extensive diagnostic search, and only a sudden sharp deterioration in the patient’s condition, requiring emergency delivery, and rapid positive dynamics in the early postpartum period allowed the diagnosis of preeclampsia to be finally confirmed.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.