Модулирующие эффекты гексапептида на субпопуляции CD16+IFNα/βR1–CD119+, CD16+IFNα/βR1+CD119– и CD16+IFNα/βR1+CD119+ нейтрофильных гранулоцитов у пациентов с постковидным синдромом
- Аннотация
- Статья
- Ссылки
- English
Цель: изучение эффектов гексапептида (ГП) Arginyl-alpha-Aspartyl-Lysyl-Valyl-Tyrosyl-Arginine in vitro на фенотип субпопуляций CD16+IFNα/βR1–CD119+, CD16+IFNα/βR1+CD119– и функциональную активность НГ у пациентов с ПКС.
Материал и методы. Исследованы 45 пациентов (24–60 лет) с ПКС и ГВИ (ВПГ1, ВЭБ, ВЧГ6, ЦМВ) – группа исследования 1 (ГИ1). Проведено анкетирование для оценки тяжести симптомов ПКС в баллах, определение содержания и фенотипа субпопуляций НГ CD16+IFNα/βR1-CD119+, CD16+IFNα/βR1+CD119-, фагоцитарной и NADPH-оксидазной функции НГ до инкубации (ГИ1) и после инкубации с ГП (10-6 г/л, 60 минут при температуре 37 °С) in vitro – группа исследования 1а (ГИ1а).
Результаты. У пациентов ГИ1 с микст-ГВИ установлены более выраженные клинические проявления СХУ и КР, чем при моно-ГВИ. Выявлено повышение плотности экспрессии всех изучаемых рецепторов на CD16+IFNα/βR1+CD119- НГ и CD16+IFNα/βR1-CD119+ НГ, свидетельствующих об активности НГ с инициацией цитотоксичности или NETosis, снижение фагоцитарной функции. Получены данные об иммуномодулирующем влиянии ГП in vitro (ГИ1а): снижение плотности экспрессии CD16-рецептора в обеих субпопуляциях, CD119-рецептора в субпопуляции CD16+IFNα/βR1-CD119+ НГ, восстановление дефектной фагоцитарной функции НГ и снижение чрезмерной активности NADPH-оксидаз.
Заключение. Позитивные иммуномодулирующие эффекты влияния ГП у пациентов с ПКС на дефектно функционирующие НГ обосновывают возможность использования иммунотерапии лекарственным препаратом на основе ГП в лечении различных проявлений ПКС, в том числе при СХУ, КР, ГВИ, что обеспечит адекватное функционирование противовирусных и регуляторных механизмов иммунной системы.
Цель: изучение эффектов гексапептида (ГП) Arginyl-alpha-Aspartyl-Lysyl-Valyl-Tyrosyl-Arginine in vitro на фенотип субпопуляций CD16+IFNα/βR1–CD119+, CD16+IFNα/βR1+CD119– и функциональную активность НГ у пациентов с ПКС.
Материал и методы. Исследованы 45 пациентов (24–60 лет) с ПКС и ГВИ (ВПГ1, ВЭБ, ВЧГ6, ЦМВ) – группа исследования 1 (ГИ1). Проведено анкетирование для оценки тяжести симптомов ПКС в баллах, определение содержания и фенотипа субпопуляций НГ CD16+IFNα/βR1-CD119+, CD16+IFNα/βR1+CD119-, фагоцитарной и NADPH-оксидазной функции НГ до инкубации (ГИ1) и после инкубации с ГП (10-6 г/л, 60 минут при температуре 37 °С) in vitro – группа исследования 1а (ГИ1а).
Результаты. У пациентов ГИ1 с микст-ГВИ установлены более выраженные клинические проявления СХУ и КР, чем при моно-ГВИ. Выявлено повышение плотности экспрессии всех изучаемых рецепторов на CD16+IFNα/βR1+CD119- НГ и CD16+IFNα/βR1-CD119+ НГ, свидетельствующих об активности НГ с инициацией цитотоксичности или NETosis, снижение фагоцитарной функции. Получены данные об иммуномодулирующем влиянии ГП in vitro (ГИ1а): снижение плотности экспрессии CD16-рецептора в обеих субпопуляциях, CD119-рецептора в субпопуляции CD16+IFNα/βR1-CD119+ НГ, восстановление дефектной фагоцитарной функции НГ и снижение чрезмерной активности NADPH-оксидаз.
Заключение. Позитивные иммуномодулирующие эффекты влияния ГП у пациентов с ПКС на дефектно функционирующие НГ обосновывают возможность использования иммунотерапии лекарственным препаратом на основе ГП в лечении различных проявлений ПКС, в том числе при СХУ, КР, ГВИ, что обеспечит адекватное функционирование противовирусных и регуляторных механизмов иммунной системы.


Введение
Постковидный синдром (ПКС), или затяжной COVID, представляет собой полисистемное состояние, включающее часто тяжелые симптомы, которые следуют в 10–30% случаев за перенесенной инфекцией SARS-CoV-2 [1] и отмечаются не только у пациентов с коморбидной патологией, но и среди молодых и ранее не предъявлявших жалобы здоровых людей [2]. Пост-COVID-синдром теперь включен в Международную классификацию болезней 10-го пересмотра [3].
ПКС объединяет множество неблагоприятных исходов с часто возникающими впервые состояниями, включая сердечно-сосудистые, тромботические и цереброваскулярные заболевания, диабет 2 типа [4], миалгический энцефаломиелит/синдром хронической усталости (СХУ) [5] и дизавтономию, особенно синдром постуральной ортостатической тахикардии [6]. Проявления ПКС разнообразны и непредсказуемы, и крайне важно оценить у таких пациентов развитие возможных осложнений, часто сопровождающих течение тяжелых вирусных инфекций с развитием СХУ и выраженных когнитивных расстройств (КР) [7]. Массовое международное исследование показало, что усталость, недомогание и когнитивные нарушения являются наиболее распространенными симптомами среди лиц с ПКС [8].
Стойкое ощущение СХУ характеризуется астенией различной степени тяжести, затяжным или волнообразным течением и является одной из самых частых жалоб пациентов [1, 8]. Выраженные КР проявляются снижением процессов запоминания, усвоения новой информации, понимания, воспроизведения увиденного, услышанного, прочитанного, выполнения повседневной деятельности, отмечаются трудности в общении с окружающими, концентрации внимания, снижение умственной работоспособности, забывчивость, ощущение тумана в голове, нарушение сна и засыпания, а также наблюдаются многочисленные и разнообразные вегетативные нарушения (головная боль, головокружение, перепады артериального давления и пульса, аритмии, тахикардии), мигрирующие боли в суставах и мышцах. При нейропсихологическом тестировании и оценке двигательной активности выявляются дефекты коммуникативности, внимания, узнавания, понимания, мышления, моторики, запоминания, воспроизведения ряда слов, цифр, фигур, страдают приспособительное поведение, работоспособность, познавательная деятельность, осмысливание, оперативная, фиксационная, кратковременная и долговременная память [9].
Больных также беспокоят повышенная потливость, длительный субфебрилитет, непостоянные боли в спине, поясничной области, горле, грудной клетке, одышка, кашель, регионарная лимфоаденопатия, потеря или изменение вкуса, запаха или слуха, плохая переносимость света и шума, боли в животе, диарея, кожные проявления васкулитов и/или аллергических реакций, выпадение волос и др. [7, 9]. Сохраняющиеся негативные сдвиги в физическом и эмоциональном состоянии приводят к социальной дезадаптации пациентов и отрицательно отражаются на качестве их жизни. Наблюдаются панические атаки, расстройства настроения: эмоциональная лабильность и психогенная депрессия, повышенная тревожность и различные фобии, асоциальное поведение, конфликтность [10]. Перечисленные осложнения встречаются у 30–50% реконвалесцентов, чаще у женщин, чем у мужчин, а их выраженность и стойкость более высоки у больных с полиорганными и коморбидными формами патологии, находившихся на лечении в палатах интенсивной терапии и реанимационных отделениях [11].
Симптомы ПКС возникают примерно через три месяца после перенесенного COVID-19 и могут длиться годами, и, в частности, в случаях впервые выявленного СХУ и дизавтономии ожидается, что при отсутствии лечения могут сохраняться всю жизнь [12]. Однако в настоящее время не существует проверенных эффективных методов лечения ПКС.
Было предложено несколько гипотез патогенеза ПКС, в том числе персистирующие резервуары SARS-CoV-2 в тканях [13], микрососудистое свертывание крови с эндотелиальной дисфункцией, нарушенная передача сигналов в стволе мозга и/или блуждающем нерве, негативное воздействие SARS-CoV-2 на микробиоту [14–17], иммунная дисрегуляция с реактивацией основных патогенов или без нее, включая герпесвирусы, такие как вирус Эпштейна – Барр (ВЭБ) и вирус герпеса человека 6 (ВГЧ6) [14, 17–19].
Нарушения в работе иммунной системы (ИС) могут сопровождаться при ПКС развитием аутоиммунных механизмов, различных фенотипов аллергических заболеваний, истощением и функциональной неполноценностью клеток врожденного и адаптивного иммунитета [7, 20].
Исследования, изучающие иммунную дисрегуляцию у людей с ПКС, обнаружили снижение числа Т-клеток CD4+ и CD8+ и повышенную экспрессию PD1 в центральных клетках памяти, сохраняющиеся не менее 13 месяцев [17, 18], высокую активность клеток врожденного иммунитета, отсутствие наивных Т- и В-клеток и повышенную экспрессию интерферонов (IFNβ и IFNλ1), сохраняющиеся в течение как минимум восьми месяцев [10], увеличение количества неклассических моноцитов, активированных В-клеток. Также было показано, что экспансия цитотоксических Т-клеток связана с желудочно-кишечным проявлением ПКС [21], а повышенные уровни цитокинов, особенно IL-1β, IL-6, TNF, IP10 и CCL11, связаны с КР [22, 23].
Также с утомляемостью и нейрокогнитивной дисфункцией, в частности, у пациентов с ПКС/СХУ, связывают реактивацию вирусов ВЭБ и ВГЧ6, которые приводят к фрагментации митохондрий и серьезно влияют на энергетический обмен [21, 24]. Кроме того, у большей части пациентов с ПКС отмечаются рекуррентные респираторные инфекции в виде частых повторных эпизодов ОРВИ, обострение хронических бактериальных и грибковых инфекций (хронические гаймориты, синуситы, фарингиты, отиты, циститы, уретриты, вульвовагиниты и др.), развитие ко-инфекций различной локализации [25].
Прогрессирование нарушений молекулярных механизмов, связанных с различными дефектами функционирования нейтрофильных гранулоцитов (НГ), является ключевым признаком постковидного периода [26, 27]. НГ, являясь эффекторными и регуляторными клетками иммунной системы, экспрессируют поверхностные мембранные рецепторы, формируя субпопуляции с различным фенотипом и функциональной активностью, имеют особое значение в противовирусной иммунной защите при восстановлении в постковидном периоде [26, 27]. С учетом вышеизложенных фактов выявленных нарушений функционирования иммунной системы, возникает необходимость разработки новых диагностических методов мониторинга, контролирующего особенности прогрессирования и тяжесть болезни, и создания новых таргетных иммунотерапевтических стратегий в лечении пациентов в постковидном периоде.
Имеется положительный опыт использования во время пандемии COVID-19 в Китае иммуномодулирующего пентапептида тимопентина (Arg-Lys-Asp-Val-Tyr, RKDVY, TP5), являющегося активным центром гормона тимуса тимопоэтина [28]. В России зарегистрирован лекарственный иммуномодулирующий препарат, активной субстанцией которого является гексапептид (ГП) Arginyl-alpha-Aspartyl-Lysyl-Valyl-Tyrosyl-Arginine – синтетический аналог активного центра гормона тимуса тимопоэтина, который обладает всеми биологическими активностями нативного гормона тимуса [29]. ГП оказывает позитивное иммунорегуляторное действие на дефектно функционирующую ИС, осуществляя восстановление Т-клеточного звена, численность и активность НГ, моноцитов, нормализацию синтеза цитокинов; также описаны его гепатопротекторные, антиоксидантные свойства, способность усиливать эффективность антибактериальной терапии, ингибировать множественную лекарственную устойчивость организма [25, 29].
Изучение молекулярных механизмов нарушений в системе НГ у пациентов с проявлениями ПКС, в частности регуляторных субпопуляций, экспрессирующих IFNα/βR-, IFNγR (CD119)- и CD16-рецепторы на мембране НГ, обеспечивающих взаимодействие между врожденным и адаптивным иммунитетом, является актуальным и представляет несомненный интерес, а изучение эффектов влияния ГП на фенотип и функции НГ может помочь в поиске терапевтических стратегий для восстановления иммунного ответа после перенесенной SARS-CoV-2-инфекции.
Цель – изучение эффектов гексапептида Arginyl-alpha-Aspartyl-Lysyl-Valyl-Tyrosyl-Arginine в системе in vitro на фенотип субпопуляций CD16+IFNα/βR1–CD119+, CD16+IFNα/βR1+CD119 и функциональную активность нейтрофильных гранулоцитов периферической крови пациентов с постковидным синдромом.
Материал и методы
С письменного информированного согласия пациентов на участие в исследовании согласно Хельсинкской декларации Всемирной медицинской ассоциации 2013 г. и на обработку персональных данных проведено исследование 45 человек (24 женщины, 21 мужчина) в возрасте 24–60 лет, находившихся на диспансерном наблюдении после перенесенного заболевания COVID-19, – группа исследования 1 (ГИ1). У пациентов ГИ1 через три месяца после перенесенного заболевания отмечались различные симптомы и проявления ПКС. Анамнестически по результатам компьютерной томографии органов грудной клетки в остром периоде COVID-19 характеризовался картиной вирусного поражения КТ 2–3. Группа сравнения (ГС) сформирована из 30 добровольцев, сопоставимых по полу и возрасту, обследованных в доковидный период.
Комплексное исследование включало сбор анамнеза, методы физикального обследования, общий и биохимический анализы крови, для выявления реактивации хронических герпесвирусных инфекций (ГВИ) использовали метод полимеразной цепной реакции (ПЦР) в реальном времени с детекцией ДНК вируса простого герпеса 1 (ВПГ1), ВЭБ, ВЧГ6, цитомегаловируса (ЦМВ) в соскобе с миндалин и задней стенки глотки.
Для оценки выраженности клинических симптомов у пациентов с СХУ и КР использована анкета, ранее разработанная нами для пациентов с ПКС, в которой оценивалось наличие или отсутствие симптомов в зависимости от тяжести их проявления в баллах от нуля до пяти [25].
На следующем этапе проведено исследование количества НГ субпопуляций CD16+IFNα/βR1-CD119+, CD16+IFNα/βR1+CD119-, CD16+IFNα/βR1+CD119+ и их фенотипа по плотности экспрессии мембранных рецепторов – MFI (FC 500, Beckman Coulter, США) с использованием конъюгатов МКАТ: IFNαβR1-FITC, CD119-PE, CD16-ECD (Beckman Coulter International S.A., Франция), до инкубации (ГИ1) и после инкубации с ГП (в концентрации 10-6 г/л) в системе in vitro течение 60 минут при температуре 37 °С – группа исследования 1а (ГИ1а).
В ГИ1 и ГИ1а также оценивали фагоцитарную функцию НГ по доле активно фагоцитирующих НГ (%ФАН), объему захваченного бактериального материала (Staphylococcus aureus, штамм 209) по показателям: фагоцитарное число (ФЧ), фагоцитарный индекс (ФИ) и завершения фагоцитарного акта по проценту переваривания (%П), индексу переваривания (ИП). Параллельно производился подсчет на 100 НГ доли клеток в апоптозе и клеток, образующих нейтрофильные экстрацеллюлярные сети (NET). Активность NADРН-оксидазы НГ определяли в NBT-спонтанном тесте (NBTсп) и в NBT-стимулированном in vitro S. aureus тесте (NBTст) по показателям: средний цитохимический индекс (СЦИсп, СЦИст), процент формазан-позитивных клеток (%ФПКсп, %ФПКст) и коэффициент мобилизации (КМ) – %ФПКcт/%ФПКсп. Группа сравнения (ГС) была сформирована ретроспективно по изучаемым показателям 30 добровольцев, обследованных в доковидный период.
Для статистической обработки полученных данных использованы компьютерные программы Microsoft Excel. Результаты представляли в виде медианы (Ме) и верхнего и нижнего квартилей (Q1; Q3), применяли критерии Манна – Уитни и Вилкоксона. Статистически значимые различия определяли при p < 0,05.
Результаты
В результате проведенного анкетирования установлено, что частота встречаемости клинических проявлений СХУ и КР была выявлена у всех пациентов ГИ1 с оценкой их выраженности согласно разработанной нами пятибалльной шкале (0 баллов – отсутствие симптомов, 1 балл – минимальные симптомы, 2 балла – средняя выраженность симптомов, 3 балла – тяжелая степень, 4 балла – очень тяжелая степень, 5 баллов – крайне тяжелая степень). Общее количество баллов составило 16,0 (14,75; 20,25), что в 16 раз больше, чем в ГС – 1,0 балл (0,5; 2,0) (р < 0,05) (табл. 1).
Наиболее выраженными признаками, которые отмечались в 100% случаев в ГИ1, являлись ощущение хронической усталости, непереносимость физической нагрузки, снижение работоспособности, повышенная утомляемость. Также у всех пациентов выявлялись разной степени выраженности когнитивные нарушения в виде снижения процессов запоминания, трудности с концентрацией внимания, ощущение тумана в голове, панические атаки и психогенная депрессия, нарушения сна и засыпания, а также присутствовали головная боль, головокружение, артралгии, миалгии. У большинства пациентов (75%) возникали периодически повышенная потливость и субфебрилитет, а в 18% случаев длительно сохранялись кашель и одышка.
У пациентов ГИ1 были выявлены клинические признаки ГВИ с последующей их детекцией. Согласно полученным данным, в ГИ1 частота встречаемости моно- и микст-ГВИ была следующей: у 20 пациентов отмечались клинические проявления ВПГ1-инфекции орофациальной локализации, из них у 37,2% детектировалась моно-ГВИ – ВПГ1-инфекция; у 62,8% – микст-ГВИ: ВПГ1-инфекция и ВЭБ-инфекция (36,8%), ВПГ1-инфекция и ВЧГ6-инфекция (21%), ВПГ1-инфекция, ВЭБ-инфекция и ВЧГ6-инфекция (5%). У пациентов с микст-ГВИ отмечено доминирование ВЭБ-инфекции в 41,8% случаев. Среди пациентов, страдающих микст-ГВИ, отмечались наиболее яркие клинические проявления ПКС, среди которых лидирующее место занимали длительные ощущения СХУ и КР, а выраженность симптомов составляла 19,0 (17,0; 21,0) балла, тогда как при моно-ГВИ – 15,0 (14,0; 16,0) балла.
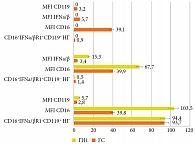
При исследовании уровня субпопуляций НГ, экспрессирующих рецепторы к IFN I (IFNα/βR1) и II типов (IFNγR (CD119)) и активационный маркерный рецептор CD16, было установлено, что в периферической крови добровольцев ГС циркулируют три субпопуляции НГ: CD16+IFNα/βR1-CD119+, CD16+IFNα/βR1+CD119-, CD16+IFNα/βR1+CD119+. Доля основной субпопуляции НГ – CD16+IFNα/βR1-CD119+ составляет 93,7 (89,8; 96,5)%, с плотностью экспрессии по MFI CD16 – 39,8 (20,4; 51,3) и CD119+(IFNγ) – 2,8 (2,5; 3,1); субпопуляция CD16+IFNα/βR1+CD119-, не экспрессирующая рецептор к IFNγ, представлена 1,4 (0,5; 2,4)% НГ с плотностью экспрессии по MFI IFNα/βR1 – 3,4 (2,6; 4,1) и MFI CD16 – 39,9 (22,9; 54,5). Также определялась субпопуляция НГ CD16+IFNα/βR1+CD119+, одновременно экспрессирующая IFNα/βR1- и IFNγ-рецепторы, представленная всего у 0,9 (0,4; 1,8)% НГ, но при этом имеющая более высокие значения плотности экспрессии IFNα/βR1 (p > 0,05) и CD119-молекул (p > 0,05) (рисунок).
Отличительной особенностью ГИ1 явилось отсутствие в 93% случаев субпопуляции CD16+IFNα/βR1+CD119+ (n = 42) (см. рисунок). При этом в 7% случаев, только у трех пациентов с микст-ГВИ (ВПГ1-инфекция, ВЭБ-инфекция и ВЧГ6-инфекция) регистрировались 0,3 (0,3; 0,7)% НГ субпопуляции CD16+IFNα/βR1+CD119+ с повышенными в 1,8 раза MFI IFNα/βR1-10,3 (9,82; 10,5), в 6 раз CD119 – 18,4 (10,4, 34,8) и в 1,4 раза CD16 – 54,7 (38,4; 91,8) по отношению к значениям ГС (p1–3 < 0,05).
Содержание НГ субпопуляции CD16+IFNα/βR1-CD119+ в ГИ1 не отличалось от ГС (p > 0,05), но при этом отмечалось увеличение плотности экспрессии по MFI рецепторов CD16 в 2,6 раза (p < 0,05) и CD119 – в 1,9 раза (p < 0,05). Также наблюдалась тенденция к снижению в 2,8 раза содержания субпопуляции CD16+IFNα/βR1+CD119- НГ (p > 0,05). Для этой субпопуляции были характерны повышенные в 4,5 раза уровни экспрессии рецептора IFNα/βR1 (p < 0,05) и в 1,7 раза – CD16 (p < 0,05) по отношению к показателям ГС (см. рисунок).
Инкубация с ГП in vitro НГ пациентов с ПКС выявила модулирующие эффекты на фенотип двух субпопуляций – CD16+IFNα/βR1-CD119+, CD16+IFNα/βR1+CD119-, не влияя на их содержание. Так, на НГ субпопуляции CD16+IFNα/βR1-CD119+ наблюдалось снижение в 1,6 раза плотности экспрессии по MFI как СD16 до 64,0 (54,5; 76,0) против 103,5 (83,9; 121,0) в ГИ1 (p < 0,05), так и СD119 до 3,5 (3,5; 5,2) против 5,7 (5,4; 6,8) в ГИ1 (p < 0,05). При этом регистрируемые показатели MFI СD16 и MFI СD119 оставались повышенными по отношению к уровню экспрессии молекул на НГ данной субпопуляции в ГС (p1, 2 < 0,05). Эффекты влияния ГП на фенотип субпопуляций CD16+IFNα/βR1+CD119-НГ также заключались в снижении в 1,4 раза MFI CD16 по отношению к показателям ГИ1 (p < 0,05) до уровня, определяемого в ГС (p > 0,05), при этом плотность экспрессии IFNα/βR1 не менялась и не отличалась от значений, регистрируемых в ГИ1 пациентов с ПКС, оставаясь в 4,7 раза выше значений в ГС (р > 0,05) (табл. 2).
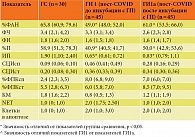
Анализ функционального потенциала НГ при ПКС выявил значительное снижение в 1,3 раза доли активно фагоцитирующих НГ (%ФАН) (p < 0,05), %П в 1,4 раза и 2,9 раза ИП (р1, 2 < 0,05) по отношению к показателям ГС, на фоне увеличения содержания НГ-образующих NETs и клеток в апоптозе. При этом в этой группе пациентов отмечалось: в спонтанном NBT-тесте напряженность NADPH-оксидаз по показателям СЦИсп – 0,46 (0,41; 0,49) и %ФПКсп – 8,0 (6,8; 9,0)% в сравнении с ГС (р1, 2 < 0,05); в стимулированном NBT-тесте при дополнительной нагрузке S. aureus снижение показателей СЦИст – 0,36 (0,33; 0,39) и %ФПК 6,0 (5,8; 7,0), что демонстрирует истощение оксидазного микробицидного потенциала, КМ – 0,86 (0,75; 1,26) (р1, 2 < 0,05) (табл. 3).
После инкубации НГ пациентов с ПКС в системе in vitro с ГП отмечалось статистически значимое увеличение доли ФАН (p < 0,05) и восстановление процессов киллинга и переваривания (%П, ИП) до уровня показателей ГС (р1, 2 > 0,05), снижение спонтанной и усиление стимулированной активности NADPH-оксидаз как по показателям %ФПК, так и по СЦИ с сохранением резервного микробицидного потенциала, КМ – 1,2 (1,1; 1,9). ГП в системе in vitro не влиял на процессы образования NETs и апоптоз (см. табл. 3).
Обсуждение
Таким образом, у пациентов исследуемой группы с СХУ и КР на фоне моно- и микст-ГВИ отмечается трансформация фенотипа субпопуляций НГ, несущих рецепторы к IFNα и IFNγ, регулирующих и запускающих противовирусную активность НГ и активационный рецептор CD16, отвечающий за цитотоксичность НГ по отношению к инфицированным вирусами клеткам. Выявлено статистически значимое повышение плотности экспрессии всех изучаемых рецепторов на НГ субпопуляций CD16+IFNα/βR1+CD119- и CD16+IFNα/βR1-CD119+, свидетельствующих об активности и готовности к восприятию цитокиновых сигналов с инициацией вероятнее всего антителозависимой клеточной цитотоксической реакции или NETosis. Также выявлено снижение функциональной активности НГ, проявляющееся в снижении процессов захвата и переваривания бактериальных антигенов и напряженности NADPH-оксидазной активности с истощением резервных возможностей НГ.
Учитывая, что IFN I и II типов усиливают NETosis [26, 30], возможно предположить, что значительное повышение экспрессии рецепторов, отмечаемое в ГИ1, может усугубить нейтрофильную инфильтрацию и нетоз, а также связанные с этими процессами проявления ПКС. Кроме того, при инфекционных процессах НГ синтезируют и секретируют IFNγ, который через свои же рецепторы активирует синтез NADPH-оксидазы, миелопероксидазы и аргиназы. Высокие уровни активации NADPH-оксидазы также запускают формирование NET, происходит локальное снижение концентрации аргинина, что влечет за собой торможение функциональной активности Т-лимфоцитов [26, 30].
В настоящем исследовании продемонстрированы экспериментальные данные, свидетельствующие о позитивном иммуномодулирующем влиянии ГП на количественные и фенотипические характеристики субпопуляций НГ: CD16+IFNα/βR1-CD119+, CD16+IFNα/βR1+CD119-, фагоцитарную и NADPH-оксидазные функции НГ пациентов с ПКС. В эксперименте in vitro под влиянием ГП было показано умеренное снижение MFI CD16-рецептора в обеих субпопуляциях, MFI CD119-молекул в субпопуляции CD16+IFNα/βR1-CD119+НГ (p1, 2 < 0,05), показатели MFI IFNα/βR1 в субпопуляции CD16+IFNα/βR1+CD119- НГ сохранялись на уровне значений ГИ1. Такая трансформация фенотипа в изучаемых субпопуляциях НГ, вероятно, является оптимальной для баланса между гиперактивацией клеток и необходимостью контроля за ГВИ. Кроме того, под влиянием ГП отмечалось восстановление дефектной фагоцитарной функции НГ и снижение чрезмерной активности NADPH-оксидаз.
Ранее нами были получены данные о позитивных клинико-иммунологических эффектах, достигнутых при использовании комплексного подхода к лечению ГВИ, включающего в числе других лечебных мероприятий таргетную интерферонотерапию и иммуномодулирующую терапию с использованием лекарственного препарата на основе ГП. Отмечена коррекция дисрегуляторных нарушений в системе ИФН, иммунной системе – восстановление количества и функциональной активности Т-лимфоцитов, обладающих цитотоксической киллерной активностью (CD3+CD8+-Т-лимфоцитов и NKT), что способствовало значительному улучшению состояния пациентов, регрессу СХУ, КР и восстановлению работоспособности [25].
Заключение
Полученные позитивные эффекты влияния ГП в системе in vitro у пациентов с ПКС на дефектно функционирующие нейтрофильные гранулоциты в виде реставрации измененного фенотипа субпопуляций нейтрофильных гранулоцитов CD16+IFNα/βR1-CD119+, CD16+IFNα/βR1+CD119-, устранения дисбаланса восприятия интерферонов, восстановления эффекторных функций НГ с уменьшением их агрессивного потенциала, спровоцированного перенесенной SARS-CoV-2-инфекцией и активацией ГВИ, обосновывают возможность использования иммуномодулирующей терапии лекарственным препаратом на основе ГП в лечении ПКС с полисимптомными проявлениями, в том числе при СХУ и КР, возникших на фоне дисрегуляторных процессов в иммунной системе и увеличенного агрессивного потенциала исследованных субпопуляций НГ. Снижение инфекционной нагрузки в постковидном периоде, уменьшение агрессивного потенциала субпопуляций НГ CD16+IFNα/βR1-CD119+, CD16+IFNα/βR1+CD119-, восстановление их эффекторных функций, а также адекватного функционирования противовирусных механизмов иммунной системы, по-видимому, способствуют полноценной реализации механизмов нейроиммуноэндокринной регуляции. Продемонстрированные экспериментальные данные дополняют известные сведения об иммунопатогенезе ПКС и более полно освещают и объясняют дополнительные причины позитивного влияния ГП, являющегося действующей субстанцией препарата Имунофан®, на позитивную клиническую эффективность, полученную нами в более ранних исследованиях при проведении интерфероно- и иммуномодулирующей терапии у пациентов с ПКС [25].
I.V. Nesterova, MD, PhD, Prof., G.A. Chudilova, MD, PhD, M.G. Atazakhova, V.A. Matushkina, S.V. Kovaleva, MD, PhD, V.N. Chapurina
Kuban State Medical University
Patrice Lumumba Peoples' Friendship University of Russia
Contact person: Irina V. Nesterova, inesterova1@yandex.ru
Postcovid syndrome (PCS) is a polysystemic pathology that includes various syndrome complexes: chronic fatigue syndrome (CFS), cognitive disorders (CD) occurring against the background of reactivation of chronic herpesvirus infections (HVI). The diverse and sometimes unpredictable clinical manifestations of PCS require clarification of immunopathogenesis, identification of immune system dysfunctions, in particular, neutrophil granulocytes (NG), and the search for immunotherapeutic strategies.
Objective: to study the effects of Arginyl-alpha-Aspartyl-Lysyl-Valyl-Tyrosyl-Arginine hexapeptide (GP) in vitro on the phenotype of CD16+IFNa/βR1–CD119+, CD16+IFNa/βR1+CD119+ subsets and functional activity of NG in patients with PCS.
Material and methods. 45 patients (24–60 years old) with PCS and HVI (HSV1, EBV, HHV6, CMV) – study group 1 (SG1) were studied. A questionnaire was conducted to assess the severity of PCS symptoms in points,
to determine the content and phenotype of subsets of NG – CD16+IFNa/βR1-CD119+, CD16+IFNa/βR1+CD119–, phagocytic and NADPH oxidase functions of NG before incubation (SG1) and after incubation with GP (10-6 g/l, 60 min at T 37°C) in vitro – study group 1a (SG1a).
Results. In patients of SG1 with mixed-GVI, more pronounced clinical manifestations of CFS and CD were established than in mono-GVI. An increase in the expression density of all studied receptors on CD16+IFNa/βR1+CD119–NG and CD16+IFNa/βR1–CD119+NG was revealed, indicating the activity of NG with the initiation of cytotoxicity or NETosis, a decrease in phagocytic function. Data on the immunomodulatory effect of GP in vitro (SG1a) were obtained: reduction of CD16 receptor expression density in both subsets, CD119 receptor in CD16+IFNa/βR1–CD119+NG subset, restoration of defective phagocytic function of NG and reduction of excessive NADPH oxidase activity. Data on the immunomodulatory effect of GP in vitro (SG1a) were obtained: reduction of CD16 receptor expression density in both subpopulations, CD119 receptor in CD16+IFNa/βR1-CD119+NG subset, restoration of defective phagocytic function of NG and reduction of excessive NADPH oxidase activity. Data on the immunomodulatory effect of GP in vitro (SG1a) were obtained: reduction of CD16 receptor expression density in both subsets, CD119 receptor in CD16+IFNa/βR1-CD119+ NG subset, restoration of defective phagocytic function of NG and reduction of excessive NADPH oxidase activity.
Conclusion. The positive immunomodulatory effects of GP in patients with PCS on defectively functioning NG justify the possibility of using GP-based immunotherapy in the treatment of various manifestations of PCS, including in CFS, CD, GVI, which will ensure the adequate functioning of antiviral and regulatory mechanisms of the immune system.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.