Астения и когнитивные расстройства у пациентов среднего возраста: этиология, патогенез, подходы к терапии
- Аннотация
- Статья
- Ссылки
- English
Лечение когнитивных нарушений у пациентов молодого и среднего возраста представляет сложную задачу с учетом полиэтиологической природы данного состояния. Первоочередная задача терапии – выявление и устранение либо уменьшение выраженности причины, приведшей к развитию когнитивных нарушений. Широко используются нелекарственные методы. Терапия может быть дополнена препаратами неспецифического ноотропного и антиоксидантного действия.
Лечение когнитивных нарушений у пациентов молодого и среднего возраста представляет сложную задачу с учетом полиэтиологической природы данного состояния. Первоочередная задача терапии – выявление и устранение либо уменьшение выраженности причины, приведшей к развитию когнитивных нарушений. Широко используются нелекарственные методы. Терапия может быть дополнена препаратами неспецифического ноотропного и антиоксидантного действия.

![Схема обработки эмоционально негативных импульсов при когнитивном искажении [28]](/upload/resize_cache/iblock/10d/195_350_1/Preobrazhenskaya3.jpg)
Введение
Когнитивные нарушения – часто развивающийся синдром, который может быть как следствием непосредственного поражения головного мозга, так и проявлением многих соматических и дисметаболических расстройств, сопутствовать расстройствам настроения и поведения. Распространенность когнитивных нарушений достаточно высока. В 2022 г. в мире насчитывалось более 40 млн пациентов с деменцией. Ожидается, что к 2050 г. этот показатель превысит 115 млн [1].
К сожалению, точные данные о частоте встречаемости недементных когнитивных нарушений, или так называемых легких и умеренных когнитивных расстройств (УКР), получить сложнее, поскольку когнитивные нарушения, не достигающие степени деменции, еще более полиэтиологичны, чем состояния, приводящие пациента к деменции.
Как показывают результаты исследований, за год УКР развиваются в среднем у 21% пожилых пациентов [2]. Аналогичные результаты приводят K.M. Ishikawa и соавт. [3]: когнитивные нарушения манифестируют у 27% пожилых пациентов в год. Дополнительное увеличение частоты развития УКР в популяции скорее всего обусловлено дополнительной социальной изоляцией, которая из-за пандемии COVID-19 оказалась типичной для пожилых людей в период проведения исследования [3]. Следует обратить внимание на тот факт, что исследования касаются исключительно пациентов в возрасте 65 лет и старше; представленность УКР у трудоспособных пациентов среднего возраста неизвестна.
Такие же сложности отмечаются и при оценке частоты встречаемости так называемых субъективных когнитивных расстройств (СКР) – состояний, когда пациент ощущает изменение скорости или качества когнитивного процесса, но при проведении количественного нейропсихологического тестирования специалист не выявляет отклонений от возрастной нормы [4].
Распространенность СКР у пациентов старше 60 лет оценивали в международных когортах. Общее количество участников исследований составило 39 387 [5]. СКР зафиксированы почти в четверти случаев – 23,8% (95%-ный доверительный интервал 23,3–24,4). Однако оценки распространенности в разных исследованиях сильно различались. Показано, что распространенность СКР выше у мужчин, у лиц с более низким уровнем образования, а также у лиц, проживающих в странах с низким и средним уровнем дохода. Кроме того, достаточно высокие показатели распространенности СКР получены в исследованиях, проведенных в более поздние годы либо десятилетия. Таким образом, имеющиеся данные свидетельствуют не только о высокой распространенности СКР среди пожилого населения планеты, но и о возрастании частоты развития СКР в мире в последние годы. О частоте представленности СКР у пациентов молодого и среднего возраста мы, к сожалению, по-прежнему не имеем каких-либо достоверных статистических данных.
В то же время астенический синдром, или астения (усталость, снижение работоспособности, внимания, скорости психических процессов, активности в течение дня) – одно из самых частых состояний как у пациентов, перенесших инфекцию, так и у пациентов с эмоциональными расстройствами и разнообразными соматическими заболеваниями. Астенический синдром – частое болезненное проявление у пациентов молодого и среднего возраста. Под астенией подразумевается патологическое состояние, проявляющееся повышенной утомляемостью, истощаемостью психических процессов, повышенной раздражительностью, нередко с нарушением сна, непереносимостью резких звуков, запахов, света [6]. Часто для обозначения астении в современной клинической практике используют термин «синдром хронической усталости» (chronic fatigue syndrome). Как видим, субъективные или умеренные когнитивные нарушения являются облигатной составляющей данного состояния. Частота встречаемости астенического синдрома среди людей молодого и среднего возраста достаточно высока – от 15 до 57% в зависимости от популяции [7]. Таким образом, жалобы на когнитивное снижение у пациентов молодого и среднего возраста – явление не редкое.
Клинические проявления астенического синдрома у пациентов среднего возраста
При диагностике когнитивных нарушений в рамках астенического синдрома следует учитывать ряд диагностических трудностей. Так, важно правильно определять и отличать физиологическую усталость и астению. Между указанными состояниями имеется существенное различие. Физиологическая усталость, вызванная активной, напряженной работой, недостаточным количеством сна, проходит после отдыха. Астения – болезненное состояние, приводящее к снижению повседневной активности пациента и не проходящее после отдыха. В Международной классификации болезней 10-го пересмотра астения характеризуется как неврастения, органическое эмоционально-лабильное расстройство, неспецифическая астения [8].
Развитие астенического синдрома – типичная реакция на тяжелый стресс и нарушение адаптации. Кроме того, астения часто сопутствует неврологическим заболеваниям. Например, хроническая усталость регулярно отмечается у пациентов с синдромом дефицита внимания и гиперактивности, расстройствами аутистического спектра, энцефалопатиями различной этиологии, особенно при поражении так называемого первого блока организации психической деятельности согласно концепции А.Р. Лурии [9] – ствола головного мозга, базальных ганглиев, включая структуры гиппокампова круга, лимбическую систему, медиобазальную лобную кору. Астения – частое проявление в рамках сосудистых когнитивных расстройств, в одинаковой степени типична как для пациентов с постинсультными когнитивными нарушениями, так и для пациентов с болезнью малых сосудов на любой стадии развития [10]. Высокая коморбидность указанных состояний объясняется прежде всего тем, что при болезни малых сосудов уже на начальных этапах поражаются так называемые зоны водораздела: конечные зоны кровообращения передней, средней и задней мозговых артерий и, как следствие, базальные ганглии, медиобазальная лобная кора, лимбическая система и связи лобных долей с другими отделами головного мозга. Астения – регулярное проявление экстрапирамидной патологии, в частности болезни Паркинсона [11].
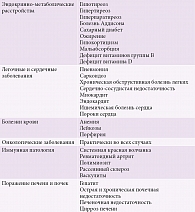
Нередко астения вызывается соматическими причинами (таблица). По сути, чтобы установить диагноз синдрома хронической усталости, пациенту необходимо выполнить детальное обследование с целью исключения другого фактора, на фоне которого развиваются когнитивное снижение, утомляемость, слабость и нарушения сна.
Следует обращать внимание также и на то, какие лекарственные препараты получает пациент, поскольку в ряде случаев астения является их типичным побочным действием. Часто астению вызывают лучевая и химиотерапия, а также прием препаратов, таких как леводопа, дексаметазон, ингибиторы моноаминоксидазы, бета-блокаторы, дилтиазем, бензодиазепины, дигоксин.
Особый интерес вызывает постинфекционная астения. Надо отметить, что астенический синдром наблюдается после перенесенной острой сезонной вирусной инфекции и проявляется слабостью, усталостью, снижением познавательных способностей, повышенной раздражительностью и нарушением сна примерно у 30% пациентов [12]. Развитие постинфекционной астении не зависит от тяжести перенесенного заболевания. Астенический синдром может развиться при любой инфекции, в том числе при хронических инфекциях (вирус иммунодефицита человека, туберкулез, сифилис, боррелиоз и т.д.), а также после заболевания гриппом, острыми респираторными вирусными инфекциями, вирусным гастроэнтеритом.
Вероятно, астения после инфекционного заболевания развивается по физиологическим причинам: организму необходимо время на восстановление после перенесенного заболевания. При этом снижение познавательных способностей, слабость, утомляемость могут быть обусловлены в том числе нейротропным действием ряда вирусов. Например, таким действием характеризуются вирусы гриппа, кори, лихорадки западного Нила, COVID-19 [13, 14]. В отношении последнего астения и симптомы когнитивного снижения описаны наиболее ярко. Частота распространения данного состояния даже привела к созданию отдельных терминов – пост-COVID, или long-COVID [15–17].
Интересно, что термин long-COVID был введен не медицинским сообществом. Впервые его предложила Элиза Перего, археолог из Ломбардии. В июне 2020 г. охват хештега #LongCovid вырос, поскольку пациенты по всему миру перевели его на французский (#apresJ20), испанский (#covid persiste), японский (#), финский (#koronaoire) и некоторые другие языки. В медицинской прессе термин long-COVID впервые появился в июне 2020 г., после того как врач интенсивной терапии доктор Джейк Суэтт присоединился к группе поддержки, созданной пациентами, в Facebook: «31-летний доктор Джейк Суэтт помогал Британии бороться с коронавирусом всего неделю, прежде чем 20 марта у него появились симптомы. У врача отделения интенсивной терапии, который работает в NHS в Норфолке, не было серьезных проблем со здоровьем, и он ходил в спортзал четыре или пять раз в неделю. Но то, что сначала казалось усталостью и болью в горле, вскоре превратилось в лихорадку, сухой кашель и одышку. Двенадцать недель спустя он все еще страдал от болей в груди, одышки, нечеткости зрения, потери памяти, высокой температуры, проблем с концентрацией внимания и не мог работать. Он сказал Sky News: „Я все еще задыхаюсь, когда мою посуду или хожу по дому. Я провел три дня, задыхаясь в постели, я действительно думал, что умру, это было очень мучительно. С тех пор ситуация улучшилась, но ненамного и очень, очень медленно. У меня также были желудочно-кишечные симптомы и стреляющие боли в руках и ногах“» [16].
Месяц спустя (июль 2020 г.) Британский медицинский журнал (BMJ) опубликовал запись в блоге, подписанную коллективом пострадавших врачей: «Опыт пациентов с „хроническим COVID-19“ отсутствует в отчетах национальной службы здравоохранения Великобритании» [18]. Структурированный анализ контента социальных сетей от пациентов, считающих себя больными long-COVID, показал, что до июня 2020 г. они были «невидимы» для здравоохранения: длительное течение COVID-19 не диагностировалось либо пациенты подвергались газлайтингу со стороны врачей, получали очень мало поддержки, информации и лечения». Разрыв между пациентами и медицинским учреждением начал сокращаться во втором семестре 2020 г., когда научные журналы и правительства стали сообщать о возможном существовании long-COVID [19].
Как продемонстрировали результаты исследований, long-COVID развивается достаточно часто. Так, в когортном исследовании с участием 1733 пациентов с подтвержденным COVID-19 три четверти сообщили о наличии в анамнезе хотя бы одного из следующих симптомов: утомляемость или мышечная слабость (63%), нарушения обоняния (11%) или вкуса (7%), головная боль (2%), миалгии (2%). На тревогу/депрессию указали 23% пациентов [20].
В исследовании H.E. Davis (n = 2433) были получены аналогичные результаты. При этом повышенная утомляемость была ведущим симптомом – у 30% пациентов [21].
Большой онлайн-опрос Patient-Led Research Collaborative выявил гораздо более высокую распространенность неврологических симптомов, включая когнитивную дисфункцию (85%), головную боль (77%), расстройства настроения (88%) и ухудшение памяти (77%) [21].
Метаанализ данных почти 50 000 пациентов показал, что 80% из них сообщали по крайней мере об одном постоянном симптоме: головной боли (44%), утомляемости (58%) и нарушении внимания (27%) в качестве основных жалоб после перенесенного COVID-19 [22].
Астения на фоне long-COVID, как правило, не только проявляется слабостью, повышенной утомляемостью и снижением работоспособности, но и сочетается с эмоциональными расстройствами (внутреннее напряжение, тревога, перепады или снижение настроения, раздражительность и др.), когнитивными нарушениями (нарушение внимания, рассеянность, снижение памяти и др.), вегетативными расстройствами (головокружение, тахикардия, гипертермия, гипергидроз, гипервентиляция, диспепсия и др.), болевыми феноменами (миалгии, головные боли напряжения, кардиалгии, абдомиалгии, боли в спине и др.), мотивационными и обменно-эндокринными расстройствами (диссомния, снижение либидо, изменение аппетита, снижение массы тела, дисменорея и др.), гиперестезией (повышенная чувствительность к свету, звуку и другим раздражителям), то есть соответствует клиническим проявлениям астенического синдрома [23]. Проведенные обследования показали, что уровень тревожности у пациентов после перенесенного COVID-19 достаточно высок. Так, в исследовании R.F. Damiano и соавт. [24] участвовали 425 пациентов, которые были обследованы через 6–9 месяцев после выписки из больницы с лабораторно подтвержденным COVID-19 c помощью структурированного психиатрического интервью, психометрических тестов и когнитивной батареи. Диагнозы «депрессия», «генерализованное тревожное расстройство» и «посттравматическое стрессовое расстройство» были установлены у 8, 15,5 и 13,6% пациентов соответственно. После начала пандемии (то есть в течение предыдущего года) распространенность диагнозов депрессии и генерализованного тревожного расстройства у участников исследования составила 2,56 и 8,14% соответственно. О снижении памяти субъективно сообщили 51,1% пациентов. Психиатрические или когнитивные исходы не были обусловлены какими-либо клиническими переменными, связанными с тяжестью острой фазы заболевания, и психосоциальными стрессорами, касающимися заболевания.
Систематический обзор 1458 статей (18 исследований, 10 530 пациентов) показал, что примерно у 25% пациентов наблюдались расстройства внимания, тревожность, спутанность сознания и проблемы с памятью [25]. Субъективные симптомы чаще встречались в долгосрочной (шесть месяцев и более), чем в краткосрочной (3–6 месяцев после COVID) перспективе с совокупной распространенностью 25 и 40% для «мозгового тумана», 20 и 40% для тревоги соответственно. При этом для пациентов не была характерна когнитивная дисфункция, то есть их состояние соответствовало субъективным когнитивным расстройствам. Фактически подгруппа субъективных когнитивных жалоб и психических симптомов может появиться de novo после фазы выздоровления и, вероятно, не является прямым следствием острого COVID-19, но, возможно, связана с повышенной тревожностью.
Тревога и депрессия развиваются в популяции чрезвычайно часто. Депрессией в мире страдают не менее 300 млн пациентов, причем частота случаев депрессии ежегодно увеличивается: в среднем общемировой прирост депрессивных расстройств составляет 18% в течение десяти лет [26]. Таким образом, каждый десятый взрослый на планете переживает в течение жизни хотя бы один депрессивный эпизод. Пик распространенности депрессии приходится на молодой возраст: к 19 годам каждый четвертый молодой человек в США и странах Евросоюза переживает хотя бы один депрессивный эпизод [27]. К пожилому возрасту распространенность депрессии снижается до 10–15% в популяции, однако при утрате пожилым человеком супруга/супруги, круга общения и/или при помещении в социальное учреждение возрастает до 20–25%.
Когнитивные нарушения – типичные проявления как депрессии, так и тревоги. Наиболее частыми когнитивными расстройствами являются: дефицит внимания (как зрительного, так и слухоречевого), снижение уровня кратковременной и оперативной памяти, трудности, возникающие при обработке информации любой модальности, снижение скорости обработки информации, а также трудности выстраивания программы деятельности и контроля за ее исполнением. Когнитивным симптомом, требующим дополнительного обсуждения, является так называемое когнитивное искажение – смещение фокуса от положительных стимулов к отрицательным, а также неадекватные реакции на отрицательную обратную связь и принятие решений. В исследовании S.G. Disner и соавт. показано, что когнитивное искажение при депрессии – симптом, связанный с функциональными и морфологическими изменениями мозга [28]. Сигналы от входящих отрицательных стимулов вызывают гиперактивность в таламусе, передаются от таламуса к миндалевидному телу и гиппокампу, которые в свою очередь демонстрируют при депрессии взаимное облегчение проведения импульсов во время обработки эмоциональной информации. Далее импульс направляется к поясной коре (ПК). Различные отделы ПК играют разные когнитивные роли. Так, вентральная ПК участвует в маркировке стимулов с эмоциональной валентностью, а ростральная ПК определяет стимулы с самореферентными значениями. ПК передает лимбическую активность в более высокие области коры, такие как префронтальная кора. В то же время гипоактивность дорсолатеральной префронтальной коры обусловливает снижение когнитивного контроля и адаптивной регуляции. Конечным результатом этого процесса является повышение осведомленности, сознательный выбор и обработка преимущественно негативных раздражителей из окружающей среды (рисунок). Учитывая, что когнитивное искажение формируется в первом блоке организации психической деятельности согласно концепции А.Р. Лурии, оно предсказуемо будет связано не только с когнитивным снижением, но и с колебанием уровня активности, повышенной истощаемости и, возможно, нарушением сна, то есть с симптомокомплексом астенического синдрома или синдрома хронической усталости.
Существует гипотеза, согласно которой когнитивные нарушения могут предшествовать депрессии и служат диагностическим маркером ее развития [29]. В одном из ранних исследований сравнивали когнитивные функции здоровых близнецов из монозиготных и дизиготных пар, где второй близнец страдал большим депрессивным расстройством [30]. Средний возраст исследуемых пар близнецов колебался от 38 до 48 лет. После контроля демографических и клинических переменных сравнительный анализ когнитивных функций показал, что здоровые, не страдавшие депрессией близнецы, также имели нарушение внимания, рабочей памяти, исполнительных функций, обработки речи и памяти. Аналогично в более позднем исследовании с участием взрослых (средний возраст – 45 лет) монозиготных близнецов, дискордантных по депрессии, после поправки на возраст и пол признаки нарушения внимания и интеллекта были обнаружены как у больных, так и у здоровых близнецов по сравнению с парами близнецов без истории депрессии [31].
Помимо описанных выше причин развития субъективных и легких когнитивных нарушений молодого и среднего возраста следует учитывать такие состояния, как реактивная, первичная и вторичная астения [32].
Реактивная астения развивается у здорового человека под воздействием неблагоприятных факторов (сменная работа, экзамены, соревнования и др.). Развитие данного состояния дополнительно провоцируют работа по сменному графику, необходимость поддерживать высокий уровень внимания длительное время (например, у авиадиспетчеров). Пациента начинают беспокоить повышенная слабость, утомляемость, трудности выполнения привычной повседневной активности, снижение уровня внимания, выносливости, памяти, мотивации. Важной особенностью реактивной астении является ее обратимость: при устранении фактора, приводящего к развитию данного состояния, симптомы полностью проходят в течение некоторого времени.
Первичная, или функциональная, астения является самостоятельным заболеванием. Как правило, пациенты с функциональной астенией имеют низкую массу тела, большой рост, удлиненные конечности, плохо переносят физические и эмоциональные нагрузки. Вторичная астения – клинический симптом другого заболевания (причины вторичной астении подробно рассмотрены выше).
Подходы к терапии
Исходя из того, что легкие и субъективные когнитивные нарушения молодого и среднего возраста – полиэтиологическое состояние, основные задачи терапии сводятся к выявлению причины, приведшей к развитию когнитивных нарушений, и устранению либо уменьшению выраженности этой причины. Должно быть проведено подробное соматическое и неврологическое обследование пациента. При выявлении у пациента тревожного или депрессивного расстройства предпочтение следует отдавать антидепрессантам, улучшающим когнитивную функцию: дулоксетину, венлафаксину/десвенлафаксину, вортиоксетину, тианептину и миртазапину [33]. Хотя антидепрессанты у пациентов с когнитивными нарушениями могут быть менее эффективны, чем у когнитивно здоровых пациентов, ни доза, ни продолжительность лечения не должны отличаться.
В лечении субъективных и умеренных когнитивных нарушений, в том числе у пациентов с синдромом хронической усталости, можно использовать немедикаментозные методы. Пациентам с синдромом хронической усталости рекомендуют проведение рефлексотерапии [12, 34, 35]. Широко используются методы релаксации и медитации [36], коррекция питания, гигиена сна, неспецифический когнитивный тренинг [37]. Пациентам важно объяснить необходимость оптимизации образа жизни (упорядочить режим труда, отдыха и сна), ежедневной физической активности.
Среди лекарственных препаратов преобладают средства неспецифического действия с ноотропным, антиоксидантным и нейрометаболическим эффектами. Одним из наиболее часто применяемых в таком случае лекарственных средств является Глицин производства ООО «МНПК «БИОТИКИ». Уникальная запатентованная технология микрокапсулирования обеспечивает стойкий терапевтический эффект и длительное высвобождение действующего вещества.
Следует отметить, что в разработке лекарств-метаболитов, регулирующих физиологические процессы естественным образом, компания «БИОТИКИ» использует стандарт GMP (Good Manufacturing Practice, Надлежащая производственная практика), принципы Международной организации по гармонизации (ICH Q8, ICH Q9 и ICH Q10). Система менеджмента качества основана на ISO 9001. Многие препараты, особенно такие, как Глицин и Биотредин, хорошо известны и широко используются неврологами, терапевтами и педиатрами.
Глицин представляет собой заменимую аминокислоту, поступающую в организм с пищей и синтезируемую de novo, принимает непосредственное участие в синтезе пуринов, порфиринов, креатина и фосфолипидов. Кроме того, он способствует поддержанию работы дыхательной цепи, усиливает энергообразующую и энергосберегающую функцию митохондрий, увеличивает образование аденозинтрифосфата и энергетику клетки в целом [38].
Глицин способен выступать в роли аллостерического коагониста глутаматных рецепторов. Он усиливает способность глутамата и NMDA открывать катионный канал. Как известно, глутамат – универсальный активатор NMDA-рецепторов, открытие которых в свою очередь приводит к изменению поляризации мембраны нейрона с последующим формированием электрического импульса. Недостаточная активация NMDA-рецепторов часто лежит в основе таких когнитивных феноменов, как снижение уровня внимания и общей психической активности: пациент не в состоянии выделить из фонового шума значимый импульс и качественно запомнить и быть способным его воспроизвести [39]. Вероятно, умеренное влияние на глутаматный каскад и объясняет основное действие глицина – повышение умственной работоспособности на фоне снижения стресса. Кроме того, глицин действует непосредственно как постсинаптический тормозной медиатор [40].
Глицин, используемый в монотерапии, уменьшает психоэмоциональное напряжение и выраженность вегетативной дисфункции, снижает уровень стресса и мышечную утомляемость, повышает умственную работоспособность, улучшает сон [41]. Исследователями была выявлена значительная эффективность Глицина в отношении отдельных психопатологических синдромов, симптомов депрессии и риска развития психоза. Отмечалось также снижение тревоги у пациентов с симптомами посттравматического стрессового расстройства [42, 43].
Эффективность Глицина в терапии тревоги у пациентов с расстройством адаптации оценивали в отечественном рандомизированном плацебо-контролируемом исследовании [44]. В исследование были включены 64 пациента, 34 из них составили основную группу, 30 – контрольную (плацебо).
Общее состояние пациентов оценивали по шкале общего клинического впечатления CGI-S (тяжесть состояния), выраженность симптомов тревоги – по шкале Гамильтона HAM-A. У всех пациентов была выявлена легкая выраженность тревожного аффекта. Результаты показали достоверное снижение уровня тревоги у пациентов основной группы по сравнению с пациентами группы плацебо через четыре недели терапии. Наиболее чувствительными к терапии Глицином оказались такие симптомы, как тревожное настроение (52 против 29% редукции в группе плацебо), нарушение сна (45 против 19%), напряжение (42 против 12%).
Сублингвальный прием глицина обусловливает его быстрое поступление в кровоток и повышение концентрации в плазме. Имеющиеся данные свидетельствуют о том, что длительное лечение глицином не вызывает каких-либо серьезных побочных эффектов у пациентов, находящихся под тщательным наблюдением лечащего врача [45].
Сходным влиянием на уровень внимания и общую активность психических процессов обладает Биотредин, содержащий треонин и пиридоксин [46]. Среди множества эффектов пиридоксина следует отметить его участие в процессах усвоения глюкозы нервными клетками, белковом обмене и трансаминировании аминокислот [47].
Треонин вместе с 19 другими протеиногенными аминокислотами участвует в образовании белков и является незаменимой аминокислотой. Основное действие треонина – влияние на обмен нервными импульсами между нейронами, что в свою очередь положительно влияет на процессы консолидации памяти, усвоения информации и развития нервной ткани.
Е. Шешегова и соавт. оценивали влияние Биотредина на эмоциональное состояние, умственную работоспособность и уровень внимания у 64 подростков в возрасте 16–17 лет [48]. В исследовании анализировали показатели работоспособности с помощью таблиц Крепелина, определяли объем кратковременной памяти и внимания (тест Шульте), оценивали динамику эмоционального состояния (цветовой тест Люшера). Исследование показало повышение уровня внимания и умственной работоспособности на фоне применения Биотредина. У 35% обследованных препарат способствовал улучшению настроения и повышению уверенности в себе в отсутствие вегетативных реакций. В значительном числе случаев время переключения внимания сокращалось в 1,5 раза с одновременным уменьшением числа ошибок более чем на 50%. В то же время скорость счета цифр в таблице Крепелина увеличилась на 18%.
Следует отметить, что наибольший эффект Биотредина достигается в сочетании с Глицином. Глицин принимают сублингвально за 10–15 минут до приема Биотредина. Длительный прием препаратов не вызывает побочных эффектов, не сопровождается формированием зависимости и синдромом отмены.
Заключение
Субъективные и умеренные когнитивные нарушения у пациентов молодого и среднего возраста – часто встречающийся полиэтиологический синдром, который может быть связан с соматической или неврологической патологией, реакцией на перенесенный стресс, инфекционным заболеванием, неправильным режимом дня, повышенной профессиональной нагрузкой. Когнитивные нарушения у пациентов молодого и среднего возраста практически облигатно сопутствуют тревожным и депрессивным расстройствам, а по некоторым данным – предвосхищают их развитие.
Лечение когнитивных расстройств в молодом и среднем возрасте – сложная задача, поскольку причин когнитивного снижения много.
Основным направлением лечения является устранение или уменьшение выраженности причины снижения познавательных функций. Важно своевременно выявить и устранить симптомы тревоги и депрессии. Дополнительная терапия предполагает использование немедикаментозных методов в сочетании с лекарственными препаратами, оказывающими преимущественно неспецифическое антиоксидантное и ноотропное действие.
I.S. Preobrazhenskaya, PhD, Prof., V.G. Zilov, PhD, Prof., Academician of RASci
I.M. Sechenov First Moscow State Medical University
Contact person: Irina S. Preobrazhenskaya, preobrazhenskaya_i_s@staff.sechenov.ru
The article discusses the possible causes of cognitive impairment in young and middle-aged patients. Cognitive impairment may be the result of a somatic or infectious disease, taking certain groups of medications, and developing against the background of anxiety and depressive disorder. The commonality of subjective cognitive impairment and chronic fatigue syndrome is emphasized.
The treatment of cognitive impairment in young and middle-aged patients is a difficult task, taking into account the polyetiological nature of this condition. The primary task of therapy is to identify and eliminate or reduce the severity of the cause that led to the development of cognitive impairment. Non-medicinal methods are widely used. Therapy can be supplemented with drugs of non-specific nootropic and antioxidant action.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.