Модифицированная программа комбинированной интерфероно- и иммунотерапии при ассоциированных респираторных и герпетических вирусных инфекциях у иммунокомпрометированных детей
- Аннотация
- Статья
- Ссылки
- English
Введение
В настоящее время не теряют своей актуальности вопросы, связанные с лечением и реабилитацией иммунокомпрометированных детей, страдающих с высокой степенью частоты не только повторными острыми респираторными вирусными инфекциями (ОРВИ), но и рецидивирующими и/или персистирующими герпесвирусными инфекциями [1, 2, 3].
Интерфероны (ИФН) реализуют свои эффекты через когнитивные рецепторные комплексы (интерфероновый альфа-рецептор (IFNAR) и интерфероновый гамма-рецептор (IFNGR)). При контакте с вирусами происходит немедленная активация врожденного иммунитета (продукция ИФН I типа) и провоспалительных цитокинов, которые инициируют последующее включение в активную работу механизмов адаптивного иммунитета [4, 5, 6].
Продемонстрировано, что при острой вирусной инфекции значительно повышаются уровни ИФН и более 70% клеток находятся в состоянии антивирусного статуса, в то время как при тяжелых вирусных инфекциях часто наблюдается иммунодефицит [7]. Острая вирусная инфекция может приводить к истощению системы ИФН и присоединению вторичной инфекции. Описаны врожденные дефекты IFNAR-2 и IFNGR, которые сопровождались клиническими проявлениями снижения противовирусной резистентности. Показано, что вирусы могут ингибировать их действие, нарушать продукцию ИФН посредством разнообразных механизмов. Например, белки NS1 и NS2 респираторного синцитиального вируса модулируют иммунный ответ, воздействуя на ИФН-опосредованную противовирусную защиту и ингибируя синтез ИФН, созревание дендритных клеток и ответ Т-лимфоцитов [8, 9]. Вирусы гриппа нарушают синтез ИФН и инактивируют секретируемые ИФН [10]. Вирус парагриппа блокирует ИФН-сигнальные пути через STAT1, а также TLR7- и TLR9-зависимую сигнализацию [7]. Аденовирусы нарушают экспрессию генов ИФН в эпителиальных клетках, блокируя фосфорилирование транскрипционных факторов STAT1 и STAT2 [11]. Герпесвирусы блокируют активацию TLR3, ингибируя систему 2-5-олигоаденилат-синтетазы/РНКазы L, препятствуя активации JAK/STAT сигнального пути [12, 13]. Описаны приобретенные дефекты в системе ИФН у лиц, страдающих повторными ОРВИ и различными герпесвирусными инфекциями [2, 3, 14]. Показана возможность персистенции респираторных вирусов, в том числе непосредственно в клетках иммунной системы [15].
Среди методов, используемых для иммунореабилитации детей с данной патологией, широко используется терапия рекомбинантным ИФН-альфа, при этом учитывается универсальный противовирусный, антибактериальный и иммуномодулирующий характер действия ИФН-альфа [14, 16, 17, 18]. В ряде случаев, при неглубоких дефектах в системе ИФН, достигается позитивный клинический эффект, заключающийся в первую очередь в значительном снижении частоты заболеваемости ОРВИ. В то же время очевидны и неудачи при проведении интерферонотерапии у детей с повторными ОРВИ, что требует детального изучения и осмысления.
Цель исследования
На основе анализа архивного материала – амбулаторных карт иммунокомпрометированных детей, страдающих ассоциированными респираторными и герпетическими инфекциями, – оценить особенности клинической эффективности эпизодической несистемной интерфероно- и/или иммунотерапии и, изучив особенности функционирования противовирусного иммунитета и системы ИФН у иммунокомпрометированных детей с такой же патологией, разработать эффективную модифицированную программу комбинированной интерфероно- и иммунотерапии.
Материалы и методы
I этап исследования. Проведен анализ архивного материала – амбулаторных карт детей с повторными вирусно-бактериальными респираторными инфекциями. Оценена клиническая эффективность реабилитации таких детей. В комплекс реабилитационных мероприятий включалась интерферонотерапия.
Всего за период с 2009 по 2011 г. на базе консультативно-диагностического отделения № 1 Детской краевой клинической больницы г. Краснодара было обследовано 7912 детей в возрасте от 1 до 18 лет, страдающих повторными острыми респираторными инфекциями (ОРИ) (от 8 до 24 раз в год) в течение 1–5 лет. Пациенты были рандомизированы на две основные группы: 1-я архивная группа – 1549 детей с повторными ОРИ; 2-я архивная группа – 6363 ребенка с повторными ОРИ и сопутствующей хронической ЛОР-патологией: хроническим аденоидитом (28%), хроническим тонзиллитом (23%), хроническим синуситом (18%), хроническим фарингитом (10%).
II этап исследования. Под нашим наблюдением находилось 27 детей (14 мальчиков и 13 девочек) в возрасте от 5 до 8 лет, страдающих повторными ОРВИ с высокой частотой, вне периода острых клинических проявлений. ОРВИ были ассоциированы с рецидивирующими и/или персистирующими моно- и микст-герпесвирусными инфекциями: вирусом простого герпеса (ВПГ) I/II типа, вирусом Эпштейна – Барр (ВЭБ), цитомегаловирусной инфекцией (ЦМВ), вирусом герпеса человека (ВГЧ) VI типа. Контрольную группу составили 20 условно-здоровых детей, сопоставимых по полу и возрасту.
Иммунологическое исследование проводили дважды: до и после интерфероно- и иммунотерапии. Методом проточной цитометрии на “CYTOMICS FC500” (“Beckman Coulter”, США) проводили иммунофенотипирование субпопуляций Т-лимфоцитов, В-лимфоцитов, естественных киллерных клеток с помощью панели моноклональных антител (“Beckman Coulter”, США). Изучение фагоцитарной и микробицидной функции нейтрофильных гранулоцитов (НГ) проводили с определением количества активно фагоцитирующих НГ, определяя абсолютный (ФАН, абс.) и процентный (ФАН, %) показатели; оценкой киллинговой активности, устанавливая фагоцитарное число (ФЧ) и фагоцитарный индекс (ФИ), а также переваривающей способности: процент переваривания (П, %), индекс переваривания (ИП, %), интегральный показатель переваривающей активности (ИППА). NADPH-оксидазную активность НГ периферической крови определяли, оценивая процент формазан-позитивных клеток в спонтанном (ФПКсп) и стимулированном (ФПКст) NBT-тесте (nitroblue tetrazolium test, NBT-тест) (индукция Staphylococcus aureus, штамм 209), подсчитывая клетки с восстановленным формазаном (средний цитохимический индекс, СЦИ) с последующим расчетом коэффициента мобилизации (КМ), вычисляемого по отношению ФПКст, % к ФПКсп, % и СЦИст к СЦИсп. Определялся уровень сывороточных иммуноглобулинов (Ig) IgA, IgM, IgG. ИФН-статус (уровень сывороточных ИФН-альфа, ИФН-гамма) оценивали методом иммуноферментного анализа на приборе “Labsystems Multiskan Ascent” (Финляндия) с помощью тест-систем ООО «Цитокин» (Россия). Детекцию герпесвирусов проводили с использованием полимеразной цепной реакции (ПЦР) и серодиагностики. Для оценки эффективности комбинированной интерфероно- и иммуномодулирующей терапии были созданы клинические критерии. Статистическую обработку данных проводили с использованием методов вариационной статистики (Biostat 6.0).
Результаты исследования
I этап исследования. Был проанализирован материнский анамнез детей 1-й и 2-й архивных групп. Было установлено, что в 34% случаях сами матери (либо их родственники) часто и длительно болели, а также имели неблагоприятное течение беременности, хроническую соматическую патологию. Около 30% матерей в период беременности были в возрасте старше 30 лет. Некоторые дети были из социально неблагополучных и неполных семей (11%), а у их родителей имелись вредные привычки.
В раннем возрасте у 47% детей наблюдались отклонения и патология в период адаптации новорожденного (недоношенность, родовая травма, асфиксия, аномалия конституции, гипотрофия, патология центральной нервной системы и др.). Большая часть детей (54%) были рано (на 1–2-м месяце жизни) переведены на искусственное вскармливание. У 17% детей до трехлетнего возраста имела место тимомегалия, подтвержденная рентгенологически и по данным УЗИ. Около 2% детей имели генетическую патологию (болезнь Дауна, синдром Шерешевского – Тернера, муковисцидоз и др.).
Большинство из группы часто и длительно болеющих детей проживали в промышленных городах Краснодарского края, а 1,5% детей являлись внуками ликвидаторов последствий аварии на Чернобыльской АЭС, а также эвакуированных c загрязненной территории. Таким образом, дети были предрасположены к повышенной заболеваемости ОРИ, аллергизации организма, формированию хронической патологии в результате проживания в районах с напряженной экологической ситуацией.
Обращает на себя внимание тот факт, что, несмотря на неблагоприятный анамнез, в том числе и вакцинальный, 1/3 детей была проведена иммунизация в соответствии с календарем профилактических прививок. Именно у этих детей (33%) отмечался неблагополучный поствакцинальный период: зарегистрированы поствакцинальные общие и местные реакции, отмечались ОРИ с последующими их рецидивами.
Согласно амбулаторным картам клинический период острых проявлений ОРИ характеризовался манифестированием катарального риносинусита, аденоидита, фарингита, катарального тонзиллита. Длительность течения периода острых проявлений варьировала от 5 до 22 и более дней. У 41% детей острые проявления продолжались от 8 до 15 дней (41%), а от 16 до 22 и более дней – у 40%. Короткие эпизоды ОРИ (до 8 дней) наблюдались лишь у 18% детей. Более чем у 80% детей первые эпизоды ОРИ были уже на первом году жизни, что является неблагоприятным признаком, предопределяющим частоту и тяжесть течения ОРИ, высокую вероятность бактериальных осложнений. У 18% пациентов повторные респираторные инфекции возникли после первых посещений детских коллективов, в связи с контактом с вирусными и бактериальными агентами.
Основным осложнением ОРИ являлся острый обструктивный бронхит (около 50%). Другими осложнениями были острый гнойный тонзиллит, острый гнойный аденоидит, острый гнойный средний отит, острый трахеит, острая пневмония. Осложнения возникали как изолированно, так и в разнообразных сочетаниях. В 90% случаев у детей для лечения ОРИ и их осложнений в первые же дни заболевания использовали агрессивную антибактериальную терапию от 3–12 и более раз в год, при этом 2–3 препарата назначали одновременно или необоснованно часто меняли. Антибиотикотерапия проводилась как по назначению врача, так и по самовольному решению родителей. Как известно, некорректная антибактериальная терапия отягощает течение заболевания и усугубляет вторичный иммунодефицит [17].
Практически у всех детей с повторными ОРИ лабораторно подтверждено наличие бактериальной инфекции. В бактериологических посевах из носоглотки, ротоглотки, кишечника почти в 100% случаев выявлена условно-патогенная микрофлора (гемофильная палочка, пневмококк, бета-гемолитический стрептококк группы А, синегнойная палочка, протей, гемолизирующая кишечная палочка, золотистый стафилококк и др.), представленная как отдельными микроорганизмами, так и микробными ассоциациями. В 32% случаев обнаруживалась атипичная флора – хламидии, микоплазмы. Эти внутриклеточные паразиты способны к длительной персистенции в клетках эпителия респираторного тракта, особенно у иммунокомпрометированных детей, что и является причиной развития бронхообструктивного синдрома, а в дальнейшем формирования хронических воспалительных заболеваний легких, в том числе бронхиальной астмы [19].
Более 35% детей с повторными ОРИ из архивных групп были привиты противогемофильной комбинированной вакциной. Можно предположить, что в результате этиологическую значимость приобретают другие представители условно-патогенной микрофлоры или из-за дефектов реагирования иммунной системы формируется недостаточный поствакцинальный иммунитет против гемофильной инфекции.
Как показывает анализ архивного материала, общее число детей с повторными ОРИ и хронической патологией ЛОР-органов в 4 раза больше по сравнению с количеством детей без сопутствующей хронической ЛОР-патологии. Это связано с тем, что при повторных ОРИ, наряду с инфицированием новыми микроорганизмами, происходит активация латентной, персистирующей инфекции вирусного и бактериального генеза, что утяжеляет течение болезни, способствует хронизации процесса, усугубляет нарушения в иммунной системе [16, 19].
На протяжении ряда лет без исследования иммунного и ИФН-статуса детям обеих групп проводилась симптоматическая и иммуномодулирующая терапия в рамках традиционного лечения. Помимо традиционных методов лечения (фитосборы, гомеопатические средства, витамины с микроэлементами, физиолечение, закаливание и др.) использовалась также терапия препаратом Виферон (человеческим рекомбинантным ИФН-альфа-2). Интерферонотерапия проводилась короткими курсами длительностью 3–5 дней, как правило, в период острых клинических проявлений ОРИ, средними или низкими дозами согласно инструкции. В 22% случаев 5-дневный курс Виферона повторялся через 5 дней. Такие курсы интерферонотерапии были эффективны в острый период заболевания, сокращая длительность ОРИ в среднем на 3–5 дней, а также снижая количество осложнений со стороны верхних и нижних дыхательных путей. Однако такой подход к лечению не давал длительной клинической ремиссии между эпизодами ОРИ. Иммунокомпрометированные дети были подвержены повторным заболеваниям ОРИ, а у 24% детей длительность клинически благополучного периода составляла всего 4–5 дней.
В этой связи очевидно, что необходимо оптимизировать и внедрить в практику действенные методы проведения интерферонотерапии у иммунокомпрометированных детей с повторными ОРИ, включающие пролонгированную терапию ИФН с более гибким и адекватным режимом дозирования (высоко-, средне-, низкодозовая интерферонотерапия).
II этап исследования. Клинический анализ состояния детей, находившихся под нашим динамическим наблюдением, показал, что на протяжении 2 и более лет (в среднем 4,5 года) дети переносили от 7 до 24 эпизодов ОРВИ в год (17,2 ± 1,01) с продолжительностью острого периода от 4 до 14 дней (8,2 ± 0,23). При проведении клинической, серологической и ПЦР-диагностики герпетической инфекции у 100% детей с повторными ОРВИ выявлены различные варианты моно- и микст-герпетической инфекции (ВПГ I/II типа, ВЭБ, ЦМВ, ВГЧ VI типа). При этом в 59,3% случаев определена репликация герпесвирусов. Наличие рецидивирующих форм ВПГ I/II типа встречалось в 40,7% случаев.
У детей с повторными ОРВИ, ассоциированными с герпесвирусными инфекциями, в 88,5% случаев установлены различные нарушения иммунной системы. Из них изолированные поражения иммунной системы диагностированы в 48% случаев: дефектное функционирование НГ – 44%, дефекты гуморального иммунитета – 4%. Комбинированные поражения иммунной системы, выявленные у 52% детей, представлены в виде различных сочетаний: Т-клеточный дефицит и дефицит НГ – 26%, дефекты гуморального иммунитета и дефицит НГ – 17%, дефицит естественных киллерных клеток и НГ – 9%. Стоит отметить тот факт, что дефектное функционирование НГ имеет место у большинства детей с данной патологией – 96%. Важно и то, что в 100% случаев выявлены дефекты системы ИФН (дефицит сывороточного ИФН-альфа и ИФН-гамма).
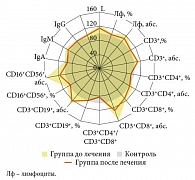
Анализируя параметры лимфоцитарого звена иммунной системы у детей с повторными ОРИ, ассоциированными с герпесвирусной инфекцией, установлен ряд особенностей (рис. 1). Так, выявлено отсутствие колебаний со стороны общего количества CD3+-лимфоцитов, CD19+-лимфоцитов. Характер субпопуляционного состава Т-лимфоцитов отличался от контрольной группы. Отмечено снижение относительного содержания CD3+CD4+-лимфоцитов до 37,4 ± 0,9% против 42,0 ± 1,89% в контроле (р < 0,05) при неизмененном по отношению к контролю абсолютном содержании CD3+CD4+-лимфоцитов (1,17 ± 0,07 × 10⁹ против 1,09 ± 0,11 × 10⁹ в контроле, р > 0,05). Количество цитотоксических CD3+CD8+-лимфоцитов было достоверно повышено в относительном (29,5 ± 0,8% против 25,5 ± 1,02% в контроле, р < 0,01) и абсолютном содержании (0,97 ± 0,05 × 10⁹ против 0,62 ± 0,08 × 10⁹ в контроле, р < 0,001). Данные изменения приводят к нарушению соотношения лимфоцитов с индукторной и цитотоксической активностью, и иммунорегуляторный индекс снижается в 1,3 раза – до 1,3 ± 0,05 против 1,63 ± 0,14 в контроле (р < 0,05). В данной группе детей увеличено абсолютное содержание СD16+CD56+-лимфоцитов (естественных киллерных клеток) – 0,04 ± 0,03 × 10⁹ против 0,26 ± 0,03 × 10⁹ в контроле (р < 0,001) – при отсутствии изменений процентного содержания этих клеток (13,1 ± 1,04% против 12,3 ± 1,16% в контроле, р > 0,05). Вероятно, увеличение количества CD3+CD8+-лимфоцитов и естественных киллерных клеток связано с постоянной вирусной нагрузкой (персистенция респираторных вирусов, репликация герпесвирусов) вне острых клинических проявлений заболеваний.
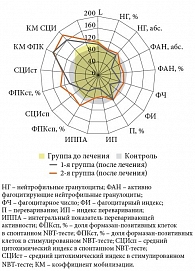
Анализ состояния системы НГ у детей с повторными ОРВИ и герпесвирусной инфекцией показал наличие дефектов их фагоцитарной и микробицидной функций, проявляющихся депрессией поглотительной, киллинговой и переваривающей, в том числе NADPH-оксидазной, активности. Так, при исследовании фагоцитарной функции НГ отмечался количественный дефицит активно фагоцитирующих НГ (44,25 ± 1,26 против 57,85 ± 3,34 в контроле, р < 0,001). Показатели поглощающей способности НГ также были снижены: фагоцитарное число составило 3,87 ± 0,13 против 4,82 ± 0,35 в контроле (р < 0,05) и фагоцитарный индекс – 1,79 ± 0,12 против 2,58 ± 0,31 в контроле (р < 0,05). Выявлено ухудшение интенсивности и завершенности фагоцитарного акта: в 1,5 раза снижен индекс переваривания – 1,27 ± 0,06 против 1,86 ± 0,17 в контроле (р < 0,01), ИППА имел тенденцию к снижению (74,82 ± 8,87 против 95,15 ± 9,6 в контроле, р > 0,05). Отмечено снижение спонтанной и стимулированной активности NADPH-оксидаз как по ФПК, % (р < 0,05), так и по СЦИ (р < 0,05), но резервный микробицидный потенциал сохранен (КМ СЦИ, р < 0,05; КМ ФПК, р < 0,05) (рис. 2).
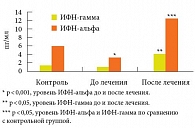
Уровень ИФН-альфа был снижен в 1,8 раза (3,6 ± 0,66 пг/мл против 6,42 ± 1,05 пг/мл, р < 0,05), а ИФН-гамма – в 1,3 раза (ИФН-гамма – 1,39 ± 0,42 пг/мл против 1,78 ± 0,53 пг/мл, р > 0,05) по отношению к контрольным значениям (рис. 3).
Для уточнения дифференцированности влияний базисной монотерапии рекомбинантным ИФН-альфа-2 в комбинации с антиоксидантами (Виферон) и комбинированной интерфероно- и иммунотерапии, включающей базисную интерферонотерапию Вифероном и иммуномодулирующую терапию Ликопидом, обследованные иммунокомпрометированные дети были рандомизированы на 2 группы.
Группа 1 получала:
- для коррекции и модуляции ИФН-статуса – базисную системную терапию Вифероном (в виде ректальных суппозиториев) начиная с 1 млн МЕ с постепенным снижением дозы каждые 20 дней до 150 тыс. МЕ и локальную терапию гелем Виферон – смазывание носовых ходов и ротоглотки 5–7 раз в день в течение 2,5 месяца;
- для элиминации герпесвирусных инфекций – противовирусную терапию Изопринозином из расчета 50 мг/кг массы тела – 3 курса по 10 дней с перерывом 14 дней.
Группа 2 получала аналогичную терапию. Кроме этого, для направленной коррекции нарушений в системе НГ им дополнительно был назначен Ликопид 2 мг/сут двумя 10-дневными прерывистыми курсами, чередующимися с курсами Изопринозина.
Продемонстрирована высокая клиническая эффективность проводимой терапии у детей обеих групп как во время проведения исследования, так и в катамнезе. При этом отмечалось значительное сокращение частоты эпизодов ОРВИ в год: с 15,1 ± 1,23 до 4,69 ± 0,3 (р < 0,001) в группе 1 и с 19,1 ± 1,3 до 3,29 ± 0,3 (р < 0,001) в группе 2. Кроме того, отмечалось увеличение длительности клинически благополучного периода с 7,9 ± 0,3 до 11,1 ± 0,5 месяца (р < 0,001) в группе 1 и с 7,19 ± 0,5 до 11,5 ± 0,4 месяца (р < 0,001) в группе 2. Продолжительность клинически благополучного периода (в днях) в обеих группах выросла с 7–10 дней до лечения до 100–150 дней после проведенной терапии.
В результате проведенной интерфероно- и иммунотерапии выявлен модулирующий характер изменений со стороны лимфоцитарного звена иммунитета (рис. 1). Относительное содержание CD3+CD4+-лимфоцитов достигло контрольных значений (38,57 ± 1,5% против 42,0 ± 1,89% в контроле, р > 0,05). Количество CD3+CD8+-лимфоцитов снизилось в абсолютном (р < 0,05) и в относительном содержании (р > 0,05), но по сравнению с контролем отмечена нормализация только абсолютного количества CD3+CD8+-лимфоцитов (0,8 ± 0,06 × 10⁹ против 0,62 ± 0,08 × 10⁹ в контроле, р > 0,05), а процент CD3+CD8+-лимфоцитов еще оставался повышенным (28,9 ± 1,12% против 25,5 ± 1,02% в контроле, р < 0,05). Дисбаланс между CD3+CD4+-лимфоцитами и CD3+CD8+-лимфоцитами сохранился (индекс реактивности иммунитета составил 1,37 ± 0,16 против 1,63 ± 0,14 в контроле, р > 0,05). Количественных изменений CD3+-лимфоцитов не произошло. Абсолютное содержание СD16+CD56+-лимфоцитов снизилось в 1,3 раза (р < 0,001) и восстановилось до контроля (с 0,04 ± 0,03 × 10⁹ до 0,3 ± 0,02 против 0,26 ± 0,03 × 10⁹ в контроле, р > 0,05).
Характеризуя гуморальный иммунитет детей, страдающих повторными ОРВИ и герпесвирусной инфекцией, можно отметить отсутствие достоверных колебаний уровня IgA, IgM, IgG (рис. 1). При этом у 14,8% детей имелось снижение уровня IgG и у 7,4% детей – уровня IgM ниже значения 1,5 контрольной зоны. На фоне комбинированной иммунотерапии содержание IgA, IgM, IgG достигло контрольных величин. В то же время комбинированная интерфероно- и иммунотерапия не повлияла на количество CD3+CD19+-лимфоцитов (рис. 1).
В 1-й группе у детей, получивших Виферон и Изопринозин, фагоцитарная активность НГ имела тенденцию к восстановлению, но показатели всех исследуемых параметров оставались ниже контрольных значений: ФАН, % (р < 0,001), фагоцитарное число (р < 0,05), фагоцитарный индекс (р < 0,001), индекс переваривания (р < 0,001). При этом резервная NADPH-оксидазная активность повысилась в 2 раза по коэффициенту мобилизации формазан-позитивных клеток и в 1,4 раза – по коэффициенту мобилизации среднего цитохимического индекса по сравнению с исходными данными, что было выше контроля (р < 0,05 и р < 0,05 соответственно) (рис. 2).
Во 2-й группе – у детей, получивших Виферон, Ликопид и Изопринозин, – количество активно фагоцитирующих НГ достигло контрольных величин – с 44,25 ± 1,26% до 50,54 ± 2,38% против 57,85 ± 3,34% в контроле (р > 0,05), восстановилась поглотительная функция нейтрофильных гранулоцитов – фагоцитарное число выросло с 3,87 ± 0,13 до 4,43 ± 0,29, достигнув уровня контроля 4,82 ± 0,35 (р > 0,05), и фагоцитарный индекс восстановился до контрольных значений – с 1,79 ± 0,12 до 2,28 ± 0,27, а в контроле – 2,58 ± 0,31 (р > 0,05), улучшилась интенсивность и завершенность фагоцитарного акта (индекс переваривания – с 1,27 ± 0,06 до 1,35 ± 0,13 при 1,86 ± 0,17 в контроле); ИППА имел тенденцию к восстановлению, но не достиг контрольных значений. Кроме того, отмечена активация резервной NADPH-оксидазной активности в 2 раза по коэффициенту мобилизации формазан-позитивных клеток и в 1,6 раза по коэффициенту мобилизации среднего цитохимического индекса по отношению к показателям до лечения, что выше контроля (р < 0,01 и р < 0,001 соответственно) (рис. 2).
Со стороны системы ИФН на фоне интерферонотерапии отмечалась позитивная динамика в виде увеличения как уровня ИФН-альфа с 3,6 ± 0,66 пг/мл до 12,88 ± 2,62 пг/мл (р < 0,001), так и уровня ИФН-гамма с 1,39 ± 0,42 пг/мл до 4,52 ± 0,98 пг/мл (р < 0,05), что выше контрольных величин в 2 раза по уровню ИФН-альфа (р < 0,05) и в 2,5 раза по уровню ИФН-гамма (р < 0,05) (рис. 3).
Заключение
Таким образом, разработанная программа модифицированной комбинированной интерфероно- и иммунотерапии при ассоциированных респираторных и герпетических вирусных инфекциях у иммунокомпрометированных детей показала высокую клиническую эффективность. Так, частота эпизодов повторных ОРВИ снизилась в 3,2 раза в группе 1 и в 5,8 раза в группе 2, при этом длительность клинически благополучного периода увеличилась в 1,4 раза в группе 1 и в 1,6 раза в группе 2. Кроме того, выявлен и положительный иммунологический эффект: отмечался модулирующий характер влияния на Т-звено и гуморальное звенья, естественные киллерные клетки. Адекватные дозы рекомбинантного ИФН-альфа (Виферон) способствовали значимому повышению уровней ИФН-альфа и ИФН-гамма. По нашему мнению, наблюдаемое после проведения базисной интерферонотерапии значительное повышение уровней сывороточного ИФН-альфа и ИФН-гамма необходимо для элиминации респираторных вирусов или прекращения репликации герпесвирусов. Такое повышение уровней сывороточного ИФН-альфа и ИФН-гамма является признаком позитивной активации продукции ИФН и коррелирует с позитивной клинической динамикой. Включение в программу комбинированной интерфероно- и иммунотерапии иммуномодулирующей терапии Ликопидом (при дефектном функционировании НГ у детей с ассоциированными вирусно-вирусными инфекциями) демонстрирует весомые преимущества, связанные с эффективной коррекцией выявленных нарушений в системе НГ.
Modified program of combination treatment with interferon and immunotherapy in immunocompromised children with respiratory and herpesvirus associations
I.V. Nesterova1, S.V. Kovalyova2, Ye.I. Kleschenko2, N.V. Kolesnikova2, G.A. Chudilova2, L.V. Lomtatidze2, O.N. Shinkareva2
1 Peoples’ Friendship University of Russia, Allergology and Immunology Department, Faculty of Continuous Professional Education of Health Professionals
2 Kuban State Medical University, Krasnodar
Contact person: Irina Vadimovna Nesterova, inesterova1@yandex.ru
The authors presented modified program of combination treatment with interferon (IFN) and immunotherapy in frequently and chronically ill children with respiratory and herpesvirus associations. The patients were treated with prolonged and flexible IFN-alpha Viferon regimen in combination with Isoprinosine; in some children Licopid was added. The treatment was associated with reduced frequency of recurrent acute viral infections. Modulatory effects on T-cell and humoral immunity were demonstrated. Appropriate doses of recombinant interferon alpha produced significant increase in IFN-alpha and IFN-gamma levels which promoted elimination of respiratory viruses or termination of herpesvirus replication. In patients with dysfunctional neutrophil granulocytes, treatment with Licopid resulted in functional recovery.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.